测定化学物对乙酰胆碱酯酶抑制毒性的微板吸光法研究
陶珊珊,葛会林,袁宏球,阳辛凤
1. 中国热带农业科学院分析测试中心 海南省热带果蔬产品质量安全重点实验室,海口 571101 2. 华中农业大学植物科学技术学院,武汉 430070
近代化学物质(农药、医用药品、工业用品、生活用品等)使用日益增多,各方面污染残留情况日益严重,加强污染物残留与毒性检测技术的研究受到越来越多的重视。污染物检测方法主要有仪器分析、生物检测和酶抑制法等。仪器分析法主要有气相色谱、液相色谱以及与质谱的联用方法等。生物检测一般使用细菌、细胞、藻类、鱼等活体生物来表征污染物的毒性。酶抑制法一般通过污染物对各种酶如乙酰胆碱酯酶、辣根过氧化酶、荧光素酶[1]等的抑制来表征污染物毒性。生物检测与酶抑制法具有仪器分析法无可替代的特点是可用于表征混合污染物的综合毒性。酶抑制法相比生物检测具有操作简单、重复性好、测试时间短等特点。
乙酰胆碱酯酶(AChE)最常用于酶抑制法当中,其基本原理是AChE催化底物乙酰胆碱(ATCh)水解得到胆碱,胆碱与显色剂二硫代二硝基苯甲酸(DTNB)反应,生成黄色物质5-硫代-2-硝基-苯甲酸,通过在412 nm检测此黄色物质的吸光度变化来反映酶催化反应的变化[2]。有机磷或氨基甲酸酯类农药对AChE功能有抑制作用,反应生成共价结合的磷酰化胆碱酯酶或可水解的氨基甲酰化胆碱酯酶,抑制率与农药的浓度呈正相关,可通过抑制毒性来判断出样品中是否有有机磷或氨基甲酸酯类农药的存在以及残留情况[3-4]。
AChE抑制法应用广泛且成效显著,是一种相对成熟的检测方法[5],可用于各种AChE抑制剂的筛选[6-8],以及部分农药残留的检测[9]。如AChE抑制法用于蔬菜、水果、茶叶中有机磷和氨基甲酸酯类农药的残留检测[10],并制定了相关的国家标准和农业标准。目前的形势是需检的污染物数目及种类越来越多,农产品中农药残留检测任务越来越繁重,所以AChE抑制法还需要进一步的简化、优化与高通量化。
酶抑制实验的影响因素较多,如pH、温度、反应时间、酶的敏感性等,前人已进行了一些影响因素的条件优化研究[11-13]。王小红[14]观察到辛硫磷、敌敌畏、乐果在45 ℃对植物酯酶的抑制作用最大。侯学文等[15]使用碘化硫代丁酰胆碱作为底物,观察到某胆碱酯酶对辛硫磷十分敏感。但少有人研究AChE、DTNB、ATCh浓度对污染物抑制AChE毒性测定的影响。
AChE抑制法通常使用比色管分光光度法测定,这一定程度上制约了其进行多次重复,也不利于实现高通量操作,而且需要消耗大量的试剂药品。环境介质中农药的存在形式一般是低剂量与混合残留[16-17],为了从单个污染物预测与评价混合物毒性,需要准确测定单个污染物的低剂量效应与全局剂量-效应曲线(DRC),这就需要增加试验的次数与重复性,而使用比色管法无法满足这样的要求。
微孔板具有可高通量操作、易于多次重复、所需试样体积少等特点,目前越来越多地用于污染物毒性检测,微孔板可作为酶[1]、发光菌[18]甚至线虫[19]的暴露反应载体。灭多威作为一种氨基甲酸酯类农药,施用后残留于环境形成污染物[20],本研究以其为例,研究AChE、ATCh、DTNB浓度对灭多威毒性测定的影响,最终建立稳定、重复性好、可高通量操作的AChE抑制法,同时与国标方法进行对比与验证,为今后AChE抑制法的应用与研究提供参考和方法支持。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
Synergy2型多功能微孔板测定仪(美国BioTek公司),AL204型四位电子天平(梅特勒-托利多公司),雷磁PHS-3E型pH计(上海精密科学仪器有限公司),96孔透明微板(Corning 9018)。
用于AChE催化体系显色的物质包括碘化硫代乙酰胆碱ATCI(aladdin,纯度98%,CAS号1866-15-5)、DTNB(Vetec,纯度98%,CAS号69-78-3)、电鳗AChE(Sigma,C3389-2kU,CAS号9000-81-1)。DTNB、ATCI和AChE溶解于pH 6.8的磷酸盐缓冲液(含0.025 mol·L-1KH2PO4与0.025 mol·L-1Na2HPO4·12H2O)并避光保存于4 ℃冰箱中。为溶解DTNB,参考文献[2],每克DTNB添加0.379 g的NaHCO3。受试化合物灭多威(Chem Service,纯度99.1%,CAS号16752-77-5)也溶解于pH 6.8的磷酸盐缓冲液并避光保存于4 ℃冰箱中。
1.2 乙酰胆碱酯酶体系组分浓度对显色的影响
进行化学物对AChE的毒性试验之前,需要了解不同因素对AChE催化体系显色的影响。本研究采用空调控温(29±1) ℃,影响显色因素实验的吸光度均为反应15 min时在412 nm波长测定。通过固定AChE、DTNB和ATCI其中2种物质的浓度,改变另一种物质的浓度,研究其与显色的关系。其中变化浓度的组分每个浓度8次重复且加入体积为100 μL,浓度不变的组分加入体积为50 μL。DTNB与ATCI浓度为0.25 g·L-1时,各列AChE浓度依次为1、0.7、0.49、0.34、0.24、0.17、0.12、0.082、0.058、0.04、0.028、0.02 U·mL-1;ATCI浓度为0.25 g·L-1,AChE浓度为0.05 U·mL-1,各列DTNB浓度依次为5、2.5、1.25、0.65、0.315、0.155、0.08、0.039、0.0195、0.01、0.005 g·L-1;DTNB浓度为0.25 g·L-1,AChE浓度为0.05 U·mL-1,各列ATCI浓度依次为5、2.5、1.25、0.65、0.315、0.155、0.08、0.039、0.0195、0.01、0.005 g·L-1。
1.3 乙酰胆碱酯酶微板毒性分析
参考发光菌的微板毒性分析[18],建立乙酰胆碱酯酶的微板毒性分析程序如下。将96孔微板第12列的8个孔加入100 μL磷酸盐缓冲液作为空白对照,其余11列加入按一定稀释因子设计的11个浓度梯度污染物100 μL,每个浓度8个重复,接着每孔依次加入50 μL 1 g·L-1DTNB、50 μL 1 g·L-1ATCI与 50 μL 0.2 U·mL-1AChE,每孔总体积共250 μL,然后将微板送入酶标仪中测定吸光度(A),默认的暴露时间为15 min。
污染物对AChE的抑制毒性E按照公式(1)计算,得到的剂量-效应曲线(DRC)使用公式(2)所示Weibull函数进行最小二乘法拟合,并计算观测值的95%置信区间[21],得到典型效应浓度如EC90、EC50、EC10等。
E=1-△At/△Ac
(1)
E=1-exp(-exp(a+b×log10(C)))
(2)
式中ΔAt为与0 min相比处理吸光度变化值,ΔAc为与0 min相比空白吸光度变化值,C为浓度,E为效应,a为位置参数,b为斜率参数。
1.4 污染物抑制乙酰胆碱酯酶毒性的影响因素
为研究暴露时间对污染物抑制AChE的影响,测定暴露时间为5、10、15、20、25、30 min时灭多威抑制AChE的DRC。
通过固定AChE、ATCI、DTNB其中2种物质的浓度,改变另一种物质的浓度,测定灭多威抑制AChE 15 min的DRC,研究AChE、ATCI、DTNB浓度对灭多威抑制AChE的影响。其中DTNB与ATCI浓度为0.2 g·L-1时,AChE浓度选取0.004、0.01、0.04、0.16 U·mL-1;ATCI浓度为0.2 g·L-1,AChE浓度为0.04 U·mL-1,DTNB浓度选取0.02、0.2、2 g·L-1;DTNB浓度为0.2 g·L-1,AChE浓度为0.04 U·mL-1,ATCI的浓度选取0.02、0.2、2 g·L-1。
1.5 方法验证
以国标GB/T 5009.199—2003[22]中的酶抑制法(此后简称国标法)作为参考对本研究方法进行验证。国标法中,采用pH 8.0的KH2PO4-K2HPO4缓冲液,DTNB与AChE用缓冲液配制,每克DTNB添加0.0975 g的NaHCO3,ATCI用纯水配制,反应溶液中ATCI与DTNB的终浓度分别为0.298 g·L-1与0.286 g·L-1;AChE浓度没有明确指定,此处采用0.04 U·mL-1。检测方式为2.5 mL样品溶液,加入0.1 mL AChE、0.1 mL DTNB,摇匀后于37 ℃放置最少15 min,再加入0.1 mL ATCI,记录反应3 min的吸光度变化值。为与微板法对比,将国标法换算后移植到微板上进行,加样体积为处理/空白100 μL+AChE 50 μL+DTNB 50 μL+ATCI 50 μL。因为国标法测试分温浴和显色2个阶段,加样顺序会对测试结果有影响。所以我们设计了板(36)的AChE+DTNB+ATCI (称国标法)、板(37)的AChE+ATCI+DTNB (称国标法变异1)、板(38)的DTNB+ATCI+AChE (称国标法变异2)3种加样顺序;3种物质中前两者37 ℃温浴15 min,再加第3种物质显色并在37 ℃测试;相应地暴露时间表示为温浴时间(15 min)加上实际显色时间,但国标法变异2的温浴时间不算在暴露时间内。
2 结果与讨论(Results and discussion)
2.1 乙酰胆碱酯酶体系组分浓度对显色吸光度的影响
图1(a)为不同AChE浓度下的吸光度曲线,可以看出随着AChE浓度(0.02~1 U·mL-1)的增加,吸光度相应增加,从0.173到2.212。类似地,余淑英等[23]报道AChE浓度在0~0.0667 U·mL-1范围与吸光度保持良好的线性关系,并建议反应体系酶终浓度应控制在0.0667 U·mL-1以内。图1(b)为不同DTNB浓度下的吸光度曲线,随着DTNB浓度(0.005~5 g·L-1)的增加,吸光度也相应增加,从0.138到1.332。图1(c)为不同ATCI浓度下的吸光度曲线,随着ATCI浓度(0.005~5 g·L-1)的增加,吸光度也相应增加,从0.138到1.834。有研究表明,ATCh浓度与吸光度存在双相关系[24],转折点对应的ATCh浓度约3.3 mmol·L-1(即0.95 g·L-1的ATCI)。本研究中没有观察到ATCI浓度对吸光度的双相关系,原因有待进一步研究。
2.2 乙酰胆碱酯酶体系组分浓度对显色吸光度变化速率的影响
将图1中15 min测定的A值分别减去0 min的A值,所得差值除以15 min即为吸光度的变化速率(ΔA·min-1),可以看出AChE、DTNB与ATCI浓度与吸光度变化速率呈现出完全不同类型的曲线(图2)。随着AChE浓度的增加,吸光度变化速率呈现递增的曲线(图2a)。随着DTNB浓度的增加,吸光度变化速率呈现基本水平的曲线(图2b),每分钟A值的变化量约为0.004。而随着ATCI浓度的增加,吸光度变化速率呈现先增后减的双相曲线(图2c),最大值出现在ATCI浓度为0.315 g·L-1(即1.09 mmol·L-1),这反映了AChE的过量底物抑制效应;建议采用上升阶段曲线,ATCI的浓度以小于0.315 g·L-1为宜。Ellman等[2]报道牛红细胞胆碱酯酶催化乙酰胆碱水解速率也呈现先增后减的双相曲线,其最大值出现在乙酰胆碱浓度约为0.5 mmol·L-1。但丁酰胆碱酯酶(BChE)无过量底物抑制效应,如鸡血清BChE[9],这也是区分AChE和BChE的特性之一[25]。
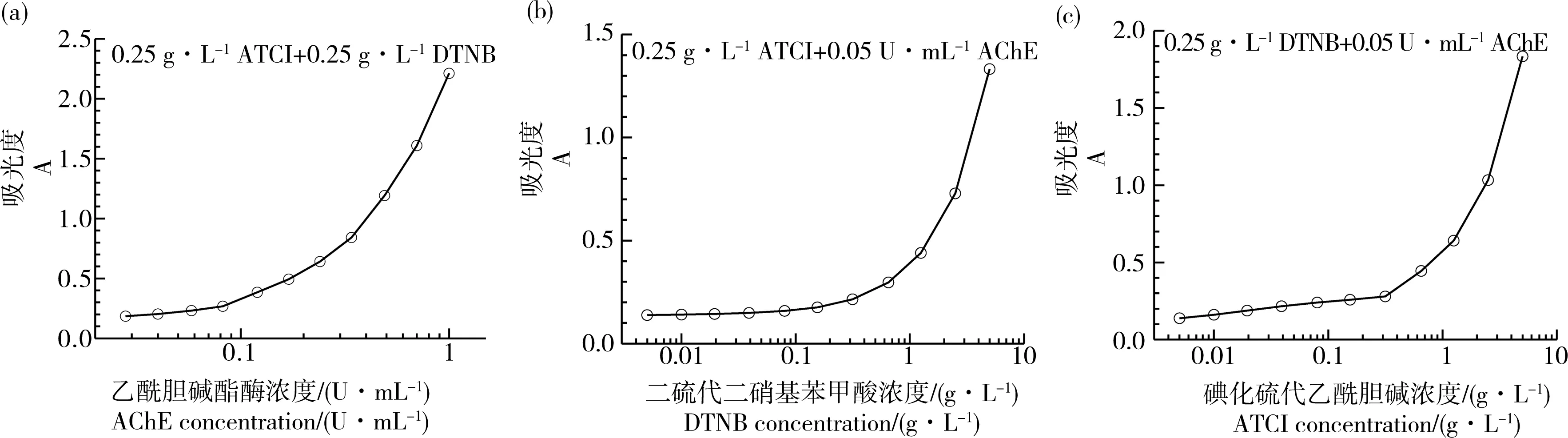
图1 影响乙酰胆碱酯酶催化体系显色吸光度的因素注:(a) 乙酰胆碱酯酶(AChE)浓度;(b) 二硫代二硝基苯甲酸(DTNB)浓度;(c) 碘化硫代乙酰胆碱(ATCI)浓度。Fig. 1 Factors affecting the absorbance of AChE catalytic systemNote: (a) acetylcholinesterase (AChE) concentration; (b) 5,5'-dithiobis-2-nitrobenzoic acid (DTNB) concentration; (c) acetylthiocholine iodide (ATCI) concentration.
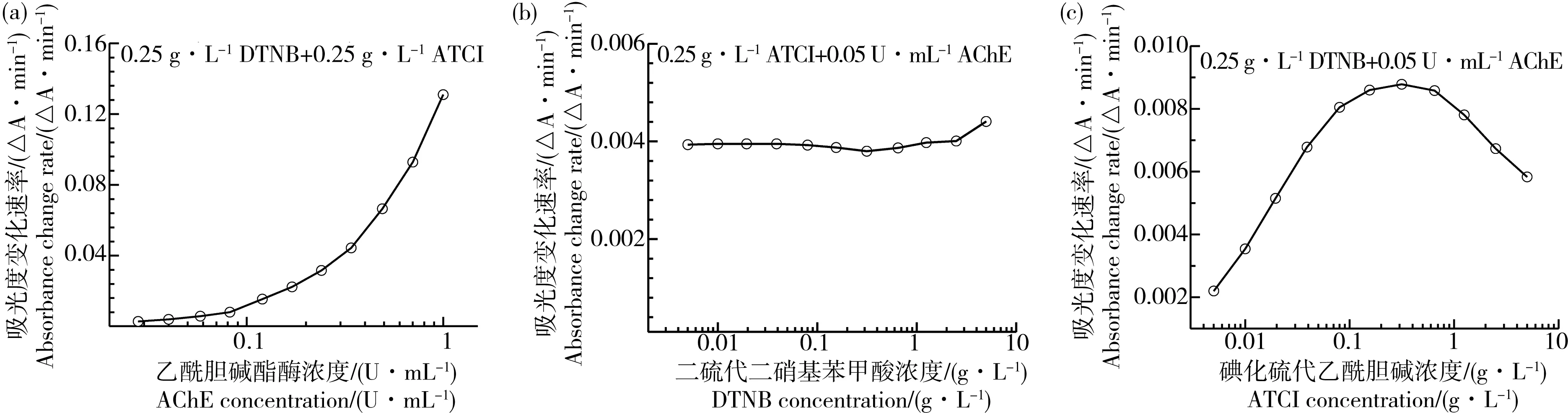
图2 影响乙酰胆碱酯酶催化体系显色吸光度变化速率的因素Fig. 2 Factors affecting the change rate of absorbance of AChE catalytic system
2.3 污染物抑制乙酰胆碱酯酶的影响因素研究
图3(a)为不同暴露时间下灭多威的DRC,可以看出随着暴露时间的增加灭多威DRC向左移动,灭多威的毒性随之增大,表1中EC50随之减小,5、15、30 min时分别为5.08×10-6、2.41×10-6、1.60×10-6mol·L-1。可以看出15 min后毒性变化已不大,考虑试验效率等因素并参考惯例,选择15 min作为毒性测试默认的暴露时间。
图3(b)为AChE浓度为0.004、0.01、0.04、0.16 U·mL-1时灭多威的DRC,这4条DRC基本重合,表明一定范围内AChE浓度变化不会对污染物的毒性测试产生影响。李维[9]也发现不同比酶活力的鸡血清BChE对农药的抑制率基本相同。图3(c)为DTNB浓度为0.02、0.2、2 g·L-1时灭多威的DRC,这3条DRC基本重合,表明一定范围内DTNB浓度变化也不会对污染物的毒性测试产生影响。
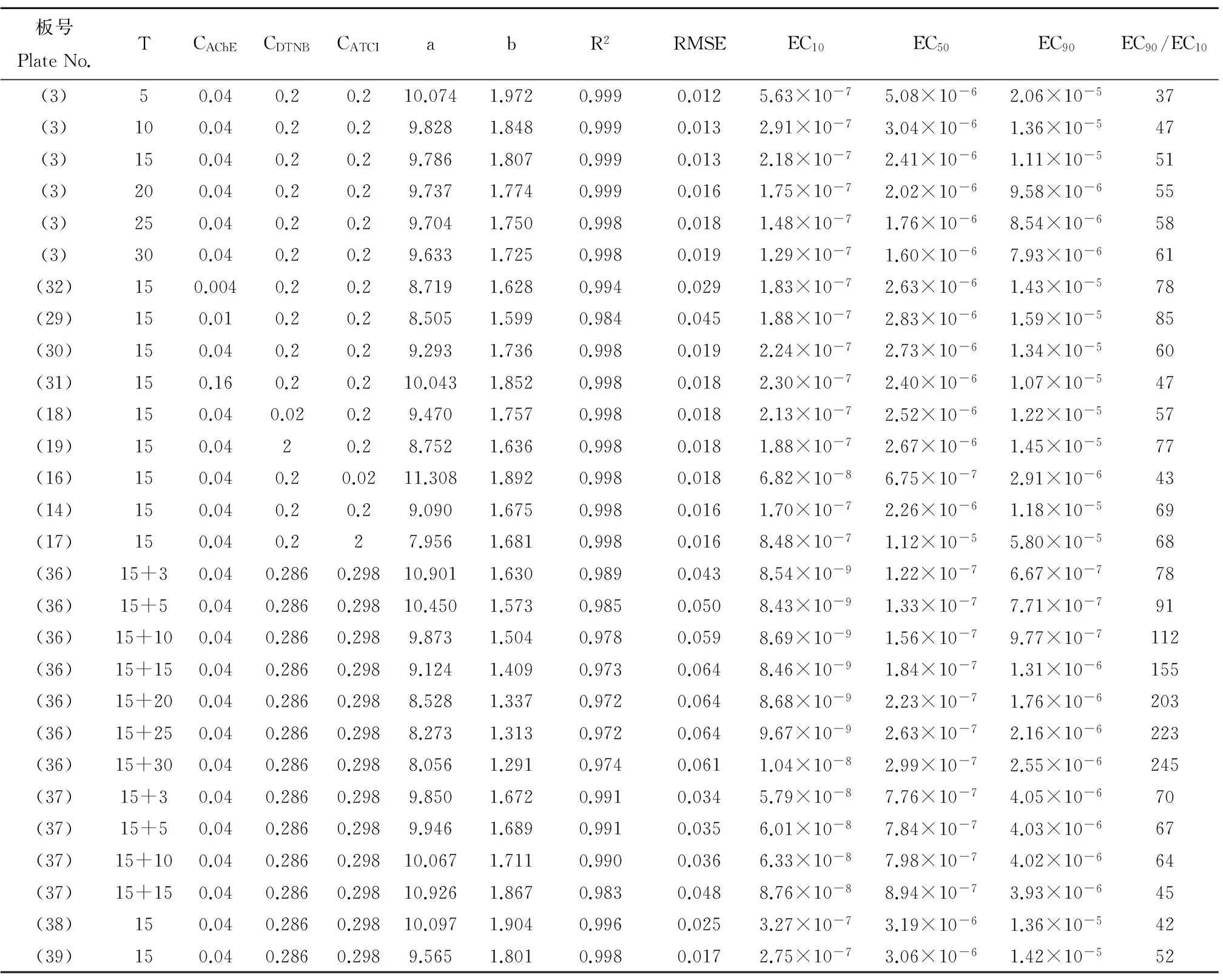
表1 灭多威抑制乙酰胆碱酯酶的剂量-效应模型及相关参数Table 1 Dose-response model of methomyl inhibiting acetylcholinesterase and related parameters
注:T为暴露时间,单位为min;CAChE为反应溶液中的AChE浓度,单位为U·mL-1;CDTNB与CATCI为反应溶液中DTNB与ATCI的浓度,单位为g·L-1;a与b为Weibull模型的位置与斜率参数;R2为拟合决定系数;RMSE为均方根误差;EC10、EC50、EC90为产生10%、50%、90%效应的浓度,单位为mol·L-1。
Note: T is the exposure time with the unit minute; CAChEis the concentration of AChE in the reaction solution with the unit U·mL-1; CDTNBand CATCIare the concentrations of DTNB and ATCI in the reaction solution with the unit g·L-1; a and b are the location parameter and slope parameter for Weibull model; R2is the fitting coefficient of determination; RMSE is the root mean square error; EC10,EC50and EC90are the 10%, 50% and 90% effect concentration with the unit mol·L-1.
图3(d)为不同ATCI浓度下灭多威的DRC,可见随着ATCI浓度的增大,DRC向右大幅度移动。灭多威的毒性随着ATCI浓度的增大而减小,其EC50在ATCI浓度为0.02、0.2、2 g·L-1时分别为6.75×10-7、2.26×10-6、1.12×10-5mol·L-1,其中最大值是最小值的16.6倍,所以ATCI浓度变化能显著影响污染物对AChE的抑制毒性。所以,ATCI浓度是决定化学物抑制AChE毒性的关键参数,不同文献中若ATCI浓度不一样,得到的化学物抑制AChE的EC50一般是没有可比性的,这对于AChE抑制法的研究与应用具有重要的参考意义。此结果一个潜在的含义是可通过改变ATCI浓度来调控污染物抑制AChE毒性的大小,ATCI作用类似于一个化学探针,为使毒性指标更灵敏,在保证重复性的前提下,可适当降低ATCI的浓度。可以预计荧光素酶毒性试验中[1],三磷酸腺苷(ATP)也有类似于ATCI的作用,ATP浓度变化应能显著影响化学物对荧光素酶的毒性。反而AChE浓度不影响灭多威毒性测试结果。文献报道灭多威是与AChE活性位点以外的部位结合,为非竞争性抑制,主要通过改变酶分子的形状而产生抑制[26]。同时,灭多威对AChE的抑制作用是可逆的[27-28]。从研究结果、试剂成本因素等方面综合考虑,确定最终优化实验浓度为DTNB 0.2 g·L-1、ATCI 0.2 g·L-1与AChE 0.04 U·mL-1。优化的酶浓度也在文献[23]建议的浓度范围内。
2.4 方法验证与总结
从图3(e)与表1可以看出,板(38)的国标法变异2与板(3)的本研究方法所测结果基本一致,板(38)所测EC50是板(3)1.32倍,国标法变异2与本研究方法结果基本是等同的,两者具有相近的稳定性与灵敏度。板(39)为采用国标法中的溶液浓度,加样顺序按照本研究方法DTNB+ATCI+AChE,并立即在29 ℃检测。可以看出板(38)在37 ℃所测EC50是板(39)在29 ℃的1.04倍,几乎完全一样,所以AChE酶抑制法对于温度是不敏感的。板(39)所测EC50是板(3)的1.27倍,所以pH在一定范围内如6.8~8.0对测试结果的影响不大。板(38)与(39)所测DRC随时间增加向左移动,与板(3)的变化规律一致。但是,板(36)的国标法与板(37)的国标法变异1与板(3)的本研究方法所测结果差异显著,板(3)的15 min的EC50分别是板(36)、(37)的(15+3) min的EC50的19.8、3.1倍!板(36)所测毒性也远较板(37)大,我们认为主要与板(36)温浴15 min的暴露过程中没有ATCI与灭多威竞争酶作用位点有关。相比板(3),板(36)与(37)温浴15 min过程中虽然已处于暴露阶段,但抑制率只能在显色后的时间进行计算,这可称为瞬时抑制率,而板(3)可称为平均抑制率,这一定程度上可能导致板(3)所测毒性偏小。图3(f)显示板(36)所测DRC随时间增加向右移动,图3(g)表明板(37)所测DRC基本不移动,这与板(3)所测DRC左移即人们通常认为的一段时间内随着时间增加而毒性增加的规律是有差异的。以EC90/EC10来表示毒物发挥毒性效应的范围,从表1可以看出,随着时间增加,板(3)与(36)的此范围不断加宽,但板(37)的范围不断变窄。
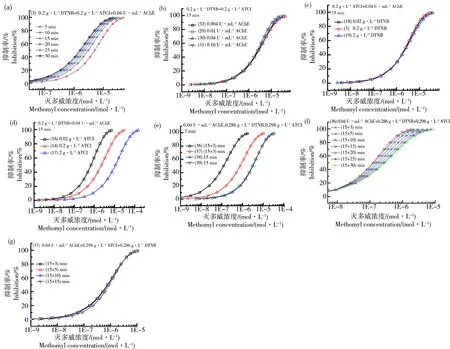
图3 影响灭多威抑制乙酰胆碱酯酶剂量-效应曲线的因素注:(a, f, g) 暴露时间;(b) AChE浓度;(c) DTNB浓度;(d) ATCI浓度;(e) 试剂加样顺序。Fig. 3 Factors affecting the dose-response curves of methomyl inhibiting acetylcholinesteraseNote: (a, f, g) Exposure time; (b) AChE concentration; (c) DTNB concentration; (d) ATCI concentration; (e) Reagent injection sequence.
图4为3种典型加样顺序条件下灭多威抑制乙酰胆碱酯酶的剂量-效应曲线。国标法(图4a)具有最高的灵敏度,适合于农药低剂量残留等的检测。国标法变异1(图4b)的优点是测试毒性对时间因素不敏感,适合于要求结果高稳定性的实验。我们研究方法(图4c)的特点是更符合生物体中AChE与ATCh同时存在的特征,同时测试方法能全面完整反映暴露全过程的毒性变化。
综合来看,AChE抑制率与灭多威浓度成S型DRC关系,可用Weibull函数有效表征,拟合决定系数R2>0.97,拟合均方根误差RMSE<0.07,空白变异控制在了±10%以内。灭多威毒性测试结果重复性较好,低浓度毒性变化趋势较为合理,DRC曲线覆盖范围全面。这与文献[1]中荧光素酶毒性测试结果的重复性相当。基于比色管分光光度的国标法[22]中,以E≥50%作为阳性标准,灭多威的检出限为6.16×10-7mol·L-1;本研究中基于微板分光光度的国标法的EC50为1.22×10-7,后者相比前者具有更高的灵敏度。但本文提出的方法尚需要进一步开展标准化研究,通过与国内外现行标准方法进行平行比较研究,进一步验证方法的可靠性。
通过研究可以看出,影响污染物抑制AChE的因素主要有ATCI浓度的准确性、污染物浓度的准确性、试剂加样顺序等。不同污染物在不同pH条件下的稳定性不同,在保证酶活性较高的情况下,本试验使用磷酸盐缓冲液控制反应体系pH值6.8,能最大程度适合大多数污染物的毒性测试。使用空调控温反应在(29±1) ℃,不需要额外的控温手段,操作更加简单便利。AChE微板毒性分析,使用稀释因子得到等对数间距浓度污染物,能保证效应从高到低完整覆盖DRC的有效范围。ATCI加入体积占每孔总体积的1/5,保证了ATCI浓度的准确性,以及每个处理的8次重复,都保证了DRC测试的有效重复。本研究建立的AChE微板毒性分析法,一块微板,一次测定,即得到样品一条完整的剂量-效应曲线,具有操作程序化、普适化、高通量、结果重复性好等特点,适合环境污染物毒性的高通量测试,也可用于AChE抑制剂的筛选等工作。
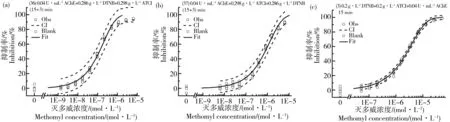
图4 3种典型加样顺序下灭多威抑制乙酰胆碱酯酶的剂量-效应曲线注:□,空白控制;○,实验数据;—,Weibull模型拟合曲线;┄,置信区间。Fig. 4 Dose-response curves of methomyl inhibiting acetylcholinesterase at three typical injection sequencesNote: □, Blank Control; ○, Experimental data; —, Weibull model fit; ┄, Confidence interval.
致谢:感谢中国热带农业科学院热带生物技术研究所贾瑞宗博士在文章修改中给予的帮助。感谢审稿人对文章提出的有建设性的修改意见。
参考文献(References):
[1]葛会林, 刘树深, 陈浮, 等. 测定化学物对萤光素酶抑制毒性的微板发光法研究[J]. 光谱学与光谱分析, 2013(10): 2766-2770
Ge H L, Liu S S, Chen F, et al. Microplate luminometry for toxicity bioassay of chemicals on luciferase [J]. Spectroscopy and Spectral Analysis, 2013(10): 2766-2770 (in Chinese)
[2]Ellman G L, Courtney K D, Andres V, et al. A new and rapid colorimetric determination of acetylcholinesterase activity [J]. Biochemical Pharmacology, 1961, 7(2): 88-95
[3]杜美红, 孙永军, 汪雨, 等. 酶抑制-比色法在农药残留快速检测中的研究进展[J]. 食品科学, 2010, 31(17): 462-466
Du M H, Sun Y J, Wang Y, et al. Advances in the application of enzyme inhibition/colorimetric assay to the rapid detection of pesticide residues [J]. Food Science, 2010, 31(17): 462-466 (in Chinese)
[4]朱岩, 王飞飞, 张亚辉, 等. 3种有机磷农药对水生生物的乙酰胆碱酯酶抑制效应的物种敏感度分析初探[J]. 生态毒理学报, 2016, 11(3): 211-218
Zhu Y, Wang F F, Zhang Y H, et al. A preliminary study on species sensitivity analysis of inhibition effect of three organophosphorus pesticides on acetylcholinesterase in aquatic organisms [J]. Asian Journal of Ecotoxicology, 2016, 11(3): 211-218 (in Chinese)
[5]Pohanka M, Musilek K, Kuca K. Progress of biosensors based on cholinesterase inhibition [J]. Current Medicinal Chemistry, 2009, 16(14): 1790-1798
[6]Pang Y P, Quiram P, Jelacic T, et al. Highly potent, selective, and low cost bis-tetrahydroaminacrine inhibitors of acetylcholinesterase-steps toward novel drugs for treating Alzheimer's disease [J]. Journal of Biological Chemistry, 1996, 271(39): 23646-23649
[7]Ibach B, Haen E. Acetylcholinesterase inhibition in Alzheimer's disease [J]. Current Pharmaceutical Design, 2004, 10(3): 231-251
[8]Ferreira A, Proença C, Serralheiro M L, et al. The in vitro screening for acetylcholinesterase inhibition and antioxidant activity of medicinal plants from portugal [J]. Journal of Ethnopharmacology, 2006, 108(1): 31-37
[9]李维. 鸡血清丁酰胆碱酯酶分离纯化与农药敏感性研究[D]. 成都: 西华大学, 2014: 25-33
Li W. Study on isolation, purification and pesticide sensitivity of buturylcholinesterases from chicken serum [D]. Chengdu: Xihua University, 2014: 25-33 (in Chinese)
[10]李晓婷, 王纪华, 朱大洲, 等. 果蔬农药残留快速检测方法研究进展[J]. 农业工程学报, 2011, 27(S2): 363-370
Li X T, Wang J H, Zhu D Z, et al. Research progress of fast detection methods of fruits and vegetables pesticide residues [J]. Transactions of the Chinese Society of Agricultural, 2011, 27(S2): 363-370 (in Chinese)
[11]廖秀丽, 罗术东, 伍翔, 等. 小峰熊蜂头部乙酰胆碱酯酶测定条件的优化及其对六种常用杀虫剂的敏感性[J]. 昆虫学报, 2011, 54(12): 1361-1367
Liao X L, Luo S D, Wu X, et al. Optimization of conditions for assaying activity of acetylcholinesterase in Bombus hypocrita (Hymenoptera: Apidae) and its sensitivity to six common insecticides [J]. Acta Entomologica Sinica, 2011, 54(12): 1361-1367 (in Chinese)
[12]邱朝坤, 刘晓宇, 林晓娜, 等. 鲫鱼乙酰胆碱酯酶酶活测定条件的优化研究[J]. 食品科学, 2008, 29(8): 425-429
Qiu Z K, Liu X Y, Lin X N, et al. Study on optimization of conditions for analyzing activity of acetylcholinesterase derived from crucian [J]. Food Science, 2008, 29(8): 425-429 (in Chinese)
[13]Ensibi C, Hernández-Moreno D, Míguez Santiyán M P, et al. Effects of carbofuran and deltamethrin on acetylcholinesterase activity in brain and muscle of the common carp [J]. Environmental Toxicology, 2014, 29(4): 386-393
[14]王小红. 酶抑制法检测蔬菜中的有机磷农药残留的方法研究[D]. 武汉: 华中农业大学, 2006: 31-32
Wang X H. Study on methods based on enzyme inhibition principle of determination to organophosphorus residue [D]. Wuhan: Huazhong Agricultural University, 2006: 31-32 (in Chinese)
[15]侯学文, 何衍彪, 徐汉虹. 胆碱酯酶抑制法检测辛硫磷农药残留[J]. 河北师范大学学报, 2003, 27(2): 181-184
Hou X W, He Y B, Xu H H. A method to detect phoxim residue by analyzing the inhibition of cholinesterase [J]. Journal of Hebei Normal University, 2003, 27(2): 181-184 (in Chinese)
[16]Silva E, Rajapakse N, Kortenkamp A. Something from “nothing” - eight weak estrogenic chemicals combined at concentrations below NOECs produce significant mixture effects [J]. Environmental Science & Technology, 2002, 36(8): 1751-1756
[17]汪鹏鹏, 张松林, 靳佳, 等. 辛硫磷和敌百虫协同抑制斑马鱼乙酰胆碱酯酶(AChE)活性[J]. 生态毒理学报, 2017, 12(1): 298-304
Wang P P, Zhang S L, Jin J, et al. Phoxim and trichlorfon synergistically reduce acetylcholinesterase (AChE) activity of zebrafish (Brachydanio rerio) [J]. Asian Journal of Ecotoxicology, 2017, 12(1): 298-304 (in Chinese)
[18]刘保奇, 葛会林, 刘树深. 测定环境污染物对青海弧菌发光强度抑制的微板发光法研究[J]. 生态毒理学报, 2006, 11(2): 186-191
Liu B Q, Ge H L, Liu S S. Microplate luminometry for toxicity bioassay of environmental pollutant on a new type of fresh water luminescent bacterium (Vibrio-qinghaiensis sp.- Q67) [J]. Asian Journal of Ecotoxicology, 2006, 11(2): 186-191 (in Chinese)
[19]梁爽, 于振洋, 尹大强. 环境浓度下磺胺混合物对秀丽线虫(Caenorhabditis elegans)生长、饮食、抗氧化酶及其调控基因表达水平的影响[J]. 生态毒理学报, 2015, 10(4): 88-95
Liang S, Yu Z Y, Yin D Q. Effects of sulfonamide mixtures at environmental concentrations on growth, feeding, catalase activity and the gene expression levels of Caenorhabditis elegans [J]. Asian Journal of Ecotoxicology, 2015, 10(4): 88-95 (in Chinese)
[20]Wilson P C, Foos J F. Survey of carbamate and organophosphorous pesticide export from a South Florida (USA) agricultural watershed: Implications of sampling frequency on ecological risk estimation [J]. Environmental Toxicology and Chemistry, 2006, 25(11): 2847-2852
[21]朱祥伟, 刘树深, 葛会林, 等. 剂量-效应关系两种置信区间的比较[J]. 中国环境科学, 2009, 29(2): 113-117
Zhu X W, Liu S S, Ge H L, et al. Comparision between two confidence intervals of dose-response relationships [J]. China Environmental Science, 2009, 29(2): 113-117 (in Chinese)
[22]中华人民共和国卫生部, 中国国家标准化管理委员会. GB/T 5009.199—2003 蔬菜中有机磷和氨基甲酸醋类农药残留量的快速检测[S]. 北京: 中国标准出版社, 2004
Ministry of Health of the People's Republic of China, National Standardization Administration of China. GB/T 5009.199-2003 Rapid determination for organophosphate and carbamate pesticide residues in vegetables [S]. Beijing: China Standard Press, 2004 (in Chinese)
[23]余淑英, 卢艳, 王星丽, 等. 金针菇乙酰胆碱酯酶抑制剂筛选条件的优化与应用[J]. 食药用菌, 2017, 25(1): 34-39
Yu S Y, Lu Y, Wang X L, et al. Optimization and application of acetylcholinesterase inhibitor screening criteria from the fruiting body of Flammulina velutipes [J]. Edible and Medicinal Mushrooms, 2017, 25(1): 34-39 (in Chinese)
[24]杜晓华. 观赏植物马尾杉内生菌及其次生代谢产物对AChE的抑制活性[D]. 杨凌: 西北农林科技大学, 2003: 23-24
Du X H. Endophytes from Phlegmariurus carinatus and their second metabolites inhibition AChE activity [D]. Yangling: Northwest Sci-Tech University of Agriculture and Forestry, 2003: 23-24 (in Chinese)
[25]丁运华, 陈勇智. 用于检测农药残留的胆碱酯酶酶源的研究进展[J]. 热带农业科学, 2007, 27(5): 73-77
Ding Y H, Chen Y Z. Advances on sources of cholinesterase for pesticides residue determination [J]. Chinese Journal of Tropical Agriculture, 2007, 27(5): 73-77 (in Chinese)
[26]赵飞. 灭多威对乙酰胆碱酯酶及大鼠神经系统的影响[D]. 武汉: 华中科技大学, 2015: 20-21
Zhao F. Effects of methomyl on acetylcholinesterase and nervous system in rats [D]. Wuhan: Huazhong University of Science and Technology, 2015: 20-21 (in Chinese)
[27]Hastings F L, Main A R, Iverson F. Carbamylation and affinity constants of some carbamate inhibitors of acetylcholinesterase and their relation to analogous substrate constants [J]. Journal of Agricultural and Food Chemistry, 1970, 18(3): 497-502
[28]Makrides C, Koukouvas M, Achillews G, et al. Methomyl-induced severe acute pancreatitis: Possible etiological association [J]. Journal of the Pancreas, 2005, 6(2): 166-171

