氮肥减量对华北夏玉米节根内生真菌群落组成的影响
李瑞霞 霍艳丽 李洪杰 王惟帅 张爱平 杨正礼
(1.中国农业科学院农业环境与可持续发展研究所, 北京 100081; 2.河北经贸大学旅游学院, 石家庄 050061;3.河北北方学院基础医学院, 张家口 075000; 4.德州市农业科学研究院, 德州 253015)
0 引言
氮素是作物生长发育的主要限制因子,但土壤中过量氮素的存在既会影响氮肥增产效用的发挥、增加氮素的损失,又易引起环境污染[1]。研究表明,施氮量的50%通过挥发、淋溶、径流和反硝化作用进入环境[2],造成水体富营养化、温室气体排放、土壤退化等严重的环境问题[3]。华北平原是我国的典型农区,氮肥施用过量问题突出。为了解决作物高产与氮肥大量施用引起的环境污染这一矛盾,如何基于作物高产稳产,提高氮肥利用效率已是亟待解决的问题。
CHEN等[4]通过对我国三大粮食作物主产区实施的153个田间试验研究表明,在化肥用量不变情况下,我国水稻、小麦、玉米至少还有30%~50%的增产潜力。近年来大量田间试验也证实,适量减氮有助于作物稳产高产[5-8]。PENG等[5]研究表明,与农民习惯施肥相比,在植物营养生长阶段减施氮肥总用量的30%不仅不会降低产量,反而略有增产,并使氮肥农学利用率翻倍。易琼等[6]在长江中下游平原研究发现,与当地习惯施肥相比,减氮20%~30%时小麦产量没有降低。李录久等[7]在巢湖流域水稻产区,在施氮量180 kg/hm2基础上,适当减少氮肥施用量对水稻产量影响不大。董强等[8]研究表明,3种减量施氮模式较传统施氮模式施氮量减少20%的情况下,玉米产量连续3年无显著变化。因此,确定适宜的减氮量有利于发挥作物增产潜力,提高氮肥利用效率,同时降低环境成本,是我国农业面临的巨大挑战,也是改善全球氮平衡的一项重要举措[9]。
植物内生真菌(Endophytic fungi)是指生活在植物寄主中并度过全部或近乎全部生活周期,而对寄主植物并不引起明显病害的真菌[10]。植物内生真菌作为一种新型的微生物资源,具有提高宿主抗逆能力(干旱、病虫害和重金属等)以及促进宿主对氮、磷等元素的吸收和利用[11-13]。由于根系与土壤接触,其定殖的内生真菌主要来自土壤微生物的侵染。研究表明,氮肥水平能显著影响土壤真菌的多样性和菌群结构组成[14],特别是能改变丛枝菌根的菌群结构[15]。由于丛枝菌根真菌能够增加植物-真菌之间的交互作用,可在减少外源施肥的情况下,促进植物生长[16],为减量施氮提供了可能。
玉米节根分为地上节根(气生根)和地下节根(次生根),由于其分枝多、根毛密、根量大、功能期长,是玉米的主要根系[17],在抗倒伏、水分和营养物质吸收中起着重要作用[18]。灌浆期是玉米产量形成的重要时期,受到研究者的普遍重视。目前,关于灌浆期夏玉米节根内生真菌多样性以及不同节根内生真菌多样性对产量的影响机制尚未见报道。因此,本研究基于田间定位试验,研究氮肥减量对夏玉米节根内生真菌多样性的影响,旨在揭示地上和地下节根内生真菌多样性对产量影响的机制,以期建立合理减氮措施,提高氮肥利用效率,为实现农业可持续发展提供科学依据。
1 试验材料与方法
1.1 试验设计
试验地点位于山东省德州市平原县黄河涯镇德州市现代农业科技园试验基地。德州市平原县属暖温带半干旱地区,土壤类型为砂壤土,年平均降水量547.5 mm,主要集中在6—8月,年平均气温12.9℃,平均无霜期为206 d,年积温4 639℃。试验前耕层(0~20 cm)有机质和碱解氮、有效磷、速效钾质量比分别为13.17 g/kg和26.56、34.27、106 mg/kg,pH值8.54。
在常规施肥270 kg/hm2的基础上,设置3个氮肥减量处理,分别为:0%(CK:270 kg/hm2)、-10%(N1:243 kg/hm2)、-20%(N2:216 kg/hm2)和-30%(N3:189 kg/hm2),采取随机区组设计,3次重复,每个小区面积30 m2,小区间隔1 m,共计12个小区。种植制度为冬小麦-夏玉米轮作,供试作物为夏玉米,品种为鲁宁184,采用机械播种,行距60 cm、株距20 cm。氮肥按照基肥和拔节期追肥6∶4的比例施入,磷(P2O5)和钾(K2O)分别为45、60 kg/hm2,作底肥一次性施入。灌水、除草和喷药等措施同常规田间管理。2016年6月27日播种,10月10日收获。
1.2 根系取样方法
夏玉米灌浆后期(2016年9月27日),在每小区中间部位随机选取植株生长均匀一致的5株玉米,割掉地上部位后在距玉米根10 cm处四周挖断层面,然后沿每株主根方向垂直向下挖20 cm深完整根块,根系样品用清水洗净,然后把茎生节根分为地下节根和地上节根两类,将组织表面的水分用滤纸吸干,浸泡于1%次氯酸钠溶液中50 s,无菌水冲洗3次,再浸泡于75%乙醇溶液1 min,用无菌水冲洗3次,进行表面消毒灭菌。滤纸吸干后,再剪成0.5 cm×0.5 cm的根段,置于无菌袋并保存于-80℃冰箱备用。根样送至北京奥维森基因科技有限公司,进行基因DNA提取、PCR扩增、荧光定量,并应用Illumina MiSeq平台对内生真菌基因ITS1进行测序。
1.3 高通量测序方法
高通量测序作为第二代测序技术,能够一次并行对几十万到几百万条DNA分子进行序列测序,有助于准确分析环境中微生物群落组成和分布。本研究采用此技术,通过Illumina MiSeq 平台进行Paired-end测序,下机数据经过QIIME(V1.8.0)软件过滤、拼接、去除嵌合体,再调用uclust德尔方法[19]对优质序列按相似度大于等于97%进行OTU的聚类,选取每个类最长的序列为代表序列。然后调用RDP-classifier(Version 2.2,http:∥sourceforge.net/projects/rdp-classifier/)数据库对OTU代表序列进行物种注释分析,最终得到每个OTU分类学信息。对于不符合以上标准的 OTU 归为“未分类真菌类群”。
利用 Mothur 软件(Version 1.31.2)计算内生真菌ɑ多样性指数,其中Chao1丰富度指数计算公式为
式中Sobs——检测到的所有OTU总数
N1——只有1条序列的OTU数目
N2——只有2条序列的OTU数目
Shannon-Wiener多样性指数计算公式为
SShannon-Wiener=-∑(ni/N)ln(ni/N)
式中ni——各分类单元中包含的序列数
N——所有数列之和
相似性系数采用Sorenson指数公式
Cs=2j/(a+b)
式中j——2个群落共有物种数
a、b——群落A、B的物种数
1.4 数据分析方法
采用 SPSS 16.0 (SPSS Inc.,Chicago, IL, Version 16.0)对数据进行单因素方差分析(ANOVA),确定氮肥减量对夏玉米地上和地下节根内生真菌多样性和丰度的影响,采用Duncan多重比较法,在0.05水平进行差异显著性检验。采用Pearson系数分析地上和地下节根内生真菌群落组成与产量及产量构成因素之间的相关性。
2 结果与分析
2.1 氮肥减量对夏玉米节根内生真菌多样性指数的影响
由表1可知,地上和地下节根内生真菌多样性对氮肥减量的响应不同。群落丰富度Chao1 指数越大,说明群落丰富度越高。在对照、N1和N3处理中地下节根丰富度大于地上节根,N2处理中地上节根丰富度大于地下节根。Shannon-Wiener指数越大,说明群落多样性越高。在对照和N3两个处理中地下节根Shannon-Wiener指数大于地上节根,N1和N2两处理中地上节根Shannon-Wiener指数大于地下节根。
在地上节根,氮肥减量对Chao1指数影响不显著,其中N2处理Chao1指数最高,N3处理Chao1指数最低,N2和N3处理之间差异显著;氮肥减量显著增加Shannon-Wiener指数,其中N1、N2和N3处理分别增加36.75%、34.63%和12.37%。在地下节根,与对照相比,Chao1指数在N1处理中略有降低,但未达到显著水平;N2和N3两个处理分别显著降低22.30%和28.02%,Shannon-Wiener指数显示N1、N2和N3处理分别显著降低14.02%、14.25%和20.79%(表1)。

表1 不同处理节根内生真菌和土壤真菌多样性指数Tab.1 Nodal root endophytic fungal and soil fungal diversity index in different treatments
注:数据形式为平均值±标准差,a、b和c代表不同处理间的差异显著(P<0.05),下同。
2.2 氮肥减量对夏玉米节根内生真菌群落组成的影响
在门分布水平,除去未鉴定出来的真菌(undentified fungus)外,两类节根内生壶菌门(Chytridiomycota)只出现在CK、N1和N2处理。子囊菌门、担子菌门(Basidiomycota)、球囊菌门和接合菌门(Zygomycota)4个门在所有处理中都有分布,其中子囊菌门为优势菌门,在地上节根内相对丰度为54.15%~78.38%,在地下节根内相对丰度为91.62%~99.10%。在地上节根内,与对照相比,N1处理显著显著提高球囊菌门3443.16%,显著降低子囊菌门丰度15.48%;N3处理显著提高子囊菌门丰度13.39%(图1a)。在地下节根内,N1、N2和N3处理显著提高子囊菌门丰度36.52%、38.60%和30.69%,显著降低担子菌门86.20%、77.87%和93.89%。N1和N3处理分别显著提高球囊菌门丰度336.30%和893.06%,而N1和N2处理却分别显著降低接合菌门丰度79.02%和91.91%(图1b)。
在子囊菌门常见目水平,与对照相比,N1、N2和N3处理显著提高地上节根内格孢菌目丰度,分别提高435.64%、213.89%和809.95%;其中N2处理显著提高粪壳菌目丰度766.75%,N3处理显著降低刺盾炱目丰度(Chaetothyriales)27.39%(图1a)。与对照相比,N1、N2和N3处理显著提高地下节根粪壳菌目139.16%、532.62%、1 319.22%和刺盾炱目丰度335.93%、553.47%、297.83%,显著降低肉座菌目52.78%、15.13%、78.14%和炭角菌目丰度96.74%、98.50%、99.04%,其中N1处理还显著提高格孢菌目丰度1239.23%(图1b)。
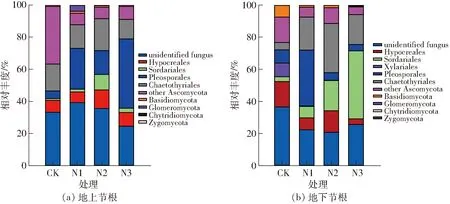
图1 不同处理节根内生真菌门和目水平(子囊菌门的常见目)相对丰度Fig.1 Proportions of nodal root endophytic fungal phyla and common fungal orders (1%) within Ascomycota in different treatments
在OTU水平,由图2a可知,所有处理在地上节根中总计发现379 OTU,各个处理中都有123个相同的OTU,占总OTU比例为32.45%。其中,CK、N1、N2和N3中分别有232、254、264和210 OTU,特有OTU分别有29、18、32和33。与对照相比,N1、N2和N3的相似系数分别为74.90%、69.35%和64.25%。由图2b可知,所有处理在地下节根中总计发现427 OTU,各个处理中都有140个相同的OTU,占总OTU比例为32.79%。CK、N1、N2和N3中分别有394、268、247和257 OTU,独有OTU分别为56、18、13和39。与对照相比,N1、N2和N3的相似系数分别为64.05%、57.72%和54.38%。可见,地上节根与对照的相似系数高于地下节根。
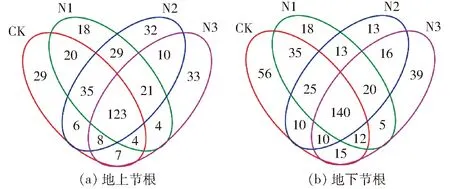
图2 不同处理节根内生真菌特有和共有OTU韦恩图Fig.2 Venn diagrams of nodal root endophytic fungual showing specific and shared OTU of different treatments
2.3 氮肥减量对夏玉米产量和产量构成因素的影响
由表2可知,与对照处理相比,氮肥减量10%~30%对夏玉米百粒质量、穗粒数和产量影响均不显著。夏玉米有效穗数在氮肥减量10%处理有降低趋势,反而在氮肥减量20%~30%两个处理中有增加趋势,均与对照处理差异不明显。可见,在华北地区氮肥减量达30%时夏玉米产量无明显变化。
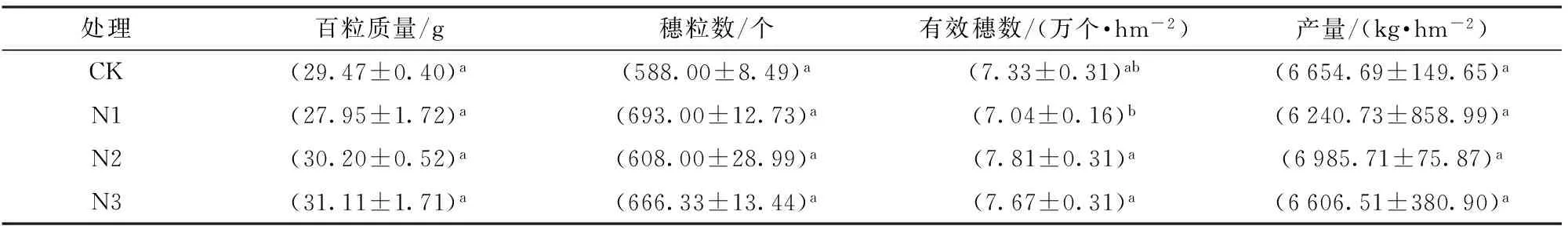
表2 不同处理下夏玉米产量和产量构成因素Tab.2 Summer maize yield and its components in different treatments
Pearson相关性分析表明(表3),夏玉米百粒质量和产量与两类节根内生真菌种群组成均不相关。穗粒数与地上节根内格孢菌目丰度和地下节根内球囊菌门丰度呈显著正相关,与地下节根内肉座菌目丰度呈显著负相关。有效穗数与地下节根内粪壳菌目丰度呈显著正相关。

表3 节根内生真菌群落组成与产量的Pearson相关系数Tab.3 Pearson’s correlation coefficient between nodal root fungi community composition and yield
注:*表示显著相关(P<0.05) 。
3 讨论
本研究发现,在夏玉米灌浆后期,氮肥减量10%~30%对地上节根内生真菌Chao1指数影响不显著,氮肥减量20%~30%时显著降低地下节根内生真菌丰富度Chao1指数;氮肥减量10%~30%显著提高地上节根内生真菌多样性Shannon-Wiener指数,却显著降低地下节根内生真菌同类指数。以上结果说明,内生真菌多样性Shannon-Wiener指数较丰富度Chao1指数敏感,氮肥减量缩小了两类节根之间的差距。这可能是由于玉米灌浆期的上层节根中非结构性碳水化合物含量高于下层节根[20],有利于地上节根内生真菌的侵染,导致地上节根内生真菌多样性Shannon-Wiener指数提高。内生真菌对感染植株的氮代谢和氮积累有显著影响[21],促进植株对氮素的吸收和高效利用。并有研究表明,在玉米生育后期,提高玉米的上层根系质量,维持其较高、较长的活力是促使玉米获得高产的关键[22-23]。可见,氮肥减量提高夏玉米灌浆后期的地上节根内生真菌多样性,将有利于玉米获得高产。
根部是内生菌进入植物体内的主要位点[24],由于根系与土壤接触,其定殖的内生真菌主要来自土壤微生物的侵染。玉米整个生长期内,根的内生真菌定殖率呈上升趋势[25]。在夏玉米灌浆后期,氮肥减量显著提高地上节根内格孢菌目丰度;显著提高地下节根内粪壳菌目和刺盾炱目丰度,却显著降低肉座菌目和炭角菌目丰度。可见,氮肥减量并未显著改变节根内生真菌群落组成,但不同程度地改变了内生真菌类群的丰度,特别是能改变丛枝菌根丰度。在减氮10%处理中地上和地下节根内球囊菌门丰度以及减氮30%处理中地下节根内球囊菌门丰度显著高于对照。球囊菌门真菌提高节根的根系活力,促进玉米生长发育,有利于提高玉米产量[26]。因此,节根内球囊菌门真菌丰度有可能作为氮肥合理减量的指示菌。随着氮肥减量比例增加,节根内生真菌群落与对照之间相似性系数逐渐降低,但总体相似性较高(大于0.50)。地上节根与对照的相似系数高于地下节根,这可能与根系组织内生理条件、组织结构和营养物质等因素不同,从而影响内生真菌的侵染过程,使内生真菌的分布表现出组织偏好性或专一性[27-28]。夏玉米灌浆后期地下节根开始老化,SUN等[28]研究发现,较老的植物组织由于发生表皮降解等变化,有利于内生真菌侵染过程的实现。相关性分析表明,地上节根内格孢菌目和地下节根内球囊菌门真菌有利于穗粒数形成,而地下节根内肉座菌目真菌却抑制穗粒数的形成。地下节根内粪壳菌目真菌促进有效穗数的形成。
本试验仅关注了氮肥减量条件下节根内生真菌群落组成对产量和产量构成因素的影响,而节根内生真菌还有很多未分类或是未确定种属的物种,它们也受到氮肥减量的影响,但其功能和特点尚不清楚,还有待通过深度测序或利用其他先进手段对微生物进行更细致的分类研究,并结合根系生长[29]和根际土壤相关指标进行深入探索。适宜的氮肥减量是保障作物高产稳产,维持土壤肥力和减少农业面源污染的关键。近年来大量研究表明,在农民习惯施氮水平下,减氮20%~30%对水稻、小麦和玉米产量影响不明显,但均是短期结果。因此,尚需对田间定位试验进行跟踪研究,最终确定适宜的减氮比例。
4 结论
(1)夏玉米灌浆后期,在氮肥减量10%~20%时,提高了地上节根内生真菌Chao1和Shannon-Wiener指数,氮肥减量10%~30%降低了地下节根内生真菌的Chao1和Shannon-Wiener指数,其中减氮20%时地上节根内Chao1和Shannon-Wiener指数高于地下节根内两指数。
(2)在门水平,氮肥减量10%时显著提高地上节根内球囊菌门和未分类菌门丰度,显著降低子囊菌门丰度;氮肥减量20%时各菌门丰度变化不显著;氮肥减量30%时显著提高子囊菌门丰度,显著降低未分类菌门丰度。氮肥减量10%~30%显著提高地下节根内子囊菌门丰度,显著降低担子菌门和未分类菌门丰度,其中氮肥减量10%和30%时显著提高球囊菌门丰度,氮肥减量10%~20%时显著降低接合菌门丰度,壶菌门真菌在减氮30%处理中消失。
(3)在子囊菌门常见目水平,氮肥减量10%~30%显著提高地上节根内格孢菌目丰度,其中减氮20%处理显著提高粪壳菌目丰度,显著降低刺盾炱目丰度。氮肥减量10%~30%显著提高地下节根内粪壳菌目和刺盾炱目丰度,显著降低肉座菌目和炭角菌目丰度,其中减氮10%时还显著提高格孢菌目丰度。在OTU水平,氮肥减量10%~20%提高了地上节根内OTU数目,减量10%~30%时降低了地下节根内OTU数目。与对照相比,相似系数随着氮肥减量比例的增加而逐渐降低。
(4)氮肥减量10%~30%对夏玉米产量、百粒质量、穗粒数和有效穗数影响均不明显。相关性分析表明,地上节根内格孢菌目真菌和地下节根内球囊菌门真菌、肉座菌目真菌是影响穗粒数的主要因素。地下节根内粪壳菌目真菌是影响有效穗数的主要因素。经综合比较,减氮30%处理的效果优于其他处理,与对照相比,在灌浆后期可显著提高地上节根子囊菌门和格孢菌目丰度而显著降低未分类菌门丰度,壶菌门真菌消失;显著提高地下节根内子囊菌门、球囊菌门、粪壳菌目和刺盾炱目丰度而显著降低担子菌门、未分类菌门、肉座菌目和炭角菌目丰度,壶菌门真菌消失。
1朱兆良. 农田中氮肥的损失与对策[J]. 土壤与环境, 2000, 9(1): 1-6.
ZHU Zhaoliang. Loss of fertilizer N from plants-soil system and strategies and techniques for its reduction[J]. Soil and Environmental Sciences,2000, 9(1): 1-6. (in Chinese)
2CAMARGO J A, ALONSO A, SALAMANCA A. Nitrate toxicity to aquatic animals: a review with new data for freshwater invertebrates[J]. Chemosphere, 2005, 58: 1255-1267.
3CUI Z L, WANG G L, YUE S C, et al. Closing the N-use efficiency gap to achieve food and environmental security[J]. Environmental Science and Technology, 2014, 48: 5780-5787.
4CHEN X P, CUI Z L, ZHANG F S, et al. Producing more grain with lower environmental costs[J]. Nature, 2014, 514: 486-489.
5PENG S B, BURESH R J, HUANG J L, et al. Strategies for overcoming low agronomic nitrogen use efficiency in irrigated rice systems in China [J]. Field Crops Research, 2006, 96: 37-47.
6易琼, 张秀芝, 何萍, 等. 氮肥减施对稻-麦轮作体系作物氮素吸收、利用和土壤氮素平衡的影响[J]. 植物营养与肥料学报, 2010, 16(5): 1069-1077.
YI Qiong, ZHANG Xiuzhi, HE Ping, et al. Effect of reducing N application on crop N uptake, utilization , and soil N balance in rice-wheat rotation system[J]. Plant Nutrition and Fertilizer Science, 2010, 16(5): 1069-1077. (in Chinese)
7李录久, 王家嘉, 李东平, 等. 减量施氮对水稻生长和肥料利用效率的影响[J]. 安徽农业科学,2013,41(1): 99-100,103.
LI Lujiu, WANG Jiajia, LI Dongping, et al. Effect of decreasing nitrogen application rate on rice growth and nitrogen use efficiency[J]. Journal of Anhui Agricultural Sciences, 2013, 41(1): 99-100,103. (in Chinese)
8董强, 吴得峰, 党廷辉, 等. 黄土高原南部不同减氮模式对春玉米产量及土壤硝态氮残留的影响[J]. 植物营养与肥料学报, 2017, 23(4): 856-863.
DONG Qiang, WU Defeng, DANG Yanhui, et al. Effects of different nitrogen reduction modes on yield of spring maize and nitrate-N residue in soils of the southern Loess Plateau[J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(4): 856-863. (in Chinese)
9LIU C, WATANABE M, WANG Q. Changes in nitrogen budgets and nitrogen use efficiency in the agroecosystems of the Changjiang River basin between 1980 and 2000[J]. Nutrient Cycling in Agroecosystems,2008, 80(1): 19-37.
10PETRINI O. Fungal endophytes of tree leaves[M]∥ANDREWS J H, HIRANO S S. Microbial ecology of leaves. New York:Springer-Vedag,1991:179-197.
11李文超. 中国常见地衣内生真菌多样性及生态分布[D]. 北京: 中国科学院大学, 2008.
LI Wenchao. China’s common lichen and ecological distribution of endophytic fungi diversity[D]. Beijing: University of Chinese Academy of Sciences, 2008. (in Chinese)
12RODRIGUE R J, REDMAN R S, HENSON J M. The role of fungal symbioses in the adaptation of plants to high stress environments[J]. Mitigation and Adaptation Strategies for Global Change, 2004, 9(3): 261-272.
13AZEVEDO J L, MACCHERONI J W, PEREIRA J O, et a1. Endophytic microorganisms: a review on insect control and recent advances on tropical plants[J]. Electronic Journal of Biotechnology, 2000, 3(1):15-16.
14周晶. 长期施氮对东北黑土微生物及主要氮循环菌群的影响[D]. 北京: 中国农业大学, 2017.
ZHOU Jing. Influence of long nitrogen fertilization on microorganisms and major N-cycling related communities in black soil in northeast China[J]. Beijing: China Agricultural University, 2017. (in Chinese)
15LIN X, FENG Y, ZHANG H, et al. Long-term balanced fertilization decreased arbuscular mycorrhizal fungal diversity in an arable soil in North China revealed by 454 pyrosequencing[J]. Environmental Science & Technology, 2012, 46(11): 5764-5771.
16REID A, GREENE S E.How Microbes can help feed the world microbiology colloquium[M]. Washington DC:Issues, 2012.
17PELLERIN S, MOLLIER A, PLENET D. Phosphorus deficiency affects the rate of emergence and number of maize adventitious nodal roots[J]. Agronomy Journal, 2000, 92(4): 690-697.
18HOCHHOLDINGER F, TUBEMSA R. Genetic and genomic dissection of maize root development and architecture[J]. Current Opinion in Plant Biology, 2009, 12(2): 172-177.
19CARON D A, COUNTWAY P D, SAVAI P, et al. Defining DNA-based operational taxonomic units for microbial-eukaryote ecology[J]. Applied and Environment Microbiology,2009, 75(18): 5797-5808.
20刘胜群,宋凤斌,周璇, 等. 灌浆期玉米不同节根的某些生理性状分析[J]. 华北农学报, 2010, 25(6):182-186.
LIU Shengqun, SONG Fengbin, ZHOU Xuan, et al. Study physiological characters of adventitious nodal roots of maize during grain filling[J]. Acta Agriculturae Boreali-Sinica, 2010,25(6): 182-186. (in Chinese)
21LYONS P C, EVANS J J, BACON C W. Effects of the fungal endophyteAcremoniumcoenopialumon nitrogen accumulation and metabolism in tall Fescue[J]. Plant Physiology,1990, 92(3): 726-732.
22鄂玉江, 戴俊英, 顾慰连. 玉米根系的生长规律及其与产量关系的研究[J]. 作物学报, 1988,14(2):149-154.
E Yujiang, DAI Junying, GU Weilian. Studies on the relationship between root growth and yield in maize (ZeaMayzL.)[J]. Acta Agronomica Sinica, 1988, 14(2): 149-154. (in Chinese)
23管建慧, 郭新宇, 王纪华, 等. 玉米不同部位根系生长发育规律的研究[J]. 玉米科学, 2007,15(6): 82-85, 88.
GUAN Jianhui, GUO Xinyu, WANG Jihua, et al. Study on growth and development rule of different parts of maize root[J]. Journal of Maize Sciences, 2007,15(6): 82-85,88. (in Chinese)
24PAN M J, RADEMAN S, KUNER K, et al. Ultrastructural studies on the colonization of banana tissue andFusariumoxysporumf. sp. Cubense race 4 by the endophytic bacteriumBurkholderiacepacia[J]. Journal of Phytopathology, 1997, 145:479-486.
25禹乐乐. 玉米内生真菌多样性及其与宿主关系研究[D]. 郑州:郑州大学, 2012.
YU Lele. Study on the relationship between the endophytic fungi diversity and its host[D]. Zhengzhou: Zhengzhou University, 2012. (in Chinese)
26薛璟花,莫江明,李炯,等. 氮沉降对外生菌根真菌的影响[J]. 生态学报,2004, 24(8): 1785-1795.
XUE Jinghua, MO Jiangming, LI Jiong, et al. Effects of nitrogen deposition on ectomycorrhizal fungi[J]. Acta Ecologica Sinica, 2004, 24(8): 1785-1795. (in Chinese)
27ALY A H, DEBBAB A, PROKSCH P. Fungal endophytes: unique plant inhabitants with great promises[J]. Applied Microbiology and Biotechnology, 2011, 90(6): 1829-1845.
28SUN J Q, GUO L D, ZANG W, et al. Diversity and ecological distribution of endophytic fungi associated with medicinal plants[J]. Science in China Series C: Life Sciences, 2008, 51: 751-759.
29银敏华, 李援农, 李昊, 等. 氮肥运筹对夏玉米根系生长与氮素利用的影响[J/OL].农业机械学报, 2016, 47(6):129-138.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20160617&journal_id=jcsam. DOI:10.6041/j.issn.1000-1298.2016.06.017.
YIN Minhua, LI Yuannong, LI Hao, et al. Effects of nitrogen application rates on root growth and nitrogen use of summer maize[J/OL].Transactions of the Chinese Society for Agricultural Machinery, 2016,47(6):129-138. (in Chinese)

