两种大豆蛋白-磷脂酰胆碱纳米乳液粉末化特性研究
江连洲 张潇元 刘 龄 李 杨 陈复生 王中江
(1.东北农业大学食品学院, 哈尔滨 150030; 2.河南工业大学粮油食品学院, 郑州 450052)
0 引言
β-胡萝卜素是广泛存在于自然界中的四萜烯类有机色素,是人机体内极为重要的维生素A来源[1-2],而且生理学研究发现β-胡萝卜素能够显著清除机体自由基、抗氧化及保护机体免疫细胞不受某些自由基的侵扰[3-4],进而避免机体内一些慢性疾病的产生[5-6],β-胡萝卜素还具有促进细胞分裂、促进胚胎发育、提高机体免疫力以及保护视力等功能,使其在功能性食品行业内拥有广阔的市场。然而,β-胡萝卜素作为脂溶性物质,水性介质中溶解度差、生物利用率低、易氧化,在食品生产加工及储藏等方面具有明显的局限性[7]。
近年来,陈冬等[8]和YUAN等[9]分别利用超声和高压均质法制备了稳定的纳米乳液,虽然该乳液在生物利用率和稳定性等方面与未包埋的油相相比,具有极为显著的优势,但纳米乳液自身是将水相作为基质制备的产品,在储藏等方面仍然具有一定的局限性。其次,食品加工对于固体物料的需求以及便携性的考虑,使纳米乳液在应用上受到一定限制。真空冷冻干燥技术是在真空下将冰升华而达到干燥目的,既可以保持乳液的优良品质又能够达到较快的干燥速率,将纳米乳液中的特定油溶性营养素包埋在壁材的玻璃化基质中,进而得到可以长时间储藏且广泛应用的粉末状产品[10]。MORAIS等[11]通过分析纳米乳液冻干粉末复原乳液粒径和ζ-电位发现,多糖小分子添加到蛋白质中制备成的纳米乳液冻干粉末稳定性相对较好且易于运输。MAREFATI等[12]研究指出采用冻干法制备的淀粉纳米乳液粉末具有良好的水复溶性,粉末可至少保持80%的油含量。目前,对复合纳米乳液的真空冷冻干燥技术仅停留在制备条件优化阶段,对真空冷冻干燥纳米乳液粉末产品的复溶特性、包埋效率及冻干对蛋白结构的影响等方面缺乏系统研究。
本文通过扫描电子显微镜(SEM)、激光粒径分析仪、红外光谱等手段研究大豆蛋白-磷脂酰胆碱纳米乳液真空冷冻干燥粉末的微观结构、粒径、晶型转变及壁材与芯材之间的相互关系,旨在弥补纳米乳液水相基质的不稳定性和应用等缺陷,以期为大豆蛋白-磷脂酰胆碱纳米乳液应用于食品工业生产提供数据支持和科学依据。
1 材料与方法
1.1 材料与试剂
大豆蛋白,蛋白质量分数89.21%(山东省高唐蓝山集团);磷脂酰胆碱(北京索莱宝科技有限公司);β-胡萝卜素(北京索莱宝科技有限公司);葵花籽油(中粮集团福临门);其它试剂均为分析纯。
1.2 仪器与设备
ALPHA 1-4 LSC型冷冻干燥机(德国Christ公司);Hitachi S-3400型扫描电子显微镜(日立高新技术公司);超声波细胞破碎仪(宁波新芝生物科技股份有限公司);实验型高压均质机(英国Stansted Fluid Power公司);Zetasizer Nano-ZS90型粒度电位仪(英国马尔文公司);Dionex Ultimate HPLC系统(美国Thermo Fisher公司);S3500型激光粒径仪(美国Microtrac公司);MAGNA-IR560型傅里叶红外光谱仪(美国尼高丽公司)。
1.3 方法
1.3.1粗乳液的制备
参考LEE等[13]的方法将0.1 mg/mL β-胡萝卜素溶于50 mg/mL葵花籽油中,混合搅拌至完全溶解,形成油相;将15 mg/mL的大豆蛋白和2 mg/mL的磷脂酰胆碱溶于缓冲液(质量浓度0.1 mol/L、pH值7.0的磷酸盐缓冲溶液)中,室温(20℃)下连续搅拌120 min,形成水相,在高速分散器的搅拌下把含有β-胡萝卜素的油相加到水相中,20 000 r/min剪切5 min,形成粗乳液。
1.3.2超声处理纳米乳液的制备
将粗乳液通过超声波细胞破碎仪进一步处理即得超声处理大豆蛋白-磷脂酰胆碱纳米乳液(Ultrasonic treatment soybean protein-phosphatidyl choline original nanoemulsion,U-SP-PC-O)(质量浓度0.1 mg/mL)。超声处理的方法及条件设定参照文献[14]并进行一定修改。首先将超声波处理器的变幅杆插入液面下3 cm,超声功率500 W下处理9 min,超声时间5 s,间隔时间5 s,采用冰水浴保持低温。
1.3.3高压均质处理纳米乳液的制备
将粗乳液通过高压均质机进一步均质乳化即得高压均质大豆蛋白-磷脂酰胆碱纳米乳液(High pressure homogeneou original nanoemulsion,H-SP-PC-O)(质量浓度0.1 mg/mL)。高压均质处理的方法及条件设定参照文献[15]并进行一定修改。高压均质压力为100 MPa,均质次数为4次,采用冰水浴保持低温。
1.3.4纳米乳液粉末的制备
分别对超声处理纳米乳液和高压均质处理纳米乳液使用真空冷冻干燥法得到两种不同处理方法的大豆蛋白-磷脂酰胆碱纳米乳液粉末。本实验采用美国SIM公司的FD5-3型冷冻干燥机,-50℃温度下冷冻12 h。
1.3.5真空冷冻干燥纳米乳液粉末的复水性以及水复溶乳液粒径的测定
将真空冷冻干燥纳米乳液粉末按照原始纳米乳液蛋白比例(质量浓度10 mg/mL)与一定量0.1 mol/L、pH值7.0的磷酸盐缓冲溶液进行复溶,即得超声处理大豆蛋白-磷脂酰胆碱复原乳液(Ultrasonic treatment soybean protein-phosphatidyl choline recoveremulsion,U-SP-PC-R)与高压均质大豆蛋白-磷脂酰胆碱复原乳液(High pressure homogeneou recover emulsion,H-SP-PC-R),采用Zetasizer Nano-90型粒度分析仪测定原始纳米乳液和真空冷冻干燥粉末复溶乳液的平均粒径。测定前先将乳液用0.1 mol/L、pH值7.0的磷酸盐缓冲溶液以1∶1 000稀释,以防止多个角度的散射效应。
1.3.6真空冷冻干燥纳米乳液粉末的微观形态观察
将真空冷冻干燥后的粉末充氮气密封、避光储藏,测量时首先用导电双面胶将真空冷冻干燥粉末固定在金属样品平台上,轻吹去多余的粉末,置于离子溅射仪的样品舱中,在15 mA的电流下喷金90 s,样品取出后,装入扫描电子显微镜(15 kV)观察室,进行观察。
1.3.7真空冷冻干燥纳米乳液粉末的粒径分布测定
采用S3500型激光粒径仪测定真空冷冻干燥纳米乳液粉末分布的情况,实验中将粉末直接加载到干法配件上,打开吸尘器抽真空,直接进行测定。测定参数为:样品折射率1.5,介质折射率1.3,设置遮光率10%~20%,测定时折光率为10%~15%。
1.3.8真空冷冻干燥纳米乳液粉末β-胡萝卜素产率和效率的测定
(1)HPLC测定β-胡萝卜素方法的确定
采用HPLC系统对真空冷冻干燥粉末复原乳液中β-胡萝卜素的含量进行测定[16]。实验选择适用于脂溶性物质分离的C30色谱柱,柱温:25℃。进样体积:20 μL/次,检测波长:450 nm。流动相A为甲醇,流动相B为甲基叔丁基醚,流速:1.0 mL/min。将梯度洗脱程序设定为:0~4 min,从90%A、10%B线性变为70%A、30%B;4~7 min,线性变为15%A、85%B;然后保持8 min,最后在17 min之内,线性变至90%A、10%B。
(2)粉末中总β-胡萝卜素含量的测定
取约0.2 g真空冷冻干燥后的粉末,与大约1 g 0.1 mol/L pH值7.0的磷酸盐缓冲溶液进行搅拌复溶,在此搅拌过程中使用锡纸避光处理。然后根据上述HPLC法测定冻干粉末复原乳液中β-胡萝卜素含量。
(3)粉末中表面β-胡萝卜素浓度的测定
取0.5 g真空冷冻干燥后的粉末,加入大约2 mL的正己烷并在常温下充分搅拌3 min,搅拌时使用锡纸进行避光处理。将得到的样品在3 000 r/min条件下离心10 min,继续重复上述步骤,至有机相颜色不变时停止,将所得有机相合并后定容[17]。通过HPLC系统测定有机相中β-胡萝卜素的浓度。包埋效率和包埋产率计算公式为
(1)
(2)
式中Y1——包埋效率,%
Y2——包埋产率,%
m1——粉末表面β-胡萝卜素的质量,g
m2——粉末中总的β-胡萝卜素的质量,g
m3——初始在产品中添加的β-胡萝卜素质量,g
1.3.9真空冷冻干燥纳米乳液粉末的红外光谱测定
红外光谱的测定参考QIN等[18]的方法并进行一定修改,首先取1 mg真空冷冻干燥纳米乳液粉末,加入100 mg溴化钾压片后测定FT-IR。测定波数范围为400~4 000 cm-1的吸收光谱,设定分辨率为4 cm-1,波数精度为0.01 cm-1,扫描次数64次,环境温度25℃。谱图处理利用Peakfit软件,在谱带范围内(酰胺Ⅰ带1 600~1 700 cm-1)对真空冷冻干燥纳米乳液粉末蛋白质的红外光谱依次进行基线校正、去卷积以及二阶导数拟合,最后通过多次拟合直至拟合残差最小。
1.3.10数据统计分析
每次实验作3次平行,结果用平均值±标准差表示,组间差异显著性采用t检验分析(p<0.05)。采用Origin 9.1软件、OMNIC软件包、Peakfit Version 4.12软件分析等进行数据分析、图表处理及图谱分析处理。
2 结果与分析
2.1 真空冷冻干燥纳米乳液粉末的水复溶性
为了进一步了解大豆蛋白-磷脂酰胆碱纳米乳液真空冷冻干燥后粉末的复原乳液性质,将真空冷冻干燥粉末以原始纳米乳液蛋白比例(10 mg/mL)与一定量的磷酸盐缓冲液进行复溶,图1是将大豆蛋白-磷脂酰胆碱纳米乳液进行真空冷冻干燥后再通过水复溶乳液的照片。如图1所示,冻干粉末能够很好地与水相混合,表现出良好的水复溶性,真空冷冻干燥粉末复原乳液体系均一,无结晶、结块等现象发生,极大地提高了纳米乳液在食品产业中的应用。

图1 大豆蛋白-磷脂酰胆碱原始乳液及真空冷冻干燥粉末复原乳稀释液照片Fig.1 Images of SP-PC original and diluted reconstituted lyophilized SP-PC nanoemulsion powders
图2所示为利用大豆蛋白-磷脂酰胆碱原始纳米乳液和真空冷冻干燥后复原乳液的粒径分布。结果表明,真空冷冻干燥纳米乳液粉末复溶后均呈现出单峰分布,超声处理及高压均质制备纳米乳液粉末复溶后平均粒径分别为345.9、282.3 nm。与原始纳米乳液的粒径分布相比,真空冷冻干燥纳米乳液粉末复溶后的平均粒径均略有增大。根据DONSI等[19]的研究结果显示,这可能是由于在乳液冻结成冰过程中大量液滴聚合引发的,但大豆蛋白-磷脂酰胆碱复合体系在油水界面形成一层厚厚的乳化剂,极大程度上阻止了乳液进一步聚合。因此如表1所示,与大豆蛋白-磷脂酰胆碱原始纳米乳液的粒径相比,复原乳液仍保持300 nm左右的纳米乳液粒径,而且所有乳液的分散性指数均在0.3左右。比较可知,通过高压均质制备的纳米乳液冻干粉末复溶后平均粒径较低,表明高压均质制备的纳米乳液更适于真空冻干粉末化操作。

图2 大豆蛋白-磷脂酰胆碱原始乳液和真空冷冻干燥β-胡萝卜素粉末复原乳液的粒径分布Fig.2 Particle size distributions of SP-PC original and reconstituted freeze-dried β-carotene nanoemulsions powders
2.2 真空冷冻干燥纳米乳液粉末的微观结构
图3所示为超声及高压均质制备的真空冷冻干燥大豆蛋白-磷脂酰胆碱纳米乳液粉末的扫描电子显微结构。由图3可知,经过超声及高压均质制备的纳米乳液粉末呈现为致密的类球形结构,粉末表面无裂缝和孔隙,表明β-胡萝卜素能很好地被包埋。比较可知,高压均质制备纳米乳液冻干粉末表面更为平整,表明高压均质处理增强了大豆蛋白-磷脂酰胆碱与油相组分的交互作用以抵抗冻干水分升华对乳化界面的影响,这种现象也补充说明了高压均质制备纳米乳液冻干粉末的水复溶粒径较低。
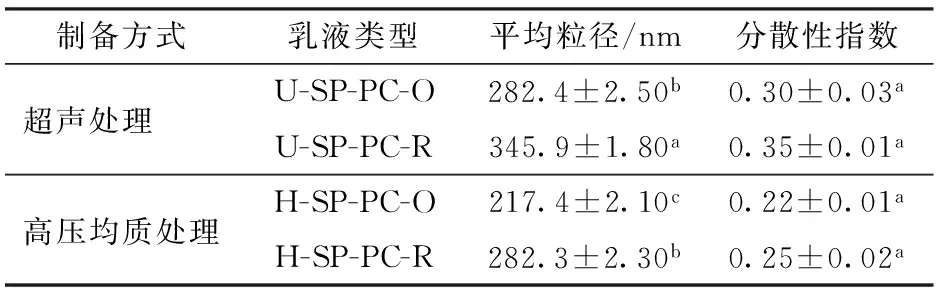
表1 大豆蛋白-磷脂酰胆碱原始乳液和真空冷冻干燥大豆蛋白-磷脂酰胆碱粉末复原乳液的平均粒径和分散性指数Tab.1 Particle size and dispersivity index of β SP-PC original and reconstituted lyophilized SP-PC nanoemulsions powders
注:同列不同字母表示数据间有显著性差异(P<0.05),下同。

图3 真空冷冻干燥大豆蛋白-磷脂酰胆碱纳米乳液粉末的显微结构Fig.3 Outer structure of lyophilized SP-PC nanoemulsion powders
2.3 真空冷冻干燥纳米乳液粉末的粒径分布
图4所示为使用激光粒径分布仪进行干法测定真空冷冻干燥大豆蛋白-磷脂酰胆碱纳米乳液粉末,得到粉末颗粒的粒径大小及分布的情况。由图4中颗粒的累积分布和微分分布图谱可以看出,超声处理制备得到的大豆蛋白-磷脂酰胆碱冻干粉末粒径主要分布在2~20 μm之间,且粒径总体呈分布双峰分布,体积平均粒径为8.24 μm;高压均质制备纳米乳液冻干粉末粒径主要分布在2~10 μm之间,粒径分布总体呈现单峰分布,体积平均粒径为6.13 μm。通过比较可知,高压均质制备纳米乳液冻干粉末颗粒粒径较低,这与扫面电镜观测结果相一致,而较低的颗粒粒径与高压均质制备纳米乳液冻干粉末水复溶后平均粒径低存在一定的相关性。纳米乳液冻干粉末复溶状态下粒径为纳米级而粉末状态下粒径为微米级,这主要是由冻干水分升华过程中界面膨胀所致。
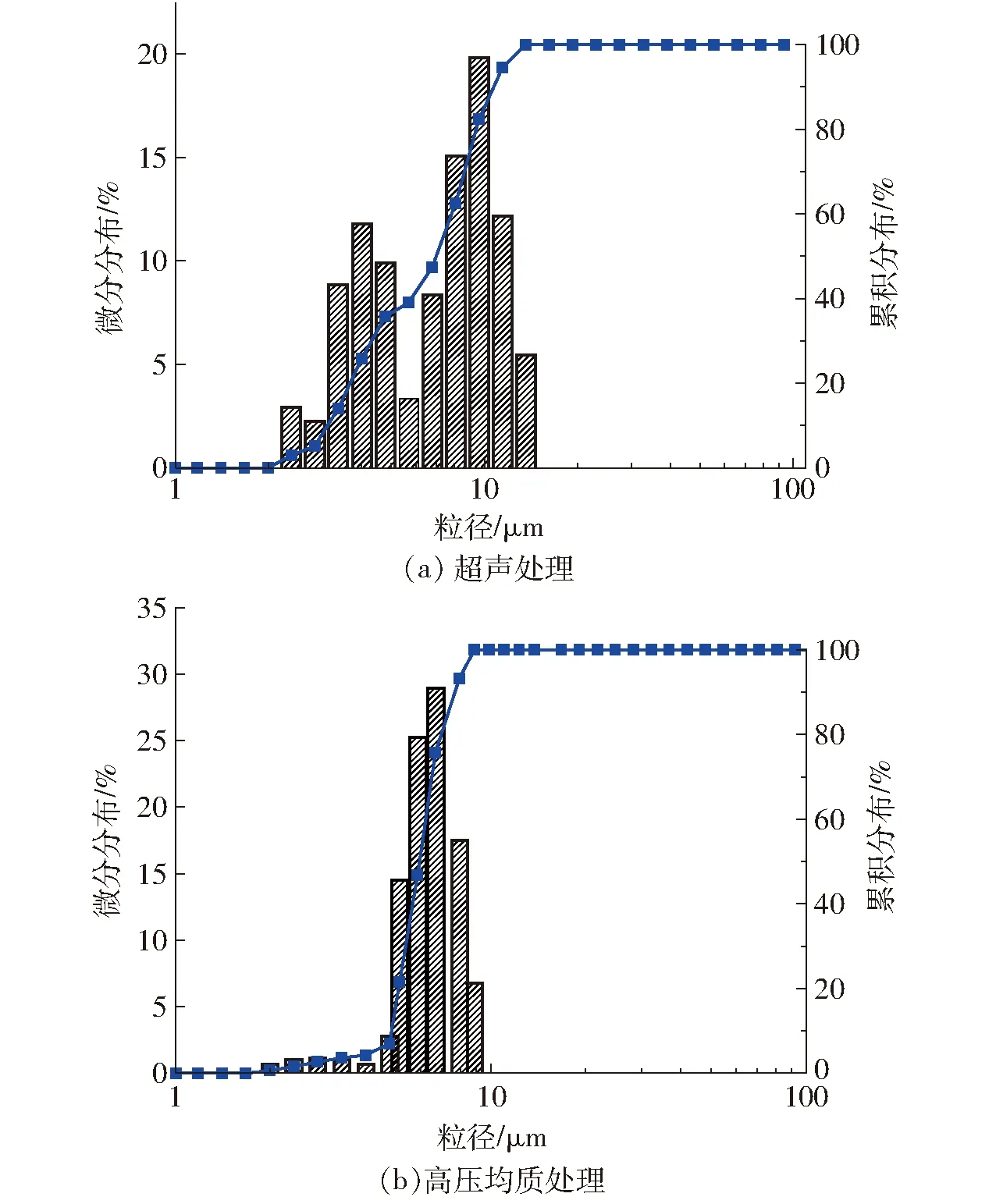
图4 真空冷冻干燥大豆蛋白-磷脂酰胆碱纳米乳液粉末的粒径分布Fig.4 Particle size distributions of lyophilized SP-PC nanoemulsion powders
2.4 真空冷冻干燥纳米乳液粉末的包埋产率及效率
前述探讨中发现真空冷冻干燥并没有对大豆蛋白-磷脂酰胆碱纳米乳液的粒径等性质产生较大影响,同时粉末稀释性和分散性均良好。但由于β-胡萝卜素易受热、强酸碱、光照、氧化作用等影响造成一定损失,因此本研究对超声处理及高压均质制备的真空冷冻干燥大豆蛋白-磷脂酰胆碱乳液粉末包埋产率及效率进行考察。由图5可知,2种处理方式制备的纳米乳液冻干粉末的包埋产率和效率均较高,均大于90%,由此证实真空冷冻干燥过程可有效防止β-胡萝卜素损失。通过比较发现,超声制备的纳米乳液冻干粉末的包埋产率、包埋效果均略优于高压均质制备的纳米冻干粉末。MORTENSON等[20]研究表明,这可能是由于高压均质制备的小粒径液滴在冷冻过程中蛋白质内的冰核增加进而引起部分包埋物外泄导致的。
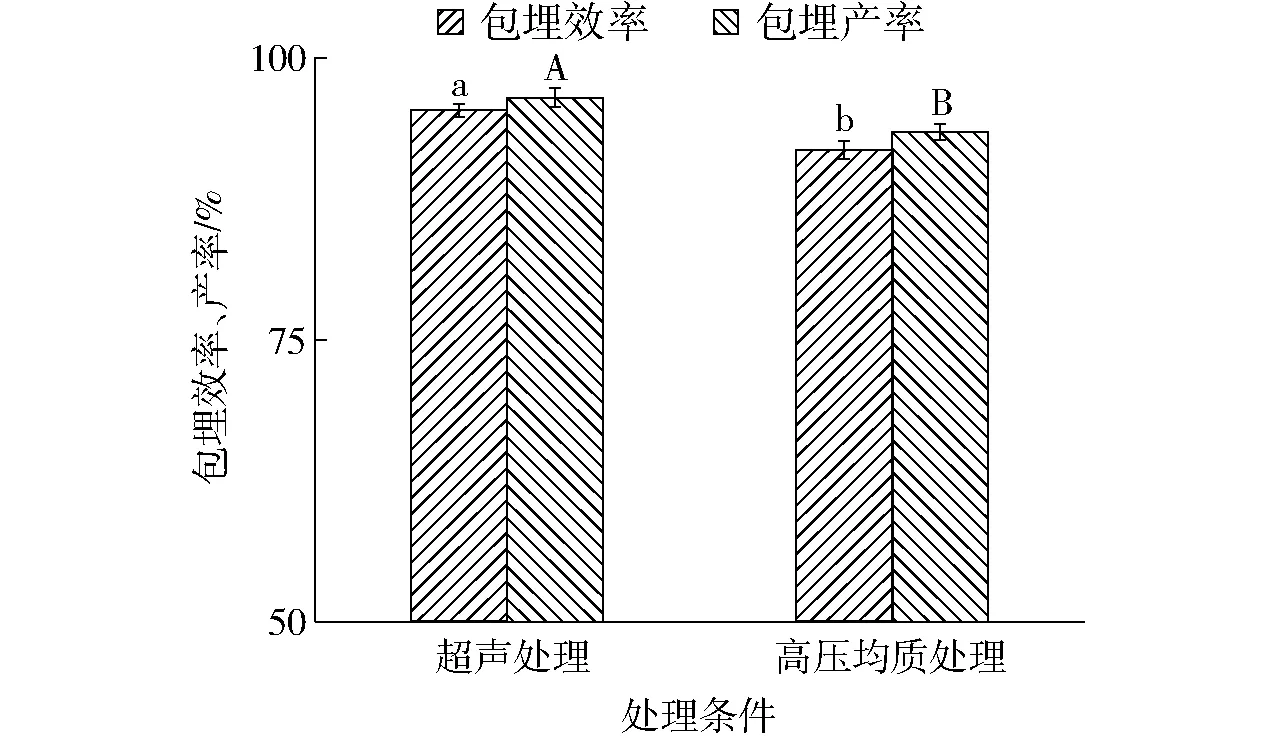
图5 不同处理条件对真空冷冻干燥大豆蛋白-磷脂酰胆碱纳米乳液粉末包埋效率和产率的影响Fig.5 Effect of different treatments on encapsulation efficiency and yield of lyophilized SP-PC nanoemulsion powders
2.5 真空冷冻干燥纳米乳液粉末的红外光谱
红外光谱是利用分子在不同波长处的振动进而通过相应红外辐射吸收所形成的红外吸收光谱对分子的基团和化学键进行检测[21]。吸收峰的位置和强弱主要与化学键或基团的种类以及其所处的环境相关,如果存在一些诱导、共轭或是空间效应,吸收峰的位置会随之发生改变[22],若有新的化学键的生成,图谱上也会显示出新的吸收峰[23]。在此,使用红外光谱分别测定超声处理及高压均质制备的真空冷冻干燥纳米乳液粉末,并通过对比其特征吸收光谱的变化,对冻干粉末中大豆蛋白二级结构的变化进行分析。图6所示为超声处理及高压均质作用制备的真空冷冻干燥纳米乳液粉末中大豆蛋白的红外光谱。
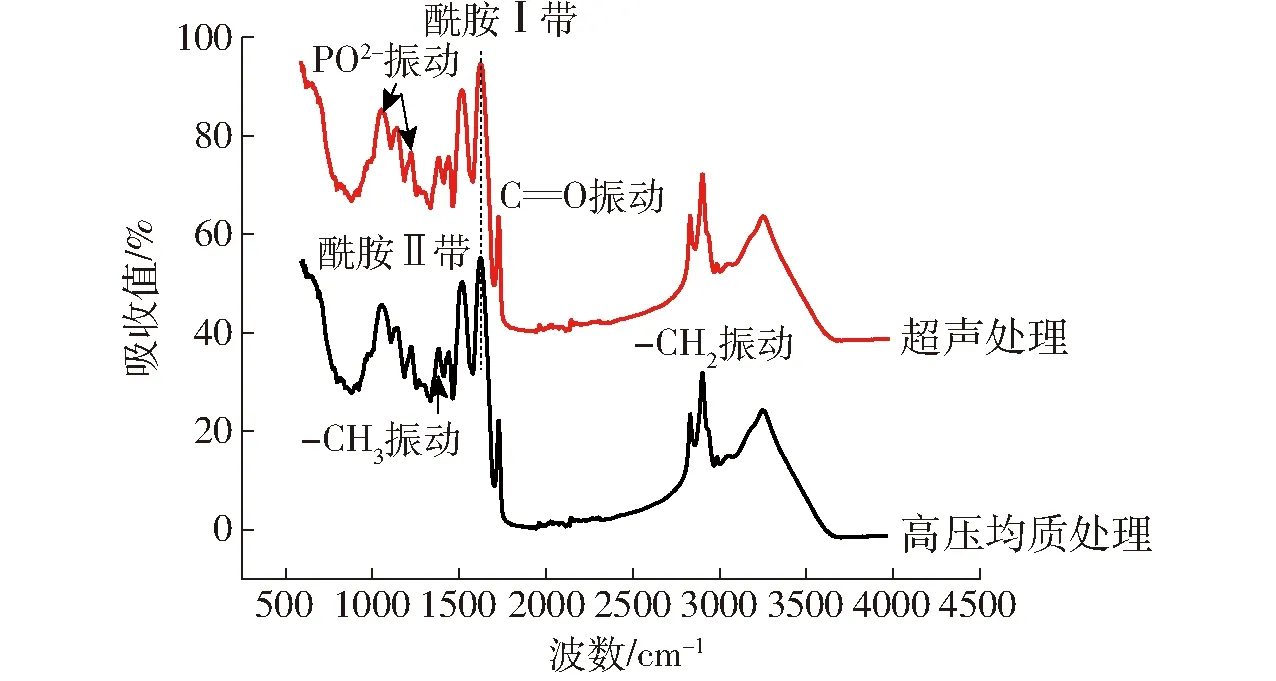
图6 不同预处理真空冷冻干燥大豆蛋白-磷脂酰胆碱纳米乳液粉末的FTIR光谱图Fig.6 IR spectrogram of different treatments on freeze-dried β-carotene nanoemulsion powders


在蛋白质的红外图谱中,通过分析酰胺I带得到真空冷冻干燥大豆蛋白-磷脂酰胆碱纳米乳液粉末蛋白质的二级结构信息,同时利用波段缩小技术对红外图谱中的酰胺I带进行处理,进而得到真空冷冻干燥粉末蛋白质的α-螺旋、β-转角、β-折叠、无规则卷曲等二级结构的定性定量信息。对蛋白质二级结构进行定量分析的方式有多种,其中二阶导数IR去卷积光谱拟合分析结果较为准确[25]。大豆蛋白的酰胺I带在二阶导数光谱中的相应位置归属面积与对应结构模式相对含量呈正相关。参考已有研究,各子峰与二级结构之间的对应关系为:1 615~1 637 cm-1和1 682~1 700 cm-1为β-折叠结构[26];1 646~1 664 cm-1为α-螺旋结构[27];1 637~1 645 cm-1为无规则卷曲结构;1 664~1 681 cm-1为β-转角结构[28]。图7显示真空冷冻干燥大豆蛋白-磷脂酰胆碱纳米乳液粉末的大豆蛋白质去卷积拟合定量图谱。如图7所示,将纳米乳液冻干粉末中蛋白质的酰胺I带原始图谱做二阶导数并采用Gauss面积法拟合,确定各峰位归属后计算其积分面积,从而得到各种二级结构种类及含量。
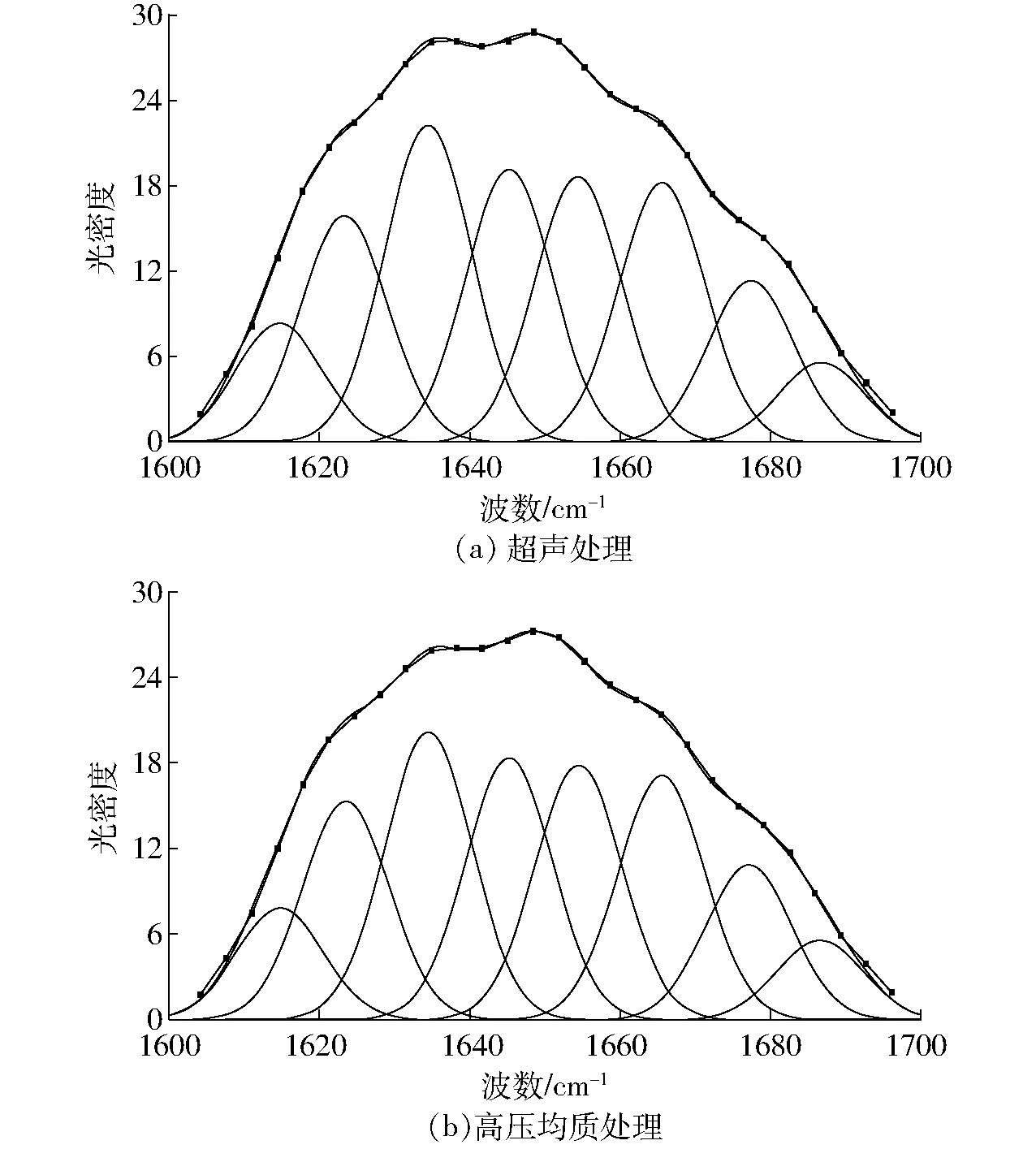
图7 不同预处理真空冷冻干燥大豆蛋白-磷脂酰胆碱纳米乳液粉末去卷积酰胺Ⅰ带二阶导数拟合图谱Fig.7 Second-derivative FTIR spectra in amide I region and Gaussian curve fitting for different treatments on lyophilized SP-PC nanoemulsion powders
如图7所示,利用傅里叶红外光谱分析不同预处理条件下真空冷冻干燥粉末蛋白质的酰胺Ⅰ带经过去卷积后含有8个峰,包括1 614、1 623、1 634、1 645、1 654、1 665、1 677、1 686 cm-1,蛋白质二级结构含量如表2所示,超声及高压均质制备大豆蛋白-磷脂酰胆碱纳米乳液冻干粉末的大豆蛋白中β-折叠构象为主要二级结构单元,比较可知超声与高压均质制备的纳米乳液冻干粉末大豆蛋白中二级结构组成较相似,可以推测两种纳米乳液在真空冷冻干燥制备过程中大豆蛋白发生了相似的结构重排。而高压均质制备纳米乳液冻干粉末的蛋白α-螺旋与β-折叠结构略低,LEE等[29]研究表明α-螺旋与β-折叠结构较低可能是由于高压均质处理诱导原有维系螺旋及折叠结构的氢键取向变化,大豆蛋白结构更松散、稳定性降低,表现出更大的柔性。
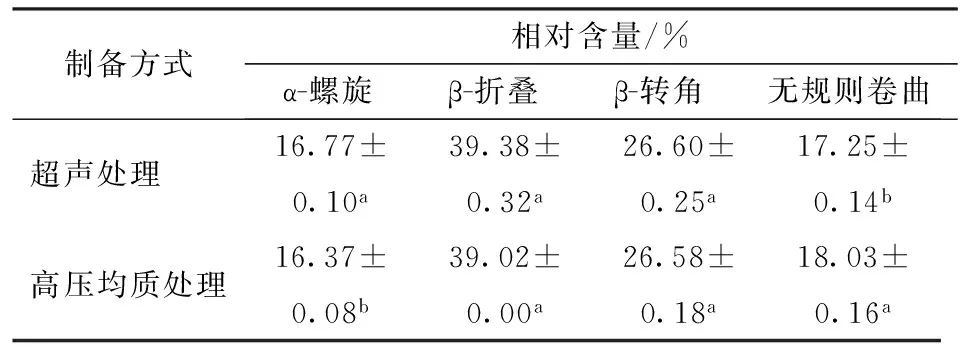
表2 真空冷冻干燥大豆蛋白-磷脂酰胆碱纳米乳液粉末中大豆蛋白二级结构特征Tab.2 Characteristics of protein secondary structure of lyophilized SP-PC nanoemulsion powders
3 结束语
直接使用真空冷冻干燥法将稳定的纳米乳液进行了冻干,得到大豆蛋白-磷脂酰胆碱纳米乳液的粉末,并进一步通过扫描电子显微镜、激光粒径分析仪、红外光谱等手段对真空冷冻干燥粉末以及复原乳液的物理化学等特性进行研究。结果表明:冻干粉末复原乳液水复溶性良好,基本保持了与原始乳液相同的纳米级粒径和分散性指数,稳定性并未出现明显变化。SEM及冻干粉末的粒径分布显示超声和高压均质制备的纳米乳液粉末结构致密均匀,表面无裂缝和孔隙,且高压均质制备粉末的表面更为平整,粒径分布总体呈现单峰分布,粒径平均值仅为6.13 μm。使用超声和高压均质制备的纳米乳液冻干粉末的包埋产率和效率均达到90%以上,同时超声制备的纳米乳液冻干粉末更有利于β-胡萝卜素的包埋,更好地防止β-胡萝卜素损失。采用红外光谱学实验验证后发现高压均质制备纳米乳液粉末的蛋白α-螺旋与β-折叠结构含量略低。综上所述,本研究为大豆蛋白-磷脂酰胆碱纳米乳液应用于食品工业生产提供了一定的理论依据。
1FERREIRA J E M, RODRIGUEZ-A M D B. Degradation of lycopene and β-carotene in model systems and in lyophilized guava during ambient storage: kinetics, structure, and matrix effects [J]. Journal of Food Science, 2008, 73(8): C589-C594.
2YONEKURA L, NAGAO A. Intestinal absorption of dietary carotenoids[J]. Molecular Nutrition & Food Research, 2007, 51(1):107-115.
4SOTIRIOS K, MICHAEL H G. Antioxidant properties of carotenoids in vitro and in vivo[J]. Food Reviews International, 2004, 20(2):99-121.
5HOU Z, ZHANG M, LIU B, et al. Effect of chitosan molecular weight on the stability and rheological properties of β-carotene emulsions stabilized by soybean soluble polysaccharides[J]. Food Hydrocolloids, 2012, 26(1):205-211.
6WANG P, LIU H J, MEI X Y, et al. Preliminary study into the factors modulating β-carotene micelle formation in dispersions using an in vitro digestion model[J]. Food Hydrocolloids, 2012, 26(26):427-433.
7刘夫国,王迪,杨伟,等.乳铁蛋白-多酚对β-胡萝卜素乳液稳定性的影响[J/OL].农业机械学报,2015,46(6):212-217,225.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?file_no=20150630&flag=1.DOI:10.6041/j.issn.1000-1298.2015.06.030.
LIU Fuguo,WANG Di,YANG Wei,et al.Effect of lactoferrin-polyphenol conjugates on stability of β-carotene emulsions[J].Transactions of the Chinese Society for Agricultural Machinery,2015,46(6):212-217,225.(in Chinese)
8陈冬, 张晓阳, 刘尧政,等. 姜油纳米乳液超声波乳化制备工艺及其稳定性研究[J/OL]. 农业机械学报, 2016, 47(6):250-258.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?file_no=20160633&flag=1.DOI:10.6041/j.issn.1000-1298.2016.06.033.
CHEN Dong,ZHANG Xiaoyang,LIU Yaozheng et al.Study on preparation and stability of ginger oil nano-emulsions[J/OL].Transactions of the Chinese Society for Agricultural Machinery,2016,47(6):250-258.(in Chinese)
9YUAN Y, GAO Y, ZHAO J, et al. Characterization and stability evaluation of β-carotene nanoemulsions prepared by high pressure homogenization under various emulsifying conditions[J]. Food Research International, 2008, 41(1):61-68.
10GHARSALLAOUI A, ROUDAUT G, CHAMBIN O, et al. Applications of spray-drying in microencapsulation of food ingredients: an overview[J]. Food Research International, 2007, 40(9):1107-1121.
11MORAIS A R, ALENCAR É D, JUNIOR F H, et al. Freeze-drying of emulsified systems: a review[J]. International Journal of Pharmaceutics, 2016, 503(1-2):102-114.
12MAREFATI A, RAYNER M, TIMGREN A, et al. Freezing and freeze-drying of pickering emulsions stabilized by starch granules[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2013, 436(35):512-520.
13LEE S J, MCCLEMENTS D J. Fabrication of protein-stabilized nanoemulsions using a combined homogenization and amphiphilic solvent dissolution/evaporation approach[J]. Food Hydrocolloids, 2010, 24(6-7):560-569.
14KEERATI-U-R M, CORREDIG M. Effect of dynamic high pressure homogenization on the ggregationstate of soy protein[J]. Journal of Agricultural & Food Chemistry, 2009, 57(9):3556-3562.
15SORGENTINI D A, WAGNER J R. Comparative study of structural characteristics and thermal behavior of whey and isolate soybean proteins[J]. Journal of Food Biochemistry, 2010, 23(5):489-507.
16ARIAS R, LEE T C, LOGENDRA L, et al. Correlation of lycopene measured by HPLC with theL,a,bcolor readings of a hydroponic tomato and the relationship of maturity with color and lycopene content [J]. Journal of Agricultural and Food Chemistry, 2000, 48(5): 1697-1702.
17SPADA J C, NORENA C P, MARCZAK L D, et al. Study on the stability of β-carotene microencapsulated withpinhão(Araucariaangustifoliaseeds) starch[J]. Carbohydrate Polymers, 2012, 89(4):1166-1173.
18QIN X S, LUO S Z, CAI J, et al. Transglutaminase-induced gelation properties of soy protein isolate and wheat gluten mixtures with high intensity ultrasonic pretreatment[J]. Ultrasonics Sonochemistry, 2016, 31:590-597.
19DONSI F, WANG Y, HUANG Q. Freeze-thaw stability of lecithin and modified starch-based nanoemulsions[J]. Food Hydrocolloids, 2011, 25(5):1327-1336.
20MORTENSON M A, REINECCIUS G A. Encapsulation and release of menthol. Part 1: the influence of OSAn modification of carriers on the encapsulation of l-menthol by spray drying[J]. Flavour & Fragrance Journal, 2008, 23(6):392-397.
21JACKSON M, MANTSCH H H. Halogenated alcohols as solvents for proteins: FTIR spectroscopic studies[J]. Biochimica et Biophysica Acta, 1992, 1118(2):139-143.
22LEE H A, CHOI S J, MOON T W. Characteristics of sodium caseinate-and soy protein isolate-stabilized emulsion-gels formed by microbial transglutaminase[J]. Journal of Food Science, 2006, 71(6):C352-C357.
23SORGENTINI D A, WAGNER J R, ANON M C. Effects of thermal treatment of soy protein isolate on the characteristics and structure-function relationship of soluble and insoluble fractions[J]. Journal of Agricultural & Food Chemistry, 1995, 43(9):2471-2479.
24BARTH A. Infrared spectroscopy of proteins[J]. BBA, 2007, 1767(9): 1073-1101.
25MAUERER A, LEE G. Changes in the amide I FT-IR bands of poly-L-lysine on spray-drying from alpha-helix, beta-sheet or random coil conformations[J]. European Journal of Pharmaceutics & Biopharmaceutics, 2006, 62(2):131-142.
26MENG G, MA C Y. Characterization of globulin fromPhaseolusangularis(red bean)[J]. International Journal of Food Science & Technology, 2002, 37(6):687-695.
27ZHAO X, CHEN F, XUE W, et al. FTIR spectra studies on the secondary structures of 7S and 11S globulins from soybean proteins using AOT reverse micellar extraction[J]. Food Hydrocolloids, 2008, 22(4):568-575.
28LI C, HUANG X, PENG Q, et al. Physicochemical properties of peanut protein isolate-glucomannan conjugates prepared by ultrasonic treatment[J]. Ultrasonics Sonochemistry, 2014, 21(5):1722.
29LEE S-H, LEFEVRE T, SUBIRADE M,et al. Effects of ultra-high pressure homogenization on the properties and structure of interfacial protein layer in whey protein-stabilized emulsion [J]. Food Chemistry, 2009, 113(1):191-195.

