不同微生境下齿肋赤藓(Syntrichia caninervis)生理生化特性对不同季节的响应
李茜倩,尹本丰, 张元明
1 中国科学院新疆生态与地理研究所干旱区生物地理与生物资源重点实验室,乌鲁木齐 830011 2 中国科学院大学,北京 100049 3 北京师范大学生命科学学院,北京 100875
荒漠地区生态环境脆弱,干旱化及风蚀等问题严重,生物土壤结皮作为荒漠生态系统的工程师,在改善和稳定脆弱的荒漠生态环境方面起着积极作用[1]。藓类结皮作为生物土壤结皮的重要组成部分,能够在相对疏松的沙丘上生长良好,并在地下形成假根,对地表水分的截留、抵御风蚀水蚀、增加土壤稳定性[2]、氮元素的固定和土壤养分的积累[3- 4]均具有重要作用。目前,学者们着重关注了荒漠藓类结皮的生态功能和生态效应并已取得了充分的认识。但关于在极端高低温,强辐射,干旱的荒漠环境中荒漠藓类在生理上如何适应并成为荒漠的拓荒者的研究相对较少,关于藓类结皮对环境胁迫的生理生化响应的研究主要集中在荒漠藓类的渗透性调节物质、细胞膜抗氧化酶系统、光合作用以及叶绿素荧光特征等方面[5- 6]。
古尔班通古特沙漠属于典型的温带荒漠,降水稀少且季节性温差大。水分缺乏和极端温度是限制荒漠藓类生长的重要原因[7]。藓类植物结构相对简单,叶片多为单层细胞,没有真正的根和维管束,对环境的变化比较敏感[8]。刘应迪等[9]研究高温胁迫下藓类游离脯氨酸含量变化时发现,高温胁迫与水分、渗透胁迫一样能够诱导植物体内脯氨酸的积累, 当高温强度在50℃以内时对湿地匍灯藓(Plagiomniumacutum)进行时长6h的高温胁迫,游离脯氨酸含量随处理温度的升高和处理时间的延长而增加。谢敏等[10]在沙坡头地区研究了降雪对结皮藓类生理生化的影响认为,降雪量的增加会使结皮藓类的光合色素和可溶性蛋白含量增加,可溶性糖、脯氨酸以及丙二醛含量降低。尹本丰[6]在冻融过程中微生境差异对齿肋赤藓生理生化特性影响的研究中发现在整个冻融过程中裸露地齿肋赤藓的3种抗氧化酶活性均显著高于灌丛下,认为裸露地的苔藓较灌丛下具有更强的抗逆特性。
本文基于前人研究成果,选择气候差异较大的冬、春、夏3个季节在古尔班通古特沙漠腹地选择双穗麻黄(Ephedradistachya)灌丛和裸露地两种不同微生境下齿肋赤藓进行样品采集,比较不同季节水热变化以及两种不同微生境(活灌丛和裸露地)下齿肋赤藓渗透性调节物质、丙二醛含量和抗氧化酶活性的变化特征。试图回答以下科学问题:(1)齿肋赤藓在适应不同季节水热变化过程中具有怎样的生理生化响应特征?(2)不同微生境下的齿肋赤藓对季节性水热变化的响应是否存在差异?从而探究荒漠藓类在适应剧烈环境变化过程中的生理机制。
1 材料和方法
1.1 研究区概况
古尔班通古特沙漠(44.18°—46.33°N,80.52°—90.00°E,海拔300—600m)地处新疆北部准噶尔盆地中部,面积4.88×104km2,是我国最大的固定、半固定沙漠。属于典型的温带荒漠,冬季有稳定积雪且极端低温,春季较为干旱,夏季不仅干旱而且高温。冬夏季节极端最低和最高温度分别可达-40℃和40℃,温差较大[11]。平均年降水量不足150mm,沙漠腹地降雨量仅有70—100mm。基于研究区微型气象站(WatchDog 2000,Spectrum,USA)数据显示,2014年1月平均气温为-17.35℃,4月份平均气温12.87℃,8月份平均温度34.56℃;1月份降雨为0.6mm,4月份降雨为17.5mm,8月份降雨为0.6mm。该沙漠生长着由梭梭(Haloxylonammdendro)、白梭梭(H.persicum) 双穗麻黄(Ephedradistachya)、淡枝沙拐枣(Calligonumleucocladum)等组成的小半乔木和灌木,并伴随一定的短命和类短命植物的发育。其间还广泛分布着发育良好的生物土壤结皮,呈现出灌木和生物结皮镶嵌分布的典型地表景观。
1.2 研究对象及采样时间的选择
该沙漠苔藓结皮多分布在丘间低地和下坡,尤其在双穗麻黄灌丛下的苔藓结皮发育良好。齿肋赤藓属于丛藓科赤藓属,具有良好的耐旱性和变水特性,是古尔班通古特沙漠苔藓结皮的优势种。在干燥条件下,其通常呈现为黑色或淡棕色,复水后能快速地变为绿色,并在短时间内恢复光合和生理活性[5]。齿肋赤藓的大量存在对沙漠的固定和微环境改善具有重要作用[12]。古尔班通古特沙漠的气候主要表现为冬季低温湿润、夏季高温干旱、春秋季节干旱缺水,因此本研究在时间尺度上分为低温湿润期(冬季)、高温干旱期(夏季)以及干旱期(春季)3个季节进行。
1.3 样方设置和样品采集
于2013年11月份在古尔班通古特沙漠腹地(45.40°N,88.00°E)选择苔藓结皮发育良好的丘间低地,设置30m×30m大样方。在大样方内分别选择活灌丛(双穗麻黄)和裸露地2种微生境各5块,大小为1m×1m,作为5个重复,各小样方之间相距2—5m。并在各生境样方附近地表下5cm处埋设ECH2O检测系统(5TM, Li-COR, Lincoln, USA),对土壤温度和水分进行连续监测。分别于2014年冬季1月、春季4月和夏季8月采集不同微生境下的齿肋赤藓样品,每个样方采用五点取样法用自制PVC取样器(直径10cm,高2cm)采集以齿肋赤藓为优势种的苔藓结皮。灌丛下的样品均采集灌丛北侧且距离蛇麻黄灌丛根部2cm处的苔藓结皮。样品采集后迅速置于装有冰袋的保温箱内。并及时用刀片快速切取苔藓(随用随取)茎叶鲜样。样品过筛3次后(去除夹杂的沙粒),为每一指标称取0.15g鲜样(0.01g精度天平), 用锡箔纸包裹并系上棉线,置于液氮罐快速冷冻保存,随后带回实验室进行后续测定和分析。
1.4 生理生化指标的测定
1.4.1植株含水量
称取齿肋赤藓鲜样,105℃烘干15min后调至80℃烘干至恒重。用电子天平称量(0.001g精度天平),并计算其相对含水量。
1.4.2渗透调节物含量的测定
本研究选定可溶性糖、可溶性蛋白和脯氨酸3种主要的渗透调节物质进行测定,所用方法分别为蒽酮法、考马斯亮蓝法和酸性茚三酮法,其吸光度值由Lamda35紫外分光光度计(PE, Waltham, USA)测定[13-15]。
1.4.3丙二醛含量和抗氧化酶活性的测定
本研究测定了与抗氧化酶体系相关的丙二醛(MDA)含量、以及超氧化物歧化酶(SOD)、过氧化物酶(POD)及过氧化氢酶(CAT)3种抗氧化酶的活性。丙二醛(MDA)含量用TBA法测定,超氧化物歧化酶(SOD)、过氧化物酶(POD)及过氧化氢酶(CAT)活性分别采用羟胺法、愈创木酚法和可见光法进行测[16-18]。
1.5 数据分析
用一般线性模型(GLM)分析不同季节和微生境及其交互作用对苔藓各项指标的影响。同时对不同处理间的数据进行单因素方差分析(One-way ANOVA)和多重比较(LSD)。用Pearson相关系数检验不同季节和微生境下齿肋赤藓的含水量、温度与游离脯氨酸、可溶性糖、可溶性蛋白、MDA含量和POD、SOD、CAT活性之间的相关性。使用SPSS 19.0软件完成所有统计分析,并用Origin 9.0软件对数据做图。
2 结果与分析
2.1 季节变化和微生境差异对植株含水量和温度的影响
由图1可知,冬季的齿肋赤藓植株含水量显著高于春季和夏季。同时,在春季和夏季,活灌丛下的齿肋赤藓植株含水量显著高于裸露地,而冬季灌丛下和裸露地的植株含水量无显著差异。由图1可知,两种微生境下温度均为夏季>春季>冬季。且在不同时期灌丛下与裸露地的温度表现不一致,冬季表现为活灌丛下温度高于裸露地,而在春季和夏季均表现为裸露地温度高于灌丛下。

图1 微生境差异下不同季节齿肋赤藓含水量与土壤温度的比较Fig.1 Comparison of the water content in Syntrichia caninervis and soil temperature from different microhabitats and seasons数值为平均值标准误差(n=5)不同字母表示季节间差异显著(P < 0.05),*表示微生境间差异显著 (P < 0.05)
2.2 季节变化和微生境差异对生理生化特性的影响
2.2.1脯氨酸
季节变化和微生境差异对齿肋赤藓脯氨酸含量均有极显著影响,且二者存在极显著的交互作用(表1)。脯氨酸含量在不同微生境下均表现为夏季> 春季>冬季。同时,在春季和夏季,齿肋赤藓脯氨酸含量均表现为裸露地处显著高于活灌丛下,而在冬季活灌丛与裸露地之间的齿肋赤藓脯氨酸含量并无显著性差异(图2)。
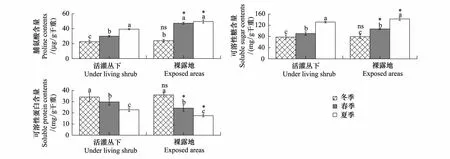
图2 微生境差异下不同季节齿肋赤藓脯氨酸、可溶性糖和可溶性蛋白含量的比较Fig.2 Comparison of the contents of osmoprotectants in Syntrichia caninervis from different microhabitats and seasons数值为平均值标准误差(n=5)不同字母表示季节间差异显著(P < 0.05),*表示微生境间差异显著 (P < 0.05)
2.2.2可溶性糖
由图2可以看出,齿肋赤藓可溶性糖含量表现为夏季>春季>冬季。同时,春夏季裸露地的齿肋赤藓可溶性糖含量显著高于活灌丛下,而冬季的齿肋赤藓可溶性糖含量在微生境之间无显著性差异。
表1不同季节和微生境差异下齿肋赤藓生化特征的双因素方差分析
Table1Two-wayANOVAanalysisontheeffectsofmicrohabitats,seasons,andtheirinteractiononphysiologicalandbiochemicalcharacteristicsinSyntrichiacaninervis

因子Factor脯氨酸含量Prolinecontent可溶性糖含量Solublesugarcontent可溶性蛋白含量Solubleproteinscontent丙二醛含量MDAcontent超氧化物歧化酶性SODactivity过氧化物酶活性PODactivity过氧化氢酶活性CATactivity微生境Microhabitats440.751**293.468**88.266**82.806**110.388**98.319**216.771**季节season266.025**8.474**10.590**100.83**134.715**107.509**84.861**微生境×季节Microhabitats×season82.59**2.0656.878**23.263**12.991**4.0547*20.21**
MDA: malonyldialdehyde; POD: peroxidase; SOD:superoxide; CAT:catalase. *,P< 0.05;**,P< 0.01
2.2.3可溶性蛋白
齿肋赤藓可溶性蛋白的含量无论在灌丛下还是裸露地处,均表现出一致的趋势:冬季>春季>夏季。同时,不同微生境下的齿肋赤藓可溶性蛋白含量在不同季节表现出不同的差异,在春季和夏季,活灌丛下的齿肋赤藓可溶性蛋白含量均显著高于裸露地,而冬季却无显著性差异(图2)。
2.3 季节变化和微生境差异对丙二醛的影响
由图3可以看出,齿肋赤藓丙二醛的含量在冬季和夏季均显著高于春季。且在3个不同时期齿肋赤藓丙二醛含量均表现为裸露地>活灌丛下。
2.4 季节变化和微生境差异对抗氧化酶的影响
季节和微生境对齿肋赤藓3种抗氧化酶活性均有显著影响,且二者存在显著的交互作用(表1)。在夏季3种抗氧化酶的活性均显著高于其他两个季节。同时由图4可以看出,齿肋赤藓的3种抗氧化酶活性在冬季、春季、夏季3个时期一致表现为:裸露地>活灌丛下。

图3 微生境差异下不同季节齿肋赤藓丙二醛含量的比较 Fig.3 Comparison of MDA in Syntrichia caninervis from different microhabitats and different seasonsMDA: malonyldialdehyde;数值为平均值标准误差(n=5)不同字母表示季节间差异显著(P < 0.05),*表示微生境间差异显著 (P < 0.05)
2.5 生理生化指标与植株含水量及地表温度的相关性分析
荒漠藓类从低温湿润的冬季经由干旱的春季再到高温干旱的夏季,期间水分和温度的剧烈变化,导致荒漠藓类的生理特征随着水热的变化而在不同时期表现出不同的差异。相关性分析表明(表2),冬季齿肋赤藓生理生化特征与含水量无显著相关性,3种抗氧化酶及MDA与温度程显著负相关,说明在冬季主要受低温影响;春季干旱少雨,齿肋赤藓生理生化特征除可溶性糖外均与水分达到显著性负相关,而与温度的相关性仅脯氨酸达到显著,说明藓类的生长主要受到了干旱的限制;到了夏季齿肋赤藓的各生理特征无论与水分还是温度均达到显著性相关,受到干旱和温度的双重胁迫。
3 讨论
3.1 季节变化对齿肋赤藓渗透调节物质含量和抗氧化酶活性的影响
季节气候变化是影响水热变动的重要因素,在温带荒漠,不同季节的温度和含水量的变化会直接或间接的影响荒漠藓类的生理代谢过程[3- 4]。在高低温和干旱胁迫下,藓类植物可以通过失复水和调节体内渗透调节物质(脯氨酸、可溶性糖、可溶性蛋白)来维持细胞渗透压[19-20],同时通过抗氧化酶(SOD、CAT、POD等)的合成来清除体内多余的活性氧和超氧化物阴离子自由基[21-22],进而减少对植物组织的过度损伤,稳定和维持细胞内大分子物质的结构与功能,增加植物体对环境的适应性。本实验发现:不同季节2种微生境的温度和水分等环境因子均存在显著差异,随着不同季节水热条件变化,齿肋赤藓植株的含水量、脯氨酸、可溶性糖、可溶性蛋白、MDA含量及SOD、POD、CAT等抗氧化酶均发生显著变化。
表2不同微生境下齿肋赤藓生理生化特征在不同季节与植株含水量和温度之间的相关系数
Table2CorrelationcoefficientsamongphysiologicaltraitsinSyntrichhiacaninervisshootsandenvironmentfactorsindifferentmicrohabitatsduringthedifferenttemperatureperiods

变量Variable脯氨酸含量Prolinecontent可溶性糖含量Solublesugarcontent可溶性蛋白含量Solubleproteinscontent丙二醛含量MDAcontent超氧化物歧化酶活性SODactivity过氧化物酶活性PODactivity过氧化氢酶活性CATactivity冬季低温期Lowtemperatureperiod含水量Watercontent0.083-0.1190.861**0.3430.4910.4140.07温度Temperature-0.419-0.031-0.104-0.657*-0.919**-0.865**-0.754*春季干旱无雨期Dryenvironment含水量Watercontent-0.905**-0.5980.638*-0.820**-0.766**-0.770**-0.760*温度Temperature0.851**0.582-0.5360.6950.4650.6200.608夏季高温期Hightemperatureperiod含水量Watercontent-0.928**-0.876**0.833**-0.943**-0.927**-0.854**-0.874**温度Temperature0.966**0.791*-0.926**0.936**0.929**0.923**0.901**
*,P< 0.05; **,P< 0.01

图4 微生境差异下不同季节齿肋赤藓过氧化物酶、超氧化物歧化酶和过氧化氢酶的比较Fig.4 Comparison of the activities of POD,SOD,CAT in Syntrichia caninervis from different microhabitats and different seasonsPOD: peroxidase; SOD:superoxide; CAT:catalase;数值为平均值标准误差(n=5)不同字母表示季节间差异显著(P < 0.05),*表示微生境间差异显著 (P < 0.05)
脯氨酸和可溶性糖作为重要的渗透调节物质,在植物受温度和干旱胁迫下其含量的增加对细胞渗透压、蛋白质结构功能的维持和稳定具有重要作用[12,19-20,23]。通过实验样地微型气象站观测数据可以发现,从冬季低温湿润期到春季干旱期再至夏季高温干旱期,是一个干旱加剧和温度升高的过程,藓类在冬季的脯氨酸和可溶性糖含量均显著低于春季和夏季,随着温度的升高、含水量的减少、胁迫的增强,植物体可通过增加脯氨酸和可溶性糖含量来维持细胞渗透压[9,24-25]。可溶性蛋白作为细胞内重要的渗透性调节物质,同时也与膜系统中的酶有关,其含量越高表明植物体的新陈代谢越旺盛[26]。藓类植株可溶性蛋白的含量无论在活灌丛下还是在裸露地均呈现冬季>春季>夏季的趋势。且在3个时期均与植株含水量呈显著性正相关,与温度呈负相关。可能是干旱、高温不利于荒漠藓类的生长,且一定的低温更适宜其生长,这与随着干旱胁迫的增加,土生对齿藓(Didymodonvinealis)的可溶性蛋白含量下降[27],以及荒漠苔藓的生长和繁殖主要发生在寒冷和湿润的冬季月份的研究结果相似[7,28]。
植物在温度和干旱胁迫下,体内的活性氧会大量积累,活性氧可以过氧化细胞内膜脂肪酸中的不饱和键,MDA作为膜脂过氧化作用的最终分解产物,其含量会随着胁迫的加剧而增加[26,29],且植物体可通过提高POD、SOD及CAT等抗氧化酶的活性,清除体内活性氧和自由基以防止过氧化[21]。前人对多蒴灰藓(HypnumfertileSenden)在短期极端高温和低温胁迫下的研究发现,高低温胁迫均会使多蒴灰藓体内MDA和CAT含量升高[30]。而在本研究中也得到类似结果:荒漠藓类的MDA含量及CAT活性在低温的冬季和高温干旱的夏季均显著高于春季;同时,结果还表明POD、SOD在夏季活性最高,说明高温干旱的夏季需要大幅度提高抗氧化酶活性来抵御不利环境。
3.2 微生境对齿肋赤藓渗透调节物质含量和抗氧化酶活性的影响
尽管不同季节的水热变化是影响生物生存和分布的主要因素,但小环境的差异也会对生物活性产生影响。灌丛的存在能够为藓类提供一个低辐射和高含水量的生存环境。前期研究表明灌丛下的藓类结皮光合活性显著高于裸露地,且苔藓结皮下层的土壤养分也存在显著差异,裸露地的土壤水分、有机碳、全氮、全钾、pH均显著低于灌丛下[31]。
目前已有不少研究发现藓类植物不仅形态特征会受微生境的影响,其生理生化特征也会因生境的不同而产生差异[8,32-33]。本研究结果发现在春夏季节,生长于裸露地的齿肋赤藓脯氨酸、可溶性糖和MDA含量及SOD、POD、CAT酶活性均显著高于具有遮阴效果的灌丛下。灌丛下的遮阴作用形成“湿岛效应”减少了干旱对植物体造成的伤害,而裸露地环境的高温及高蒸发量,是造成齿肋赤藓脯氨酸和可溶性糖含量积累的主要原因。冬季降雪的覆盖会削弱灌丛效应,脯氨酸和可溶性糖含量在两种微生境中差异不显著,而MDA含量及SOD、POD、及CAT酶的活性在冬季则表现为裸露地高于灌丛下,可能是抗氧化酶的活性对微环境差异的响应更为敏感而导致的。
与脯氨酸、可溶性糖相反,夏季和春季齿肋赤藓植株可溶性蛋白的含量均表现为活灌丛下>裸露地。相关性分析也表明可溶性蛋白与含水量呈显著性正相关,与温度呈显著性负相关,随含水量的增加,植物可溶性蛋白含量越多,植物活性越高,而高温环境不利于其生长。灌丛的遮阴作用为藓类提供了低辐射、高水分以及低蒸发量的良好生存环境[34]。同时有研究也发现,在西班牙东南部的半干旱生态系统中苔藓植物在遮阴下比暴露在阳光下的生物量更高,生长状况更好[35]。
4 结论
(1)季节变化和微生境差异对齿肋赤藓的生理生化特征具有显著影响。不同季节水分和温度的不同,齿肋赤藓在3个季节生长所受的胁迫不同,在逆境胁迫中发挥重要作用的渗透调节物质和抗氧化酶也发生不同程度的积累。冬季低温促使MDA含量及CAT活性的提高;干旱的春季藓类通过积累脯氨酸及可溶性糖含量降低体内渗透压;夏季藓类大量积累脯氨酸、可溶性糖、MDA含量和提高SOD、CAT、POD活性,进而适应极端高温干旱的环境。总之,荒漠藓类可以通过调节体内渗透调节物质含量和抗氧化酶活性来提高自身在不同环境中的适应性;同时,有意义的是,纵观春、夏、冬3个季节,脯氨酸、可溶性糖、MDA含量及3种抗氧化酶活性均在夏季达到最大积累量,这归因于夏季高温且干旱的环境。说明在荒漠藓类的生长过程中,高温而干旱的夏季仍是其生长发育的主要限制时期。
(2)荒漠藓类生理生化特性对微生境差异的响应在不同季节有一定的差异。在具有积雪覆盖的冬季,微生境差异对荒漠藓类生理生化特性无显著影响,其差异主要体现在没有积雪覆盖的春季和夏季。生长在裸露地环境中的荒漠藓类的脯氨酸、可溶性糖含量和3种抗氧化酶活性均显著高于灌丛下,说明裸露地环境中的齿肋赤藓表现出更高的生理耐受性。
致谢:感谢周晓兵博士对论文写作的帮助。
参考文献(References):
[1]张元明, 王雪芹. 荒漠地表生物土壤结皮形成与演替特征概述. 生态学报, 2010, 30(16): 4484- 4492.
[2]Eldridge D J, Greene R S B. Microbiotic soil crusts-a review of their roles in soil and ecological processes in the rangelands of Australia. Australian Journal of Soil Research, 1994, 32(3): 389- 415.
[3]West N E. Structure and function of microphytic soil crusts in wildland ecosystems of arid to semi-arid regions. Advances in Ecological Research, 1990, 20: 179- 223.
[4]Cornelissen J H C, Lang S I, Soudzilovskaia N A, During H J. Comparative cryptogam ecology: a review of bryophyte and lichen traits that drive biogeochemistry. Annals of Botany, 2007, 99(5): 987- 1001.
[5]张静, 张元明. 模拟降雨对齿肋赤藓(Syntrichiacaninervis)生理特性的影响. 中国沙漠, 2014, 34(2): 433- 440.
[6]尹本丰, 张元明. 冻融过程对荒漠区不同微生境下齿肋赤藓渗透调节物含量和抗氧化酶活力的影响. 植物生态学报, 2015, 39(5): 517- 529.
[7]Benassi M, Stark L R, Brinda J C, McLetchie D N, Bonine M, Mishler B D. Plant size, sex expression and sexual reproduction along an elevation gradient in a desert moss. The Bryologist, 2011, 114(2): 277- 288.
[8]吴玉环, 黄国宏, 高谦, 曹同. 苔藓植物对环境变化的响应及适应性研究进展. 应用生态学报, 2001, 12(6): 943- 946.
[9]刘应迪, 李和平, 肖冬林. 高温胁迫下藓类植物游离脯氨酸含量的变化. 吉首大学学报: 自然科学版, 2001, 22(1): 1- 3.
[10]谢敏, 回嵘, 刘立超, 高艳红, 李刚, 王艳莉, 魏文斐. 降雪对荒漠地区藓类结皮中真藓生理生化的影响. 生态学报, 2017, 37(3): 915- 921.
[11]魏文寿, 刘明哲. 古尔班通古特沙漠现代沙漠环境与气候变化. 中国沙漠, 2000, 20(2): 178- 184.
[12]吴楠, 魏美丽, 张元明. 生物土壤结皮中刺叶赤藓质膜透性对脱水、复水过程的响应. 自然科学进展, 2009, 19(9): 942- 951.
[13]Gonzalez C M, Pignata M L. The influence of air pollution on soluble proteins, chlorophyll degradation, MDA, sulphur and heavy metals in a transplanted lichen. Chemistry and Ecology, 1994, 9(2): 105- 113.
[14]Monreal J A, Jiménez E T, Remesal E, Morillo-Velarde R, García-Maurio S, Echevarría C. Proline content of sugar beet storage roots: response to water deficit and nitrogen fertilization at field conditions. Environmental and Experimental Botany, 2007, 60(2): 257- 267.
[15]Lassouane N, Aïd F, Lutts S. Water stress impact on young seedling growth ofAcaciaarabica. Acta Physiologiae Plantarum, 2013, 35(7): 2157- 2169.
[16]Choudhury S, Panda S K. Toxic effects, oxidative stress and ultrastructural changes in mossTaxitheliumnepalense(Schwaegr.) Broth. under chromium and lead phytotoxicity. Water, Air, and Soil Pollution, 2005, 167(1/4): 73- 90.
[17]孙守琴, 王根绪, 罗辑, 宋洪涛, 杨刚. 苔藓植物对环境变化的响应和适应性. 西北植物学报, 2009, 29(11): 2360- 2365.
[18]Wu H L, Wu X L, Li Z H, Duan L S, Zhang M C. Physiological evaluation of drought stress tolerance and recovery in cauliflower (BrassicaoleraceaL.) seedlings treated with methyl jasmonate and coronatine. Journal of Plant Growth Regulation, 2012, 31(1): 113- 123.
[19]Nagao M, Oku K, Minami A, Mizuno K, Sakurai M, Arakawa K, Fujikawa S, Takezawa D. Accumulation of theanderose in association with development of freezing tolerance in the mossPhyscomitrellapatens. Phytochemistry, 2006, 67(7): 702- 709.
[20]Lenné T, Bryant G, Hocart C H, Huang C X, Ball M C. Freeze avoidance: a dehydrating moss gathers no ice. Plant, Cell & Environment, 2010, 33(10): 1731- 1741.
[21]Zhang J X, Kirkham M B. Drought-stress-induced changes in activities of superoxide dismutase, catalase, and peroxidase in wheat species. Plant and Cell Physiology, 1994, 35(5): 785- 791.
[22]Meloni D A, Oliva M A, Martinez C A, Cambraia J. Photosynthesis and activity of superoxide dismutase, peroxidase and glutathione reductase in cotton under salt stress. Environmental and Experimental Botany, 2003, 49(1): 69- 76.
[23]Crowe J H, Carpenter J F, Crowe L M. The role of vitrification in anhydrobiosis. Annual Review of Physiology, 1998, 60: 73- 103.
[24]陈文佳, 张楠, 杭璐璐, 王媛, 季梦成. 干旱胁迫与复水过程中遮光对细叶小羽藓的生理生化影响. 应用生态学报, 2013, 24(1): 57- 62.
[25]张显强, 罗在柒, 唐金刚, 卢文芸, 乙引. 高温和干旱胁迫对鳞叶藓游离脯氨酸和可溶性糖含量的影响. 广西植物, 2004, 24(6): 570- 573.
[26]国春晖, 沙伟, 李孝凯. 干旱胁迫对三种藓类植物生理特性的影响. 北方园艺, 2014, (9): 78- 82.
[27]石勇, 赵昕, 贾荣亮, 李新荣. 逐渐干旱胁迫下生物土壤结皮中真藓和土生对齿藓的活性氧清除机制. 中国沙漠, 2012, 32(3): 683- 690.
[28]Herrnstadt I, Kidron G J. Reproductive strategies ofBryumdunensein three microhabitats in the Negev Desert. The Bryologist, 2005, 108(1): 101- 109.
[29]范苏鲁,苑兆和,冯立娟,王晓慧,丁雪梅,甄红丽. 干旱胁迫对大丽花生理生化指标的影响. 应用生态学报, 2011, 22(3): 651- 657.
[30]Shen L, Guo S L, Yang W, Cao T, Glime J M. Physiological responses ofHypnumfertileSendtn. (Musci: Hypnaceae) to short-term extreme temperature stress. Bulletin of Botanical Research, 2011, 31(1): 40- 48.
[31]尹本丰, 张元明. 荒漠区不同微生境下齿肋赤藓对一次降雪的生理生化响应. 植物生态学报, 2014, 38(9): 978- 989.
[32]许红梅, 尹本丰, 李进, 张元明. 采自不同微生境的齿肋赤藓(Syntrichiacaninervis)沙培植株生长与叶形态差异. 中国沙漠, 2015, 35(2): 373- 379.
[33]Reynolds L A, McLetchie D N. Short distances between extreme microhabitats do not result in ecotypes inSyntrichiacaninervis. Journal of Bryology, 2011, 33(2): 148- 153.
[34]范连连, 马健, 吴林峰, 徐贵青, 李彦, 唐立松. 古尔班通古特沙漠南缘草本层对积雪变化的响应. 植物生态学报, 2012, 36(2): 126- 135.
[35]Pintado A, Sancho L G, Green T G A, Blanquer J M, Lázaro R. Functional ecology of the biological soil crust in semiarid SE Spain: sun and shade populations ofDiploschistesdiacapsis(Ach.) Lumbsch. The Lichenologist, 2005, 37(5): 425- 432.

