长链非编码RNA CAF调节阿霉素诱导的心肌细胞毒性机制的研究
陈 超,张延慧,王明卉,许 胜,刘翠云,李培峰,王 昆
阿霉素(doxorubicin,DOX)是属蒽环类抗肿瘤抗生素。作为化疗药物广泛用于治疗各种肿瘤,临床上多用于治疗乳腺癌、淋巴瘤、肺癌、白血病等多种恶性肿瘤[1]。然而,限制其临床应用的主要因素是化学治疗中发挥抗肿瘤作用的同时带来的心脏毒性,其剂量的增加和积累会导致更为严重的且不可逆的各种扩张性心肌病以及充血性心力衰竭。虽然一些研究表明DOX是心肌细胞凋亡的关键刺激因素,但迄今为止,未能找到有效治疗DOX诱发的心脏毒性和心力衰竭的方法[2]。因此,研究和了解这一过程所依赖的分子机制是非常重要的,揭示DOX诱导的心肌细胞凋亡机制将为降低心脏毒性和保护心脏功能提供新的途径。
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度大于200 bp且缺乏蛋白质编码功能的RNA。越来越多的研究发现lncRNA在基因组印记、X染色体沉默以及核内运输、转录激活、转录干扰、染色质修饰等多种重要的调控过程中扮演重要角色[3]。近年来的研究证实lncRNA可能作为治疗的潜在靶点在心脏再生和修复中起重要作用[4]。本研究采用lncRNAs基因芯片筛选表达差异明显的lncRNAs进行实时定量PCR验证。
线粒体对细胞的生命和死亡起着重要的作用[5]。线粒体的融合和裂变已被确定为DOX诱导心脏细胞损伤的主要因素之一[6]。51 kDa的线粒体动力学蛋白、MIEF1基因在调节线粒体形态中起重要作用。据报道,敲除MIEF1可降低Drp1的结合并增强线粒体融合[7],另有报道也发现MIEF1起到增强线粒体融合作用[8]。然而,目前尚不清楚MIEF1是否参与了DOX治疗对心肌细胞线粒体动力学的调控。
1 材料与方法
1.1 药品与试剂 C57BL/6J小鼠购自济南朋悦实验动物繁育有限公司[SCXK-(鲁)-2014-0007];昆明小鼠乳鼠购自济南朋悦实验动物繁育有限公司[SCXK-(鲁)-2014-0007];盐酸阿霉素(上海阿拉丁生化科技股份有限公司);MIEF1抗体(英国Gibico公司);内参β-actin抗体(武汉博士德公司);二抗山羊抗兔(北京中杉金桥生物技术有限公司);山羊抗小鼠(北京中杉金桥生物技术有限公司,商品编号:ZF-0312);RR820A takara SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)(日本TaKaRa公司);DMEM培养基(英国Gibico公司);胎牛血清(英国Gibico公司);胰蛋白酶和Ⅱ型胶原酶(日本TaKaRa公司);TRIzol试剂盒(日本TaKaRa公司);RNA反转录试剂盒(日本TaKaRa公司);LipofectamineTM2000(美国Invitrogen公司);放射免疫沉淀法裂解液(北京索莱宝公司);增强化学发光液(德国Milli-pore公司),western-抗二抗去除液(杭州昊鑫生物科技股份有限公司)。
1.2 实时定量PCR检测 根据筛选出的差异表达lncRNAs基因,对研究中上调最为明显的lncRNA,NONMMUT071802,我们命名为心肌细胞凋亡因子(cardiac apoptosis factor,CAF)进行实时定量PCR验证。分别检测正常对照组和DOX处理组总RNA中lncRNA CAF含量。具体实验方法:采用合适方法提取细胞总RNA,将提取好的总RNA从-80℃冰箱取出,对总RNA使用miRcute mi-RNA First-Strandc DNA Synthesis Kit试剂盒合成第一链cDNA。然后对已经合成的cDNA使用RR820A takara SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒进行Real-Time PCR System qPCR反应检测。最后使用ABI7900荧光定量PCR仪进行定量PCR检测。上述实验均重复3次。
1.3 载体的构建 使用PCR扩增lncRNA CAF全长,将扩增后的lncRNA CAF全长双酶切连接至pcDNA3.1(-)载体的EcoRI和XhoI之间,构建过表达pcDNA3.1(-)-CAF;按照RNA干扰序列设计原则结合慢病毒载体质粒pLKO.1-puro结构的特征设计合成shRNA序列,通过分子克隆技术构建lncRNA CAF的RNA干扰慢病毒载体pLKO.1-CAF-shRNA,酶切位点为AgeI和EcoRI。转化DH5α大肠杆菌后,挑取阳性克隆子进行质粒抽提电泳及测序鉴定。
1.4 实验分组
1.4.1 动物分组及给药 参考相关文献,建立慢性DOX心脏毒性模型[9-10],具体如下:将12只C57BL/6J小鼠随机分成2组:实验组6只,腹腔注射DOX 5 mg/kg,1周1次,连续注射4周;同时设立等剂量生理盐水注射对照组6只,同一时间每周注射。4周后行心脏超声检测,评估小鼠心功能状态;同时处死小鼠,取出左心室心肌标本。取小鼠心肌组织于-80 ℃中保存,用于后续基于MIEF1的基因和蛋白表达水平的检测。
1.4.2 细胞分组 根据实验,共分为pcDNA3.1(-)空载对照组、pcDNA3.1(-)-CAF组、pLKO.1空载对照组和pLKO.1-CAF-shRNA(CAF-siRNA)组。
1.5 超声心动观察 用4%水合氯醛以0.1 mL/10g剂量腹腔注射麻醉,脱毛后将小鼠仰卧位固定于加温的检查台,连接心电图电极。
1.6 小鼠体重和心室质量称重 每次注射药物注射后称量体重(body weight,BW),取第一周称重和第四周称重分别为初重和终重。处死小鼠后,立即取出心脏,置于冷生理盐水中洗去血液,滤纸吸干水分,测心室质量(ventricular weight,VW),并计算VW/BW的比值。
1.7 乳鼠心肌细胞培养 用75%酒精浸泡1~3 d龄昆明小鼠乳鼠,消毒2次,无菌操作下取出心脏,用预冷的磷酸盐缓冲液冲洗2遍。于灭菌超净台中用眼科剪取心尖大部放入盛有1×ADS buffer的小平皿中,并放在冰台上清洗3次后剪刀剪碎并用混合酶液(胶原酶:10 mg/mL,胰液素:30 mg/mL)消化,所提取的细胞置于含有5%胎牛血清DMEM/F12培养基中,种于6孔板,细胞浓度调到(0.5~1)×105/mL。差速贴壁2 h后更换新的培养基,放入37 ℃、5%CO2培养箱。
1.8 细胞转染 将6孔板中生长状态良好的乳鼠心肌细胞用Lipofectamine2000将pcDNA3.1(-)空载、pcDNA3.1(-)-CAF、pLKO.1空载和pLKO.1-CAF-shRNA(CAF-siRNA)转入细胞中。分别为pcDNA3.1(-)空载对照组、pcDNA3.1(-)-CAF组以及pLKO.1空载对照组和pLKO.1-CAF-shRNA(CAF-siRNA)组。置37 ℃、5%CO2细胞培养箱孵育,24 h后提取细胞产物。
1.9 qRT-PCR检测MIEF1基因的表达 组织样本:取100 mg心肌组织样本加1 mL TRIzol试剂冰上研磨裂解细胞;细胞样本:细胞转染24 h后用TRIzol试剂裂解细胞(6孔板每孔加1 mL TRIzol试剂)。细胞裂解后用TaKaRa逆转录试剂盒逆转录成cDNA。用ABI StepOne实时PCR系统进行反应扩增。反应条件:95 ℃ 5 min、95 ℃10 s、60 ℃ 30 s共34个循环,实验重复3次。以β-actin作为内参,2-ΔΔCt法计算mRNA的相对表达量。RT-qPCR引物序列见表1。

表1 RT-qPCR引物序列
1.10 蛋白印迹法检测蛋白表达 组织样本:每组取3只小鼠心室标本以100 ug/mL TRIzol分别行组织匀浆,组织裂解液裂解,提取上清液,BCA法行总蛋白定量,测量蛋白浓度后取等量蛋白质样品(40 μg/孔)进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,再将凝胶转移到PVDF膜上,5%脱脂奶粉封闭 1 h后加入MIEF1的兔 -多克隆抗体(1∶1 000),室温孵育2 h后用TBST缓冲液(NaCl 8.5 g/L、Tris 6.05 g/L、Tween20 1 mL/L,pH=7.45)洗膜,HRP-山羊抗兔IgG 的二抗 (1 ∶2 000)孵育1.5 h,增强化学发光法检测,X线显影。扫描并保存图像后,用western一抗二抗去除液清洗PVDF膜后重新进行封闭,加入β-actin的小鼠多克隆抗体(1:2 000)及HRP-山羊抗小鼠IgG 的二抗 (1 ∶2 000)孵育,显影后保存影像并以β-actin表达作内参分析结果。
细胞样本:细胞转染48 h后,用蛋白裂解液裂解细胞提取总蛋白,后续操作同组织样本中总蛋白的提取。
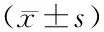
2 结果
2.1 小鼠体重与心脏重量的变化 正常对照组BW明显增加,而实验组BW明显降低,2者有显著差异(P<0.05),2组VW相比无显著差异,而实验组VW/BW明显增加,和正常对照组比较有显著差异(n=6;P<0.05,表2)。

表2 注射药物4周后2组BW、VW及VW/BW
注:与对照组比较,*P<0.05
2.2 小鼠心脏功能检测 DOX处理组(图1B)小鼠心脏超声心动波形图与对照组(图1A)相比,振幅降低,频率略有减少,心室容积下降,其心功能下降明显。

图1 小鼠超声心动图
2.3 差异表达明显的lncRNA CAF行RT-PCR验证 2 μmol/L DOX处理24 h后,DOX组lncRNA CAF的表达水平明显高于对照组(P<0.01,图2)。
注:与对照组比较,n=4;*P<0.01图2 2 μmol/L DOX处理的心肌细胞中 lncRNA CAF的表达量
2.4 DOX对心肌细胞内MIEF1的抑制作用
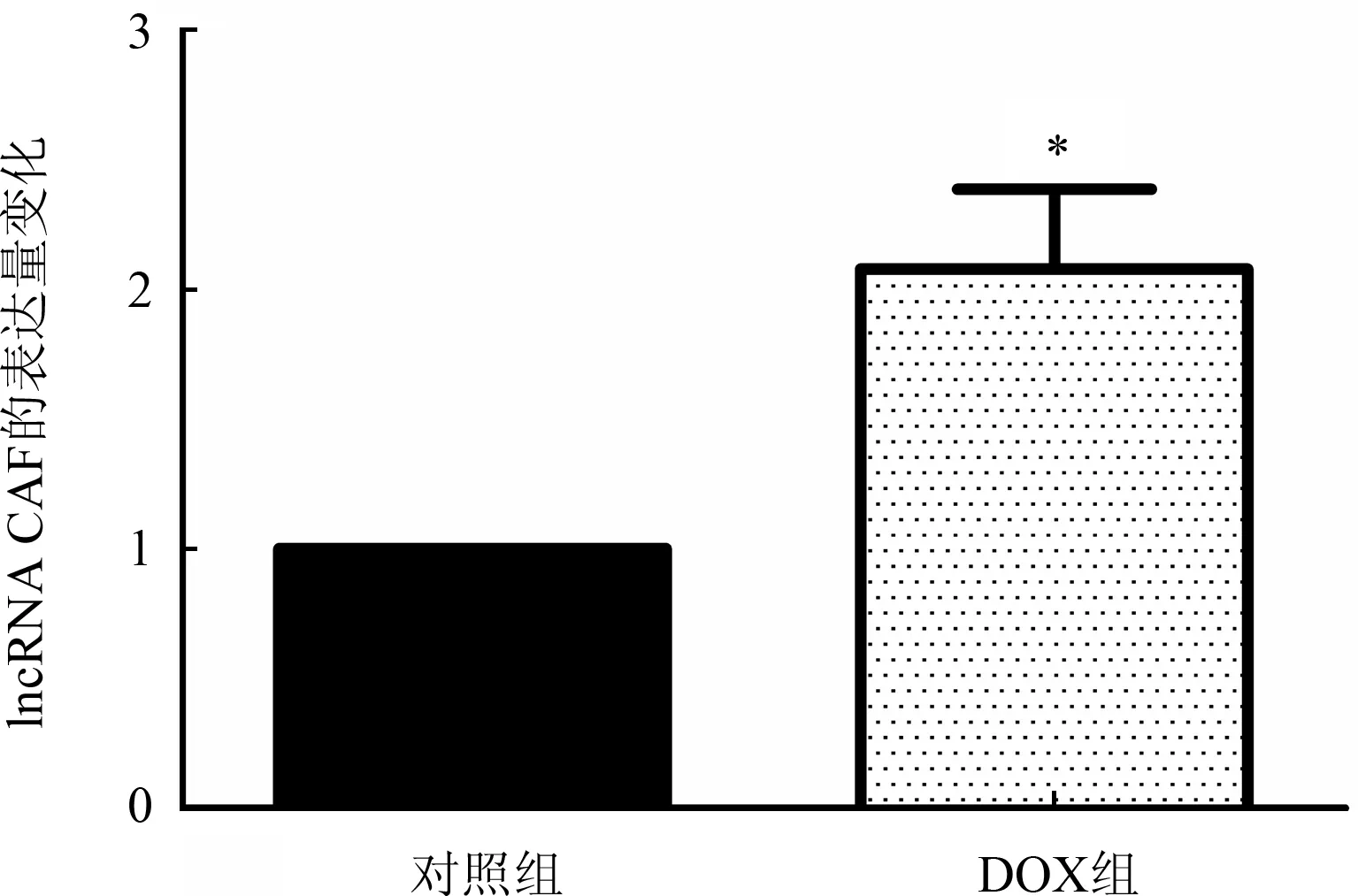
2.4.1 心脏毒性模型中各组MIEF1的表达水平经5 mg/kg浓度DOX体外注射4周后,每组取3只小鼠的心室标本做MIEF1实验的基因表达量检测。RT-PCR结果显示DOX诱导的心脏毒性模型组中MIEF1在基因水平上的表达量低于对照组(n=3;t=14.978,因P<0.01,图3)。每组取4只小鼠的心室标本做MIEF1的蛋白水平表达量检测。蛋白印迹法检测结果显示DOX处理组中基因MIEF1在蛋白质水平上的表达量都低于对照组(n=4;t=8.47,P<0.01,图4)。

注:与对照组比较,n=3;*P<0.01图3 DOX心脏毒性模型中MIEF1的基因表达量变化
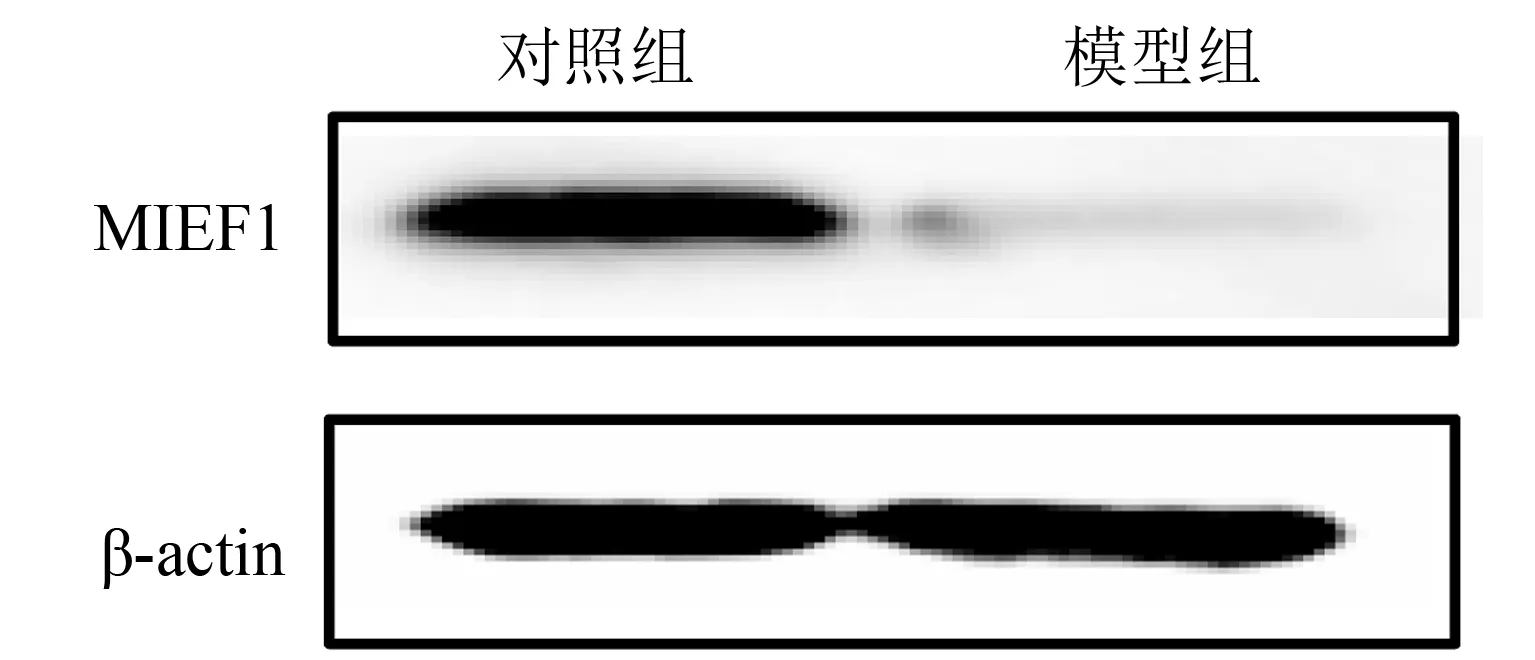
图4 DOX心脏毒性模型中MIEF1的蛋白表达量变化
2.4.2 小鼠原代心肌细胞中的各组MIEF1的表达水平 2 μmol/L、4 μmol/L、6 μmol/L DOX处理24 h后,小鼠原代心肌细胞每组中基因MIEF1在基因水平上的表达量都低于对照组,并且其表达量呈明显的梯度递减(n=4;t2 μmol/L=33.423,P<0.01;t4 μmol/L=36.120,P<0.01;t6 μmol/L=40.205,P<0.01,图5),蛋白印迹法检测结果显示小鼠原代心肌细胞中2 μmol/L DOX处理组中基因MIEF1在蛋白质水平上的表达量都低于对照组(n=4,P<0.05,图6)。

注:2 μmol/L DOX组与对照组比较,n=4;*P<0.01; 4 μmol/L DOX组与对照组比较,n=4;**P<0.01; 6 μmol/L DOX组与对照组比较,n=4;***P<0.01图5 不同浓度的DOX对小鼠原代心肌细胞表达量的变化

图6 2 μmol/L DOX处理的乳鼠心肌细胞中MIEF1 的蛋白表达量变化
2.5 小鼠原代心肌细胞中CAF对MIEF1基因表达水平的影响 pcDNA3.1(-)-CAF过表达组MIEF1的表达水平明显低于对照组(n=4;t=12.909,P<0.01);si-lncRNA组细胞的MIEF1表达水平明显高于NC组(n=4;t=33.634,P<0.01,图7)。

注:与对照组比较,n=4;*P<0.01;n=4;**P<0.01图7 乳鼠心肌细胞内MIEF1的mRNA水平相对表达
2.6 小鼠原代心肌细胞中CAF对MIEF1蛋白表达水平的影响 2 μmol/L DOX处理24 h后,pcDNA3.1(-)-lncRNA过表达组MIEF1的表达明显低于NC组(P<0.05),si-lncRNA组中MIEF1的表达明显高于对照组(P<0.05,图8)。

注:与对照组比较,n=4;*P<0.01;n=4;**P<0.01图8 MIEF1在各组中的表达
3 讨论
DOX是一种用于癌症化疗的有效药物,然而,DOX的使用受到其副作用的极大限制。DOX在许多方面对细胞的存活是恶性的,包括诱导DNA损伤、增加活性氧生成和线粒体过激活[1,11]。心脏似乎是最易感的组织[12],DOX诱导的心脏毒性通常在临床实践中构成挑战。探索和揭示DOX心脏毒性的潜在机制可能在癌症治疗中具有突破性的发现,然而,DOX心脏毒性的确切机制仍然在很大程度上是未知的。许多研究表明凋亡在确定心肌细胞的命运方面起重要作用[13]。据报道,DOX已被证明能激活胱天蛋白酶并诱导心肌细胞凋亡[14-15]。DOX还可以增加氧化剂产生并诱导心肌细胞凋亡,最终导致心肌病[16]。DOX也可能导致心肌细胞中caspase依赖性凋亡[17]。DOX诱导的心脏损伤与心脏氧化应激增加密切相关,抗氧化剂水平降低[18]。
线粒体是不断进行裂变和融合并在心肌细胞中形成动态网络的移动细胞器[19],线粒体融合产生长线粒体小管,而裂变导致小圆囊泡[20],线粒体的功能障碍与心脏毒性有关,已被确定为DOX诱导心脏亚细胞损伤的主要靶点之一[6],线粒体形态动态可影响细胞凋亡[21]。因此,保持线粒体完整性对于维持能量产生和防止细胞凋亡至关重要。线粒体不断经历融合和裂变,这是维持细胞器保真所必需的[22]。线粒体裂隙的抑制增强心肌细胞的功能[23],线粒体裂变受线粒体裂变蛋白激酶相关蛋白1(Drp1)调控[24],在线粒体裂变过程中,Drp1聚合并在收缩位点环化[25],而抑制Drp1可减轻心肌细胞线粒体裂隙[26]。MIEF1和MIEF2都是线粒体外膜蛋白[27],研究发现,敲除MIEF2抑制DOX诱导的线粒体分裂,抑制原代心肌细胞的凋亡以及小鼠的心脏毒性,揭示了由Foxo3a和MIEF2组成的调节DOX心脏毒性的新途径[28]。
lnc-RNA在心脏发育和功能维持中具有重要作用。越来越多的研究表明lnc-RNA在冠心病[29]、先天性心脏病[30]、心肌疾病[31]、心肌肥厚、心肌纤维化以及心力衰竭等方面中发挥着重要作用。目前为止,lnc-RNA在DOX诱导的心脏毒性上的研究在很大程度上仍然是未知的,值得我们研究。
本研究首次证明lncRNA CAF介导的MIEF1参与DOX心脏毒性的调节,研究结果将为DOX心脏毒性分子机制的研究提供新的见解。本研究揭示了MIEF1和lncRNA CAF在DOX诱导的心脏毒性中的作用,而lncRNA CAF和MIEF1将是有希望的治疗靶点,这一发现为治疗心脏保护提供了治疗策略。
【参考文献】
[1]Octavia Y,Tocchetti CG,Gabrielson KL,et al.Doxorubicin-induced cardiomyopathy:from molecular mechanisms to therapeutic strategies[J].J Mol Cell Cardiol,2012,52(6):1213-1225.
[2]Neilan TG,Blake SL,Ichinose F,et al.Disruption of nitric oxide synthase 3 protects against the cardiac injury,dysfunction,and mortality induced by doxorubicin[J].Circulation,2007,116(5):506-514.
[3]Quinn JJ,Chang HY.Unique features of long non-coding RNA biogenesis and function[J].Nat Rev Genet,2016,17(1):47-62.[4]Rotini A,Martínez-Sarrà E,Pozzo E,et al.Interactions between microRNAs and long non-coding RNAs in cardiac development and repair[J].Pharmacol Res,2018,127:58-66.
[5]Archer SL.Mitochondrial dynamics--mitochondrial fission and fusion in human diseases[J].N Engl J Med,2013,369(23):2236-2251.
[6]Suliman HB,Carraway MS,Ali AS,et al.The CO/HO system reverses inhibition of mitochondrial biogenesis and prevents murine doxorubicin cardiomyopathy[J].J Clin Invest,2007,117(12):3730-3741.
[7]Osellame LD,Singh AP,Stroud DA,et al.Cooperative and independent roles of the Drp1 adaptors Mff,MiD49 and MiD51 in mitochondrial fission[J].J Cell Sci,2016,129(11):2170-2181.
[8]Zhao J,Liu T,Jin S,et al.Human MIEF1 recruits Drp1 to mitochondrial outer membranes and promotes mitochondrial fusion rather than fission[J].EMBO J,2011,30(14):2762-2778.
[9]Fisher PW,Salloum F,Das A,et al.Phosphodiesterase-5 inhibition with sildenafil attenuates cardiomyocyte apoptosis and left ventricular dysfunction in a chronic model of doxorubicin cardiotoxicity[J].Circulation,2005,111(11):1601-1610.
[10]Wang JX,Zhang XJ,Feng C,et al.MicroRNA-532-3p regulates mitochondrial fission through targeting apoptosis repressor with caspase recruitment domain in doxorubicin cardiotoxicity[J].Cell Death Dis,2015,6:e1677.
[11]Zhang T,Zhang Y,Cui M,et al.CaMKII is a RIP3 substrate mediating ischemia-and oxidative stress-induced myocardial necroptosis[J].Nat Med,2016,22(2):175-182.
[12]Buzdar AU,Marcus C,Smith TL,et al.Early and delayed clinical cardiotoxicity of doxorubicin[J].Cancer,1985,55(12):2761-2765.
[13]Adameova A,Goncalvesova E,Szobi A,et al.Necroptotic cell death in failing heart:relevance and proposed mechanisms[J].Heart Fail Rev,2016,21(2):213-221.
[14]Negoro S,Oh H,Tone E,et al.Glycoprotein 130 regulates cardiac myocyte survival in doxorubicin-induced apoptosis through phosphatidylinositol 3-kinase/Akt phosphorylation and Bcl-xL/caspase-3 interaction[J].Circulation,2001,103(4):555-561.
[15]Khouri MG,Douglas PS,Mackey JR,et al.Cancer therapy-induced cardiac toxicity in early breast cancer:addressing the unresolved issues[J].Circulation,2012,126(23):2749-2763.
[16]Nozaki N,Shishido T,Takeishi Y,et al.Modulation of doxorubicin-induced cardiac dysfunction in toll-like receptor-2-knockout mice[J].Circulation,2004,110(18):2869-2874.[17]Wang S,Konorev EA,Kotamraju S,et al.Doxorubicin in-duces apoptosis in normal and tumor cells via distinctly di-fferent mechanisms intermediacy of H(2)O(2)- and p53-dependent pathways[J].J Biol Chem,2004,279(24):25535-25543.
[18]Kim SY,Kim SJ,Kim BJ,et al.Doxorubicin-induced reactive oxygen species generation and intracellular Ca2+increase are reciprocally modulated in rat cardiomyocytes[J].Exp Mol Med,2006,38(5):535-545.
[19]Chan DC.Mitochondria:dynamic organelles in disease,aging, and development[J].Cell,2006,125(7):1241-1252.
[20]van der Bliek AM,Shen Q,Kawajiri S.Mechanisms of mitochondrial fission and fusion[J].Cold Spring Harb Perspect Biol,2013,5(6):a011072.
[21]Hom J,Sheu SS.Morphological dynamics of mitochondria--a special emphasis on cardiac muscle cells[J].J Mol Cell Cardiol,2009,46(6):811-820.
[22]Chen Y,Liu Y,Dorn GW.Mitochondrial fusion is essential for organelle function and cardiac homeostasis[J].Circ Res,2011,109(12):1327-1331.
[23]Givvimani S,Pushpakumar SB,Metreveli N,et al.Role of mitochondrial fission and fusion in cardiomyocyte contractility[J].Int J Cardiol,2015,187:325-333.
[24]Jagasia R,Grote P,Westermann B,et al.DRP-1-mediated mitochondrial fragmentation during EGL-1-induced cell death in C.elegans[J].Nature,2005,433(7027):754-760.
[25]Rosenbloom AB,Lee SH,To M,et al.Optimized two-color super resolution imaging of Drp1 during mitochondrial fission with a slow-switching Dronpa variant[J].Proc Natl Acad Sci USA,2014,111(36):13093-13098.
[26]Ikeda Y,Shirakabe A,Maejima Y,et al.Endogenous Drp1 mediates mitochondrial autophagy and protects the heart against energy stress[J].Circ Res,2015,116(2):264-278.
[27]Palmer CS,Osellame LD,Laine D,et al.MiD49 and MiD51, new components of the mitochondrial fission machinery[J].EMBO Rep,2011,12(6):565-573.
[28]Zhou L,Li R,Liu C,et al.Foxo3a inhibits mitochondrial fission and protects against doxorubicin induced cardiotoxicity by suppressing MIEF2[J].Free Radic Biol Med,2017,104:360-370.
[29]Bochenek G,Häsler R,El Mokhtari NE,et al.The large non-coding RNA ANRIL, which is associated with atherosclerosis,periodontitis and several forms of cancer,regulates ADIPORI,VAMP3 and C1lORFl0[J].Hum Mol Genet,2013,22(22):4516-4527.
[30]Carrion K,Dyo J,Patel V,et al.The long non-coding HOTAIR is modulated by cyclic stretch and WNT/β-CATENIN in human aortic valve cells and is a novel repressor of calcification genes[J].PLoS One,2014,9(5):e96577.
[31]Colley SM,Leedman PJ.Steroid receptor RNA activator-a nuclear receptor coregulator with multiple partners:insights and challenges [J].Bioehimie,2011,93(11):1966-1972.

