地高辛对人B细胞淋巴瘤细胞增殖、凋亡的影响及其分子机制的研究
张文婷,江 莲,朱秀丽,刘翠萍,陈 健
强心甾是一类具有强心作用的甾体化合物,临床上用于治疗心力衰竭和心律失常。近年来有研究发现,强心甾类药物可抑制肿瘤细胞的增殖,诱导凋亡,且不影响正常细胞的功能。因此,有学者认为强心甾是一类新型的肿瘤靶向药物[1]。地高辛是一种临床上常用的强心甾类药物,目前少见有关地高辛对恶性淋巴瘤细胞的作用及其分子机制的研究报道。本研究通过体外培养人B细胞淋巴瘤Raji细胞,观察强心甾类药物地高辛对其增殖和凋亡的影响,并检测Survivin、Caspase-3在细胞中的表达情况,初步探讨地高辛对淋巴瘤细胞的作用及其可能的分子机制,为地高辛抗肿瘤的临床应用提供实验依据,并为进一步探讨新型抗肿瘤药物提供新思路。
1 材料和方法
1.1 材料
1.1.1 细胞株 人B细胞淋巴瘤Raji细胞株由河北医科大学第四医院科研中心提供。
1.1.2 主要试剂 地高辛(纯度≥98%)(美国AL公司),胎牛血清(杭州四季青生物工程材料有限公司),RPMI1640培养基、Trizol试剂盒(美国Gibco公司),二甲基亚砜(dimethyl sulfoxide,DMSO)、四甲基偶氮唑蓝、100 bp DNA Ladder(北京索来宝生物制品有限公司),PCR引物(上海捷瑞生物有限公司),RT-PCR二步法试剂盒、PCR用绿色体系(美国Promega公司),琼脂糖、溴化乙锭、乙二胺(美国Sigma公司)。
1.1.3 主要仪器 二氧化碳恒温培养箱(美国SHELDON公司),超净工作台(美国BIOLOGIC公司),倒置相差显微镜(日本OLYMPUS公司),全自动酶标仪(河北省先进医疗器械有限责任公司),流式细胞仪(美国Beckman Coulter公司),PCR扩增仪(美国ABI公司),稳压稳流电泳仪(北京六一仪器厂),凝胶成像分析系统(美国PE公司)。
1.2 方法
1.2.1 细胞培养及处理 将Raji细胞常规培养于含10%的灭活胎牛血清、100 U/mL的青霉素、100 μg/mL的链霉素的RPMI-1640培养基中,置于37 ℃、5%CO2细胞培养箱内培养,2~3 d换液1次,细胞进入对数生长期用于实验研究。实验组细胞培养基中加入DMSO溶解的地高辛,终浓度分别为25 nmol/L、50 nmol/L、100 nmol/L和200 nmol/L;对照组细胞培养基中加入与实验组等体积的DMSO。
1.2.2 四甲基偶氮唑蓝实验 将生长至对数期的Raji细胞浓度调节为1×105/mL,接种于96孔细胞培养板中。实验组加入终浓度分别为25 nmol/L、50 nmol/L、100 nmol/L、200 nmol/L的地高辛进行培养,对照组加入含终浓度为0.1%DMSO的RPMI-1640培养基,每孔终体积为200 μL。分别培养24、48及72 h后用全自动酶标仪测定吸光度,测定波长为570 nm。细胞抑制率=(1-实验组吸光度/对照组吸光度)×100%。
1.2.3 检测细胞凋亡率和周期分布 将生长至对数期的Raji细胞,细胞浓度调节为1×106/mL,实验组分别加入50 nmol/L,100 nmol/L,200 nmol/L地高辛,对照组加入0.1%DMSO。培养48 h后离心收集细胞,PBS洗涤2次,取1×106/mL样品0.1 mL,加入碘化丙啶染液1 mL,在4 ℃冰箱避光染色30 min后上机检测。流式细胞仪测定细胞周期,用流式细胞分析软件分析凋亡细胞数及凋亡百分率(apoptotic percentage,AP),并用Muticycle AV分析软件对DNA细胞周期进行拟合分析。
1.2.4 检测Raji细胞中Survivin、Caspase-3 mRNA表达水平 实验分组同上,不同浓度地高辛与Raji细胞作用48 h,细胞总RNA提取及RT-PCR步骤按试剂盒说明书进行,将提取的RNA逆转录为cDNA,然后以其为模板进行PCR扩增。Survivin引物:上游5′-GCATGGGTGCCCCGACGTTG-3′,下游5′-GCTCCGGCCAGAGGCCTCAA-3′,扩增产物为447 bp;Cas-pase-3引物:上游5′-GGTGTTGATGATGACATGGCG-3′;下游5′-GTACCCTCTGCAGCATGAGAGTAG-3,扩增产物为417 bp;β-actin引物:上游5′-TGAGACCTTCAACACCCCAG-3′,下游:5′-GCCATCTCTTGCTCGAAGTC-3′,扩增产物为312 bp。
配置含0.5 μg/mL溴化乙锭的1.5%琼脂糖凝胶,取PCR产物点样电泳,在凝胶图像分析仪分析。测定各电泳条带的灰度值(A),用β-actin的A值作为内参,表达强度以Survivin A值/β-actin A值、Caspase-3 A值/β-actin A值的比值作为目的基因的相对表达量。
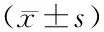
2 结果
2.1 地高辛对Raji细胞增殖的影响 25 nmol/L,50 nmol/L,100 nmol/L,200 nmol/L地高辛作用于Raji细胞24 h、48 h和72 h后,与对照组相比,增殖活性均有不同程度的下降。除25 nmol/L地高辛作用Raji细胞24 h后与对照组相比差异无统计学意义外(P>0.05),其余各实验组与对照组相比差异均有统计学意义(P<0.05)。随着时间的增加,增殖抑制率呈递增趋势。表明地高辛在一定浓度范围内,对Raji细胞有不同程度的增殖抑制作用,此作用呈剂量-效应和时间-效应依赖关系(表1,图1)。
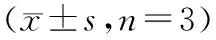
表1 不同浓度地高辛作用于Raji细胞 24、48、72 h后吸光度值变化
注:与对照组比较,*P<0.05;与25 nmol/L比较,△P<0.05;与50 nmol/L比较,◆P<0.05;与100 nmol/L比较,☆P<0.05
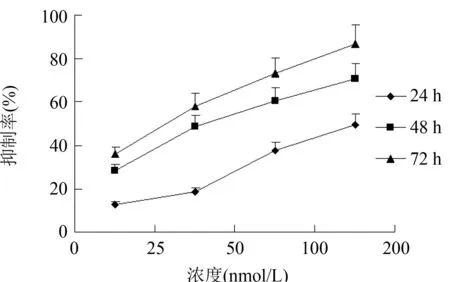
图1 不同浓度地高辛作用于Raji细胞 24 h、48 h、72 h后增殖抑制率变化
2.2 地高辛对Raji细胞周期的影响 50 nmol/L、100 nmol/L和200 nmol/L地高辛作用于Raji细胞48 h后,细胞周期分布均发生变化,G0/G1期和S期细胞数减少,G2/M期细胞数增加。实验组Raji细胞G2/M期细胞数与对照组相比差异有统计学意义(F=122.030,P<0.05)。由此说明地高辛可阻滞Raji细胞于G2/M期,随着地高辛浓度的增加,阻滞作用增强,呈一定剂量-效应依赖关系(表2)。
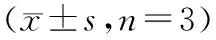
表2 不同浓度地高辛作用于Raji细胞48 h后 细胞周期的变化
注:与对照组比较,*P<0.05;与50 nmol/L比较,△P<0.05;与100 nmol/L比较,◆P<0.05
2.3 地高辛对Raji细胞凋亡的影响 50 nmol/L、100 nmol/L和200 nmol/L地高辛作用于Raji细胞48 h后,出现明显的凋亡峰,而对照组未见凋亡峰或仅有低平的凋亡峰。经单因素方差分析,各实验组地高辛作用Raji细胞48 h后的细胞凋亡率与对照组相比差异有统计学意义(F=36.409,P<0.05),说明随着地高辛浓度增加,引起Raji细胞凋亡率逐渐增大,即凋亡细胞数与地高辛浓度呈剂量-效应依赖关系(表3)。
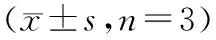
表3 不同浓度地高辛作用于Raji细胞48 h后 细胞凋亡率的变化
2.4 地高辛对Raji细胞Survivin、Caspase-3 mRNA表达水平的影响 RT-PCR检测结果显示,50 nmol/L、100 nmol/L和200 nmol/L浓度地高辛作用于Raji细胞48 h后,Survivin mRNA的相对表达量低于对照组(F=504.383,P<0.05),并随作用浓度增加相对表达量降低,同时Caspase-3 mRNA的相对表达量高于对照组(F=391.506,P<0.05),并随作用浓度增加相对表达量增高(表4,图2,图3)。
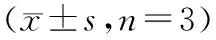
表4 不同浓度地高辛作用于Raji细胞48 h后 Survivin、Caspase-3 mRNA表达的比较
注:与对照组比较,*P<0.05;与50 nmol/L比较,△P<0.05;与100 nmol/L比较,◆P<0.05
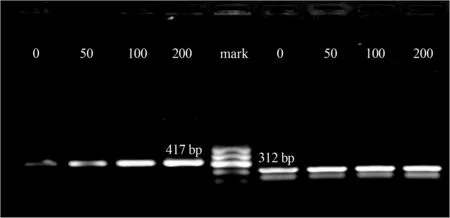
图2 不同浓度地高辛作用于Raji细胞48 h后 Survivin mRNA和β-actin mRNA的表达
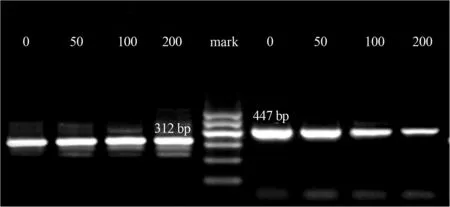
图3 不同浓度地高辛作用于Raji细胞48 h后 Caspase-3 mRNA和β-actin mRNA的表达
3 讨论
淋巴瘤为儿童常见恶性肿瘤之一,据流行病学资料显示,我国每年新发的儿童淋巴瘤病例为6 000~8 000例,其中80%左右为非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)[2]。虽然随着化疗方案的调整和改进,NHL的缓解率有了较高提升,但原发耐药和反复复发仍是影响治疗效果的因素之一。传统化疗药物造价昂贵,儿童对化疗耐受性较成年患者差,常易出现严重骨髓抑制、合并重症感染等,限制了用药强度。因此探索高效低毒的治疗药物,已成为当前研究的热点。近年研究发现强心甾类药物除了强心等作用外,还可以有效地杀伤人胰腺癌、结肠癌、肺癌、白血病等多种肿瘤细胞[3-7],能选择性地抑制相应肿瘤细胞的增殖或诱导其凋亡。研究者们推测强心甾类物质极有希望成为新的抗肿瘤药物,提出其可以单药治疗、联合化疗药物辅助并可增强放疗敏感性,用于肿瘤的治疗[8-9],因此越来越受到人们的关注。
地高辛是一种临床上常用的口服剂型的强心甾类药物,来源于玄参科植物洋地黄,服用方便,起效速度快,作用时间较短,浓度易于测定,应用最为广泛。早期地高辛被认为具有抗肿瘤作用是因为Stenkvist等[10]发现,服用地高辛的乳腺癌患者复发率及死亡率均较未口服者低。近年来,有研究对47 884例患者20年(1986~2006年)的追访重新评估了地高辛与前列腺癌的关系,发现定期服用地高辛的患者,特别是服用时间超过10年以上的患者,患前列腺癌的风险较低。地高辛在体外可有效抑制前列腺癌细胞的生长,它的使用使患前列腺癌的风险降低25%[11]。Pereira等[12]发现地高辛与顺铂联合应用,能起到协同作用,增强对宫颈癌Hela细胞增殖抑制,减少顺铂化疗的毒性反应。地高辛抗肿瘤作用机制复杂,已发现其可能通过抑制Na+/K+-ATPase活性、激活Ras和MAPK途径引起线粒体损伤,或通过抑制HIF-1α转录而减少蛋白质合成等多种途径抑制肿瘤细胞增殖,诱导凋亡[6,13]。
肿瘤是一类细胞周期调控机制遭到破坏的疾病,肿瘤的发生、发展与细胞周期的分布密切相关。G2/M期是细胞周期的一个重要的调节点,是细胞增殖的关键[14]。本研究结果显示,地高辛能够明显减少G0/G1和S期的Raji细胞,增加G2/M期细胞数。推测地高辛的作用机制可能是将细胞抑制在G2/M期的限制点内从而使细胞的增殖受到抑制。同时,地高辛对Raji细胞具有明显的诱导凋亡作用。地高辛作用于Raji细胞48 h后出现凋亡峰,且呈浓度依赖关系。
Survivin是迄今为止凋亡抑制蛋白家族中所发现的分子量最小、作用最强的凋亡抑制因子。它在多种肿瘤组织中高表达,而在正常组织及癌旁组织中无表达或低表达[15],与肿瘤细胞的增殖、分化及浸润转移密切相关。Ambrosini等[16]首次报道了Survivin与NHL之间的关系,提示Survivin在NHL中高表达。有研究表明Survivin的表达与NHL的恶性程度呈正相关,常预示着较差的预后[17]。Adida等[18]用免疫组织化学方法检测了222例弥漫大B细胞淋巴瘤组织中Survivin的表达,其阳性率为60%,且Survivin表达阳性者,5年生存率明显低于Survivin阴性者。鉴于Survivin具有独特的组织分布特点,使其在肿瘤治疗时可发挥不伤及正常组织的特性,所以Survivin有可能会成为较理想的抗肿瘤潜在靶点[19]。Survivin可通过调节Caspase级联反应中Caspase-9、Caspase-3、Caspase-7,抑制各种刺激诱导的细胞凋亡[20-21]。Survivin最终通过抑制终末效应蛋白Caspase-3来抑制细胞的凋亡。Caspase-3是Caspase家族中重要的凋亡执行者,活化的Caspase-3通过特异性地裂解一系列底物而直接导致细胞死亡。本研究实验组与对照组相比,Survivin mRNA含量明显降低,Caspase-3 mRNA表达明显升高,表明地高辛可以通过下调Survivin,激活Caspase-3的表达来促进淋巴瘤细胞的凋亡。
综上所述,强心甾类药物地高辛对Raji细胞生长具有明显的抑制作用,其可能涉及的机制包括使Raji细胞阻滞于G2/M期,抑制细胞增殖;通过下调Survivin的表达、活化Caspase-3来诱导细胞凋亡。本研究对强心甾类药物抗淋巴瘤机制进行了初步探讨,为强心甾类药物应用于淋巴瘤治疗提供了新的思路。但其在体内的作用有待于进一步研究,且地高辛过量会引起心脏毒性。目前,研究人员已在探索合适的地高辛抗肿瘤治疗剂量,希望其既能发挥抗肿瘤作用,又不增加毒性反应[22]。将地高辛与其他化疗药物联合应用有可能成为今后淋巴瘤治疗中的一种更好选择。
【参考文献】
[1]Newman RA,Yang P,Pawlus AD,et al.Cardiac glycosides as novel cancer therapeutic agents[J].Mol Interv,2008,8(1):36-49.
[2]桂林,石远凯,何小慧,等. 妊娠期淋巴瘤21例临床病理特征分析[J].中华医学杂志,2015,95(6):425-429.
[3]Liu X,Xiao XY,Shou QY,et al.Bufalin inhibits pancreatic cancer by inducing cell cycle arrest via the c-Myc/NF-κB pathway[J].J Ethnopharmacol,2016,193:538-545.
[4]Anderson SE,Barton CE.The cardiac glycoside convallatoxin inhibits the growth of colorectal cancer cells in a p53-independent manner[J].Mol Genet Metab Rep,2017,13:42-45.
[5]Kaushik V,Yakisich JS,Azad N,et al.Anti-tumor effects of cardiac glycosides on human lung cancer cells and lung tumorspheres[J].J Cell Physiol,2017,232(9):2497-2507.
[6]Zeino M,Brenk R,Gruber L,et al.Cytotoxicity of cardiotonic steroids in sensitive and multidrug-resistant leukemia cells and the link with Na(+)/K(+)-ATPase[J].J Steroid Biochem Mol Biol,2015,150:97-111.
[7]Diederich M,Muller F,Cerella C.Cardiac glycosides:from molecular targets to immunogenic cell death[J].Biochem Pharmacol,2017,125:1-11.
[8]Kapoor S.Digoxin and its antineoplastic properties:an evolving role in oncology[J].J Pediatr Hematol Oncol,2014,36(8):666-667.
[9]Slingerland M,Cerella C,Guchelaar HJ,et al.Cardiac glycosides in cancer therapy:from preclinical investigations towards clinical trials[J].Invest New Drugs,2013,31(4):1087-1094.
[10]Stenkvist B,Bengtsson E,Eriksson O,et al.Cardiac glycosides and breast cancer[J].Lancet,1979,1(8115):563.
[11]Varbanov HP,Kuttler F,Banfi D,et al.Repositioning approved drugs for the treatment of problematic cancersusing a screening approach[J].PLoS One,2017,12(2):e0171052.[12]Pereira DG,Salgado MAR,Rocha SC,et al.Involvement of Src signaling in the synergistic effect between cisplatin and digoxin on cancercell viability[J].J Cell Biochem,2018,119(4):3352-3362.
[13]Zhang H,Qian DZ,Tan YS,et al.Digoxin and other cardiac glycosides inhibit HIF-1alpha synthesis and block tumor growth[J].Proc Natl Acad Sci USA,2008,105(50):19579-19586.
[14]Le AP,Zhang LL,Liu W,et al.Cantharidin inhibits cell proliferation and induces apoptosis through G2/M phase cell cycle arrest in hepatocellular carcinoma stem cells[J].Oncol Rep,2016,35(5):2970-2976.
[15]Altieri DC.Survivin-the inconvenient IAP[J].Semin Cell Dev Biol,2015,39:91-96.
[16]Ambrosini G,Adida C,Altieri DC.A novel anti-apoptosis gene,survivin,expressed in cancer and lymphoma[J].Nature Med,1997,3(8):917-921.
[17]Kaneko N,Mitsuoka K,Amino N,et al.Combination of YM155, a survivin suppressant, with bendamustine and rituximab:a new combination therapy to treat relapsed/refractory diffuse large B-cell lymphoma[J].Clin Cancer Res,2014,20(7):1814-1822.
[18]Adida C,Haioun C,Gaulard P,et al.Prognostic significance of surviving expression in diffuse large B-cell lymphomas[J].Blood,2000,96(5):1921-1925.
[19]Garg H,Suri P,Gupta JC,et al.Survivin:a unique target for tumor therapy[J].Cancer Cell Int,2016,16:49.
[20]Wang J,Jin Y,Xu Z,et al.Involvement of caspase-3 activity and survivin downregulation in cinobufocini-inducedapoptosis in A 549 cells[J].Exp Biol Med (Maywood),2009,234(5):566-572.
[21]Rubio N,Garcia-Segura LM,Arevalo MA.Survivin prevents apoptosis by binding to caspase-3 in astrocytes infected with the BeAn strain of Theiler’s murine encephalomyelitis virus[J].J Neurovirol,2012,18(5):354-63.
[22]Zhang XH,Wang XY,Zhou ZW,et al.The combination of digoxin and GSK2606414 exerts synergistic anticancer activity against leukemia in vitro and in vivo[J].Biofactors,2017,43(6):812-820.

