镉胁迫对银灰杨根和叶片渗透调节物质的影响
张阿芳,张 庆,代惠萍,魏树和,贾根良,吴三桥,魏安智
(1.陕西理工大学 生物科学与工程学院,陕西 汉中 723001;2.陕西理工大学,陕西省资源生物重点实验室,陕西 汉中 723001;3.中国科学院沈阳应用生态研究所污染生态与环境工程重点实验室,辽宁 沈阳 110016;4.西北农林科技大学 理学院,陕西 杨陵 712100;5.西北农林科技大学 林学院,陕西 杨陵 712100)
镉是生物毒性最强的重金属之一,被列为五大毒物(Cd、Hg、As、Cr、Pb)之首。工业“三废”排放、不合理的农业管理措施等是导致土壤Cd污染的主要原因[1-3]。2014年4月17日环境保护部和国土资源部联合发布的“全国土壤污染状况调查公报”表明,在调查的630万km2面积内,我国1/5的耕地受到了重金属污染,其中镉污染的耕地涉及11个省25个地区,问题比较突出[3-5],然而,综观现有的重金属污染土壤修复技术,就污染面积较大的农田土壤来说,换土或淋洗等物理/化学修复方法均因技术、经济或社会等原因而难以应用。利用植物修复镉污染土壤,关键是寻找富集能力强的植物,研究其吸收和富集镉的机制,并在此基础上改良和培养新的镉富集植物[6-9]。与草本植物相比,木本植物杨树具有生长迅速、根系发达、地上部分生物量大等特点[5,10]。本研究前期表明,银灰杨(Populuscanescens)是我国新发现的一种原生态镉高积累植物,其对镉具有很强的耐性和积累能力,是绿色植物修复技术的一种良好潜在材料[10]。本研究以银灰杨为研究对象,初步探讨银灰杨受到镉胁迫后渗透调节物质的响应规律,为用于受镉污染土壤的植物修复提供一定的理论依据。
1 材料与方法
1.1 材料处理
本试验引进德国银灰杨(Populuscanescens)试管苗,经扩繁培养后栽入1/2 Hoagland营养液的塑料盆中,营养液每3 d更换1次,保持pH值为6.5。自然光照下培养2个月时,每盆栽植6株,并加1 000 mL Hoagland无镉营养液。向盆中营养液加入CdSO4来设置镉浓度,形成Cd为0(CK,对照)、10、30、50、70 μmol/L,设置5个处理,每处理重复6次,营养液每3 d更换1次。分别在处理7、14、21 d 和28 d时进行收获,将每株根、叶片分开,迅速用液氮速冻,保存于-80℃冰箱中,进行相关指标测定。
1.2 丙二醛(MDA)含量和过氧化氢(H2O2)、游离脯氨酸、可溶性蛋白和可溶性糖含量的测定
采用硫代巴比妥酸(TBA)法稍作改进测定丙二醛含量[10];H2O2含量测定按照代惠萍[10]的方法;脯氨酸含量测定按照李合生[11]等的方法;采用考马斯亮蓝-250蛋白染色法测定可溶性蛋白质含量[12];采用葸酮比色法测定可溶性糖含量[12]。
1.3 数据处理与统计分析
试验数据采用EXCEL和SPSS 16软件包进行平均数、方差分析及最小显著差法(LSD法)差异显著性比较。试验数据以均值±标准差表示,差异显著性水平为P<0.05。
2 结果与分析
2.1 镉对银灰杨MDA含量的影响
从表1看出,随着Cd胁迫时间的延长,银灰杨根和叶的MDA含量均呈相似增加趋势,Cd胁迫后7 d时,在10 μmol·L-1胁迫时,叶片和根系MDA含量低于相应对照,而30、50 μmol·L-1和70 μmol·L-1胁迫下,MDA含量均比相应对照增加;在14~21 d时,不同胁迫下叶片和根系的MDA含量均显著高于对照(P<0.05);随着渗透胁迫程度的加重,到第28天时,在10、30、50 μmol·L-1和70 μmol·L-1Cd胁迫下,叶和根系的MDA含量分别高于相应对照10.9%、47.3%、1.05倍、1.33倍和 95.8%、1.01倍、1.96倍和 2.82倍;进一步表明镉毒害引起银灰杨体内产生了氧化胁迫,银灰杨根系和叶片氧化损伤程度与镉浓度成正相关。
2.2 镉对银灰杨H2O2含量的影响
表2可知,随着镉胁迫时间的延长,银灰杨叶片和根系的H2O2含量均呈相似增加趋势,在7 d和14 d时,10 μmol·L-1和30 μmol·L-1Cd胁迫下叶片和根系H2O2含量均稍低于相应对照,而50 μmol·L-1和70 μmol·L-1Cd胁迫下H2O2含量均稍高于相应对照,且差异不显著(P<0.05);在21 d时,随着Cd浓度叶片和根系的H2O2含量而增加,且差异显著(P<0.05);在10、30、50 μmol·L-1和70 μmol·L-1Cd胁迫28 d时,叶片和根系H2O2含量均高于相应对照9.0%、52.6%、62.8%、75.6%和14.6%、56.2%、91.0%、1.03倍。
2.3 镉对银灰杨脯氨酸含量的影响
从图1可以看出,随着Cd浓度增加,银灰杨叶片和根系的脯氨酸含量均呈相似增加趋势。在7 d到21 d时,在10 μM Cd胁迫7 d时,叶片的脯氨酸含量比对照减少了0.7%,且不同浓度镉胁迫下叶片和根系脯氨酸含量差异显著(P<0.05);随着渗透胁迫程度的加重,在10、30、50 μmol·L-1和70 μmol·L-1Cd胁迫28 d时,叶片和根系脯氨酸含量分别高于相应对照11.7%、41.8%、80.4%、117.4%和3.2%、18.4%、80.0%和142.7%。
2.4 镉对银灰杨可溶性蛋白含量的影响
图2表明,随着镉胁迫时间的延长,银灰杨的叶片和根中可溶性蛋白含量总体呈增加趋势。在7~21 d时,不同浓度镉胁迫下,叶片和根系可溶性蛋白含量均高于对照,且差异显著(P<0.05);在10、30、50 μmol·L-1和70 μmol·L-1Cd胁迫28 d时,叶片和根系可溶性蛋白含量均高于相应对照4.2%、8.7%、13.9%、10.0%和8.5%、19.8%、23.5%、2.8%,且差异显著(P<0.05)。
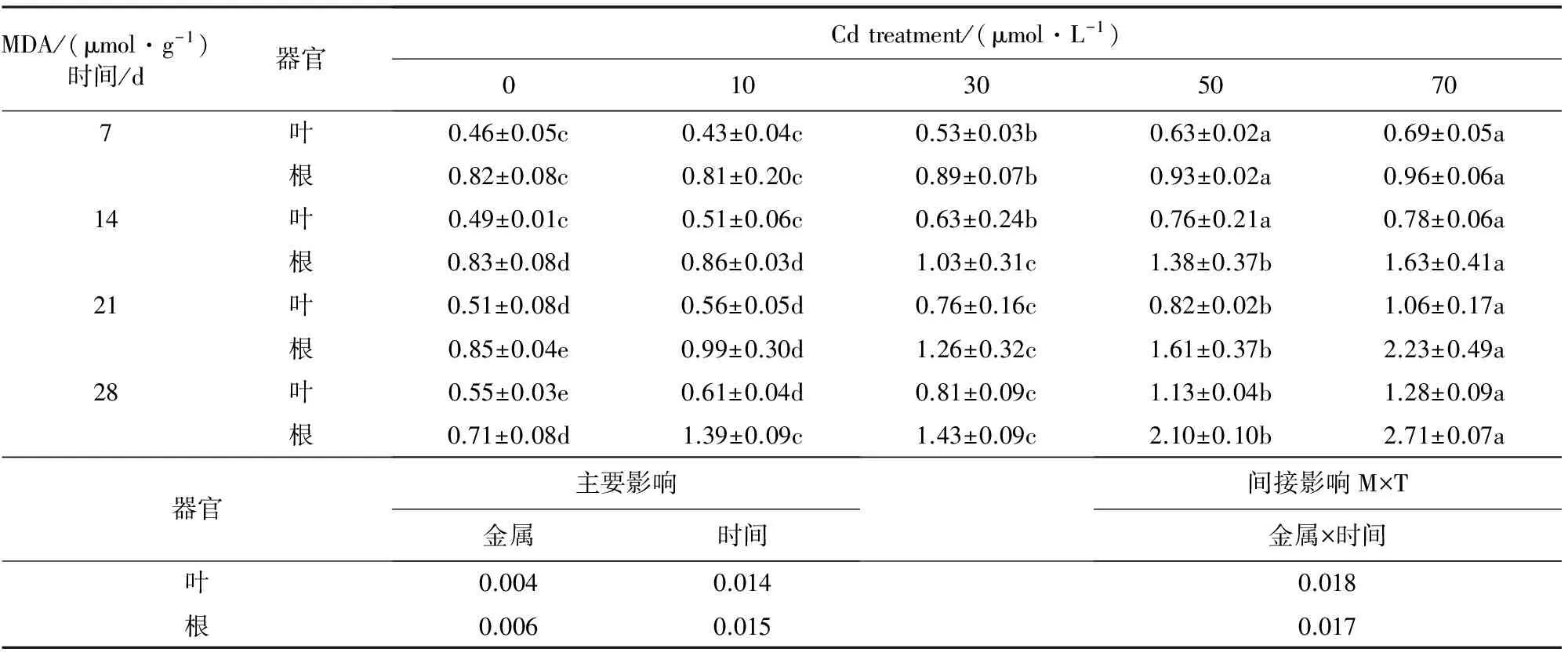
表1 Cd胁迫对银灰杨叶片和根系MDA含量的影响
注:数据显示为平均值±SE(n=6),不同字母表示P<0.05显著水平。下同。
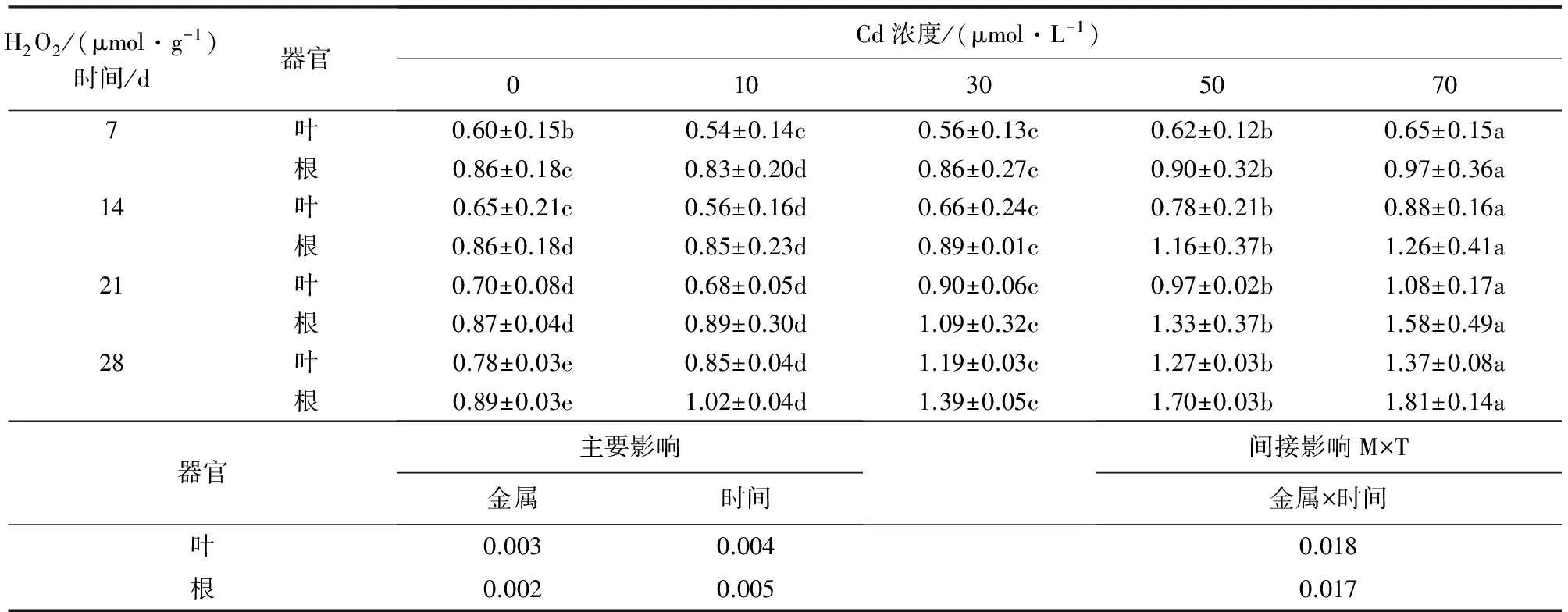
表2 Cd胁迫对银灰杨叶片和根系H2O2含量的影响

图1 Cd胁迫对银灰杨脯氨酸含量的影响

图2 Cd胁迫对银灰杨可溶性蛋白含量的影响
2.5 镉对银灰杨可溶性糖含量的影响
从图3可知,随着镉胁迫时间的延长,银灰杨的叶片和根系中可溶性糖含量均呈增加趋势。在7~21 d时,不同浓度镉胁迫下叶片和根系的可溶性糖浓度均高于相应对照,在28 d时,在10、30、50 μmol·L-1和70 μmol·L-1Cd胁迫下,叶片和根系的可溶性糖分别比对照增加了49.6%、50.4%、74.3%、96.5%和78.7%、90.7%、67.3%、51.9%,且不同浓度间差异显著(P<0.05)。
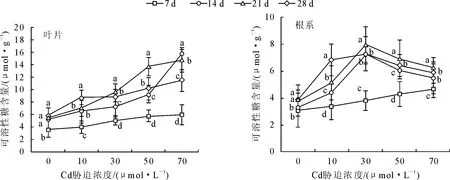
图3 Cd胁迫对银灰杨叶片和根系中可溶性糖含量的影响
3 结论与讨论
镉胁迫条件下,因在植物体内过量的ROS积累,导致膜脂过氧化,且使蛋白质脱氢而产生蛋白质自由基,使蛋白质发生链式聚合反应,从而使细胞膜系统损伤[13-17]。因此,H2O2和MDA含量是衡量氧化胁迫程度的重要指标[13]。本研究中,在低浓度10 μmol·L-1Cd胁迫7 d,叶片和根系的脂质过氧化产物MDA和H2O2的含量均稍低于相应的对照,说明在低浓度镉条件下,银灰杨体内清除过量自由基防止过氧化方面发挥重要作用。且随着镉胁迫程度的加剧,在28 d时,50 μmol·L-1和70 μmol·L-1Cd胁迫下,其根系和叶片H2O2和MDA含量显著增加,这说明Cd毒害引起银灰杨产生了氧化胁迫,氧化损伤随Cd胁迫浓度的增加而加强。本试验进一步证实了Chao[18]等的结果。
可溶性蛋白质、可溶性糖和脯氨酸是植物体内主要的渗透调节物质,三者在逆境胁迫下,植物体以保持植物细胞的含水量和膨压势,维持植物的正常生长和代谢[8]。植物在重金属胁迫下,细胞中可溶性蛋白质含量的增加,一方面可与Cd2+形成Cd结合蛋白(Cd-BP),Cd-Bp的形成限制了自由态Cd2+的存在,减轻了Cd对植物的毒害;另一方面可提高功能蛋白的数量,增加细胞渗透势,有助于维持细胞正常代谢,提高植物的抗逆性[14]。在本研究中,随Cd浓度增加,当银灰杨受到镉胁迫时,通过提高可溶性蛋白和可溶性糖的积累量来降低细胞免受伤害,维持细胞正常的生理代谢。说明银灰杨体内可能存在解毒作用的特定蛋白,这是银灰杨耐Cd毒害的一种解毒机制。本研究结果与苎麻[19]的研究结果相一致。
脯氨酸是PCs合成前体,也是重要的渗透调节物质。在Cd胁迫下,脯氨酸含量的提高有着对逆境适应的意义。镉胁迫28 d时,随着渗透胁迫程度的加重,银灰杨体内的脯氨酸含量呈上升趋势,表明镉胁迫条件下银灰杨体内脯氨酸含量的上升可视为植物的保护性反应,且认为脯氨酸含量的提高可能是银灰杨耐Cd机制之一。本研究结果与欧洲黑杨[20]的研究结果相似。
综上所述,银灰杨具有一定的耐镉性,低浓度的镉(10 μmol·L-1)胁迫对银灰杨幼苗生长的影响较小,而当镉胁迫浓度为70 μmol·L-1时会对银灰杨幼苗产生一定的毒害作用,通过主动积累脯氨酸、蛋白质和可溶性糖等渗透物质来维持自身体内的水分平衡和渗透平衡,以降低其毒害作用。镉胁迫会对银灰杨的抗逆性生理特性产生一定的影响,其自身产生的适应性生理响应可能是其缓解镉毒害的一种调节机制。
参考文献:
[1] 施卫明,薛利红,王建国,等.农村面源污染治理的“4R”理论与工程实践—生态拦截技术[J].农业环境科学学报,2013,32(9):1697-1704.
[2] 李元,祖艳群.重金属污染生态与生态修复[M].北京:科学出版社,2016.
[3] 杨肖娥,李廷强.发明专利:一种重金属中轻度污染菜地土壤的边生产边修复方法[P].中华人民共和国国家知识产权局,2007.
[4] 魏树和,杨传杰,周启星.三叶鬼针草等7种常见菊科杂草植物对重金属的超富集特征[J].环境科学,2008,29(10):2912-2918.
[5] WEI Z B,GUO X F,WU Q T,etal.Phytoextraction of heavy metal from contaminated soil by co-cropping with chelator application and assessment of associated leaching risk[J].International Journal of Phytoremediation,2011,13:719-729.
[6] 张永超,陈存根,钟发明,等.重金属铅、镉在白榆中分布规律和累积特性研究[J].西北林学院学报,2011,26(5):6-11.
ZHANG Y C,CHEN C G,ZHONG F M,etal.Distribution and accumulation of lead and cadmium inUlmuspumila[J].Journal of Northwest Forestry University,2011,26(5):6-11.(in Chinese)
[7] 张家洋,蔺芳.18种绿化树木叶片铅、镉、氯、硫含量的比较[J].西北林学院学报,2015,30(6):71-75.
ZHANG J Y,LIN F.Comparison of the contents of Pd,Cd,CI and S in the leaves of 18 greening tree species[J].Journal of Northwest Forestry University,2015,30(6):71-75.(in Chinese)
[8] DAI H P,WEI S H,TWARDOWSKA I,etal.Hyperaccumulating potential ofBidenspilosaL.for Cd and elucidation of its translocation behavior based on cell membrane permeability[J].Environ Sci Pollut Res,2017,24:23161-23167.
[9] GUO B H,DAI S X,WANG R G,etal.Combined effects of elevated CO2and Cd-contaminated soil on the growth,gas exchange,antioxidant defense,and Cd accumulation of poplars and willows[J].Environ Expe Bot,2015,115:1-10.
[10] 代惠萍.植物对非生物胁迫的生理响应机制[M].成都:西南交通大学出版社,2014.
[11] 李合生,孙群,赵世杰.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[12] DAI H P,SHAN C J,ZHAO H,etal.The difference in antioxidant capacity of four alfalfa cultivars in response to Zn[J].Ecotoxicol Environ Saf,2015,114:312-317.
[13] DAI H P,WEI S H.Effects of cadmium on the antioxidative defense system and biomass accumulation ofPopulus×canescens[J].Bangladesh J Bot,2017,46(3):865-870.
[14] WEI S H,BAI J Y,YANG C J,etal.Compound amino acids added in media improvedSolanumnigrumL.phytoremediating CD-PAHS contaminated soil[J].Intern J Phytoremediation,2016,18(4):358-363.
[15] MISHRA S,SRIVASTAVA S,TRIPATHI R D,etal.Phytochelat in synthesis and response of antioxidants during cadmium stress inBacopamonnieriL[J].Plant Physiol Biochem,2006,44:25-37.
[16] ROMERO-PUERTAS M C,CORPAS F J,RODRIGUEZ-SERRANO M,etal.Differential expression and regulation of antioxidative enzymes by Cd in pea plants[J].J Plant Physiol,2007,164:1346-1357.
[17] NAJEEB U,JILANI G,ALI S,etal.Insights into cadmium induced physiological and ultra-structural disorders in juncus effusus L.and its remediation through exogenous citric acid[J].J Hazard Mater,2011,186:565-574.
[18] CHAO Y,HONG C,KAO C.The decline in ascorbic acid content is associated with cadmium toxicity of rice seedlings[J].Plant Physiol Biochem,2010,48:374-381.
[19] 王欣,刘云国,艾比布·努扎艾提,等.苎麻对镉毒害的生理耐性机制及外源精胺的缓解效应[J].农业环境科学学报,2007,26(2):487-493.
[20] STOBRAWA K,LORENC-PLUCINSKA G.Changes in carbohydrate metabolism in fine roots of the native European black poplar (PopulusnigraL.) in a heavy-metal-polluted environment[J].Sci Total Environ,2007,373:157-165.

