榛仁五肽对HUVEC细胞氧化应激损伤的保护作用
王祖浩,郭勇,周美含,刘春雷,方丽,闵伟红
(1.吉林农业大学食品科学与工程学院,吉林长春 130118)(2.小麦和玉米深加工国家工程实验室,吉林长春 130118)
氧化还原反应是人体内进行的一种生理化学反应,人体在代谢过程中,会产生大量活性氧自由基,同时体内的氧化防御系统会清除活性氧自由基。正常情况下,健康人体抗氧化防御能力健全,防御系统处于动平衡状态,即人体内氧化自由基的产生和被清除处于动态平衡的状态[1]。然而,一旦人体产生大量活性氧自由基或抗氧化防御体系出现紊乱时,大量的活性氧自由基不能被及时清除,这种动态平衡就会被打破,造成机体氧化损伤,导致衰老,甚至发生脏器病变、细胞死亡、组织受损、糖尿病和冠状动脉硬化等许多慢性疾病[2,3]。近年来,国内外利用动物或植物蛋白通过酶控制水解技术制备获得了较好抗氧化作用的多肽,例如:玉米蛋白肽[4]、花生仁蛋白肽[5]和牛乳酪蛋白[6]等[7]。榛子富含脂肪 59.1%~69.8%、蛋白质14.1%~18.0%、碳水化合物 6.5%~9.3%、膳食纤维8.2%~9.6%及多种矿物质,其蛋白质含包括人体8种必需氨基酸在内的20余种氨基酸,是优质植物蛋白资源,亦是制备功能肽的食源性蛋白[8,9]。目前,抗氧化肽已成为活性肽研究中的热点,研究人员已从动植物蛋白中筛选出了一些具有较强抗氧化活性的天然抗氧化肽。本实验室在前期工作中通过酶法定向水解制备多肽、Sephadex G-25、Sephadex G-15、反相高效液相色谱分离纯化、质谱鉴定和化学合成获得长白山榛仁蛋白五肽Ala-Trp-Asp-Pro-Glu,在此基础上,本研究通过化学和细胞模型等方法,研究其对自由基的清除作用及对HUVEC细胞氧化应激损伤的保护作用,为长白山地区榛子蛋白资源的深度开发提供理论依据,促进优质植物蛋白资源的高效利用。
1 材料与设备
1.1 实验原料
Ala-Trp-Asp-Pro-Glu肽:北京中科亚光生物科技有限公司合成,纯度96.87%。
1.2 试剂及来源
DPPH、抗坏血酸(Vc)、血管紧张素Ⅱ(AngⅡ)、二甲基亚砜(DMSO)、四氮唑蓝(MTT)购自美国Sigma公司;RPMI·1640培养液、双抗、EDTA胰酶、胎牛血清、PBS溶液购自美国Gibco公司;HUVEC细胞、上海中乔新舟生物科技有限公司。其余试剂均为国产分析纯。
1.3 仪器与设备
高速冷冻离心机(Z36HK),HERMLE公司(德国);酶标仪(SPECTRA MAX 190),美国(Molecular Devices);紫外可见分光光度计(UV-1700),日本岛津;CO2细胞培养箱(CB150),德国BINDER公司;荧光倒置显微镜(IX53),日本Olympus公司;超净工作台(AIRTECH),苏州安泰空气技术有限公司;等常用仪器设备。
1.4 试验方法
1.4.1 榛仁活性肽制备
以长白山脱脂榛仁粉为原料,采用碱溶酸沉法制备分离蛋白,利用碱性蛋白酶酶解制备抗氧化肽,经过Sephadex G-25、Sephadex G-15、RP-HPLC三步纯化后,通过质谱鉴定出分子量为 616.63 u的Ala-Trp-Asp-Pro-Glu榛仁肽,最后由北京中科亚光生物科技有限公司合成纯度为96.87%五肽。
1.4.2 AWDPE对体外自由基清除能力的测定
1.4.2.1 DPPH自由基清除能力的测定
参照谢正军的试验方法[10]。
DPPH 清除率=[1-(A样品-A对照)/A空白]×100
1.4.2.2 ABTS+·自由基清除能力的测定
参照Kong B的试验方法[11]。
ABTS 清除率=[1-(A样品-A对照)/A空白]×100
1.4.3 人脐静脉血管内皮细胞(HUVEC)培养
取得原代HUVEC细胞,将其培养瓶放入37 ℃,5% CO2培养箱中,待其生长稳定后,进行继续培养(细胞培养液:10%培养液:90 mL 1640培养液+10 mL胎牛血清+2 mL双抗),细胞传代,细胞冻存(细胞冻存液:1640培养液:胎牛血清:DMSO=6:3:1)处理。选择生长状态良好4~9代细胞进行试验。
1.4.4 MTT法检测AWDPE对HUVEC细胞的毒性作用
选取对数期生长良好的 HUVEC细胞用胰酶消化,用10%培养液制成密度为1×105个/mL细胞悬液,以100 μL/孔接种于96孔培养板,三个平行样,空白对照组和剂量组(样品终浓度分别为0、1、10、50、100、500、1000 μg/mL),于 37 ℃、5% CO2培养 24 h后,加入MTT溶液(终浓度为5 mg/mL),继续培养4 h后,弃去培养液,加入二甲基亚砜,震荡10 min至甲臜结晶完全溶解,酶标仪测A570nm值。
细胞存活率%=(A样品组/A空白对照组)×100%。
1.4.5 HUVEC细胞氧化损伤模型的建立
实验分空白对照组、AngⅡ组(计量终浓度梯度为 0、10-9、10-8、10-7、10-6、10-5、10-4、10-3mol/L),于37 ℃、5% CO2条件下分别培养不同时间(0、2、4、6、8 h)[12],其他操作同1.4.4。
1.4.6 AWDPE对AngⅡ氧化损伤HUVEC细胞的保护作用
实验分空白对照组、AngⅡ损伤组和样品保护组,选取对数期生长良好的HUVEC细胞用胰酶消化,用10%培养液制成密度为 1×105个/mL细胞悬液,以 1 mL/孔接种于6孔培养板,待细胞完全贴壁生长后(约接种24 h),饥饿培养4 h后,样品保护组加入AWDPE溶液(样品终浓度分别为1、10、50、100、500、1000 μg/mL),培养24 h后,弃去培养液,AngⅡ损伤组和样品保护组分别加入终浓度为10-7mol/L AngⅡ,于37 ℃、5% CO2条件培养6 h,其他操作同1.4.4。
1.4.7 分析AWDPE对HUVEC细胞内各种抗氧化酶的影响
按照南京建成生物工程研究所,MDA、LDH、CAT、T-SOD、GSH-PX、总蛋白定量试剂盒进行实验。
1.4.8 统计分析
2 结果与分析
2.1 AWDPE对DPPH、ABTS+·自由基清除能力的分析
Hernández等[23]人研究发酵乳中抗氧化肽的抗氧化活性,发现His、Pro(疏水性氨基酸)可显著提高抗氧化肽的抗氧化活性,Trp(疏水性氨基酸)、Tyr对ABTS+自由基清除的贡献最大,因为这类氨基酸的吲哚基和苯环可供氢。本研究中AWDPE清除ABTS+自由基活性能力较强,可能是与其含有的Trp和Pro有关。另外,Ali Bougatef等[24]人利用沙丁鱼副产物水解分离出的抗氧化肽,研究其抗氧化功能,利用DPPH自由基清除能力检验其抗氧化能力。本研究中AWDPE所含有的氨基酸与其所研究的活性肽含有的氨基酸成分部分一致。
2.2 AWDPE对HUVEC细胞的毒性作用
图2为利用MTT试验法,考察AWDPE对HUVEC细胞的毒性作用。由图可知,以空白对照组的细胞存活率为100%,除50 μg/mL浓度外,不同浓度AWDPE对细胞存活率的影响与空白组相比并无差异显著性,说明AWDPE对HUVEC细胞无毒性作用,对HUVEC细胞的生长繁殖亦无促进作用,对细胞生长是安全的。50 μg/mL浓度虽然细胞存活率升高,具有差异显著性,但细胞存活率升高并不大,与不同浓度 AWDPE其他组分的细胞存活率相比并无差异显著性。
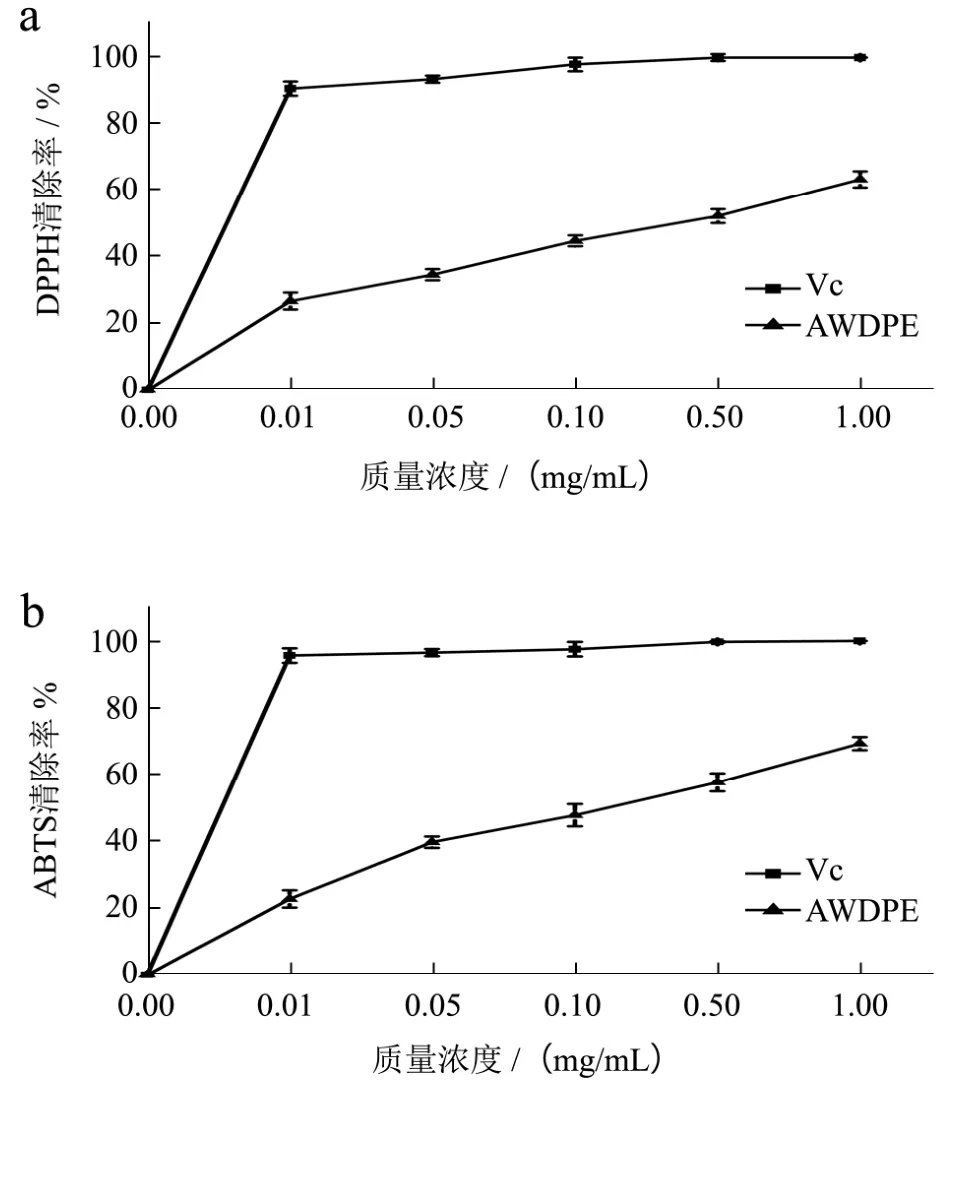
图1 AWDPE对DPPH、ABTS自由基清除作用Fig.1 The scavenging effect of AWDPE on DPPH and ABTS radicals
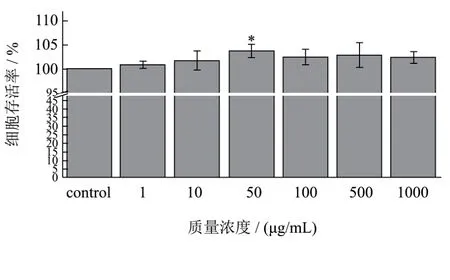
图2 不同浓度AWDPE对HUVEC细胞存活率的影响Fig.2 Effects of different concentrations of AWDPE on the survival rate of HUVEC cells
2.3 HUVEC细胞氧化损伤模型的建立
图3考察不同浓度AngⅡ溶液,作用不同时间对HUVEC细胞存活率的影响。由图可知,不同浓度AngⅡ溶液,随着培养时间的延长,细胞存活率均呈现下降趋势。当AngⅡ溶液浓度为10-3和10-4mol/L时,细胞存活率降低至空白组的0.202倍,说明该浓度对细胞刺激过于严重而导致细胞存活率低。当AngⅡ浓度为10-5、10-6、10-8和10-9mol/L,细胞存活率相差不大。而当AngⅡ浓度为10-7mol/L时,培养6 h和8 h时细胞存活率均为空白组的0.534倍,细胞损伤明显且稳定,本实验诱导模型选择浓度为10-7mol/L AngⅡ诱导HUVEC细胞损伤6 h。

图3 不同浓度AngⅡ对HUVEC细胞存活率的影响Fig.3 Effects of different concentrations of AngⅡon the survival rate of HUVEC cells
2.4 AWDPE对AngⅡ氧化损伤HUVEC细胞的保护作用
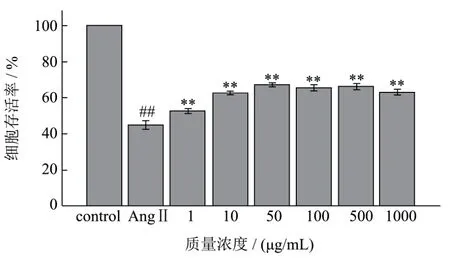
图4 不同浓度AWDPE和10-7 mol/L AngⅡ对HUVEC细胞存活率的影响Fig.4 Effects of different concentrations of AWDPE and 10-7 mol/L of AngⅡon the survival rate of HUVEC cells
如图4所示,AngⅡ损伤组细胞存活率为空白对照组的 0.45倍,表现出差异极显著性(p<0.01),说明终浓度为10-7mol/L的AngⅡ溶液处理细胞6 h后,对细胞产生了损伤作用。不同浓度AWDPE保护组与AngⅡ损伤组相比,细胞存活率均极显著高于损伤组(p<0.01),说明AWDPE对细胞产生了抗氧化保护作用。结合2.2实验结论,证明了AWDPE对细胞的保护作用源于其自身的抗氧化性,与其他因素无关。本实验选取50 μg/mL、100 μg/mL和500 μg/mL 这3 个浓度的AWDPE溶液开展后续研究。
2.5 HUVEC细胞生长形态的变化

图5 HUVEC细胞生长形态的变化Fig.5 The changes in the growth morphology of HUVEC cells
由图5中可以看出,a表明正常生长的HUVEC细胞呈现出典型的菱形、多边形和梭形镶嵌排列,生长旺盛,大小均匀,边缘清晰。b表明加入 AWDPE的细胞,生长状态与a并无明显差别,可见细胞呈现自身形态,展现细胞分裂过程。c表明经AngⅡ刺激6 h后的细胞,生长数量明显减少,大部分细胞胞体呈现圆形,出现聚缩现象,脱离培养瓶,悬浮于培养液中,呈现凋亡状态。d表明经AWDPE处理后的细胞,在经AngⅡ刺激6 h后,改变形态的细胞明显减少,大部分还呈现良好的生长趋势,说明 AWDPE对AngⅡ氧化损伤的HUVEC细胞具有的保护作用。
2.6 AWDPE对HUVEC细胞抗氧化酶的影响
详见图6a-e。乳酸脱氢酶(LDH)是一种稳定的存在于所有细胞胞质内的糖酵解酶。一般情况下,LDH稳定的存在于细胞质内部,但细胞受到刺激,胞膜受损后,LDH随着受损情况而释放出不同的量,进入到细胞培养液中,通过检测培养液和细胞内 LDH含量,计算出LDH释放率而推断细胞的受损程度[16]。如图6a所示,阴性对照组,终浓度为10-7mol/L AngⅡ溶液对HUVEC细胞的氧化损伤非常明显,细胞膜受损严重,LDH释放率最高,达到42.26±2.23%,为空白组9.06倍(p<0.01);经AWDPE保护组处理后,100 μg/mL AWDPE保护组细胞内LDH释放率降低为27.14±1.16%,为阴性对照组0.62倍(p<0.01),接近于阳性对照Vc组。这说明AWDPE处理后的细胞,细胞膜受损程度降低,大幅度提高细胞的生命力,保护细胞膜完整性,证明了AWDPE对于HUVEC细胞的氧化应激损伤的保护作用。
丙二醛(MDA)为过氧化脂质中的产物,氧化过程中产生的MDA会攻击细胞膜,而引起细胞损伤[17]。如图6b所示,阴性对照组,终浓度为10-7mol/L AngⅡ溶液氧化损伤刺激后的细胞,细胞内MDA含量达到(4.15±0.22)nmol/mg,为空白组1.49 倍(p<0.01);经AWDPE保护组处理后,细胞内MDA含量有所下降,500 μg/mL AWDPE保护组细胞内MDA含量为(3.47±0.28)nmol/mg,为阴性对照组0.73倍,但无差异显著性。这可能与细胞内本身含有一定量的MDA有关,经AWDPE保护后的细胞,产生的MDA含量有所降低,间接的说明了其在一定程度上阻止了细胞脂质过氧化过程。
过氧化氢酶(CAT)是一种酶类清除剂,其处于所有已知动物的各个组织中[18]。如图 6c所示,阴性对照组,终浓度为10-7mol/L AngⅡ溶液氧化损伤刺激后的细胞中,CAT含量最低为(1.94±0.18)U/mg,为空白组0.54倍(p<0.01);经AWDPE保护组处理后,100 μg/mL AWDPE保护组细胞内 CAT含量为(2.34±0.11)U/mg,为阴性对照组1.39 倍(p<0.05),证明了AWDPE具有一定的抗氧化性,降低了细胞内CAT的消耗量,从而保护细胞的完整性,AWDPE对于HUVEC细胞的氧化应激损伤的保护作用。
总超氧化物歧化酶(T-SOD)是一种新型酶制剂,生物界分布广泛,是一种重要的抗氧化剂,保护暴露于空气中细胞免受氧化损伤[19,20]。如图6d所示,阴性对照组,终浓度为10-7mol/L AngⅡ溶液氧化损伤刺激后的细胞中,T-SOD 含量最低为(12.28±2.27)U/mg,为空白组0.28倍(p<0.01);经AWDPE保护组处理后细胞体内,T-SOD含量随着AWDPE浓度升高而随之增加,呈浓度依赖性关系,100 μg/mL和500 μg/mL AWDPE保护组细胞内T-SOD含量为(19.88±1.99)U/mg和(23.55±1.26)U/mg,为阴性对照组的 2.18倍(p<0.01)和2.48倍(p<0.01),说明细胞内T-SOD消耗量少,进而证明AWDPE对于HUVEC细胞体氧化应激损伤的保护作用,保证细胞完整性。
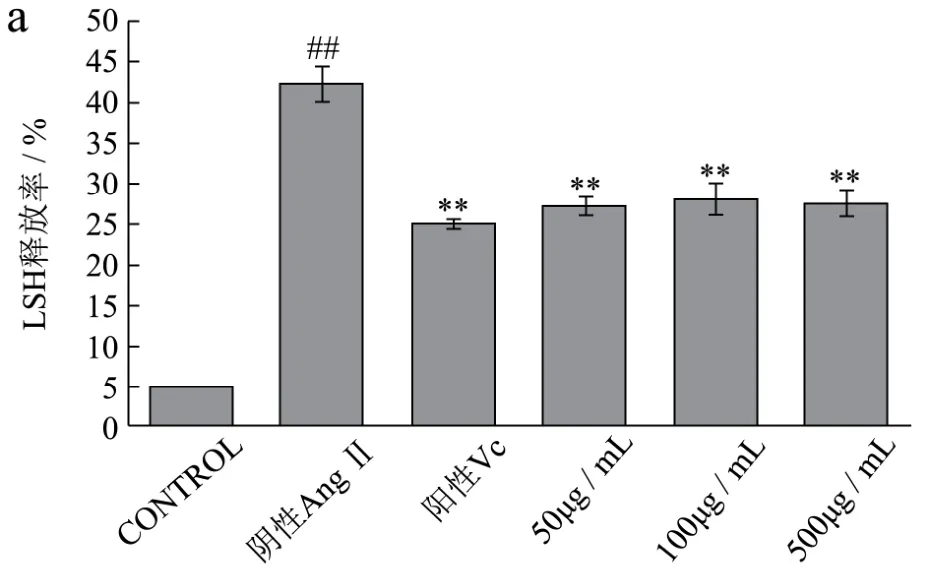

图6 不同浓度AWDPE、1 mg/mL Vc和10-7 mol/L AngⅡ对HUVEC细胞抗氧化酶的影响Fig.6 Effects of different concentrations of AWDPE, 1 mg/mL of Vc and 10-7 mol/L of Ang II on the antioxidant enzymes of HUVEC cells
谷胱甘肽过氧化物酶(GSH-PX)是机体内广泛存在的一种重要的过氧化物分解酶。它的生理功能主要是催化 GSH参与过氧化反应,清除在细胞呼吸代谢过程中产生的过氧化物和羟自由基,从而减轻细胞膜多不饱和脂肪酸的过氧化作用[21,22]。如图6e所示,阴性对照组,终浓度为10-7mol/L AngⅡ溶液氧化损伤刺激后的细胞中,GSH-PX 含量最低为(22.2±2.99)nmol/L,为空白组 0.4 倍(p<0.01);经AWDPE保护组处理后的细胞体内,GSH-PX含量随着AWDPE浓度的升高而随之增加,呈现浓度依赖性关系,500 μg/mL AWDPE保护组细胞内GSH-PX含量为(33.9±2.75)nmol/L(p<0.01),为阴性对照组的1.91倍。经AWDPE保护的细胞中,GSH-PX含量减少,进一步证明了AWDPE对于HUVEC细胞的抗氧化保护作用,保证细胞的完整性。
本实验对细胞内抗氧化酶系的研究结果与曹小舟等[25]研究的小麦胚芽抗氧化肽和林松毅等[26]研究的松子抗氧化肽,在细胞水平上结果趋势一致。证明了AWDPE肽可通过改变细胞内抗氧化酶系统的含量,实现对HUVEC细胞氧化应激的保护作用,进而证明了AWDPE的抗氧化能力。
3 结论
3.1 AWDPE抗氧化肽对DPPH、ABTS+自由基清除能力呈现出浓度依赖性关系,证明其具有良好的抗氧化能力;除50 μg/mL外,不同浓度的AWDPE抗氧化肽对HUVEC细胞生长无抑制亦无促进作用,对细胞生长形态无影响,进而证明AWDPE对于细胞氧化应激损伤的保护作用源于其自身的抗氧化能力;AWDPE抗氧化肽保护组的细胞存活率极显著高于AngⅡ氧化损伤组的细胞存活率,说明AWDPE抗氧化肽具有保护HUVEC细胞免受氧化损伤的能力和良好的抗氧化性,但其在50 μg/mL、100 μg/mL和500 μg/mL细胞存活率变化不明显,这与其在不同浓度下所作用的抗氧化酶活性有关,需进一步研究。
3.2 建立AngⅡ氧化刺激损伤HUVEC细胞模型,通过测定细胞内抗氧化酶系,研究AWDPE对HUVEC细胞的保护和抗氧化能力,经 AWDPE处理后的HUVEC细胞内LDH释放率和MDA水平下降,CAT、T-SOD和GSH-PX水平升高,表明AWDPE可通过保护细胞内重要的抗氧化酶系统降低细胞损伤,增强HUVEC应对氧化应激损伤的能力。
[1]Maritim A C, Sanders R A, Watkins J B. Diabetes, oxidative stress, and antioxidants:A review [J]. Journal of Biochemical and Molecular Toxicology, 2003, 17(1):24-38
[2]Cohen G. Oxidative stress, mitochondrial respiration and Parkinson's disease [M]. CHIUEH C C. Reactive Oxygen Species:From Radiation to Molecular Biology:A Festschrift in Honor of Daniel L Gilbert, 2000
[3]Tanzadehpanah H, Asoodeh A, Chamani J. An antioxidant peptide derived from Ostrich (Struthio camelus) egg whiteprotein hydrolysates [J]. Food Research International,2012, 49(1):105-111
[4]Tang Ning, Zhuang Hong. Evaluation of antioxidant activities of zein protein fractions [J]. Journal of Food Science, 2014,79(11):C2174-C2184
[5]Hwang Jean-Yu, Shyu Yung-Shin, Wang Yuh-Tai, et al.Antioxidative properties of protein hydrolysate from defatted peanut kernels treated with esperase [J]. Lwt-Food Science and Technology, 2010, 43(2):285-290
[6]Suetsuna K, Ukeda H, Ochi H. Isolation and characterization of free radical scavenging activities peptides derived from casein [J]. Journal of Nutritional Biochemistry, 2000, 11(3):128-131
[7]Kleekayai Thanyaporn, Harnedy Padraigin A, O'Keeffe Martina B, et al. Extraction of antioxidant and ACE inhibitory peptides from Thai traditional fermented shrimp pastes [J]. Food Chemistry, 2015, 176:441-447
[8]杜艳萍,刘春雷,闵伟红,等.长白山榛仁分离蛋白及其主要组分的功能性质研究[J].现代食品科技,2015,31(5):109-115 DU Yan-ping, LIU Chun-lei, MIN Wei-hong, et al. Major components and functional properties of changbai mountain hazelnut protein isolate [J]. Modern Food Science and Technology, 2015, 31(5):109-115
[9]李京京.长白山榛子抗氧化肽制备、纯化及功能活性研究[D].长春:吉林农业大学,2013
[10]XIE Z, HUANG J, XU X, et al. Antioxidant activity of peptides isolated from alfalfa leaf protein hydroly sate [J].Food Chemistry, 2008, 111(2):370-376
[11]KONG B, XIONG Y L. Antioxidant activity of zein hydrolysates in a liposome system and the possible mode of action [J]. Journal of Agricultural and Food Chemistry, 2006,54(16):6059-6068
[12]Majumder Kaustav, Chakrabarti Subhadeep, Davidge Sandra T, et al. Structure and activity study of egg protein ovotransferrin derived peptides (IRW and IQW) on endothelial inflammatory response and oxidative stress [J].Journal of Agricultural and Food Chemistry, 2013, 61(9):2120-2129
[13]Guerard F, Sumaya-Martinez M T, Laroque D, et al.Optimization of free radical scavenging activity by response surface methodology in the hydrolysis of shrimp processing discards [J]. Process Biochemistry, 2007, 42:1486-1491
[14]郭庆启,张娜,姜元松.榛子仁蛋白酶解工艺的优化及酶解物抗氧化能力的研究[J].食品科学,2013,34(9):189-193 GUO Qing-qi, ZHANG Na, JIANG Yuan-song. Optimization of enzymatic hydrolysis of hazelnut kernel protein and antioxidant capacity of its hydrolysate [J]. Food Science,2013, 34(9):189-193
[15]白海娜,王振宇,刘瑞海,等.白藜芦醇与黑木耳多糖协同清除ABTS 自由基活性的研究[J].现代食品科技,2014,30(3):64-68 BAI Hai-na, WANG Zhen-yu, LIU Rui-hai, et al. Synergistic ABTS radical scavenging activity of resveratrol with auricularia auricular polysaccharides [J]. Modern Food Science and Technology, 2014, 30(3):64-68
[16]Schneiderman J, Schaefer K, Kolodgie F D, et al. Leptin locally synthesized in carotid atherosclerotic plaques could be associated with lesion instability and cerebral emboli [J]. J Am Heart Assoc., 2012, 1(5):e001727
[17]Krohne T U, Kaemmerer E, Holz F G, et al. Lipid peroxidation products reduce lysosomal protease activities in human retinal pigment epithelial cells via two different mechanisms of action [J]. Experimental Eye Research, 2010,90(2):261-266
[18]Hwang Sam-Long, Yen Gow-Chin. Modulation of Akt, JNK,and p38 activation is involved in citrus flavonoid-mediated cytoprotection of PC12 cells challenged by hydrogen peroxide [J]. Journal of Agricultural and Food Chemistry,2009, 57(6):2576-2582
[19]Hasan H R, Mathkor T H, Al-Habal M H. Superoxide dismutase isoenzyme activities in plasma and tissuesof Iraqi patients with breast cancer [J]. Asian Pac. J. Cancer Prev.,2012, 13(6):2571-2576
[20]LUO Y L, ZHANG C C, LI P B, et al. Naringin attenuates enhanced cough, airway hyperresponsiveness and airway inflammation in a guinea pig model of chronic bronchitis induced by cigarette smoke [J]. Int Immunopharmacol, 2012,13(3):301-307
[21]Qiu J, Wang W N, Wang L J, et al. Oxidative stress, DNA damage and osmolality in the Pacific white shrimp,Litopenaeus vannamei exposed to acute low temperature stress [J]. Comp BiochemPhysiol C Toxicol Pharmacol, 2011, 154(1):36-41
[22]Lu bos E, Loscalzo J, Handy D E. Glutathione peroxidase1 in health and disease:From molecular mechanisms to therapeutic opportunities [J]. Antioxid Redox Sign, 2011,15(7):1957-1997
[23]Hernández -Ledesma B, Miralles B, Amigo L. Identification of antioxidant and ACE -inhibitory peptides in fermented milk [J]. Journal of the Science of Food and Agriculture,2005, 85(6):1041-1048
[24]Ali Bougatef, Naima Nedjar-Arroume, Moncef Nasri, et al.Purification and identification of novel antioxidant peptides from enzymatic hydrolysates of sardinelle (Sardinella aurita)by-products proteins [J]. Food Chemistry, 2010, 118(3):559-565
[25]曹小舟,陈海娟,沈新春,等.小麦胚芽抗氧化肽对高糖诱导的血管平滑肌细胞增殖的保护作用[J].食品工业科技,2016,17(1):49-53 CAO Xiao-zhou, CHEN Hai-juan, SHEN Xin-chun, et al.Protective effects of wheat germ antioxidant peptide on proliferation of vascular smooth muscle cells exposed to high glucose [J]. Science and Technology of Food Industry, 2016,17(1):49-53
[26]Rong Liang, Zuoming Zhang, Songyi Lin. Effects of pulsed electric field on intracellular antioxidant activity and antioxidant enzyme regulating capacities of pine nut (Pinus koraiensis) peptide QDHCH in HepG2 cells [J]. Food Chemistry, 2017, 237:793-802

