反式肉桂醛与温和加热结合对复原婴幼儿牛乳中阪崎克罗诺肠杆菌的抑杀作用
石 超,郭 都,张文婷,郭凯伦,温啓吾,刘志远,孙慧慧,陈 珊,孙 正,郭 晓,尹术华,夏效东*
阪崎克罗诺肠杆菌(Cronobacter sakazakii)是一种周生鞭毛、无芽孢的棒状革兰氏阴性菌[1]。它可引起新生儿脑膜炎、菌血症和坏死性小肠结肠炎,并可造成早产儿和低体质量新生儿的死亡[2]。对于感染的婴幼儿,死亡率高达40%~80%[3],并且,20%的感染婴幼儿会患有严重的神经后遗症,如脑积水、四肢麻痹和智力发育迟缓等[4-5]。
研究表明,婴幼儿乳粉是世界范围内婴幼儿摄取营养的主要途径[6]。然而,婴幼儿乳粉并不是一类无菌的产品,它含有致病菌并有可能导致疾病[7]。婴幼儿乳粉是阪崎克罗诺肠杆菌传播的主要途径[8]。婴儿缺乏完善的免疫系统和稳定的肠道菌群,因而更易被阪崎克罗诺肠杆菌感染。因此,食用前控制婴幼儿乳粉的微生物特别是阪崎克罗诺肠杆菌污染尤为重要。
尽管针对婴幼儿配方乳粉的优良制造标准已发布,但是保证婴幼儿乳粉无菌还是非常困难。为减少婴幼儿乳粉中的微生物风险,世界卫生组织(World Health Organization,WHO)在2007年建议婴幼儿乳粉使用70 ℃的热水冲调并快速冷却至适宜食用的温度[9]。但是,使用如此高温度的热水冲调乳粉不被父母广泛接受[10]。高温会导致乳粉中的一些热敏感物质损失[11],如对热敏感的维生素、乳铁蛋白等;并且,高温冲调也会增大烫伤的风险并且不方便婴幼儿直接食用。近年来,部分研究者将目光投向于在食用前的冲调过程使用温和加热与天然物质结合来控制杀灭微生物[12-15]。
反式肉桂醛是肉桂树皮提取物中的主要活性物质,已被美国食品药品监督管理局评价为公认安全的食品成分(批准文件序号21 CFR 182.60)。反式肉桂醛已被报道对多种食源性致病菌有抑制作用,研究表明它能够抑杀苹果汁及苹果酒中的大肠杆菌O157:H7[16],抑制牛奶中的大肠杆菌并且能够抗牛奶氧化[17],抑杀西红柿上不同血清型的沙门氏菌[18],并且,反式肉桂醛还被报道有抗癌、抗炎、治疗糖尿病、降低细菌耐药性等多种生物活性作用[19]。
本研究采用反式肉桂醛与温和加热结合处理复原婴幼儿牛乳,探讨该方法对复原婴幼儿牛乳中阪崎克罗诺肠杆菌的抑杀效果。并分别利用LIVE/DEAD®细菌活性检测试剂盒和场发射扫描电子显微镜探究二者结合作用对阪崎克罗诺肠杆菌细胞膜完整性及细胞形态的影响,试图阐述其可能的抑菌机理,为反式肉桂醛与温和加热结合应用于复原婴幼儿牛乳及其他食品中抑杀阪崎克罗诺肠杆菌提供理论依据。
1 材料与方法
1.1 菌株与试剂
阪崎克罗诺肠杆菌ATCC 29544购于美国模式菌株收集中心。阪崎克罗诺肠杆菌分离菌株14-15和18-8由西北农林科技大学食品科学与工程学院食品微生物研究团队分离自市售婴幼儿乳粉。
反式肉桂醛(色谱级,纯度≥99%) 美国Sigma公司;胰蛋白胨大豆琼脂(tryptone soya agar,TSA)、胰蛋白胨大豆肉汤(tryptone soya broth,TSB) 北京陆桥技术有限公司;LIVE/DEAD®BacLightTM细菌活性检测试剂盒 美国赛默飞世尔科技公司;其他所用有机溶剂均为国产分析纯。
1.2 仪器与设备
GHX-9050B-2细菌培养箱 上海福玛实验设备有限公司;Smart SpecTMplus分光光度计 美国Bio-Rad公司;5804R低温冷冻离心机 德国Eppendorf公司;Spectra Max M2多功能微孔板检测仪 美国Molecular Devices公司;S-4800场发射扫描电子显微镜 日本Hitachi公司。
1.3 方法
1.3.1 混合菌悬液的制备
将冻存于-80 ℃的阪崎克罗诺肠杆菌ATCC 29544、14-15和18-8采用划线法在TSA平板上活化,分别挑取单菌落接种于30 mL TSB中,将3 瓶TSB置于37 ℃、120 r/min振摇培养18 h,培养后的菌液分别离心(5 000×g、10 min、4 ℃)并去除上清液,用pH 7.2磷酸盐缓冲溶液(phosphate buffered saline,PBS)洗涤菌体沉淀,反复2 次洗涤后,使用一定量的PBS悬浮菌体沉淀,测定并调整菌悬液的OD600nm为0.5,使菌悬液浓度约为108CFU/mL。取相同体积的3 种菌悬液混合制备为混合菌悬液(浓度约为108CFU/mL)。
1.3.2 复原婴幼儿牛乳的制备
市售婴幼儿乳粉购买于陕西省咸阳市杨凌区好又多超市。按照商品标签冲调复原婴幼儿乳粉,将25.5 g乳粉溶解于180 mL无菌水中,摇匀后置于63 ℃水浴30 min进行巴氏杀菌[20],冷却至室温后备用。
1.3.3 阪崎克罗诺肠杆菌的抑菌作用
将复原婴幼儿牛乳加入试管(10 mL),向各组接种100 µL三种阪崎克罗诺肠杆菌的混合菌悬液,使复原婴幼儿牛乳中阪崎克罗诺肠杆菌的浓度约为6.5~7.0(lg(CFU/mL)),同时向样品中添加反式肉桂醛溶液(溶剂为含0.5% DMSO的无菌水),使反式肉桂醛溶液的质量分数分别为0.4%、0.3%、0.2%和0.1%(下同),将不添加反式肉桂醛的样品(含有0.5% DMSO)作为对照组。实验室前期结果表明1% DMSO在复原婴幼儿牛乳中不会影响阪崎克罗诺肠杆菌的活性。将接种后的样品置于4 个不同的温度(25、45、50、55 ℃)保温杀菌。将25 ℃和45 ℃的样品分别保温杀菌0、20、40、60、90、120 min,50 ℃和55 ℃的样品分别保温杀菌0、10、20、40、60、90 min后,将样品直接或用PBS 10 倍稀释后,涂布到TSA培养基上37 ℃恒温培养24 h,记录细菌总数,实验每组设置3 个平行。
1.3.4 阪崎克罗诺肠杆菌细胞膜完整性的测定
温和加热与反式肉桂醛结合作用对阪崎克罗诺肠杆菌细胞膜完整性影响的测定,参考Shi Chao等[21]所采用的LIVE/DEAD®细菌活性试剂盒方法。试剂盒中含有SYTO 9及碘化丙啶(propidium iodide,PI)两种核酸染料。SYTO 9染料能够穿透完整及受损的细胞膜,将所有细菌染色为绿色。相反,PI仅能穿透受损细胞膜,将细胞膜受损的细胞染色为红色,并降低SYTO 9的绿色荧光。因此,当在细菌悬液中添加SYTO 9与PI两种染料时,细胞膜完整的菌体呈现绿色,细胞膜不完整的菌体呈现红色。为探究结合作用对阪崎克罗诺肠杆菌的抑制机理,我们选择ATCC 29544菌株进行后续的研究。将37 ℃振摇(120 r/min)培养18 h的阪崎克罗诺肠杆菌离心(10 000×g、15 min、4 ℃)弃去培养液,将菌体沉淀溶解于2 mL的0.85% NaCl溶液中。分别取1 mL菌悬液加入20 mL 0.85% NaCl溶液和20 mL 70%异丙醇溶液并置于室温孵育1 h(每15 min轻柔振摇1次),从而得到活细胞和死细胞悬液。随后将两管菌悬液离心(10 000×g,10 min),使用0.85% NaCl溶液将活细胞和死细胞沉淀重新悬浮并制备为活细胞和死细胞混合溶液,使活细胞的比例为0、10%、50%、90%和100%。
在无菌的离心管中加入活细胞样品,按照处理条件不同将菌悬液分为4 组:对照组(25 ℃处理)、单纯反式肉桂醛组(0.2%反式肉桂醛+25 ℃处理)、单纯温和加热组(50 ℃处理)和结合作用实验组(0.2%反式肉桂醛+50 ℃处理),每组3 个平行。将样品处理后离心(11 000×g、1 min)并使用0.85% NaCl重悬浮。将100 µL标准样品及实验样品加入黑色96 孔酶标板中,将SYTO 9和PI混合染料加入每孔并轻柔混合。将样品置于25 ℃避光孵育15 min,随后使用多功能酶标仪检测荧光强度。绿色荧光染料SYTO 9的激发、发射波长分别为485、542 nm,红色荧光染料PI的激发、发射波长分别为485、610 nm。通过检测不同活细菌比例标准样品(0、10%、50%、90%和100%)的绿色荧光强度,构建绿色荧光强度与细胞膜完整细菌(活细菌)百分比之间的线性关系。检测实验组的绿色荧光强度,根据本研究测定的绿色荧光强度与细胞膜完整细菌百分比之间的拟合方程,计算出细胞膜完整细菌百分比。
1.3.5 阪崎克罗诺肠杆菌细胞形态的观察
反式肉桂醛与温和加热结合对阪崎克罗诺肠杆菌细胞形态的影响参照Li Guanghui等[22]利用场发射扫描电子显微镜的方法。将37 ℃、120 r/min振摇培养18 h的阪崎克罗诺肠杆菌离心(5 000×g、15 min、4 ℃)并弃去TSB培养液,使用TSB将菌体沉淀重新悬浮。将菌悬液分为4 组,同1.3.4节,将样品分别培养1 h或2 h。随后将菌体离心并使用PBS清洗两次,使用含有0.25%戊二醛的PBS 4 ℃固定细胞。12 h后将菌体离心(5 000×g、10 min、4 ℃)并使用PBS及无菌水分别清洗菌体1次,随后使用含有1%锇酸的PBS于4 ℃固定细胞5 h后,将菌体离心(5 000×g、10 min、4 ℃),并使用不同体积分数的无水乙醇(30%、50%、70%、80%、90%和100%)梯度洗脱细胞,每次10 min。将菌体滴加至洁净的玻片表面进行干燥后喷金处理,使用场发射扫描电子显微镜观测细胞形态。
1.4 数据统计分析
所有实验重复3 次,结果以 ±s表示。使用SPSS 19.0软件,对实验数据进行统计分析。采用ANOVA对结果间的显著性进行比较,不同处理间P<0.05认为差异显著,P<0.01则认为差异极显著。
2 结果与分析
2.1 阪崎克罗诺肠杆菌的抑菌效果
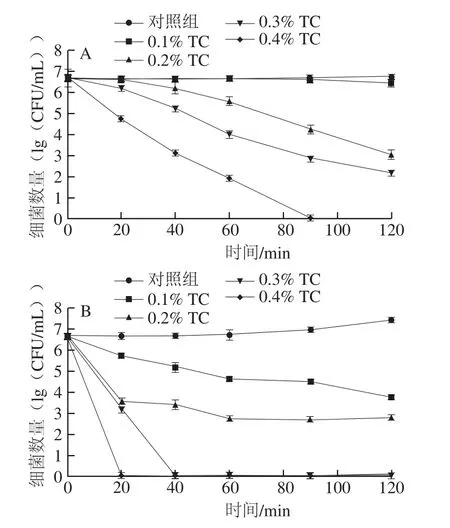
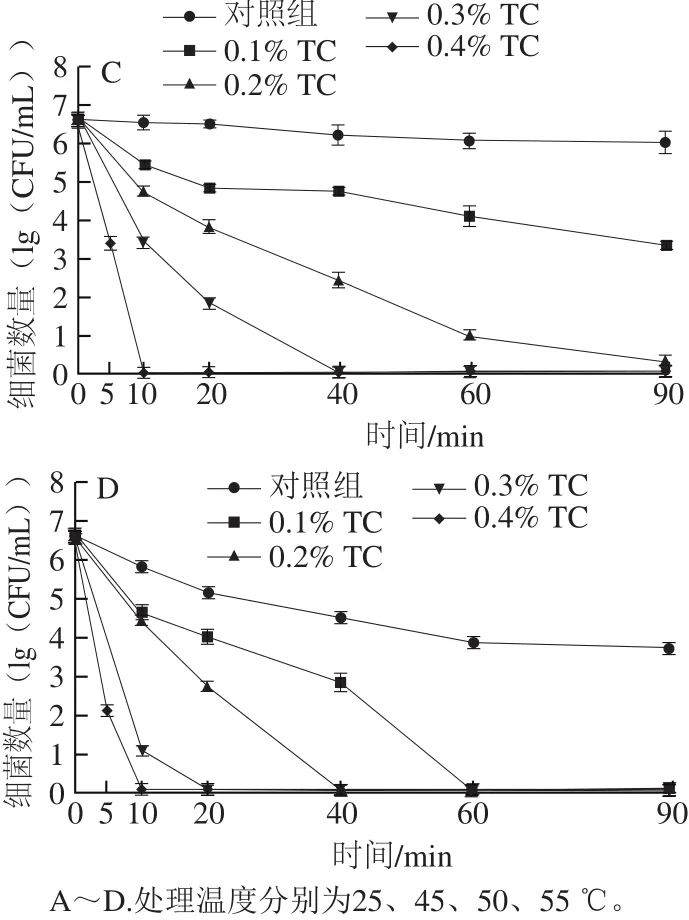
图1 反式肉桂醛结合温和加热对复原婴幼儿牛乳中阪崎克罗诺肠杆菌数量的影响Fig. 1 Effect of combined treatment with trans-cinnamaldehyde and mild heating on C. sakazakii populations in reconstituted infant formula
复原婴幼儿牛乳样品中阪崎克罗诺肠杆菌的起始浓度约为6.6(lg(CFU/mL))。由图1A可知,对照组在120 min内细菌总数与起始值没有显著性差异(P>0.05)。经0.1%反式肉桂醛处理120 min后,阪崎克罗诺肠杆菌总数下降约0.3(lg(CFU/mL))。经0.2%、0.3%和0.4%反式肉桂醛处理60 min后,细菌总数分别下降约1.1、2.7、4.7(lg(CFU/mL))。处理90 min后,0.4%反式肉桂醛使阪崎克罗诺肠杆菌细菌总数下降至检出限以下。
由图1B可知,对照组在120 min细菌总数增加约0.8(lg(CFU/mL)),这说明阪崎克罗诺肠杆菌对45 ℃有一定的耐受能力。经0.1%、0.2%和0.3%反式肉桂醛处理20 min后,阪崎克罗诺肠杆菌细菌总数下降约0.9、3.1、3.5(lg(CFU/mL)),经0.4%反式肉桂醛处理20 min及0.3%反式肉桂醛处理40 min后,细菌总数下降至检出限以下。
由图1C可知,对照组在作用60 min后,阪崎克罗诺肠杆菌总数下降约0.5(lg(CFU/mL)),但作用90 min与60 min没有显著性差异(P>0.05)。经0.1%、0.2%和0.3%反式肉桂醛结合50 ℃处理20 min后,阪崎克罗诺肠杆菌总数分别下降约1.9、2.7、4.8(lg(CFU/mL))。经0.1%和0.2%反式肉桂醛结合50 ℃处理90 min后,细菌总数分别下降约3.4、6.2(lg(CFU/mL))。0.3%反式肉桂醛在作用40 min及0.4%的反式肉桂醛作用在作用10 min时将阪崎克罗诺肠杆菌的总数降低至检出限以下。
由图1D可知,反式肉桂醛和55 ℃温和加热结合与45 ℃和50 ℃相比对阪崎克罗诺肠杆菌有较强的抑杀效果。对照组在作用90 min后,阪崎克罗诺肠杆菌总数下降约3.0(lg(CFU/mL))。经0.1%反式肉桂醛处理40 min后,阪崎克罗诺肠杆菌总数下降约3.8(lg(CFU/mL)),处理60 min后,细菌总数降低至检出限以下。经0.2%反式肉桂醛处理20 min后,阪崎克罗诺肠杆菌总数下降约3.8(lg(CFU/mL)),处理40 min后,细菌总数降低至检出限以下。经0.3%反式肉桂醛处理10 min后,阪崎克罗诺肠杆菌总数下降约5.7(lg(CFU/mL)),处理20 min后,细菌总数降低至检出限以下。经0.4%反式肉桂醛处理5 min后,阪崎克罗诺肠杆菌总数下降约4.6(lg(CFU/mL)),处理10 min后,细菌总数降低至检出限以下。
2.2 对阪崎克罗诺肠杆菌细胞膜完整性的影响

图2 不同处理组对阪崎克罗诺肠杆菌ATCC 29544细胞膜荧光强度的影响Fig. 2 Fluorescence of C. sakazakii ATCC 29544 subjected to various treatments
实验首先构建了绿色荧光与细胞膜完整细菌百分比的线性关系,得到绿色荧光强度与细胞膜完整细菌百分比的线性拟合方程:y=431.3x+329.5(R2=0.988)。由图2可知,未经反式肉桂醛和温和加热处理的对照组,细胞膜完整的细菌百分比为100%,经0.2%反式肉桂醛处理20 min后,细胞膜完整的细胞比例为2.73%,与对照组有极显著差异(P<0.01)。经0.2%反式肉桂醛与50 ℃结合作用处理20 min,细胞膜完整的细胞比例仅为0.65%,与对照组有极显著差异(P<0.01)。
2.3 对阪崎克罗诺肠杆菌细胞形态的影响

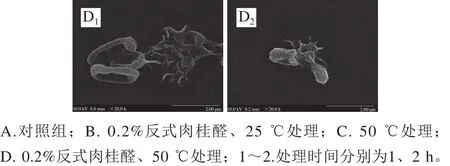
图3 场发射扫描电子显微镜下阪崎克罗诺肠杆菌的形态Fig. 3 Scanning electron micrographs of C. sakazakii
场发射扫描电子显微镜观测发现,未经温和加热和反式肉桂醛处理的阪崎克罗诺肠杆菌呈棒状,菌体饱满,表面光滑(图3A、E)。经0.2%反式肉桂醛作用后,阪崎克罗诺肠杆菌菌体从中部干瘪,细胞扁平呈椭圆状,且部分细胞破碎,出现碎片(图3B、F)。经50 ℃处理的阪崎克罗诺肠杆菌菌体出现皱缩,并有部分细菌破裂(图3C、G)。反式肉桂醛与温和加热结合作用后阪崎克罗诺肠杆菌的形态如图3D、H所示,结合作用后1 h,部分细胞干瘪,部分细胞破裂。结合作用后2 h,大部分菌体破裂且瓦解为碎片。结合作用比反式肉桂醛单独作用和温和加热单独作用造成的菌体皱缩干瘪程度更大,破碎菌体比例更大。
3 讨 论
研究表明,与肠杆菌科的其他属种相比,阪崎克罗诺肠杆菌有着较强的耐干燥的能力[23],能够在干燥的乳粉中存活2 年[24]。Breeuwer等[25]发现阪崎克罗诺肠杆菌能够通过维持细胞膜蛋白和磷脂的稳定从而保护自身应对高渗透压环境。这说明阪崎克罗诺肠杆菌能够在乳粉的货架期中长期存活,为抑杀阪崎克罗诺肠杆菌从而降低其引起的感染,食用前的冲调乳粉过程尤为重要。尽管WHO已推荐消费者使用70 ℃的热水冲调乳粉迅速降低至适宜的温度,但由于该方法存在操作繁琐,导致乳液感官品质及营养改变、易造成烫伤等多种缺点而不被消费者广泛接受。温和加热结合天然物质对食品中食源性致病菌的抑杀作用成为近年来的研究热点。Espina等[26]研究结果表明200 μL/L柑橘精油与54 ℃结合作用与单独加热相比能够显著缩短作用时间,提高苹果汁中大肠杆菌O157:H7的抑杀效率。与美国食品药品管理局推荐的71.11~82.22 ℃处理果汁的方法相比,能够减少能耗并维持果汁良好的感官性状。Gabriel等[27]研究结果表明,香草醛及甘草根提取物与55 ℃结合能够有效降低椰汁中大肠杆菌O157:H7的数量。Choi等[28]研究结果表明20 mmol/L辛酸和30 mmol/L香草醛结合45 ℃能在5 min将复原婴幼儿牛乳中的鼠伤寒沙门氏菌降低至检出限以下(起始菌浓度约为7.0(lg(CFU/mL))。
在实验中,0.3%反式肉桂醛处理的复原婴幼儿牛乳在50 ℃和55 ℃能够显著降低阪崎克罗诺肠杆菌的数量,在作用20 min使阪崎克罗诺肠杆菌总数至检出限以下,然而在相同的作用时间内,反式肉桂醛在50 ℃和45 ℃对阪崎克罗诺肠杆菌的抑杀作用较弱(分别下降4.8、3.5(lg(CFU/mL)))。类似的,Jang等[11]研究表明与50 ℃和55 ℃相比,辛酸在45 ℃下对阪崎肠杆菌抑制作用较弱。Char等[29]发现当温和加热温度升高时,香草醛在橙汁中的杀菌作用更强。反式肉桂醛随温度升高抑杀作用增强可能归因于升高的温度使反式肉桂醛在复原婴幼儿牛乳中的溶解度升高。同时,猜测温和加热作用能够造成细菌细胞膜受损从而增强反式肉桂醛的抑杀作用。
为阐明反式肉桂醛与温和加热结合对阪崎克罗诺肠杆菌细胞形态的改变及细胞膜的损伤,利用场发射扫描电子显微镜对未处理、经过反式肉桂醛处理、经过温和加热处理和经过反式肉桂醛与温和加热结合处理的阪崎克罗诺肠杆菌进行了观测。结果表明单独温和加热作用使细胞皱缩,延长作用时间,菌体出现了破碎,呈现作用时间依赖性。这是由于温和加热影响了细胞膜蛋白的空间结构松散、伸展,造成细胞膜的穿孔和裂隙,并且使膜蛋白更容易被蛋白酶水解。单独反式肉桂醛作用使阪崎克罗诺肠杆菌菌体皱缩及破裂。Pasqua等[30]通过测定处理后的细菌细胞膜不饱和脂肪酸含量,得出肉桂醛的主要作用靶点在于细胞膜,肉桂醛能够增大菌体细胞膜的面积,改变细胞膜的结构,并能够使金黄色葡萄球菌细胞膜破裂,同时,肉桂醛也能够穿透细胞膜进入细胞,造成菌体死亡。Helander等[31]研究推测反式肉桂醛是通过OM转运孔蛋白进入细胞的。本研究中,温和加热和反式肉桂醛结合作用使菌体破裂数量增多,瓦解破碎程度增大,这说明结合作用对细胞膜的破坏程度大于反式肉桂醛和温和加热单独作用。
本实验探究了反式肉桂醛与温和加热结合对复原婴幼儿牛乳中阪崎克罗诺肠杆菌的抑杀效果,结果表明这种结合作用对阪崎克罗诺肠杆菌有良好的抑杀效果。反式肉桂醛的抑杀活性随温度的升高而增大,0.4%反式肉桂醛与55 ℃结合在10 min内使阪崎克罗诺肠杆菌全部失活。通过LIVE/DEAD®细菌活性检测试剂盒检测结合作用对细胞膜完整性的影响,结果表明与对照组相比单独反式肉桂醛作用与结合作用使细胞膜完整性极显著降低(P<0.01)。利用场发射扫描电子显微镜探究对细胞形态的影响,结果表明反式肉桂醛与温和加热结合增大了细胞形态的皱缩干瘪程度,并且使细胞破裂比例增大。以上结果表明反式肉桂醛有潜力作为抑菌剂在婴幼儿乳粉中应用,反式肉桂醛在乳粉复原冲调时与温水或温和加热结合,能够降低通过污染的婴幼儿乳粉造成阪崎克罗诺肠杆菌感染的风险,这种结合的方法有潜力替代常规使用高温度水冲调乳粉的方式。然而,现行的GB 2760—2014《食品安全国家标准 食品添加剂使用标准》中,仅规定了肉桂醛作为防腐剂用途在表面处理的鲜水果的残留量,对复原婴幼儿牛乳中的限量问题没有规定。因此,反式肉桂醛作为食品添加剂在复原婴幼儿乳粉中的添加量及与温和加热结合对复原婴儿牛乳的感官品质的影响,需要在推荐使用前深入探究。
参考文献:
[1] KIM T J, SILVA J L, WENG W L, et al. Inactivation of Enterobacter sakazakii by water-soluble muscadine seed extracts[J]. International Journal of Food Microbiology, 2009, 129(3): 295-299. DOI:10.1016/j.ijfoodmicro.2008.12.014.
[2] BAR-OZ B, PREMINGER A, PELEG O, et al. Enterobacter sakazakii infection in the newborn[J]. Acta Paediatrica, 2001, 90(3): 356-358.DOI:10.1080/080352501300067857.
[3] BOWEN A B, BRADEN C R. Invasive Enterobacter sakazakii disease in infants[J]. Emerging Infectious Diseases, 2006, 12(8): 1185-1189.
[4] FORSYTHE S J. Enterobacter sakazakii and other bacteria in powdered infant milk formula[J]. Maternal and Child Nutrition, 2005, 1(1): 44-50.DOI:10.1111/j.1740-8709.2004.00008.x.
[5] LAI K K. Enterobacter sakazakii infections among neonates, infants, children, and adults: case reports and a review of the literature[J]. Medicine, 2001, 80(2): 113-122. DOI:10.1097/00005792-200103000-00004.
[6] DRUDY D, MULLANE N R, QUINN T, et al. Enterobacter sakazakii:an emerging pathogen in powdered infant formula[J]. Clinical Infectious Diseases, 2006, 42(7): 996-1002. DOI:10.1086/501019.
[7] TORLAK E, SERT D. Inactivation of Cronobacter by gaseous ozone in milk powders with different fat contents[J]. International Dairy Journal,2013, 32(2): 121-125. DOI:10.1016/j.idairyj.2013.05.013.
[8] ZHOU X F, FU S Z, GAO J X, et al. Enterobacter sakazakii: an emerging foodborne pathogenic bacterium[J]. Annals of Microbiology, 2012,62(1): 1-5. DOI:10.1007/s13213-011-0274-x.
[9] World Health Organization. Safe preparation, storage and handling of powdered infant formula: guidelines[A/OL]. [2017-12-10]. http://www.who.int/iris/handle/10665/43659.
[10] CARLETTI C, CATTANEO A. Home preparation of powdered infant formula: is it safe?[J]. Acta Paediatrica, 2008, 97(8): 1131-1132.DOI:10.1111/j.1651-2227.2008.00846.x.
[11] JANG H I, RHEE M S. Inhibitory effect of caprylic acid and mild heat on Cronobacter spp. (Enterobacter sakazakii) in reconstituted infant formula and determination of injury by flow cytometry[J]. International Journal of Food Microbiology, 2009, 133(1/2): 113-120. DOI:10.1016/j.ijfoodmicro.2009.05.009.
[12] AIT-OUAZZOU A, ESPINA L, GARCIA-GONZALO D, et al.Synergistic combination of physical treatments and carvacrol for Escherichia coli O157:H7 inactivation in apple, mango, orange, and tomato juices[J]. Food Control, 2013, 32(1): 159-167. DOI:10.1016/j.foodcont.2012.11.036.
[13] GAYAN E, SERRANO M J, MONFORT S, et al. Combining ultraviolet light and mild temperatures for the inactivation of Escherichia coli in orange juice[J]. Journal of Food Engineering, 2012,113(4): 598-605. DOI:10.1016/j.jfoodeng.2012.07.018.
[14] PAN X J, MAK L M, NAKANO H. Efficacy of essential oils on inactivation of Escherichia coli O157:H7 in vegetable juice[J].Food Science and Technology Research, 2014, 20(5): 1043-1049.DOI:10.3136/Fstr.20.1043.
[15] SILVA F V M, TAN E K, FARID M. Bacterial spore inactivation at 45-65 ℃ using high pressure processing: study of Alicyclobacillus acidoterrestris in orange juice[J]. Food Microbiology, 2012, 32(1): 206-211. DOI:10.1016/J.Fm.2012.04.019.
[16] BASKARAN S A, AMALARADJOU M A R, HOAGLAND T, et al.Inactivation of Escherichia coli O157:H7 in apple juice and apple cider by trans-cinnamaldehyde[J]. International Journal of Food Microbiology,2010, 141(1/2): 126-129. DOI:10.1016/j.ijfoodmicro.2010.04.002.
[17] CHUN J Y, KIM K B, SHIN J B, et al. Effect of trans-cinnamaldehyde and high pressure treatment on physico-chemical and microbial properties of milk during storage periods[J]. Korean Journal for Food Science of Animal Resources, 2013, 33(1): 16-23. DOI:10.5851/kosfa.2013.33.1.16.
[18] MATTSON T E, JOHNY A K, AMALARADJOU M A R, et al.Inactivation of Salmonella spp. on tomatoes by plant molecules[J].International Journal of Food Microbiology, 2011, 144(3): 464-468.DOI:10.1016/j.ijfoodmicro.2010.10.035.
[19] ZHANG L Q, ZHANG Z G, FU Y, et al. Trans-cinnamaldehyde improves memory impairment by blocking microglial activation through the destabilization of iNOS mRNA in mice challenged with lipopolysaccharide[J]. Neuropharmacology, 2016, 110: 503-518.DOI:10.1016/j.neuropharm.2016.08.013.
[20] AMALARADJOU M A R, HOAGLAND T A,VENKITANARAYANAN K. Inactivation of Enterobacter sakazakii in reconstituted infant formula by trans-cinnamaldehyde[J]. International Journal of Food Microbiology, 2009, 129(2): 146-149. DOI:10.1016/j.ijfoodmicro.2008.11.016.
[21] SHI Chao, SONG Kaikuo, ZHANG Xiaorong, et al. Antimicrobial activity and possible mechanism of action of citral against Cronobacter sakazakii[J]. PLoS ONE, 2016, 11(7): e0159006. DOI:10.1371/journal.pone.0159006.
[22] LI Guanghui, XU Yunfeng, WANG Xin, et al. Tannin-rich fraction from pomegranate rind damages membrane of Listeria monocytogenes[J].Foodborne Pathogens and Disease, 2014, 11(4): 313-319. DOI:10.1089/fpd.2013.1675.
[23] CAUBILLA-BARRON J, HURRELL E, TOWNSEND S, et al.Genotypic and phenotypic analysis of Enterobacter sakazakii strains from an outbreak resulting in fatalities in a neonatal intensive care unit in France[J]. Journal of Clinical Microbiology, 2007, 45(12): 3979-3985.DOI:10.1128/Jcm.01075-07.
[24] BARRON J C, FORSYTHE S J. Dry stress and survival time of Enterobacter sakazakii and other Enterobacteriaceae in dehydrated powdered infant formula[J]. Journal of Food Protection, 2007, 70(9):2111-2117.
[25] BREEUWER P, LARDEAU A, PETERZ M, et al. Desiccation and heat tolerance of Enterobacter sakazakii[J]. Journal of Applied Microbiology,2003, 95(5): 967-973. DOI:10.1046/j.1365-2672.2003.02067.x.
[26] ESPINA L, SOMOLINOS M, OUAZZOU A A, et al. Inactivation of Escherichia coli O157:H7 in fruit juices by combined treatments of citrus fruit essential oils and heat[J]. International Journal of Food Microbiology,2012, 159(1): 9-16. DOI:10.1016/j.ijfoodmicro.2012.07.020.
[27] GABRIEL A A, PINEDA J K F. Influences of vanillin and licorice root extract supplementations on the decimal reduction times of Escherichia coli O157:H7 in mildly heated young coconut liquid endosperm[J]. Food Control, 2014, 38: 136-141. DOI:10.1016/j.foodcont.2013.10.011.
[28] CHOI M J, KIM S A, LEE N Y, et al. New decontamination method based on caprylic acid in combination with citric acid or vanillin for eliminating Cronobacter sakazakii and Salmonella enterica serovar Typhimurium in reconstituted infant formula[J]. International Journal of Food Microbiology, 2013, 166(3): 499-507. DOI:10.1016/j.ijfoodmicro.2013.08.016.
[29] CHAR C D, GUERRERO S N, ALZAMORA S M. Mild thermal process combined with vanillin plus citral to help shorten the inactivation time for Listeria innocua in orange juice[J]. Food and Bioprocess Technology,2010, 3(5): 752-761. DOI:10.1007/s11947-008-0155-x.
[30] PASQUA R D, BETTS G, HOSKINS N, et al. Membrane toxicity of antimicrobial compounds from essential oils[J]. Journal of Agricultural and Food Chemistry, 2007, 55(12): 4863-4870. DOI:10.1021/Jf0636465.
[31] HELANDER I M, ALAKOMI H L, LATVA-KALA K, et al.Characterization of the action of selected essential oil components on Gram-negative bacteria[J]. Journal of Agricultural and Food Chemistry,1998, 46(9): 3590-3595. DOI:10.1021/Jf980154m.

