基于Glu/GABA分子系统的阴阳属性探讨❋
王生万,胡镜清
(中国中医科学院中医基础理论研究所,北京 100700)
1 概述
阴阳学说是中医理论的基础和重要支柱之一。中医学借用阴阳概括一切生命现象,解释人体生理病理。就人体而言,阴阳具有时间和空间属性。时间上,阴阳联系着日节律、年节律等自然节律。《素问》[1]81篇中有52篇、《灵枢》81篇中有62篇论及阴阳的时间特征。空间上,它联系着人体阴阳在形体上下左右、脏腑内外阴阳之气多少和其功能的差异。任应秋先生在1959年所著《阴阳五行》一书中谈到人体阴阳时说:“脏腑内外、形体内外可以用阴阳的属性来概括。[2]”《素问·天元纪大论》说:“阴阳之气各有多少,故曰三阴三阳也。”三阴三阳是维系阴阳时空关系的纽带。
我们通过对蛋白质组分子群筛选对比系统分析发现,从脑到脊髓再到脏腑(器)以及外周四肢的谷氨酸(Glu)系统和γ-氨基丁酸GABA系统的相对分布和协调为用显示了上述阴阳属性。
2 Glu和GABA系统
谷氨酸(glutame,Glu)和γ-氨基丁酸(GABA)是神经系统内最丰富的神经递质。Glu存在于所有神经元和体细胞中,Glu对突触后细胞有极强的兴奋作用,是主要的兴奋性氨基酸(excitatory aminoacid,EAA)。在Glu转化酶(GAD)的作用下,Glu转化为GABA[3-6]。GABA是哺乳动物体内最主要的抑制性神经递质,广泛存在于中枢、外周神经系统和体细胞。它对突触后细胞起抑制作用,是主要的抑制性氨基酸(inhibitory aminoacid,IAA)。 Glu和GABA参与已知的各种分子途径,参与调控神经元和体细胞几乎所有的活动。Glu、GABA与其他神经递质和调质的相互作用,调控细胞的兴奋和抑制及其他分子过程。
Glu通过其促离子型受体GRINI(共22个)和促代谢型受体GRM(8个)介导其细胞的兴奋性作用和相关生理功能。Glu转运者SLC1A1、SLC1A2、SLC1A3、SLC1A6和SLC1A7把Glu从细胞外转运至细胞内,囊泡转运者SLC17A6、SLC17A7、SLC17A8从细胞质转运Glu和其他递质到突触前囊泡发挥共表型作用(co-phenotype)。GABA通过其促离子型受体GABAA(共19个)和促代谢型受体GABAB(共2个)介导细胞的抑制性。GABA转运者SLC6A1、SLC6A11、SLC6A12和SLC6A13把GABA从细胞外转运至细胞内,囊泡转运者SLC32A1从细胞质共转运GABA和其他递质到突触前囊泡发挥共表型作用。GABA转氨酶(GABA-T)是GABA降解酶。
图1显示,Glu产生自三羧酸循环,谷氨酰胺酶(CLS)是其合成酶,Glu脱氢酶1(CLUD1)、Glu脱氢酶2(CLUD2)为其代谢酶。由于Glu经GAD酶转化为GABA,而Glu调节细胞兴奋性,GABA调节细胞抑制性,GAD通过调控Glu向GABA的转化而在分子水平对兴奋和抑制起开关作用[4]。

图1 Glu和GABA转化示意图(仿参考文献4绘)
人体内上述Glu、Glu合成酶、降解酶、表达在突触前后的受体、转运者、囊泡转运者构成Glu系统,GABA、GABA合成酶、降解酶、表达在突触前后的受体、转运者、囊泡转运者构成GABA系统。
在Glu和GABA系统中,Glu和GABA进化高度保守,结构紧密连接,化学简洁高效,发育过程高度依从,功能互相对立、互相依从、互相消长、互相转化,显示了类似阴阳的属性。本文将重点讨论Glu/GABA系统分子在人体所显示出的阴阳时空属性。
3 Glu/GABA在昼夜节律中的阴阳变化时间属性
在适应自然界昼夜节律的长期进化过程中,人类形成自身的生物节律。自然日夜节律对人体的影响是由光信号经过视传导系统把光信号转化为化学信号Glu和GABA,然后通过不同化学和生物电级联传导进而触发生物节律。
光刺激视网膜,视网膜引发一系列由日节律诱导的级联反应,传导至下丘脑主起搏器视交叉上核(suprachiasmatic nucleus,SCN),SCN输出产生不同的生理效应。SCN是哺乳动物最主要的昼夜节律起搏器。图2显示[7],在视网膜光由黑视蛋白阳性的固有感光神经节细胞(intrinsically photoreceptive ganglion cell,IPGCs)转导为神经信号,并沿着视网膜下丘脑束(retinohypothalamic tract,RHT)传送到SCN核,引起神经递质Glu释放到SCN视网膜接收细胞。Glu活化N-甲基-D-天冬氨酸(NMDA)受体,通过级联反应后将输出电信号和化学信号经输出纤维投射到其他起搏器和颅内其他结构。

图2 光周期分子和细胞基础(由外界光引起的节律产生和阴阳)(转自参考文献7)
节律性SCN壳细胞包括一套分子钟,由联锁的正负自调节转录-翻译反馈环(如Per,Cry,Rev-Erba,BMAL1)驱动。它们由Glu和GABA系统级联调节,精确地调控人体的时间节律,这符合阴阳日夜节律和人体阴阳节律相应的时间特点。
黄昏到黎明的暗光触发体内褪黑素的产生,其受体引起级联反应产生生理效应,由此而产生的GABA引发睡眠。褪黑素是昼夜生理节律转换的重要激素[8-9],产生于松果体,其合成和分泌呈24 h周期性变化,高峰期在夜晚,与其相关的酶和中间产物均呈24 h周期变化。
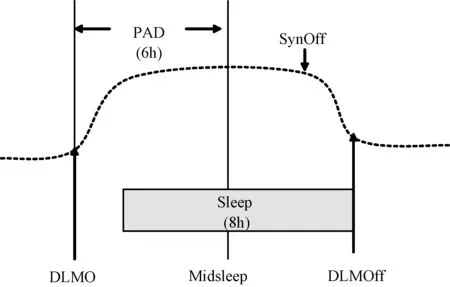
图3 褪黑素分泌的三个时相(仿参考文献9绘)
图3显示,褪黑素分泌三个时相[9],暗光褪黑素分泌开始(dim light melatonin onset,DLMO);暗光褪黑素分泌消退(dim light melatonin onset,DLMOff)(亮光抑制褪黑素分泌,暗光刺激其分泌)和褪黑素合成消退(melatonin synthesis offset,SynOff)。SynOff是指褪黑素分泌开始下降的时间。SynOff由一个提示黎明(平旦)的单独起搏器调节。平旦是阴消阳长的重要时间节点,中医认为平旦阳气生。这一时相褪黑素显示,分泌消长特征是人体夜节律分段的依据。脑所摄取的褪黑素浓集于中脑和丘脑下部,它增强脑吡多醛激酶(brain-pyridoxal kinase)的活性,从而促进Glu脱羧形成GABA[10]。
把昼夜分为两段,昼的变化对人体的影响是通过Glu系统,夜的变化对人体的影响是通过GABA系统。昼夜节律阴阳消长对应人体生物节律阴阳的消长和转化。平旦是阴阳转化的一个重要的转折节点(上述SynOff)。
4 Glu/GABA形体解剖及其功能协调的阴阳空间分布属性
4.1 Glu/GABA 在脑、脊髓和躯干四肢功能的阴阳空间分布属性
脊髓是神经系统把大脑的信号传递到外周组织的中继站。由大脑和小脑传出的Glu和GABA化学信号,通过神经纤维经脊髓中继传导到外周器官和组织,作用于外周组织不同受体,产生不同的生理作用,它们的分布显示了明显的位置特征。
分子解剖学显示,大脑皮层锥体细胞传出Glu能纤维[11],易化伸肌,抑制屈肌[12]。小脑惟一的传出纤维浦肯野纤维为GABA能神经纤维,通过红核脊髓束易化屈肌[12]抑制伸肌。大脑的Glu能神经纤维传出支配部位属性为阳,小脑的GABA能神经纤维传出支配部位属性为阴。
成体脊髓内Glu的含量虽较脑区低,但其分布呈现出背根高于腹根、背部灰质高于腹部灰质的特点[11]。Shh是一个主要的人体腹背轴腹侧发育基因,它是GABA能神经元的重要命运决定基因[13-16],也是所有腹侧结构形成的关键基因。从分布上看,背侧兴奋性Glu能神经元较多,腹侧抑制性GABA能神经元较多,符合中医背为阳、腹为阴的划分。
脊髓传出神经纤维作用于肌组织从而调节运动行为。行走动物前后肢的运动有赖于伸肌和屈肌交替兴奋和抑制,而这种兴奋和抑制是由Glu和GABA介导的。实验显示[17],鼠胚胎第11天,脊髓dI6发育相关基因为WT1,胚胎化学表型为GABA/Glycine;脊髓V0发育相关基因为Evx1/2,胚胎化学表型为V0b GABA/Glycine,脊髓V0v胚胎化学表型为Glu;脊髓V1发育相关基因为En1,胚胎化学表型为GABA/Glycine;脊髓V2发育相关基因V2a为Chx10,V2b为Gata3,胚胎化学表型V2a为Glu,V2b为GABA/Glycine;脊髓MN发育相关基因为Hb9、Isl1,胚胎化学表型为Ach、Glu;脊髓V3发育相关基因为Sim,胚胎化学表型为Glu。这种脊髓腹侧神经元Glu和GABA的交替表达,为我们理解屈伸肌交替运动从而产生运动兴奋抑制网络打开了思路。Glu和GABA化学表型的交替,表达显示了它们支配肌的阴阳协调属性。
胚胎脊髓传出神经纤维化学表型的支配范围,规划了成体脊神经传出纤维化学表型对四肢肌的支配范围蓝图。骨骼肌蛋白质组分析显示,骨骼肌表达的Glu受体是GRINA,一种Glu相互作用蛋白2(glutamate receptor interacting protein GRIP2),在骨骼肌中表达超过正常组织表达5倍以上,表达的GABA受体是GABBR1、GABRP。对于硬线连接的神经纤维而言,有受体表达的地方就有神经纤维。脊髓Glu能化学表型脊髓细胞投射纤维到达肌组织外侧, GABA能化学表型脊髓细胞投射纤维到达肌组织内侧。表1显示,V0和V2区Glu和GABA化学表型的共表达,它们的纤维投射应该到达一个从屈肌到伸肌、从伸肌到屈肌的转圜区。

表1 鼠脊髓胚胎发育模式化学表型的阴阳属性
中医认为,四肢伸肌侧的属性为阳,屈肌侧为阴,这些脊髓腹侧神经元相关基因产生的化学表型及其投射的相应肌群符合阴阳空间的划分。
4.2 Glu/GABA脏器功能的阴阳空间分布属性
从大脑到脊髓神经硬线连接投射来源的Glu系统和GABA系统,除了有与肢体连接协调四肢的功能外,还有与内脏连接共同协调其功能,形成人体中脏腑形体共同协调作用网络,它们表现为相互依存和相互协调。Glu/GABA主要通过自主神经系统调节脏器功能。应用蛋白质组对照研究方法,可获得肝、胆、心、小肠、脾、胃、肺、大肠、肾、膀胱等脏器组织的细胞表面Glu和GABA受体及其转运者的类型和数量。初步分析,各脏器组织内部Glu和GABA的合成、细胞膜上表达的Glu和GABA受体以及转运者的类型和数量,似乎与中医学所定义的脏腑阴阳属性及其内部阴阳互存、协调为用相一致。
肝脏组织Glu系统包含1种促离子型Glu受体、1种促代谢型Glu受体和3种Glu转运者。肝组织内Glu合成酶2(GLS2)mRNA表达丰度为其他RNA的5倍以上。GABA系统包含1种促离子型GABA受体、3种GABA转运者,其中SLC6A1、SLC6A12的mRNA表达丰度为其他RNA的5倍以上。它们共同参与调节肝脏的生理功能,并通过神经联络和其他脏器、四肢头面形成网络。
胆囊组织Glu系统包含4种促离子型Glu受体和4种Glu转运者,其中SLC1A7 RNA表达丰度为其他RNA的5倍以上,包括1种Glu囊泡转运者SLC17A7。胆囊组织GABA系统包含5种促离子型GABA受体和2种GABA转运者,它们共同参与并调节胆囊的生理功能,通过神经联络和其他脏器、四肢头面形成网络。
心脏组织Glu系统包含5种促离子型Glu受体、2种促代谢型Glu受体和2种Glu转运者,其中促代谢型受体GRIN2CmRNA表达丰度为其他RNA的5倍以上;心脏组织GABA系统包含5种促离子型GABA受体和1种GABA转运者,它们共同参与并调节心脏的生理功能,通过神经联络和其他脏器、四肢头面形成网络。
小肠组织Glu系统包含3种促离子型Glu受体、3种Glu转运者和1种Glu囊泡转运者,其中SLC1A1、SLC17A8 mRNA表达丰度为其他mRNA的5倍以上。小肠组织GABA系统包含3种促离子型GABA受体、1种促代谢型GABA受体,它们共同参与并调节小肠的生理功能,通过神经联络和其他脏器、四肢头面形成网络。
脾脏组织Glu系统包含5种促离子型Glu受体和1种Glu转运者,其中GRIN3BmRNA表达丰度为其他mRNA的5倍以上;脾脏组织GABA系统包含5种促离子型GABA受体、1种促代谢型GABA受体,它们共同参与并调节脾脏的生理功能,通过神经联络和其他脏器、四肢头面形成网络。
胃组织Glu系统包含2种促离子型Glu受体,3种Glu转运者。胃组织GABA系统包含2种促离子型GABA受体、1种促代谢型GABA受体和1种GABA转运者。它们共同参与并调节胃的生理功能,通过神经联络和其他脏器、四肢头面形成网络。
肺脏组织Glu系统包含2种促离子型Glu受体和3种Glu转运者。肺脏组织GABA系统包含3种促离子型GABA受体、1种促代谢型GABA受体和3种GABA转运者,它们共同参与并调节肺脏的生理功能,通过神经联络和其他脏器、四肢头面形成网络。
大肠组织Glu系统包含2种促离子型Glu受体、1种促代谢型Glu受体和2种Glu转运者和1种Glu囊泡转运者。大肠组织Glu系统包含3种促离子型GABA受体和1种GABA转运者,它们共同参与并调节大肠的生理功能,并通过神经联络和其他脏器、四肢头面形成网络。
肾脏组织Glu系统包含3种促离子型Glu受体和1种Glu转运者,肾脏组织GABA系统包含4种促离子型GABA受体和2种GABA转运者,其中SLC6A12、SLC6A13 mRNA表达丰度为其他RNA的5倍以上;GABA合成酶GAD1,是脏腑组织中惟一表达GAD的组织,它们共同参与并调节肾脏的生理功能,通过神经联络和其他脏器、四肢头面形成网络。
膀胱组织有Glu受体和GABA受体[18],暂无蛋白质组学资料,它们共同参与并调节膀胱的生理功能,通过神经联络和其他脏器、四肢头面形成网络。
4.3 Glu/GABA在颅面器官中功能的阴阳空间分布属性
有研究资料显示,所有颅神经感觉神经纤维的兴奋和抑制均由Glu/GABA调控。以三叉神经为例,在出生前发育鼠丘脑腹后内侧核(Ventral posteromedial nucleus VPM),兴奋性反应完全由Glu受体NMDARs(GRINs)介导,而GABA在胚胎第18天(E18)开始起作用。VPM接受来自三叉神经嘴侧主核(Rostral Principal nucleus PrV)和尾侧三叉神经脊束核(Caudal spinal nuceulSpV)的投射[19]。
脊椎动物运动结构研究显示,在前脑、脑干和脊髓,兴奋性神经元是Glu能的,它们活化突触后AMPA受体(GRIAs)和NMDA受体(GRINs),GABA神经元下调运动活性[20]。
视网膜双极细胞接受来自光受体的Glu传入和水平细胞的GABA传入,它们既介导生物节律(前述)又参与视觉感知,既探测可见光,也参与视网膜的发育。视网膜双极细胞接受来自光受体的Glu能传入和来自水平细胞的GABA能输入。Glu输入提供Glu兴奋性输入到视网膜节细胞,GABA抑制性输入到无长突细胞,这些输入对感光具有开关作用[21]。开的作用由Glu介导,关的作用由GABA介导。介导视觉感知的分子包括促离子型Glu受体GRIN1、GRIN2、促代谢性Glu受体GRM6和GRM8等。
听觉传导经毛细胞通过听神经到耳蜗核,再经上橄榄核到外侧丘系和上丘,到达下丘脑内侧膝状体,最后到达听觉皮层。投射纤维为Glu能和GABA能(或Gly)的化学表型[22]。介导听觉感知的兴奋性分子为促代谢型Glu受体GRM7。上橄榄核对听觉靶细胞的功能由GABA介导,包括促离子型GABA受体GABRA5、GABRB2、GABRB3等。研究还显示,听觉系统GABA突触抑制具有声音定位作用[23]。同脏器传出纤维一样,颅面结构内脏传出纤维中Glu/GABA通过自主神经传递。Glu/GABA也介导嗅觉和味觉功能[24]。
5 结语
通过上述讨论, Glu和GABA系统分子功能符合中医阴阳理论中阴阳互相对立、互相依从、互相消长、互相转化的属性(图4),也符合昼夜节律、形体内外、脏腑之间位置关系决定的时空阴阳属性,可能是人体阴阳变化的分子基础之一。
图4 GLU和GABA
参考文献:
[1] 陈梦雷.古今图书集成·医部全录·医经注释[M].北京:人民卫生出版社, 1988.
[2] 任应秋.阴阳五行[M].上海:上海科学技术技出版社, 1959:29.
[3] S P H ALEXANDER .Glutamate. Encyclopedia of neuroscience[M].北京:科学出版社,2010: 178-187.
[4] A SCHOUBOEAS, H S WAAGEPETERSENW .Gamma- Aminobutyric Acid(GABA).Encyclopedia of neuroscience[M].北京:科学出版社,2010: 168-172.
[5] K L BEHAR .GABA Synthesis and Metabolism .Encyclopedia of neuroscience[M].北京:科学出版社, 2010: 120-126.
[6] J-M BILLARD, B POTIERP. Glutamateric and Gabaergic systems. Encyclopedia of neuroscience [M].北京:科学出版社,2010: 204-210.
[7] A M ROSENWASSERR. Entrainment of Circadian Rhythms By Light. Encyclopedia of neuroscience[M].北京:科学出版社, 2010: 114-121.
[8] R JREITER AND D-X TAN .PinealGland and Melatonin Encyclopedia of neuroscience[M].北京:科学出版社,2010: 427-431.
[9] A J LEWY,J SONGER, K YUHASEDY.Circadian Function and Therapeutic Potential of Melatonin in Human .Encyclopedia of neuroscience[M].北京:科学出版社, 2010: 42-49.
[10] 上海第一医学院.组织学[M]. 北京:人民卫生出版社,1980: 865-873.
[11] 徐科.神经生物学纲要[M]. 北京:科学出版社,2001: 194-202.
[12] 张培林.神经解剖学[M].北京:人民卫生出版社,1999: 300-333.
[13] 蔡文琴,李海标.发育神经生物学[M].北京:科学出版社,2001: 329.
[14] ROBERT LANZEED. HandBook of Stem Cell[M].Embryonic,北京:科学出版社,2004:243.
[15] MARC FUCCILLO, ALEXANDRA L,JOYNER, GORDFISHELL. Morphogen to mitogen: the multiple roles of hedgehog signaling in vertebrate neural development[J]. Natureviews neuroscience,2006,10(7):772-781.
[16] CARL P,EONDERS, STEWART A.ANDERSON. The Origin and specification of cortical interneurons[J].Natureviews neuroscience,2006,9(7):687-694.
[17] MARTYN GOULDING . Circuits controlling Vertebrate locomotion:moving in a new direction[J]. Natureviews neuroscience,2009,7(10): 507-511.
[18] CLARE J FOWLERF,DEREK CRIFFITHS,WILLIAM C.DE GROAT .The neural control of micurition[J]. Natureviews neuroscience,2008,6(9):453-462.
[19] REHA S.ERZURUMLU,YASUNORI MURAKAMI,FILIPPO M.RIJLI.Mapping the face in the somatosensory brainstem[J]. Natureviews neuroscience, 2010,4(11):252-261.
[20] STEN GRILLNERS. The motor infrastructure:fromion channels to neuromal networks[J]. Natureviews neuroscience 2003,7(4):573-583.
[21] THOMAS EULER,SILKEHAVERKAMP,TIMM SCHUBERTS, et al. Retinal bipolar ceels: elementary building blocks of Vision[J]. Natureviews neuroscience, 2014,8(15):507-519.
[22] BORIS GOUREVITEH,JEAN-MARCM EDELINEE, FLORIANF, et al. Is the din really harmless:long-term effects of non-traumatic noise on the adult auditory system[J]. Natureviews neuroscience,2014,7(15): 485-491.
[23] BENEDIKT GROTHE. New roles for synaptic inhibition in sound localization[J]. Natureviews neuroscience, 2003, 7(4):540-549.
[24] PETER MOMBAERTS .Genes And Ligands For Odorant, Vomeronasal And Taste Receptors[J]. Natureviews neuroscience,2004,4(5):263-276.

