RAPID'Sakazakii Agar克罗诺杆菌属显色培养基的性能评价
张西萌 韩笑 付溥博 曾 静 魏海燕 陈鑫 魏咏新
(北京出入境检验检疫局 北京 100026)
1 前言
克罗诺杆菌属原名阪崎肠杆菌,在自然界中分布广泛,在水、土壤、食品中均可分离出该菌。克罗诺杆菌属能导致严重的新生儿脑膜炎、小肠结肠炎和菌血症,并可引起神经系统后遗症和死亡,因该菌感染引起的死亡率高达50%以上[1]。该菌属[2,3]包括1个新组合、4个新种和3个新亚种。新组合为阪崎肠克罗诺杆菌;4个新种分别为苏黎世克罗诺杆菌、丙二酸盐阳性克罗诺杆菌、穆汀斯克罗诺杆菌、都柏林克罗诺杆菌;3个新亚种分别为都柏林克罗诺杆菌都柏林亚种、都柏林克罗诺杆菌洛桑亚种、都柏林克罗诺杆菌乳粉亚种。此外还有1个克罗诺杆菌基因种1不是新种,但属于克罗诺杆菌属,即克罗诺杆菌属共有6个种[4]。在目前采用的克罗诺杆菌属检测方法中,传统培养分离法仍是最常用的鉴定方法,而最常见的显色培养基为DFI琼脂,可选择的其他类似培养基并不多见。因此,本研究通过国家标准GB 4789.40方法及伯乐公司研发的新型培养基RSA快速筛选方法对50株克罗诺杆菌属及30株非克罗诺杆菌属进行RAPID'Sakazakii Agar(以下简称RSA)显色培养基鉴定及应用研究。
2 材料与方法
2.1 材料
2.1.1 实验菌株
共选取50株目标菌株,其中1株为ATCC 29544标准菌株,其余49株分离株分别来源于奶粉、婴幼儿食品、蛋白粉、黄油、芝士、冰淇淋、面包粉等食品,详见表1。
2.1.2 试剂
RAPID'Sakazakii Agar克罗诺杆菌属显色培养基:RSA 伯乐 2C0010,法国;脑心浸液肉汤:BRAINHEART INFUSION BHI梅里埃 1001221840,法国;克罗诺杆菌属显色培养基:DFI陆桥 121227,国产;缓冲蛋白胨水:Baffer Peptone Water BPW OXIOD 1143896,英国;改良月桂基硫酸盐胰蛋白胨肉汤:Modified Lauryl Sulfate Tryptose Broth mLST陆桥 121128,国产;万古霉素:Vancomycin陆桥130108,国产。
2.1.3 仪器设备
微生物鉴定仪:法国梅里埃 VITEK2 COMPACT30,法国;恒温培养箱(37℃):MMM FC222,德国;全温振荡器(36℃±1℃):培英 THZ-C-1,国产;涡旋振荡器:IKA ms3Ds25,德国;McFarland标准比浊仪:梅里埃 DENSICHEK,意大利。
2.2 方法
2.2.1 RSA培养基主要原理
利用克罗诺杆菌属特异性产生α-葡萄糖酶,在此酶的作用下酶底物 5-溴-4氯-3吲哚α-D-甲基葡萄糖苷显示蓝至蓝绿色菌落。44℃培养后脱氧胆酸钠和结晶紫会抑制其他杂菌和干扰菌的生长。
2.2.2 RSA快速筛选培养基选择性研究
2.2.2.1 特异性分析
采用包括ATCC 29544参比菌株在内的49株克罗诺杆菌属针对RSA快速筛选培养基进行特异性研究。
2.2.2.2 交叉反应分析
为了测试该培养基与非克罗诺杆菌属是否存在交叉反应,采用包括肠杆菌科的大肠埃希菌、沙门菌、阴沟肠杆菌、弗氏柠檬酸杆菌等30株非目标菌,同时选取国标法采用的DFI显色培养基与RSA培养基进行交叉反应测试。
2.2.3 RSA快速筛选培养基检测相对准确性研究
2.2.3.1 添加实验
目标菌株:克罗诺杆菌属 ATCC 29544;
干扰菌株:大肠埃希菌为 ATCC 25922;
目标菌添加水平:0=阴性对照,1 600 CFU/100 g样品,120 CFU/100 g;
干扰菌添加水平:2.5×106CFU/100 g样品。
添加方法:将添加菌株在BHI平板上活化,接种单个菌落于 10 mL BHI液体培养基中,36℃150~200 rpm 摇床过夜培养;将培养液用灭菌生理盐水进行梯度稀释,克罗诺杆菌属培养液稀释到10-4和10-5,菌液浓度分别为1 600 CFU/mL和120 CFU/mL;大肠埃希菌菌液添加浓度为2.5×106CFU/mL。分别取1 mL菌液,添加到经高压灭菌的100 g样品中,按照GB 4789.40和RSA快速筛选方法进行检验,添加样品类型主要是乳粉和乳制品。
2.2.3.2 培养条件的影响
培养条件主要是评估关键因素对方法检出率的影响,在此设定的关键因素是培养温度和培养时间。方法:单一菌株的添加;添加方法和添加目标菌株的量:同2.2.3.1;添加基质:经实验证明不含克罗诺杆菌属的婴儿配方奶粉。温度、时间组合为36℃,16 h;36℃,20 h;38℃,16 h;38℃,20 h。每个组合做 2 个平行样品。
2.2.3.3 实际样品的检测
在超市购买50个乳和乳制品样品,样品类别包括3个阶段的婴儿(幼儿)配方奶粉及各种品牌酸奶制品,分别用GB 4789.40和RSA快速筛选方法进行检验。
3 结果
3.1 特异性
RSA快速筛选培养基特异性实验结果见表1。

表1 RSA快速筛选培养基特异性实验结果
表1结果显示:在RSA快速筛选培养基上,ATCC29544参比菌株表现特征性的“蓝绿色”菌落;49株分离株,除BJ-E.sa-56、57表现为蓝色菌落外,其余菌株均表现“蓝绿色”特征菌落;BJ-E.sa-56和57进一步鉴定为克罗诺杆菌属。因此,RSA快速筛选培养基的特异性准确率为96%。
3.2 交叉反应
非目标菌在DFI显色培养基与RSA培养基的测试结果见表2。
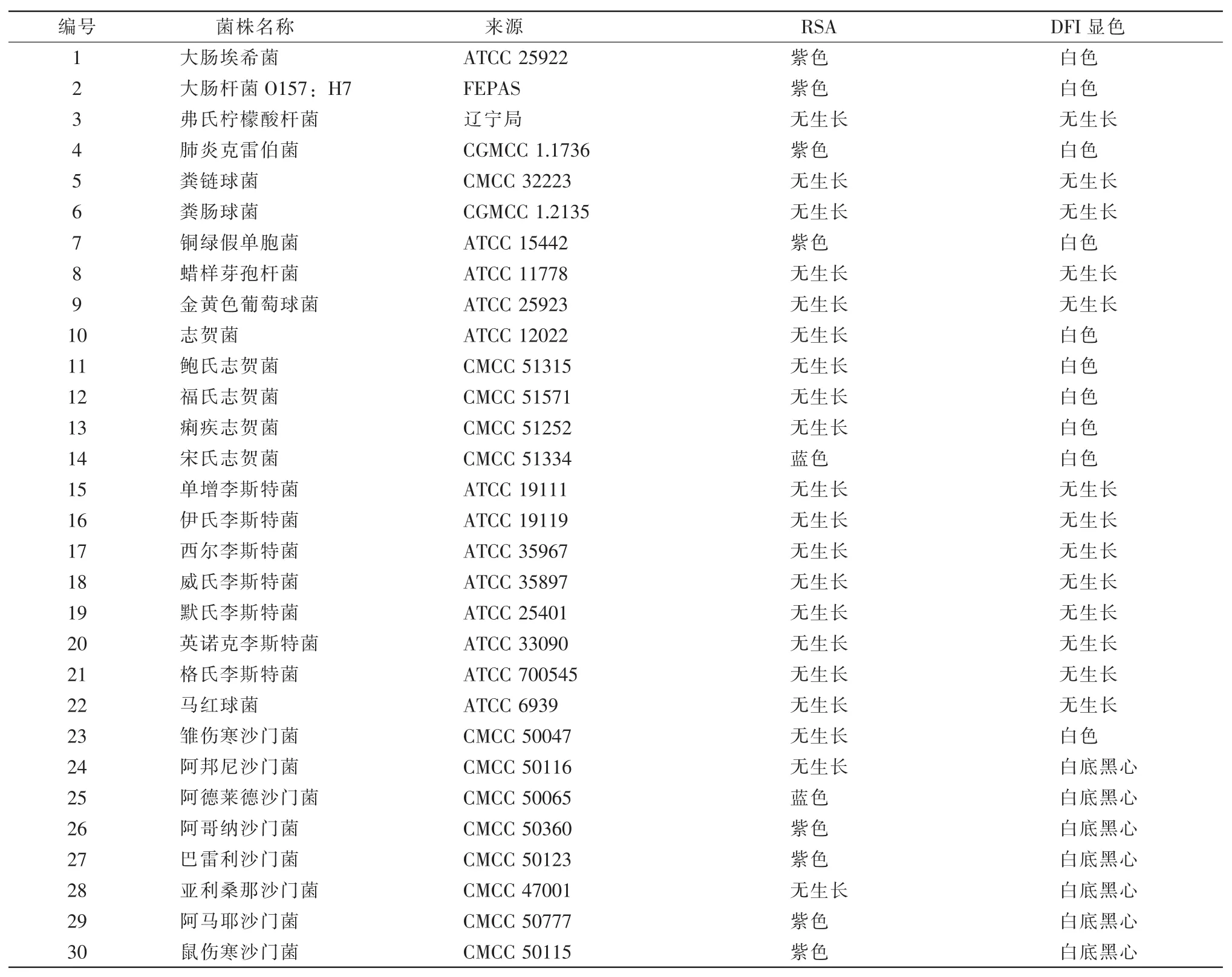
表2 30株非目标菌在RSA快速筛选培养基上的菌落特征
表2结果显示:30株非目标菌中一些菌株在RSA培养基上被抑制,不能生长,能生长的菌株多呈紫色和蓝色;在DFI显色培养基上呈白色或者是白的有黑心的菌落。由此结果得出:RSA快速筛选培养基具有非常好的分辨力。
3.3 相对准确性
3.3.1 添加实验
混菌添加实验结果见表3。
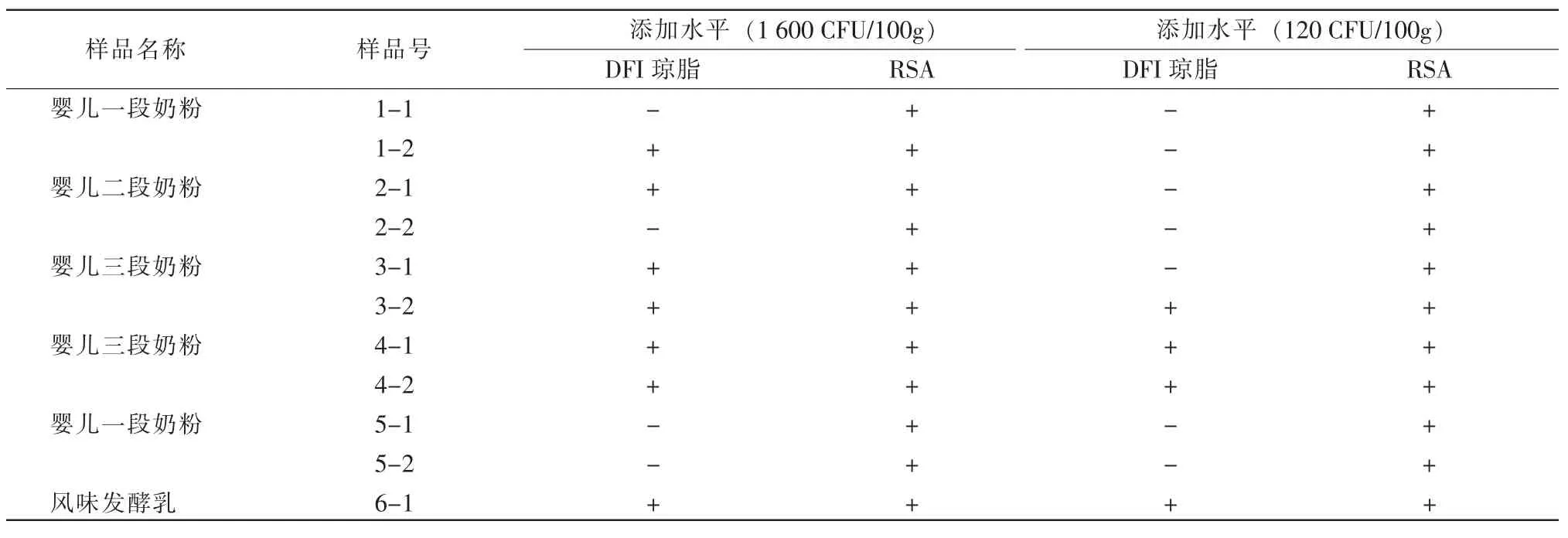
表3 混菌添加实验
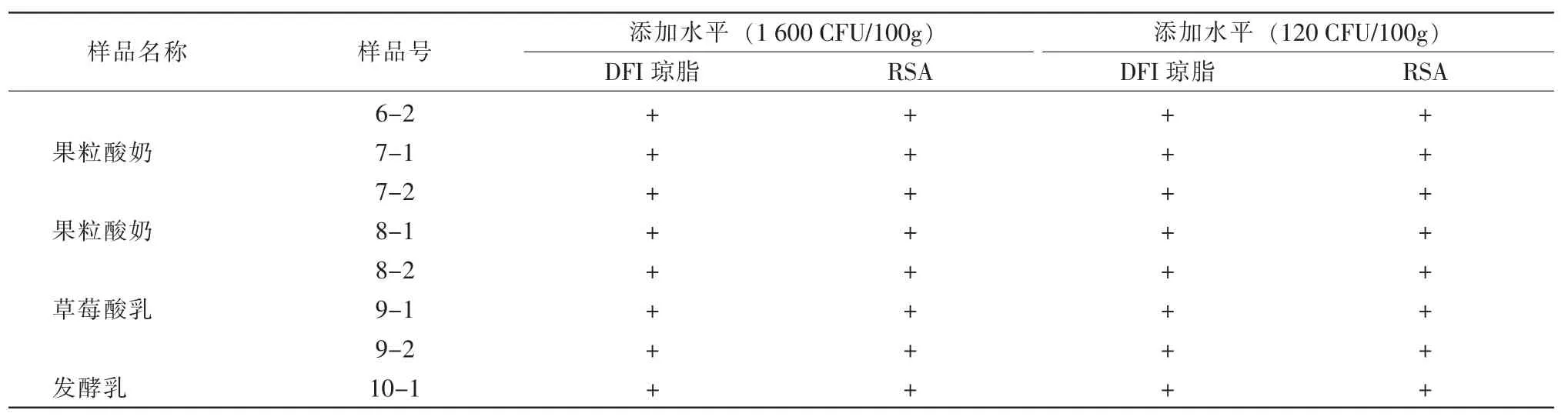
(续表 3)
表3结果显示:10个不同样品,每个做2个平行样,共计20个样品的测试,在高浓度杂菌干扰的情况下,添加水平为1 600 CFU/100 g样品时,DFI显色培养基的检出率为16/20,即80%;RSA 选择性培养基的检出率为20/20,即100%。添加水平为120 CFU/100 g样品时,DFI显色培养基的检出率为13/20,即65%;RSA 选择性培养基的检出率为20/20,即100%。因此,RSA选择性培养基在高浓度杂菌干扰的情况下,选择性和检出率均优于DFI显色培养基。
3.3.2 培养条件
不同培养温度和培养时间对实验结果的影响见表4。
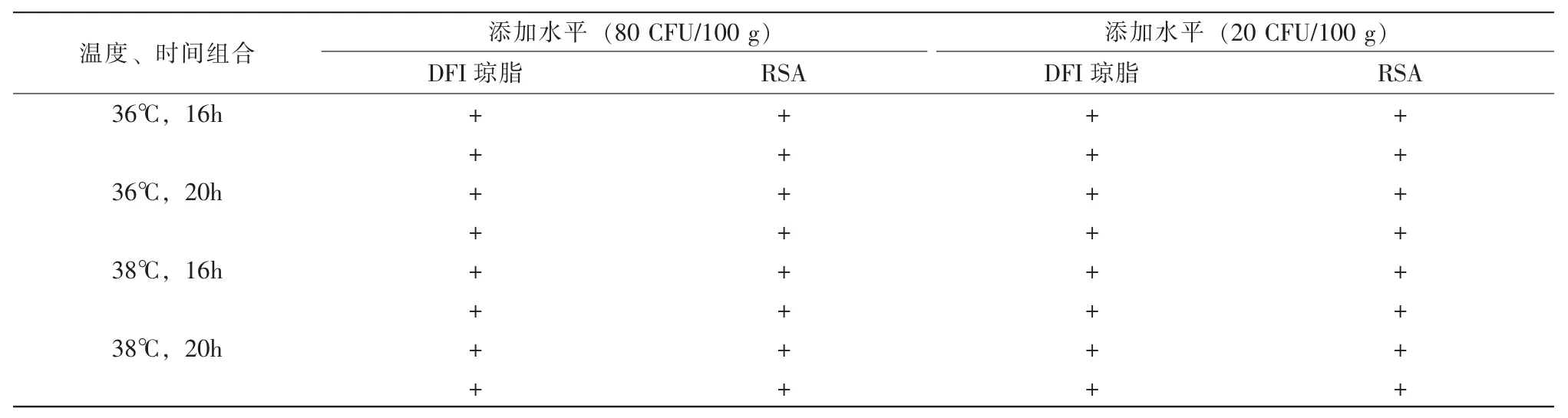
表4 培养温度和时间对试验结果的影响
表4结果显示:许可范围内,在80 CFU/100 g和20 CFU/100 g添加水平,温度在变化2℃和培养时间变化2 h的情况下,对RSA快速筛选方法的检出率没有影响。
3.3.3 实际样品检测结果
实际样品检测实验中,通过两种检测方法均未检出阳性样品。
4 结论与讨论
克罗诺杆菌属对新生儿危害极大,致死率高达50%以上,因此受到世界各国高度重视。在我国,该项目是国家食品安全标准婴儿配方食品(0-6个月)中必检项目。
Muytjens等[5]研究了克罗诺杆菌属和相关菌株的酶反应特点,研究发现克罗诺杆菌属和其他肠杆菌之间存在主要的不同点:克罗诺杆菌属α-葡萄糖苷酶活性均为阳性,而其他肠杆菌科均为阴性。因此本研究采用的两种显色培养基均利用上述原理,添加了酶底物与之反应,来鉴别克罗诺杆菌属。1985年Farmer等[6]检测了57株克罗诺杆菌属,其中53株α-葡萄糖苷酶活性为阳性。1983年Aldova等[7]评估了从捷克斯洛伐克分离的73株克罗诺杆菌属吐温80脂酶活性,结果显示97.13%的菌株含有该酶。由上述文献记载可以得出,并非全部克罗诺杆菌属都产α-葡萄糖苷酶,因此本研究所采用菌株中2株分离株未显出目标菌蓝绿色菌落,也属正常现象。
本研究通过对50株目标菌及30株非目标菌对克罗诺杆菌属RSA显色培养基进行特异性和交叉性分析、混菌添加、温度条件、实际样品检测等方法进行实验,其中特异性分析实验表明该培养基显示出了良好的分辨力,准确度高达96%以上,其中与其他菌株显色不同的2株分离株来源于同一国家,同一品牌,且这两株分离株的耐药实验显示,在选择的20种抗生素实验中,这两株菌相似度极高,抑菌圈直径基本一致,因此推测这两株具有同源性。交叉性分析实验选取30株非目标菌,包括多株与克罗诺杆菌属近似的革兰阴性肠道菌及部分革兰阳性菌,结果全部菌株都与目标菌颜色有明显差别,易分辨。混菌添加实验和温度实验检出率均为100%,优于同类比对培养基。
微生物检测实验中,培养基的质量优劣将直接影响到检测工作的精准性和可靠性。针对致病菌检测,如能选择一种检出率高于同类产品且易于观察的高品质培养基,对整体实验结果的准确率会有大幅度提高。通过上述5项研究结果充分表明,与传统克罗诺杆菌属显色培养基相比,本次实验所采用的RSA显色培养基具有准确率高、特征性菌落易观察等优点,同时该培养基还具备多项优势:首先操作步骤比传统GB 4789.40方法节省了选择性增菌环节,检测时限缩短1天,其次培养基不需添加任何添加剂,称取量比其他培养基低,从而降低了检测成本。综上所述,RSA显色培养基具有多项同类产品不具备的优点,利于操作及保存,是理想的克罗诺杆菌属检测的培养基。
本研究所采用的RSA培养基显示出良好的分辨力,准确度高达96%以上,干扰菌添加实验和温度实验检出率均为100%,优于同类比对培养基,其可以作为一种选择性培养基在微生物检测行业推广使用。
[1]Joint FAO/WHO workshop on Enterobacter sakazakii and other microorganisms in powderedinfantformula,Geneva,2-5.February 2004 EB/OL.http://www.who.int/food-safety/micro/meetings/en/report.pdf.
[2]裴晓燕,刘秀梅.阪崎肠杆菌的生物学性状与健康危害[J].中国食品卫生杂志,2004,16(6):550-555.
[3]NOTIFICATION LIST.Notification that new names and new combinations have appeared in volume 58,part 6,of the IJSEM[A].Int J Systematic and Evolutionary Microbiol,2008,(58):1995-1996.
[4]赵贵明,袁飞,杨海荣,等.阪崎肠杆菌的分类变化及新种属生物学特性[J]. 卫生研究,2010,39(2):248-250.
[5]Muytjens H L,van der Rosvan de Repce J,van Druten H A.Enzymatic profiles of Enterobacter sakazakii and relatedspecies with specialreference to the alphaglucosidase reaction and reproducibility of the test system[J].J Clin Micro2biol,1984,20(4):684-686.
[6]Farmer J J,Davis B R,Hickman Brenner F W,etal.Biochemicalidentification ofnew speciesand biogroupsof Enterobacteriaceae isolated from clinical specimens[J].J Clin Microbilo,1985,21(1):46-76.
[7]Aldova E,Hausner O,Postupa R.Tween 2 esterase activity in Enterobacter sakazakii[J].Zentralbl Bakteriol Mikrobiol Hyg,1983,256(l):103-108.

