4种活化部分凝血活酶时间试剂因子敏感性的量化评估及临床应用探讨
王 威,何晓璇,仝晓宁,刘 哲,邓 凯,王 刚
(西安交通大学第一附属医院检验科,西安 710061)
活化部分凝血活酶时间(APTT)可以反映内源性凝血途径和(或)共同途径的因子缺乏,并且在多因子缺乏或者明显的单因子缺乏时表现为时间延长,但当因子缺乏时,APTT是否延长及延长的程度取决于APTT试剂对内源性凝血因子的敏感性。不同的APTT试剂对内源性凝血因子的敏感性不同,这种差异不仅来源于APTT试剂所采用的激活剂以及磷脂种类的不同,还来源于试剂各组分的浓度差异[1-2]。那么,实验室如何评估APTT试剂对内源性凝血因子FⅧ、FⅨ、FⅪ、FⅫ的敏感性,如何做到标准化评估操作,临床如何应用因子敏感性不同的试剂,这些均是实验室亟待解决的问题。美国临床和实验室标准化协会(CLSI)在H47-A2文件中将APTT试剂敏感性定义为APTT升高到已建立的正常参考区间上限时的因子水平[3]。在我国,实验室工作人员已注意到不同品牌的APTT试剂对同一份标本的检测结果不尽相同,但很少深究造成差异的原因,以及这种差异可能导致的临床后果[4-5]。国内前期研究中,虽然评估了不同APTT试剂的因子敏感性,但并未给出详细的定量的内源性因子敏感性结果[1]。本研究采用CLSI提供的APTT试剂敏感性的评估方法,量化评估本实验室可获得的4种不同APTT试剂的因子敏感性,分析其不同的临床适用范围,以及H47-A2未提及的FⅫ对APTT结果的影响,期望筛选出适用于术前筛查及单因子缺乏患者筛查的试剂。
1 材料与方法
1.1仪器与试剂 仪器:日本Sysmex CS5100全自动血凝仪;法国恩塔高(STAGO)-R全自动血凝仪。试剂A:APTT测定试剂盒(CS-5100适用),上海太阳生物技术有限公司生产,接触激活物为鞣花酸;试剂B:APTT测定试剂盒(STAGO适用),上海太阳生物技术有限公司生产,接触激活物为白陶土;试剂C:APTT测定试剂盒(Siemens Dade Actin),西门子(Siemens)生产,接触激活物为鞣花酸;试剂D:APTT测定试剂盒(STAO®-PTTA),STAGO公司生产,接触激活物为硅土。4种APTT试剂组分中所含的磷脂种类均为兔脑磷脂。所有APTT试剂的说明书均注明适用于相关仪器。CaCl2来自于相应的APTT试剂厂家,浓度均为0.025 mmol/L。
1.2标本来源 冻干标准血浆、冻干乏Ⅷ因子血浆、冻干乏Ⅸ因子血浆、冻干乏Ⅺ因子血、冻干乏Ⅻ血浆均来自于SIEMENS。整个研究过程中,均使用同一批号的冻干血浆。健康人血浆标本来自20~48岁的30例男性和30例女性捐献者(问卷调查排除饮食、药物、疾病等影响因素),平均年龄28.6岁。标本采用0.109 mmol/L枸橼酸钠抗凝,2 000×g离心15 min收获血浆,无溶血、脂血、黄疸。
1.3方法 冻干标准血浆及乏因子血浆恢复至室温后,每支加入1 mL蒸馏水复融。标准血浆及单因子缺乏血浆的FⅧ、FⅨ、FⅪ、FⅫ因子活性,采用Siemens Dade Actin试剂和相应Siemens乏因子血浆试剂在CS-5100仪器进行检测。APTT因子敏感性评估参照CLSI H47-A2相关指南进行[3]:用商品化的单因子缺乏血浆与标准血浆按比例配制出不同单因子活性的混合血浆,因子活性范围为<1%~100%,由此可以得到单因子活性为100%、90%、80%、70%、60%、50%、40%、30%、20%、10%、<1%的11份标本。每份标本一式3份均用4种不同的APTT试剂,在相应的仪器上进行检测,测定结果取平均值,且每管间差异(CV%)须小于5%。60例健康捐献者的标本分离的新鲜血浆分别用4种不同APTT试剂进行检测,所得APTT检测结果用于计算各APTT试剂的正常参考区间[2]。APTT试剂敏感性为达到正常参考区间上限的最大因子浓度。正常参考区间上限定义为APTT测定结果的均值加2s[2,6]。所有标本均在4 h内完成测定。
1.4统计学处理 APTT试剂测定不同因子水平的混合血浆,所得的APTT均值分别与相应的凝血单因子活性拟合非线性回归曲线,曲线与正常参考区间上限交叉点的百分活度(%)即相应因子的敏感性[3]。所有数据的统计学处理采用GraphPad Prism 4(GraphPad Software,Inc.La Jolla,CA,USA)软件。
2 结 果
2.1标准血浆与乏因子血浆内源性因子活性结果 标准血浆与乏因子血浆的FⅧ、FⅨ、FⅪ、FⅫ因子活性,见表1。标准血浆的因子活性均在正常参考范围内。乏因子血浆除去特定的因子活性<1%外,其余因子活性均在正常参考范围内,但低于标准血浆的因子活性。
2.24种不同APTT试剂的内源性因子敏感性 4种不同APTT试剂的正常参考范围上限:试剂A为37.0 s;试剂B为41.1 s;试剂C为40.1 s;试剂D为44.2 s。相应因子的敏感性为非线性回归曲线与正常参考区间上限交叉点的百分活度(%)。4种APTT试剂的FⅧ、FⅨ、FⅪ、FⅫ敏感性,见表2。4种APTT试剂FⅧ敏感性范围为25.6%(试剂B)~54.0%(试剂A);FⅨ敏感性范围为16.5%(试剂B)~37.3%(试剂A);FⅪ敏感性范围为19.1%(试剂D)~56.5%(试剂A);FⅫ敏感性范围为18.6%(试剂B)~36.4%(试剂A)。试剂A对FⅧ、FⅨ、FⅪ、FⅫ均表现为最高敏感性,且对FⅧ、FⅪ表现为超敏感(>50%)。试剂B对FⅧ、FⅨ、FⅫ均表现为最低敏感性,且对FⅨ、FⅫ敏感性均低于20%。试剂D对FⅧ、FⅨ、FⅪ、FⅫ均表现为低敏感性(<30%),对FⅨ敏感性低于20%,但对FⅧ、FⅨ、FⅫ的敏感性高于试剂Ⅱ。试剂C对FⅧ、FⅨ、FⅪ表现为适中的敏感性(>30%~<50%),对FⅫ表现为低敏感性(<30%)。
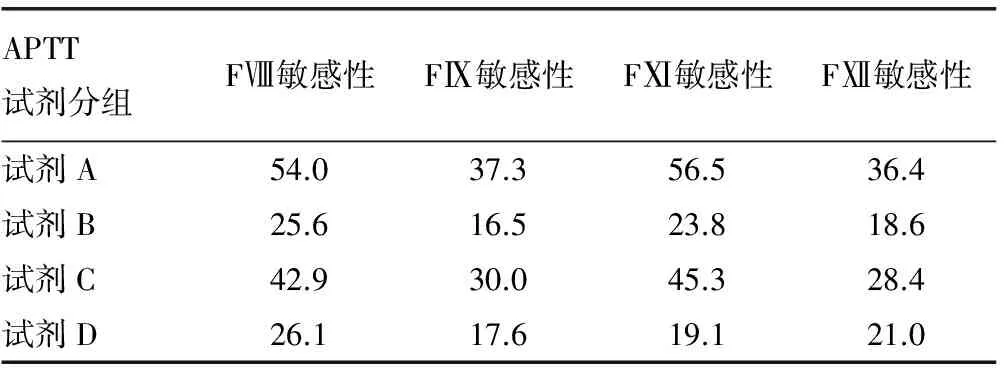
表2 4种不同APTT试剂的内源性途径因子敏感性(%)
3 讨 论
本研究应用CLSI H47-A2指南实现了对APTT试剂因子敏感性的量化评估,研究表明4种不同的APTT试剂的内源性因子敏感性差异较大。因此,临床应用中应根据不同的目的选择相应的APTT试剂。CLSI H47-A2指出:APTT所在检测系统(试剂/仪器组合)在FⅧ、FⅨ、FⅪ低于0.3 U/mL(30%因子活性)时,应当表现为时间异常延长,理想状态下,试剂对因子的敏感性应该在30%~45%[3]。本研究中,试剂A与试剂C对FⅧ、FⅨ、FⅪ的敏感性均≥30%,符合CLSI指南要求。由于这两种试剂对FⅧ、FⅨ有较高的敏感性,均可用于亚临床型血友病A、B[7]的筛查,但试剂A优于试剂C。在我国,多数实验室的FⅧ、FⅨ活性的检测是在标准曲线的基础上,根据APTT的检测结果换算得到血浆中凝血因子的活性值[8]。如果应用对FⅧ、FⅨ不敏感的APTT试剂,在检测FⅧ、FⅨ轻度缺乏的标本时,不会出现APTT的延长,从而导致所获得的因子活性值在正常范围内,得到一个假阴性结果。因此,试剂B与试剂D并不适用于轻型或亚临床型血友病的筛查,但可作为中度或重度单因子缺乏的确证试剂应用于临床。
遗传性FⅪ缺陷症在临床较为罕见。FⅪ水平高低与出血的严重程度不呈正比,无明显的自发性出血倾向[9-10]。但在外伤或手术中,某些缺乏FⅪ的患者,FⅪ的水平高于30 IU/dL,也会有明显的出血,部分患者FⅪ的水平即便达到40 IU/dL,也会出现严重的出血及低凝血酶生成[11]。由此可见,术前筛查需要FⅪ敏感的APTT试剂,用于检出FⅪ轻度缺乏的患者,预防术中的出血。笔者认为,用于术前筛查的APTT试剂,FⅪ敏感性应至少达到40%(40 IU/dL),才能满足筛查试验的要求。本研究中试剂A与试剂C符合要求。
根据CLSI指南,试剂A与试剂C均可作为合格的术前筛查试剂应用于临床。但是,笔者认为适用于术前筛查的APTT试剂,不仅要考虑其对内源性因子FⅧ、FⅨ、FⅪ的敏感性,也需要考虑FⅫ的影响。FⅫ属于接触激活因子,是体外模拟内源性凝血途径的启动因子,在APTT试验中占有重要的地位。FⅫ活性的减低不会引起明显的出血现象,有研究报道:遗传性FⅫ缺陷的患者,FⅫ:c为2%,FⅫ:Ag<1%时也未见明显出血[12]。所以,术前筛查应当选择对FⅫ的敏感性尽可能低的APTT试剂,以避免FⅫ轻度缺乏导致的APTT延长,误导临床医生给患者进行后续的确诊试验,延误患者治疗。试剂A的FⅫ敏感性是本研究中最高的,比试剂C高8%。因此,作为术前筛查的试剂,试剂A并不合适。试剂B与试剂D虽然FⅫ敏感性低(<25%),但对FⅧ、FⅨ、FⅪ的敏感性也很低(<30%)。因此,这两种试剂也不适用于术前凝血项筛查。试剂C对FⅧ、FⅨ、FⅪ、FⅫ的敏感性处于相对适中的范围,适用于术前筛查。
不同的APTT试剂对内源性凝血因子的敏感性不同,激活剂是其中很重要的影响因素。本研究中的4种APTT试剂,试剂A因子敏感性高于试剂B,试剂D敏感性最低,与文献报道不一致[10],此结果可能与试剂的其他组分浓度有关。磷脂的种类和浓度亦会影响APTT检测结果[6],在本研究中,4种试剂所用磷脂虽均为兔脑磷脂,但磷脂浓度未知,因此APTT试剂对因子的敏感性不同是否是由于不同磷脂浓度造成的,还需要进一步研究。
对APTT试剂可以用于普通肝素的监测、狼疮抗凝物质检测及内源性因子缺乏检测,本研究仅关注了其中的一个方面。目前,几乎所有厂家的APTT试剂说明书均未标注出APTT试剂的适用范围,以及对因子、肝素、狼疮抗凝物质的敏感性。如何在众多APTT试剂中选择合适的试剂,并将APTT检测的效用最大化,还需要检验工作者加强对试剂的了解,根据不同的临床需求选择相应的试剂,并对所选择的试剂进行评估。
[1]王学锋,胡晓波,程胜利,等.APTT检测试剂敏感性的比较[J].中华血液学杂志,2001,22(3):159-160.
[2]TOULON P,ELOIT Y,SMAHI M,et al.In vitro sensitivity of different activated partial thromboplastin time reagents to mild clotting factor deficiencies[J].Int J Lab Hematol,2016,38(4):389-396.
[3]Clinical and Laboratory Standards Institute.One-stage prothrombin time(PT) test and activated partial thromboplastin time(APTT) test;approved guideline-second edition:H47-A2[S].Wayne,PA,USA:CLSI,2010.
[4]林敏,徐伟鹏,邓小燕.活化部分凝血活酶时间标准化报告方式的可行性探讨[J].检验医学与临床,2015,12(12):1778-1779.
[5]高艳新,朱玉洁,李慕芳,等.两种不同试剂对SD大鼠血凝四项检测结果的比对[J].中国比较医学杂志,2015,25(10):21-23.
[6]Clinical and Laboratory Standards Institute.How to define and determine reference intervals in the clinical laboratory;approved guideline-second edition:C28-A2[S].Wayne,PA,USA:CLSI,2000.
[7]彭黎明,邓承祺.现代血栓与止血的实验室检测及其应用[M].北京:人民卫生出版社,2004:139.
[8]成斐,王学锋,周文宾,等.凝血因子Ⅷ和Ⅸ实验室检测现状调查与分析[J].中华检验医学杂志,2014,37(3):203-206.
[9]周娜,欧阳建,周荣富,等.两例遗传性凝血因子Ⅺ缺乏症患者的基因分析[J].血栓与止血学,2016,22(3):307-310.
[10]戴利亚,张德亭,谢海啸,等.一个遗传性凝血因子Ⅺ缺陷症家系的基因分析[J].温州医科大学学报,2015,45(5):376-380.
[11]MARTINUZZO M,BARRERA L,RODRIGUEZ M,et al.Do PT and APTT sensitivities to factors′ deficiencies calculated by the H47-A2 2008 CLSI guideline reflect the deficiencies found in plasmas from patients?[J].Int J Lab Hematol,2015,37(6):853-860.
[12]戴利亚,张德亭,林杰,等.新的纯合子Leu519Arg导致的遗传性凝血因子Ⅻ缺陷症家系分析[J].中华检验医学杂志,2015,38(7):466-469.

