TMEPAI蛋白表达对溶酶体稳定性的影响
罗深恒,白喜龙,景 磊,李玉银,刁爱坡
(天津科技大学生物工程学院,天津 300457)
溶酶体于1955年被发现,是一个由单层膜围绕、内含多种酸性水解酶类的囊泡状细胞器[1-2].溶酶体的主要功能是消化作用,同时还具有降解表面受体、失活病原微生物、修复细胞膜等功能[3].近年来研究表明,溶酶体调控着细胞内的多种死亡信号[3-4].当它受到一些外界因子,如肿瘤坏死因子[5-6]、Fas[7]、p53[8]、微管稳定剂[9]、氧化应激[7,10]和星形孢菌素[11]刺激时,溶酶体膜发生通透化,其内部的组织蛋白酶从溶酶体腔释放到细胞质.一旦这些组织蛋白酶被释放到细胞质中,特别是半胱氨酸组织蛋白酶B和L以及天冬氨酰蛋白酶 D,可诱发线粒体外膜通透化,继而引发半胱天冬蛋白酶或细胞凋亡诱导因子介导的凋亡[11-13],或者调节半胱天冬蛋白酶或细胞凋亡诱导因子介导的细胞程序性死亡[6,14].另外,由于不同因素引起的溶酶体膜稳定性下降可导致与溶酶体相关疾病的发生,如矽肺、类风湿性关节炎等[15].
目前已被鉴定的溶酶体相关蛋白包括溶酶体相关膜蛋白(LAMP1、LAMP2)、溶酶体内在蛋白(LIMP2)以及溶酶体膜糖蛋白(LGP85).这些蛋白都高度糖基化,能保护溶酶体膜不被其内部的水解酶降解[16-18],防止溶酶体通透化,从而维持溶酶体稳定性.
前列腺跨膜蛋白(transmembrane prostate androgen-induced protein,TMEPAI)是 N-端含有一个跨膜区(TMD)的Ⅰ型跨膜蛋白,由287个氨基酸组成. 编码TMEPAI的基因最早于2000年由Xu等[19]在前列腺癌细胞中通过基因表达系列分析受雄激素调控的基因时发现的,TMEPAI基因定位于染色体 20q13,TMEPAI在众多癌细胞中高表达,包括乳腺癌[20-21]、肺癌[22]、骨癌[23]、卵巢癌[24]、前列腺癌[25]、结肠癌、肾癌及胃癌细胞[26-28].TMEPAI在癌细胞中的表达受部分生长因子(EGF和 TGF-β)调控,如在肺癌细胞中,TMEPAI的持续高表达需要 TGF-β的刺激,EGF能够协同 TGF-β共同调节诱导 TMEPAI的表达[29].本实验室近期研究发现 TMEPAI蛋白在细胞内定位于溶酶体和晚期内吞体,并能够通过促进 TGF-β受体(TβR)的溶酶体降解负调控 TGF-β信号[22].
鉴于 TMEPAI是溶酶体膜相关蛋白并且在癌细胞中高表达,那么其功能是否可以增加溶酶体的稳定性,从而增强癌细胞的抗凋亡能力.基于此猜想,本研究拟构建稳定表达 TMEPAI细胞株,通过 MTT法、流式细胞技术和免疫荧光技术研究细胞内TMEPAI蛋白表达对溶酶体稳定性的影响,为探索TMEPAI在肿瘤细胞发生中的作用提供理论依据.
1 材料与方法
1.1 材料
1.1.1 菌种、细胞及质粒
大肠杆菌(E.coli)TOP10、肺癌细胞 A549及质粒pEF-IRES-puro 均为本实验室保存.
1.1.2 主要试剂
Taq DNA 聚合酶、T4 DNA连接酶、限制性内切酶、DAN marker、蛋白 预染 marker,Fermentas 公司;质粒小提试剂盒、DNA纯化回收试剂盒、胶回收试剂盒,上海生工生物工程有限公司;LipofectamineTM2000、Alexa Fluor®555 goat anti-rabbit IgG、Alexa Fluor®488 donkey anti-mouse IgG、Alexa Fluor®680 goat anti-rabbit IgG,Invitrogen公司;细胞完全培养基F-12K、胰酶、胎牛血清、DPBS,GIBIO公司;Flag抗体、嘌呤霉素(puromycin)、吖啶橙(acridine orange,AO)、DNA 染料(hoechst 33342),Sigma 公司;TMEPAI抗体为本实验室纯化所得;LAMP2抗体,Abcam公司;Rab7抗体,Santa Cruz 公司;β-actin抗体,天津三箭生物技术有限公司;引物合成和基因测序由北京华大基因公司完成.
1.2 方法
1.2.1 pEF-IRES-TMEPAI-Flag重组载体的构建与鉴定
根据目的基因 TMEPAI的核酸序列和表达载体pEF-IRES-puro 的多克隆位点,设计扩增目的基因的引物,其中上、下游引物 P1、P2分别添加 AflⅡ和XbaⅠ的酶切位点(下划线标示).P1∶5'-CGCGCTT AAG ATGCACCGCTTGATGGG-3';P2∶5'-CTGTCT AGACTACTTGTCGTCATCGTCTTTGTAGTCGCTC GAGAGAGGGTGTCCTTTCTGTTTATCC-3'.以实验室保存的重组质粒 pEGFP-N3-TMEPAI为模板进行PCR扩增得到 TMEPAI基因片段.真核表达载体pEF-IRES-puro以及 TMEPAI基因纯化产物经 AflⅡ和XbaⅠ双酶切后纯化回收.酶切产物经T4,DNA连接酶连接并转化大肠杆菌 TOP10,挑取单克隆菌落进行培养并提取质粒后,经AflⅡ和XbaⅠ酶切及PCR鉴定为阳性的重组质粒,进一步测序鉴定.
1.2.2 稳转细胞系的建立
最适嘌呤霉素筛选浓度的确定:在 6孔板中接种适量A549细胞,37,℃、5%,CO2条件下培养细胞生长至 80%~90%,,更换含有不同浓度嘌呤霉素(0~2,μg/mL)的培养基继续培养.每天镜下观察,隔天更换含有嘌呤霉素新鲜培养液.培养3~5,d后,导致细胞全部死亡的嘌呤霉素最低浓度为最低致死浓度,即最适嘌呤霉素筛选浓度(一般以4,d完全致死为准).
稳定细胞系的建立:在 100,mm 培养皿中接种适量细胞,37,℃、5%,CO2条件下培养细胞生长至70%~80%,时,利用LipofectamineTM2000将重组质粒转染A549细胞,24,h后更换含有最适嘌呤霉素筛选浓度的新鲜培养液.每天更换含有筛选浓度嘌呤霉素的新鲜培养液进行培养.待单克隆长至肉眼可见时,将单克隆挑起并转移至新的培养皿继续培养,收集细胞,免疫印迹实验(Western blot)检测稳定细胞系是否建立成功.
1.2.3 免疫印迹实验检测TMEPAI蛋白的表达
收集对数生长期的单克隆细胞,加入适量 RIPA裂解缓冲液(50,mmol/L,Tris-HCl(pH,7.4),150,mmol/L NaCl,1%,Triton X-100)(含蛋白酶抑制剂)在冰上裂解 30,min,离心收集上清加入 SDS上样缓冲液,经12%,SDS-PAGE分离后转至 PVDF膜上,5%,的脱脂奶粉室温封闭 1,h,于 4,℃下进行一抗(TMEPAI 1∶500、β-actin 1∶2,000)孵育过夜,PBST洗膜后再与二抗孵育2,h后,PVDF膜在Odyssey红外激光成像系统下扫描成像.
1.2.4 免疫荧光法检测TMEPAI在细胞中定位
将适量细胞接种于已预先放置无菌细胞爬片的30,mm 培养皿中,待细胞生长至约 70%,,取出细胞爬片用预冷的甲醇-20,℃固定 5,min,DPBS洗涤 1次后一抗(Flag 1∶100、LAMP2 1∶200、Rab7 1∶100)室温孵育 3,h,DPBS洗涤 3次后二抗(Alexa Fluor®555,goat anti-rabbit IgG 1 ∶ 200 、Alexa Fluor®488 donkey anti-mouse IgG 1∶200、hoechst 33342 10,μg/mL)室温孵育 30,min,共聚焦荧光显微镜下观察拍照.
1.2.5 MTT法检测细胞增殖
实验设置实验组与对照组,每组设 6个复孔.96孔板每孔接种 5,000个细胞.待细胞贴壁后,分别加入 0、1、2、4、8、16、32、64、128,μmol/L 氯喹.处理48,h后,每孔加入20,μL MTT溶液(5,mg/mL),继续培养 4,h后,小心吸去孔内培养液.每孔加入 200,μL二甲基亚砜(DMSO),置摇床上低速振荡 10,min,使结晶物充分溶解,酶标仪测定490,nm处吸光度.
1.2.6 吖啶橙(AO)染色分析过表达TMEPAI对溶酶体稳定性的影响
荧光显微镜分析:将适量对数期的细胞接种于放有细胞爬片的30,mm培养皿中,培养24,h后,DPBS洗涤2次,加入含有2,µmol/L AO的DPBS,于37,℃孵育 15,min,DPBS洗涤 3次,细胞爬片在荧光显微镜下观察拍照.
流式细胞术分析:将适量细胞接种于 60,mm培养皿中培养 24,h后,胰酶消化细胞,收集 1×106个细胞于DPBS中,加入2,µmol/L AO,于37,℃避光孵育15,min.流式细胞仪检测红色荧光强度.
1.3 统计学分析
应用 SPSS软件进行数据的整理分析,采用 t检验进行组间比较,检验结果P<0.05表示差异有统计学意义,*、**和***分别表示与对照组比较 P<0.05、P<0.01和P<0.001.
2 结果与分析
2.1 重组质粒pEF-IRES-TMEPAI-Flag的构建
以本实验室构建的 pEGFP-N3-TMEPAI重组载体为模版,利用引物 P1、P2,定向扩增目的片段(图1(a)).PCR产物经双酶切纯化后连接,转化 E.coli TOP10宿主菌.挑取 Amp+抗性阳性克隆菌培养,提取质粒后进行 PCR检测(图 1(b)),在 913,bp处有明显条带,与 TMEPAI目的基因大小一致.进一步将重组质粒进行双酶切鉴定(图 1(c)),结果大小分别为载体片段 5,700,bp和目的片段 913,bp.基因测序结果显示,目的基因与 GenBank中 TMEPAI基因序列(GenBank No.NM_020182.4)完全一致.以上结果表明,重组质粒pEF-IRES-TMEPAI-Flag构建成功.
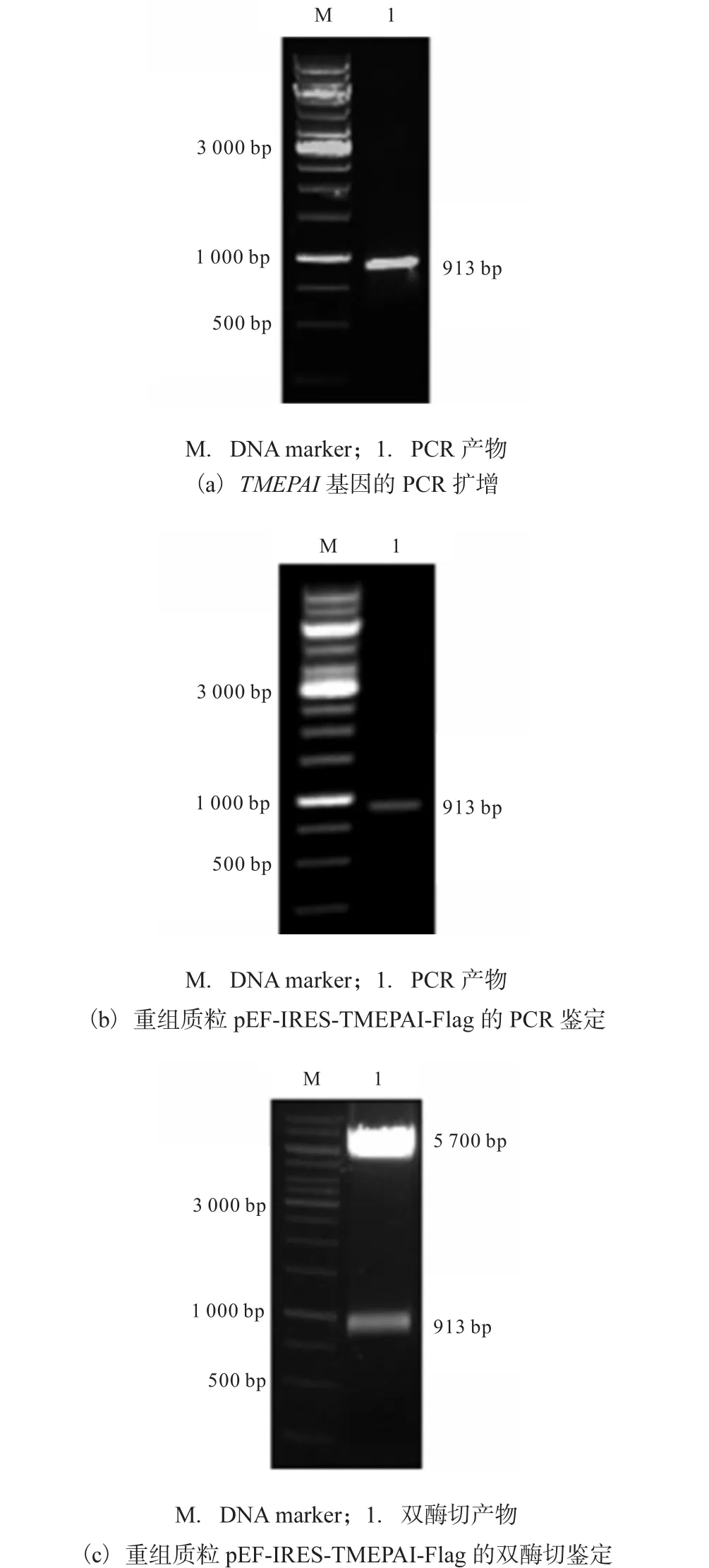
图1 重组质粒pEF-IRES-TMEPAI-Flag的构建和鉴定Fig. 1 Construction and identification of the recombinant plasmid pEF-IRES-TMEPAI-Flag
2.2 稳定表达TMEPAI细胞株的构建及鉴定
稳定细胞株构建实验筛选获得 2个空载体对照的细胞株,分别为 pEF-IRES-puroⅠ、pEF-IRES-puroⅡ;3个稳定表达 TMEPAI-Flag的细胞株,分别为TMEPAI-FlagⅠ、TMEPAI-FlagⅡ、TMEPAI-FlagⅢ.采用Western blot检测稳定株TMEPAI蛋白表达,结果如图 2所示,其中 A549为正常 A549细胞;pEFIRES-puroⅠ/Ⅱ为空载体对照组;TMEPAI-FlagⅠ/Ⅱ/Ⅲ为稳定表达 TMEPAI-Flag的 A549细胞株.正常的 A549细胞与空载体对照组的 A549细胞中TMEPAI的表达量较低,而稳定表达 TMEPAI-Flag的A549细胞中TMEPAI蛋白水平显著提高.由此表明,稳定表达TMEPAI的A549细胞株构建成功,其中 TMEPAI-FlagⅢ表达量最高,因此选用该稳定株进行后续实验.

图2 Western blot 检测稳定细胞株TMEPAI表达Fig. 2 Detection of the expression of TMEPAI in stable cell lines by Western blot
采用免疫荧光法检测构建的 A549稳定细胞株中TMEPAI的定位情况.如图3所示,在稳定细胞株中,TMEPAI与 LAMP2(溶酶体 marker)有明显共定位,与 Rab7(晚期内吞体 marker)有部分共定位,由此进一步证明,成功构建稳定表达 TMEPAI-Flag的A549细胞株.
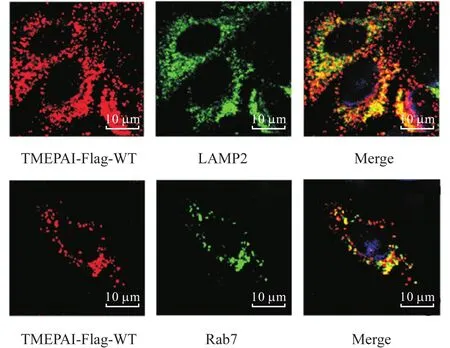
图3 稳定细胞株中TMEPAI的定位Fig. 3 TMEPAI localization in stable cell lines
2.3 TMEPAI过表达对溶酶体稳定性的影响
氯喹是一种溶酶体抑制剂,通过升高溶酶体腔内pH使溶酶体膨大,并引起溶酶体通透化,从而抑制溶酶体功能[30].利用不同浓度的氯喹处理稳定细胞株,观察TMEPAI表达对溶酶体稳定性的影响,结果如图4所示.随着氯喹处理细胞的浓度增加,48,h后正常 A549细胞的存活率逐渐降低,32,μmol/L时细胞基本完全死亡.而稳定细胞株在氯喹处理浓度32,μmol/L 时仍有细胞存活.由此说明,过表达TMEPAI可以增加溶酶体对氯喹的耐受性,使溶酶体稳定性增强.
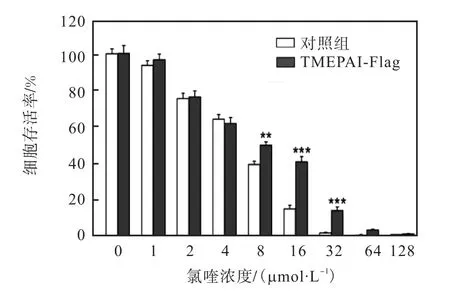
图4 MTT检测过表达TMEPAI对溶酶体稳定性的影响Fig. 4 Effect of TMEPAI expression on the lysosome stability by MTT assay
2.4 吖啶橙染色分析过表达 TMEPAI对溶酶体稳定性的影响
吖啶橙(AO)是一种溶酶体异质性荧光染料,可透过细胞膜进入溶酶体内,细胞内不同区域的 pH影响AO分布的浓度,即pH低时AO浓度高,而pH高时AO浓度低.当用紫外光激发时,AO在高浓度(当其存在于溶酶体内)下显示橘红色荧光,而在低浓度(当其存在于细胞质和细胞核中)下显示绿色荧光[31].因此,AO染色的细胞内橘红色荧光强度越强,说明溶酶体越稳定,分别通过荧光显微镜以及流式细胞技术分析细胞内红色荧光的强度.
利用荧光显微镜观察 AO在稳定表达 TMEPAI细胞株内的分布情况,结果如图 5所示.与对照组相比,稳定细胞株(TMEPA1-FlagⅢ)的红色荧光较强,说明过表达 TMEPAI后,溶酶体的稳定性增强,即TMEPAI增加了溶酶体的稳定性.
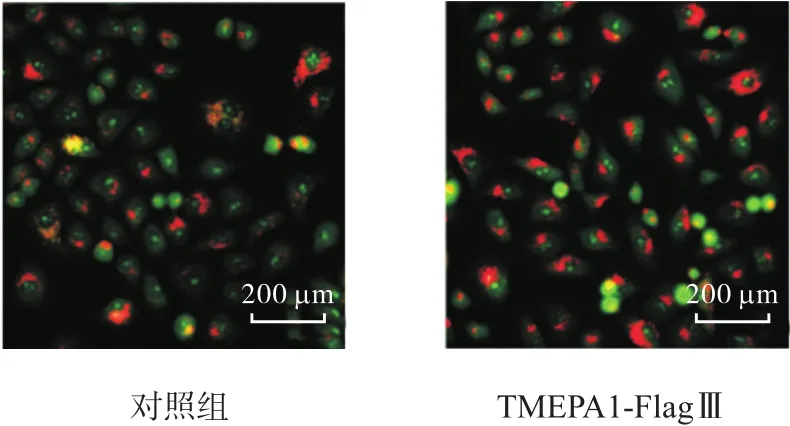
图5 AO染色检测TMEPAI表达对溶酶体稳定性的影响Fig. 5 Effect of TMEPAI expression on the lysosome stability by AO staining
采用流式细胞技术对AO染色进行定量分析,结果如图 6所示.对照组高于红色荧光阈值(溶酶体阳性)的细胞数为 73.8%,,实验组(TMEPA1-FlagⅢ)的细胞数为 92.7%,较对照组增加了 18.9%.这说明过表达TMEPAI后,细胞内的红色荧光强度增强,溶酶体的稳定性增强.
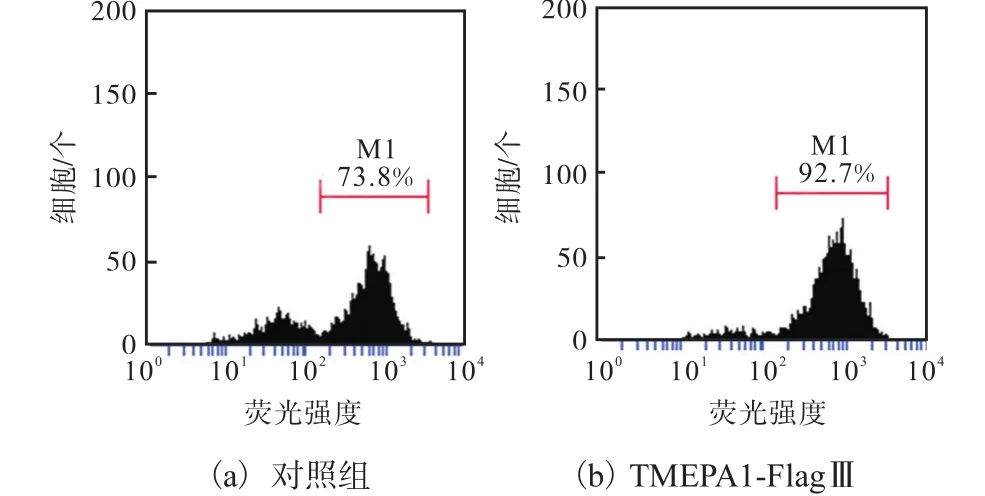
图6 流式细胞技术分析过表达 TMEPAI对溶酶体稳定性的影响Fig. 6 Impact of TMEPAI expression on the lysosome stability by flow cytometry assay
3 讨 论
溶酶体结构和功能的完整性需要溶酶体膜蛋白以及腔内水解酶的共同调节,溶酶体膜蛋白主要负责调节内腔 pH、胞质蛋白的膜融合以及降解产物的外排.越来越多的研究表明,溶酶体蛋白通过溶酶体调控一系列细胞生理过程,如溶酶体跨膜蛋白LAPTM4B能够维持溶酶体膜腔 pH,增强溶酶体的稳定性[30];转录因子 EB(transcription factor EB,TFEB)能够酸化溶酶体内腔,促进水解酶的运输以及自噬体与溶酶体的融合[32-33].TMEPAI是溶酶体定位蛋白质[22],本实验室前期研究发现 TMEPAI能够增强溶酶体的稳定性,抵抗药物刺激(etoposide)引起的溶酶体通透化(lysosomal membrane permeabilization,LMP)[34].溶酶体的通透化会使腔内H+以及酸性水解酶释放到胞质中,导致细胞内pH失衡以及细胞器损伤.通过 konckdown实验证明了干扰 TMEPAI表达能降低溶酶体膜的稳定性,与本文的结果一致,证明了TMEPAI表达能增加溶酶体膜的稳定性.
对于活细胞来说,溶酶体内高浓度的水解酶为其发挥功能起到重要作用,但它的不稳定可能会给自身带来潜在的危害.一旦溶酶体膜被破坏,将导致其内部水解酶释放至细胞质,造成溶酶体通透化,引起无法控制的细胞内容物降解.同时,大量的溶酶体膜破裂可引起细胞内酸化,从而导致细胞死亡.此外,溶酶体通透化可能与活性氧(ROS)有关,溶酶体去稳定化已被认为是由氧化应激引起的细胞损伤所造成的[35],并且 ROS可诱导溶酶体泄漏[36].本文通过构建稳定表达 TMEPAI细胞株,研究发现 TMEPAI表达能增加溶酶体膜的稳定性.Hu等[37]研究表明TMEPAI与ROS有关,由此推测TMEPAI可能通过抑制 ROS增加溶酶体稳定性.Kirkegaard等[38]发现热休克蛋白 70(Hsp70)通过调节鞘磷脂代谢增加溶酶体膜的稳定性.TMEPAI表达增加溶酶体膜的稳定性可能增强了癌细胞的抗凋亡能力,实验也表明过表达 TMEPAI可以抵抗氯喹对肺癌细胞 A549杀伤作用.因此,TMEPAI可能成为抗癌的潜在药物靶点.
4 结 语
本研究成功构建了 pEF-IRES-TMEPAI-Flag表达载体,并建立了稳定表达TMEPAI的细胞株,且证实了 TMEPAI蛋白在溶酶体表达.同时,发现TMEPAI表达可以增强溶酶体的稳定性.
参考文献:
[1] de Duve C. The lysosome turns fifty[J]. Nature Cell Biology,2005,7(9):847-849.
[2] Mullins C,Bonifacino J S. The molecular machinery for lysosome biogenesis[J]. Bioessays,2001,23(4):333-343.
[3] Jaattela M,Tschopp J. Caspase-independent cell death in T lymphocytes[J]. Nature Immunology,2003,4(5):416-423.
[4] Ferri K F,Kroemer G. Organelle-specific initiation of cell death pathways[J]. Nature Cell Biology,2001,3(11):255-263.
[5] Guicciardi M E,Deussing J,Miyoshi H,et al. Cathepsin B contributes to TNF-alpha-mediated hepatocyte apoptosis by promoting mitochondrial release of cytochrome C[J]. Journal of Clinical Investigation,2000,106(9):1127-1137.
[6] Foghsgaard L,Wissing D,Mauch D,et al. Cathepsin B acts as a dominant execution protease in tumor cell apoptosis induced by tumor necrosis factor[J]. Journal of Cell Biology,2001,153(5):999-1010.
[7] Brunk U T,Svensson I. Oxidative stress,growth factor starvation and Fas activation may all cause apoptosis through lysosomal leak[J]. Redox Report,1999,4(1/2):3-11.
[8] Yuan X M,Li W,Dalen H,et al. Lysosomal destabilization in p53-induced apoptosis[J]. Proceedings of the National Academy of Sciences of the United States of America,2002,99(9):6286-6291.
[9] Broker L E,Huisman C,Span S W,et al. Cathepsin B mediates caspase-independent cell death induced by microtubule stabilizing agents in non-small cell lung cancer cells[J]. Cancer Research,2004,64(1):27-30.
[10] Brunk U T,Dalen H,Roberg K,et al. Photo-oxidative disruption of lysosomal membranes causes apoptosis of cultured human fibroblasts[J]. Free Radical Biology &Medicine,1997,23(4):616-626.
[11] Bidere N,Lorenzo H K,Carmona S,et al. Cathepsin D triggers Bax activation,resulting in selective apoptosisinducing factor(AIF)relocation in T lymphocytes entering the early commitment phase to apoptosis[J].Journal of Biological Chemistry,2003,278(33):31401-31411.
[12] Boya P,Andreau K,Poncet D,et al. Lysosomal membrane permeabilization induces cell death in a mitochondrion-dependent fashion[J]. Journal of Experimental Medicine,2003,197(10):1323-1334.
[13] Roberg K,Kagedal K,Ollinger K. Microinjection of cathepsin D induces caspase-dependent apoptosis in fibroblasts[J]. American Journal of Pathology,2002,161(1):89-96.
[14] Vancompernolle K,Van Herreweghe F,Pynaert G,et al.Atractyloside-induced release of cathepsin B,a protease with caspase-processing activity[J]. FEBS Letters,1998,438(3):150-158.
[15] Zhang L,Sheng R,Qin Z. The lysosome and neurodegenerative diseases[J]. Acta Biochimica et Biophysica Sinica,2009,41(6):437-445.
[16] Kornfeld S,Mellman I. The biogenesis of lysosomes[J].Annual Review of Cell Biology,1989,5:483-525.
[17] Fukuda M. Lysosomal membrane glycoproteins.Structure,biosynthesis,and intracellular trafficking[J].Journal of Biological Chemistry,1991,266(32):21327-21330.
[18] Eskelinen E L. Roles of LAMP-1 and LAMP-2 in lysosome biogenesis and autophagy[J]. Molecular Aspects of Medicine,2006,27(5/6):495-502.
[19] Xu L L,Shanmugam N,Segawa T,et al. A novel androgen-regulated gene,PMEPA1,located on chromosome 20q13 exhibits high level expression in prostate[J].Genomics,2000,66(3):257-263.
[20] Tanner M M,Tirkkonen M,Kallioniemi A,et al.Increased copy number at 20q13 in breast cancer:Defining the critical region and exclusion of candidate genes[J]. Cancer Research,1994,54(16):4257-4260.
[21] Hirokawa Y S,Takagi A,Uchida K,et al. High level expression of STAG1/PMEPA1 in an androgenindependent prostate cancer PC3 subclone[J]. Cellular &Molecular Biology Letters,2007,12(3):370-377.
[22] Bai X,Jing L,Li Y,et al. TMEPAI inhibits TGF-beta signaling by promoting lysosome degradation of TGF-beta receptor and contributes to lung cancer development[J]. Cellular Signalling,2014,26(9):2030-2039.
[23] Wang L. TGFbeta induces a pro-bone metastasis program in prostate cancer[J]. Cancer Discovery,2015,5(7):23.
[24] Hidaka S,Yasutake T,Takeshita H,et al. Differences in 20q13. 2 copy number between colorectal cancers with and without liver metastasis[J]. Clinical Cancer Research,2000,6(7):2712-2717.
[25] Ishkanian A S,Mallof C A,Ho J,et al. High-resolution array CGH identifies novel regions of genomic alteration in intermediate-risk prostate cancer[J]. Prostate,2009,69(10):1091-1100.
[26] Brunschwig E B,Wilson K,Mack D,et al. PMEPA1,a transforming growth factor-beta-induced marker of terminal colonocyte differentiation whose expression is maintained in primary and metastatic colon cancer[J].Cancer Research,2003,63(7):1568-1575.
[27] Reichling T,Goss K H,Carson D J,et al. Transcriptional profiles of intestinal tumors in Apc(Min)mice are unique from those of embryonic intestine and identify novel gene targets dysregulated in human colorectal tumors[J].Cancer Research,2005,65(1):166-176.
[28] Rae F K,Hooper J D,Nicol D L,et al. Characterization of a novel gene,STAG1/PMEPA1,upregulated in renal cell carcinoma and other solid tumors[J]. Molecular Carcinogenesis,2001,32(1):44-53.
[29] Azami S,Vo Nguyen T T,Watanabe Y,et al. Cooperative induction of transmembrane prostate androgen induced protein TMEPAI/PMEPA1 by transforming growth factor-beta and epidermal growth factor signaling[J]. Biochemical & Biophysical Research Communications,2015,456(2):580-585.
[30] Li Y,Zhang Q,Tian R,et al. Lysosomal transmembrane protein LAPTM4B promotes autophagy and tolerance to metabolic stress in cancer cells[J]. Cancer Research,2011,71(24):7481-7489.
[31] Vanderlinden E,Vanstreels E,Boons E,et al. Intracytoplasmic trapping of influenza virus by a lipophilic derivative of aglycoristocetin[J]. Journal of Virology,2012,86(17):9416-9431.
[32] Settembre C,Fraldi A,Medina D L,et al. Signals from the lysosome:A control centre for cellular clearance and energy metabolism[J]. Nature Reviews Molecular Cell Biology,2013,14(5):283-296.
[33] Zhou J,Tan S H,Nicolas V,et al. Activation of lysosomal function in the course of autophagy via mTORC1 suppression and autophagosome-lysosome fusion[J]. Cell Research,2013,23(4):508-523.
[34] Luo S,Yang M,Lv D,et al. TMEPAI increases lysosome stability and promotes autophagy[J]. The International Journal of Biochemistry & Cell Biology,2016,76:98-106.
[35] Zdolsek J,Zhang H,Roberg K,et al. H2O2-mediated damage to lysosomal membranes of J-774 cells[J]. Free Radical Research Communications,1993,18(2):71-85.
[36] Antunes F,Cadenas E,Brunk U T. Apoptosis induced by exposure to a low steady-state concentration of H2O2is a consequence of lysosomal rupture[J]. Biochemical Journal,2001,356(2):549-555.
[37] Hu Y,He K,Wang D,et al. TMEPAI regulates EMT in lung cancer cells by modulating the ROS and IRS-1 signaling pathways[J]. Carcinogenesis,2013,34(8):1764-1772.
[38] Kirkegaard T,Roth A G,Petersen NH,et al. Hsp70 stabilizes lysosomes and reverts Niemann-Pick diseaseassociated lysosomal pathology[J]. Nature,2010,463(7280):549-553.

