海藻不同方法提取物体外抗病毒活性研究*
陈亚乔,侯 林,崔清华,刘相文,袁 琦,田景振山东中医药大学药学院,山东 济南 250355
海藻是海产藻类的统称,为马尾藻科植物海蒿子Sargassumpallidum(Turn.)C.Ag或羊栖菜Sargassum fusiforme(Harv.)Setch的干燥藻体,性苦、寒、咸,具有消痰,软坚散结,利水消肿的功效[1]。相关研究表明[2-6],海藻具有抗肿瘤、抗病毒、抗菌、抗氧化以及免疫调节等作用。海藻提取物有抑制单纯疱疹病毒1型(HSV-1)和柯萨奇病毒B3(COXB3)的作用,本研究在文献研究的基础上,增加对呼吸道合胞病毒(RSV)、柯萨奇病毒(COXB5)、肠道病毒71型(EV71)抗病毒活性研究,以进一步了解海藻的抗病毒谱,现将结果报道如下:
1 材料与方法
1.1 药品 海藻药材(购买于济南建联中药店,经山东中医药大学徐凌川教授鉴定为马尾藻科植物海蒿子的干燥藻体);利巴韦林注射液(山东鲁抗辰欣药业有限公司,批号:1410206811);阿昔洛韦注射液(亚宝药业制药有限公司,批号:15062005)。
1.2 宿主细胞及病毒毒种 RSV、HSV-Ⅰ、COXB5、EV71由山东省医学科学院基础医学研究所提供;人喉癌上皮细胞(Hep2)、横纹肌瘤细胞(RD)由山东省医学科学院基础医学研究所提供,由山东中医药大学B201泰山学者工作室保存。
1.3 主要试剂 1640细胞培养液(美国HyClone公司,批号:AAJ207653),含 10%新生牛血清及100 U/mL青霉素和链霉素,过滤除菌,分装置4℃备用;新生牛血清(浙江天杭生物科技有限公司,批号:141013);PBS磷酸盐缓冲液(美国HyClone公司,批号:AAK2-8442);EDTA-0.25%胰酶(美国Gibco 公司,批号:1737903);4,5- 二甲基噻唑 -2,5-二苯基四唑溴化物(MTT,Sigma公司);乙醇、丙酮均为分析纯。
1.4 仪器 HF90型CO2恒温培养箱(上海力申科学仪器有限公司);CKX-31型倒置显微镜(Olympus公司);HFsafe-1200TE型生物安全柜(上海力申科学仪器有限公司);DW-86L286型-80℃冰箱(海尔公司产品);Spectra Max M5型酶标仪(Molecular Device)。
1.5 方法
1.5.1 供试品溶液的制备
1.5.1.1 水回流提取 将海藻原药材粉碎,烘干至恒重,称取40目粉末10.0 g,加入100 mL蒸馏水,回流提取2小时,滤掉药渣,取滤液,用离心机3 000 r/min离心15分钟。取上清液抽滤,浓缩至20 mL,水浴蒸干,然后转至减压干燥机完全干燥得干浸膏,用5%二甲基亚砜(DMSO)配成浓度为0.01 g/mL的溶液,摇匀,用0.22 μm的微孔滤膜过滤除菌,存于1.5 mL EP管中,即为海藻水提物供试品溶液。
1.5.1.2 75%乙醇回流提取 将海藻原药材粉碎,烘干至恒重,称取60目粉末10.0 g,加入100mL 75%乙醇,之后处理步骤同“1.5.1.1”项下方法,即得海藻醇提物供试品溶液。
1.5.1.3 75%乙醇超声提取 将海藻原药材粉碎,烘干至恒重,称取60目粉末10.0 g,加入100 mL 75%乙醇,常温下超声提取30分钟,之后处理步骤同“1.5.1.1”项下方法,即得海藻醇超声供试品溶液。
1.5.1.4 丙酮冷浸提取 将海藻原药材粉碎,烘干至恒重,称取60目粉末10.0 g,加入100 mL丙酮,密封避光冷浸处理7天,滤掉药渣,取滤液,用离心机3 000 r/min离心15分钟。之后步骤同“1.5.1.1”项下方法,即得海藻丙酮供试品溶液。
1.5.2 病毒毒力的测定 将对数生长期的细胞消化并调整浓度为 1×105个 /mL,每孔 100 μL接种于96孔板,24小时后长成单层,弃培养液,依次加入经10倍系列稀释的待测病毒液100 μL,每浓度重复4孔,同时设细胞对照。37℃、5%CO2培养箱中培养,倒置显微镜下观察24小时,各孔加5 mg/mL MTT 10 μL,37℃、5%CO2培养箱中培养 4小时后,吸弃染液,加DMSO 100 μL,室温脱色l0分钟,震荡6分钟,酶标仪在490 nm波长下测定OD值。根据Reed-Muench公式计算病毒液的半数感染浓度(TCID50)。
细胞存活率=各组OD值/正常细胞OD值×100%
细胞比距=(高于50%病变率-50%)/(高于50%病变率-低于50%病率)×100%
TCID50=Antilg(Ig高于50%CPE百分率病毒稀释度+比距×稀释因子对数)
1.5.3 待测药物的细胞毒作用 将对数生长期的细胞消化并调整浓度为1×105个/mL,每孔100 μL接种于96孔板,24小时后长成单层,弃培养液,待测药物用1640维持液按2倍比稀释10个浓度梯度,依次接种于己经长成单层的细胞96孔板中,每浓度3个复孔,并设空白对照孔及细胞对照孔;37℃、5%CO2培养箱中培养,24小时后观察细胞病变程度,找到药物的最大无毒浓度(TC0)。MTT染色,用酶标仪在490 nm波长测定OD值,应用Reed-Muench公式计算药物半数中毒浓度(TC50)及TC0,C为供试品初始浓度。
TC50=[Antilog(log高于50%CPE百分率病毒稀释度+比距)]×C
1.5.4 海藻提取物体外抗病毒实验方法 将1×105个/mL对数生长期的细胞每孔100 μL接种于96孔板,24小时后长成单层,弃培养液,分别设药物组(100 μL 药液 +100 μL 病毒液)、细胞对照组(200μL维持液)、病毒对照组 (100μL维持液+100 μL 病毒液)、空白对照组(无细胞,100 μL 药液+100 μL病毒液),药物组将药物从最大无毒浓度开始2倍比系列稀释11个浓度,每个浓度重复3组,按每孔100 μL依次加入到96孔板中,随后加入含100个TCID50的病毒液100 μL,混合均匀。37℃、5%CO2培养箱培养,待病毒对照组细胞出现90%及以上病变时采用CPE法记录药物抑毒情况,随后MTT法测定每孔OD值,应用Reed-Muench公式计算药物半数有效浓度EC50及治疗指数(TI),C为供试品初始浓度。
EC50=[Antilog(高于50%CPE百分率病毒稀释度的值-比距)]×C
治疗指数(TI)=半数毒性浓度(TC50)/半数有效浓度(EC50)
2 结果
一般认为TI值≥2,证明药物有抗病毒活性,TI值≥4,其抗病毒成分有研究价值。本研究结果表明,海藻4种方法提取物对RSV有不同程度的抑制作用,其中水提物抗RSV活性最高,其TI值为413.00,甚至略高于阳性对照药利巴韦林;乙醇回流提取物也有较好的抗RSV病毒作用,TI值为11.63;乙醇超声物和丙酮冷浸物抗RSV活性较弱,TI值分别为3.23和3.78。
有文献报道[7]海藻有抗HSV-1的活性。本研究结果表明,海藻4种提取物均有抗HSV病毒活性,其中水提物的治疗指数为310.83,略低于阳性对照药阿昔洛韦,抗病毒活性较强;其他3种提取物的 TI 值分别为 28.84、4.20、8.06,4 种提取物均有一定的研究价值。
海藻水提、乙醇回流提取、乙醇超声提取3种方法提取物的抗COXB5活性均较弱,乙醇超声提取物活性稍强,TI值为19.97。
本研究结果表明,海藻水提物具有较强的抗EV71活性,治疗指数为176.07,其活性优于阳性药利巴韦林,另外3种提取物无抗EV71活性,见表 1—6。

表1 4种病毒的TCID50
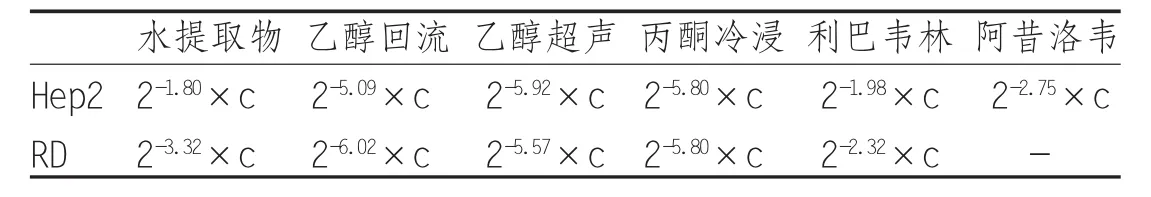
表2 待测药物的细胞毒作用TC50 mg/mL

表3 海藻体外抗RSV实验结果

表4 海藻体外抗HSV-1实验结果

表5 海藻体外抗COXB5实验结果

表6 海藻体外抗EV71实验结果
3 讨论
本实验考察了海藻对4种病毒的抗病毒效果,结果表明,海藻水提物对实验所用4种病毒均有良好的抑制作用。海藻的主要化学成分有糖类、酚类、蛋白质、脂类、萜类、黄酮等[8],本实验水提物采取加热回流提取的方式,其中所含化学成分以糖类居多,有实验表明[9]海藻多糖具有抗HSV-1和COXB3的作用,亦可调节小鼠的免疫功能[10-11]。
本实验对海藻提取物进行了抗病毒活性的初步筛选,为建立海藻抗病毒谱提供依据,进一步研究的主要任务是找出其主要抗病毒作用的物质基础及是否与其他成分相互作用以达到抗病毒效果并确定其抗病毒的作用机制。
海洋是人类的天然宝库,海藻作为海洋天然产物中的一大类,因为其较好的生物多样性而占据优势,而且海藻药理活性丰富,具有很好的研究价值。
[1]国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:295.
[2]许福泉,郭赣林,郭雷.大叶海藻化学成分及药理活性研究进展[J].淮海工学院学报:自然科学版,2011,20(4):90-92.
[3]郭立民.中药海藻海蒿子Sargassum pallidum(Turn.)C.Ag.的抗肿瘤活性成分研究[D].青岛:中国海洋大学,2006.
[4]王长振,丛建波,先宏,等.海藻硫酸多糖的分离纯化及其抗肿瘤作用研究[J].解放军药学学报,2010,26(4):283-286.
[5]孙抗,林江,张婷,等.海藻多糖抗肿瘤机制研究综述[J].广西中医学院学报,2012,15(2):103-105.
[6]牛荣丽,范晓,韩丽君.海藻甲醇提取物免疫调节作用的初步研究[J].中国免疫学杂志,2003,19(10):669-671.
[7]陈红艳.红海藻Bostrychia montagnei中硫酸半乳聚糖体外对HSV复制的抑制作用[J].国外医药:植物药分册,2002,17(3):118.
[8]侯林,孟琳,张晓平,等.海藻化学成分及药理作用研究进展[J].中国保健营养,2013,7(7):91-92.
[9]张颖,岑颖洲,黄日明,等.南海七种海藻多糖的抗病毒活性初步研究[J].病毒学报,2006,22(4):282-285.
[10]魏文青,丛建波,先宏,等.海藻硫酸多糖对小鼠免疫功能的调节作用[J].中国新药杂志,2001,10(9):670-675.
[11]高淑清,单保恩,赵泽贞,等.四种常见海藻水溶性提取液的免疫调节活性[J].癌变·畸变·突变,2004,16(1):36-38.

