玉屏风散加味方中“涤痰”“逐瘀”作用药对对CO PD大鼠肺组织TG F-β1/Smad通路的影响*
席晓蓉,程 羽,羊忠山,赵文娟,潘晶晶,袁嘉丽
云南中医学院,云南 昆明 650500
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种气流受限、进行性发展的肺系慢性疾病[1-2]。气道炎症和气道重塑是关键病变,也是导致患者肺功能及生活质量下降的根本原因[3-4]。转化生长因子β1(TGF-β1)是COPD气道重塑过程中重要的致纤维化细胞因子[5-6],TGF-β1/Smad 信号转导通路激活是气道重塑发生发展的重要机制[7-9]。“涤痰”和“逐瘀”两个作用药对是在前期研究玉屏风散加味方全方基础上进行的拆方研究。三七活血化瘀,对气道重塑血瘀阻滞尤宜;莪术破血散瘀,既入血分,又入气分。二者配伍,协同增效,行血而不伤血,散瘀而不伤正,组成“逐瘀”作用药对;桑白皮、浙贝母、白芥子组成“涤痰”作用的药对。本研究采用被动吸烟加气管内注入脂多糖(LPS)的方法复制COPD大鼠模型,观察有“涤痰”和“逐瘀”作用的两个药对对COPD大鼠肺组织TGF-β1/Smad信号转导通路的影响。
1 材料与方法
1.1 动物及用药 雄性SPF级Wistar大鼠90只,体质量(200±20)g,由四川省达硕生物研究所提供,实验动物合格证号:0017752。桑白皮15 g,浙贝母15 g,白芥子15 g组成“涤痰”作用药对;三七9 g,莪术15 g组成“逐瘀”作用药对,均购自云南鸿翔一心堂药业集团股份有限公司。每克生药加水8 mL煎药3次后取药汁,置于4℃冰箱中保存。灌胃前恢复到常温后按比例稀释使用。按成人每日治疗剂量再根据大鼠体表面积换算为等效剂量,此剂量作为实验药物的低剂量,在此基础上经浓缩获得中、高剂量。药物低、中、高剂量的比例为1∶5∶10。罗红霉素(江苏联环药业有限公司生产,批号:20141201),调制成浓度为5.4 mg/mL备用。
1.2 试剂及仪器 脂多糖(LPS,美国Simga公司生产);TGF-β1ELISA试剂盒(南京森贝伽生物科技有限公司);Smad2/3、Smad7抗体(美国SATA CRUZ公司)。
1.3 方法
1.3.1 动物模型制备及分组 大鼠适应性饲养1周,将90只大鼠随机分为正常组9只,其余81只为造模组。造模组于实验第1、14天腹腔注射10%水合氯醛麻醉后,固定于大鼠解剖台上,暴露颈部,用碘消毒并用75%乙醇脱碘,按照大鼠颈部解剖结构,用1 mL注射器以水平方向15°斜刺入气管,回抽判断刺入后气管内注入0.2 mL的LPS溶液,实验第2~56天(注射LPS当天除外)上午将大鼠置于自制密闭有机玻璃箱内,注入红塔山牌香烟烟雾,每次被动吸烟4支,持续30 min/d,制作COPD模型。正常组大鼠气管内注入等量生理盐水,不予烟熏。造模28天,正常组与造模组各处死1只大鼠,对比可见造模组支气管管腔明显狭窄,支气管纤毛上皮细胞变性、坏死、脱落;支气管周围可见大量炎性细胞浸润;肺泡结构紊乱,肺泡壁变薄或断裂,肺泡腔扩大,融合成肺大泡。将造模组剩余80只大鼠随机分为模型组、罗红霉素组及“涤痰”作用药对低、中、高剂量组和“逐瘀”作用药对低、中、高剂量组,每组10只。实验第29天开始,“逐瘀”作用药对高、中、低剂量组与“涤痰”作用药对高、中、低剂量组及罗红霉素组每日灌胃给药1次,按体质量每200g灌胃2mL,连续给药28天。正常组、模型组给予等量生理盐水灌胃。实验期间模型组大鼠死亡2只,“涤痰”作用中剂量组死亡1只。
1.3.2 指标检测 末次灌胃后24小时取材,无菌操作取肺组织制备肺组织匀浆,于4℃2 000~3 000 r/min离心机离心20分钟后收集上清液,酶联免疫吸附法(ELISA)检测TGF-β1水平。取肺组织进行液氮研磨,收集组织粉末,加蛋白抽提缓冲液500 μL,离心取上清。将此样品加入133 μL 4×SDS 上样缓冲液,100℃3~5 分钟,-80℃保存待用。二喹啉甲酸(BCA)法进行蛋白定量计算上样量,将样品加入预制的SDS-聚丙酰胺凝胶中电泳分离,采用水浴式电印迹将凝胶中的蛋白电转移至硝酸纤维素滤膜(NC膜)上。将膜置于封闭液中过夜,加入一抗,室温缓慢摇动2小时洗膜,加入二抗,室温缓慢摇动1小时洗膜。而后细胞色素氧化酶二氨基联苯胺(DAB)显色、拍照分析,使用凝胶分析软件测定各条带的平均光密度值(OD值),待测蛋白质表达量与β-actin表达量。
1.4 统计学方法 数据采用SPSS 18.0软件进行统计分析,计量资料以(±s)表示,采用单因素方差分析,两两比较方差齐用LSD-t检验,方差不齐用Dunnetts′s T 3检验,检验水准为α=0.05。
2 结果
2.1 “涤痰”及“逐瘀”作用药对对COPD大鼠肺组织TGF-β1的影响 模型组TGF-β1表达水平高于正常组(P<0.05);“涤痰”作用药对低、中剂量组和“逐瘀”作用药对低、中剂量组、罗红霉素组较模型组大鼠TGF-β1表达水平降低(P<0.05),“涤痰”作用药对和“逐瘀”作用药对高剂量组TGF-β1表达水平与模型组比较差异无统计学意义(P>0.05),见表1。
表1 各组大鼠肺组织TGF-β1表达水平(±s) ng/L
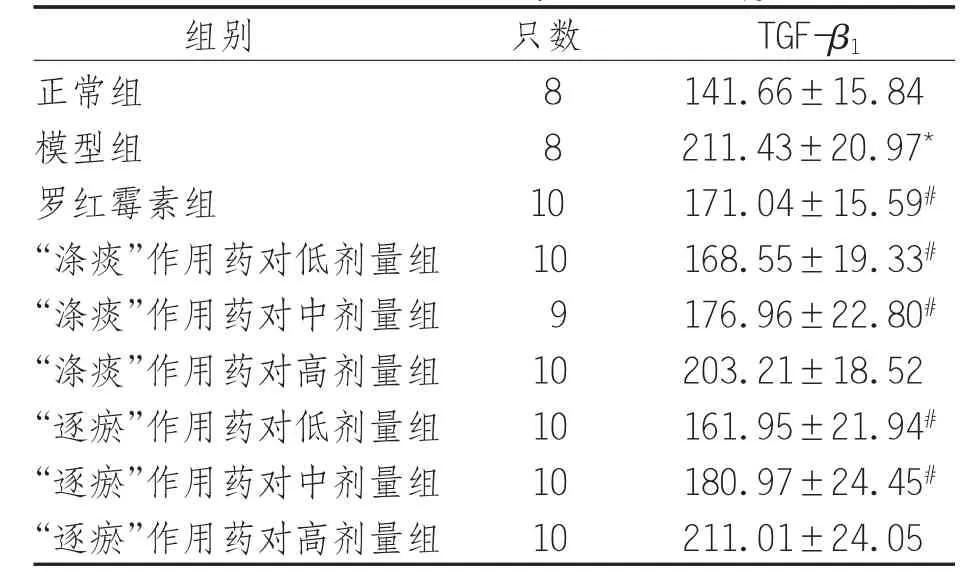
表1 各组大鼠肺组织TGF-β1表达水平(±s) ng/L
注:*表示与正常组比较,P<0.05;#表示与模型组比较,P<0.05
组别 只数 T G F-β 1正常组 8 1 4 1.6 6±1 5.8 4模型组 8 2 1 1.4 3±2 0.9 7*罗红霉素组 1 0 1 7 1.0 4±1 5.5 9#“涤痰”作用药对低剂量组 1 0 1 6 8.5 5±1 9.3 3#“涤痰”作用药对中剂量组 9 1 7 6.9 6±2 2.8 0#“涤痰”作用药对高剂量组 1 0 2 0 3.2 1±1 8.5 2“逐瘀”作用药对低剂量组 1 0 1 6 1.9 5±2 1.9 4#“逐瘀”作用药对中剂量组 1 0 1 8 0.9 7±2 4.4 5#“逐瘀”作用药对高剂量组 1 0 2 1 1.0 1±2 4.0 5
2.2 “涤痰”及“逐瘀”作用药对对COPD大鼠肺组织Smad2/3、Smad7表达的影响 模型组Smad2/3水平较正常组升高(P<0.05);“涤痰”作用药对低剂量组大鼠肺组织中Smad2/3表达低于模型组(P<0.05)。罗红霉素组、“涤痰”作用药对高剂量组及“逐瘀”作用药对低、中、高剂量组大鼠肺组织中Smad2/3表达高于模型组(P<0.05)。模型组大鼠肺组织Smad7水平低于正常组(P<0.05);“涤痰”作用药对高剂量组和“逐瘀”药对低、中、高剂量组Smad7表达水平高于模型组(P<0.05)。罗红霉素组和“涤痰”作用药对低、中剂量组大鼠肺组织中Smad7表达低于模型组(P<0.05),见图1、表2。

图1 各组大鼠肺组织Smad2/3、Smad7蛋白水平的表达
表2 各组大鼠Smad2/3、Smad7的蛋白表达水平(±s)

表2 各组大鼠Smad2/3、Smad7的蛋白表达水平(±s)
注:*表示与正常组比较,P<0.05;#表示与模型组比较,P<0.05
组别 S m a d 2/3 S m a d 7正常组 1.0 0 0±0.0 0 0 1.0 0 0±0.0 0 0模型组 1.2 2 5±0.2 8 8* 0.7 7 3±0.0 0 2*罗红霉素组 2.0 1 0±0.0 4 4#0.2 0 0±0.0 1 3#“涤痰”作用药对低剂量组 0.9 1 0±0.0 1 0#0.8 3 0±0.0 0 7“涤痰”作用药对中剂量组 1.2 0 4±0.0 0 3 0.8 4 6±0.0 1 9“涤痰”作用药对高剂量组 1.6 5 4±0.0 3 8 1.1 2 0±0.0 1 1#“逐瘀”作用药对低剂量组 2.4 0 1±0.0 2 5 1.2 4 3±0.0 1 8#“逐瘀”作用药对中剂量组 2.3 4 7±0.0 6 6 1.1 7 7±0.0 1 2#“逐瘀”作用药对高剂量组 2.6 6 6±0.0 8 3 1.0 5 1±0.0 0 9#
3 讨论
COPD的发生、发展与气道重塑密切相关,成纤维细胞与杯状细胞增生、胶原与氨基聚糖沉积、黏液腺增生肥大均与COPD重塑相关,而TGF-β1参与并调节了这些病理过程[10-11]。Smad2、Smad3 是受体调节型Smads蛋白,为TGF-β1下游调节因子,当TGF-β1与其受体TβR-Ⅱ、TβR-I结合形成复合物,通过磷酸化Smad2/3将信号从胞浆传递入胞核激活转录,促进肺病变。Smad7是抑制型Smads蛋白,在TGF-β1/Smads信号传导通路中起负反馈作用,Smad7表达不足,不能抑制Smads信号转录,从而失去对肺部病变的抑制作用,导致肺功能降低[4]。因此,抑制TGF-β1的产生或(和)活性,拮抗或阻断TGF-β1/Smads信号途径可减缓COPD气道重塑的进展[12-13]。
玉屏风散加味方基于COPD气道重塑“肺气虚衰,痰瘀互结”的病机特点,以“益肺散结”为治则组方而成。黄芪、白术、防风扶正补气益肺;桑白皮、浙贝母、白芥子平喘涤痰散结;生三七、莪术活血逐瘀散结。本研究将全方进行拆方,组成“涤痰”作用和“逐瘀”作用药对,用被动吸烟加气管内注入LPS的方法复制COPD大鼠模型,发现模型大鼠TGF-β1、Smad2/3 表达上调,而 Smad7 表达下调。“涤痰”作用药对低剂量治疗后,肺组织TGF-β1、Smad2/3表达下调;“逐瘀”作用药对低、中剂量治疗后,肺组织TGF-β1表达下调,Smad7表达上调。提示“涤痰”“逐瘀”作用药对可能通过干预TGF-β1/Smads信号转导通路抑制TGF-β1信号的细胞内转导,起到阻断COPD气道重塑的作用。
[1]Kim YI.Chronic obstructive pulmonary disease:respiratory review of 2013[J].Tuberc Respir Dis(Seoul),2014,76(2):53-58.
[2]董敏,王兰娣.穴位贴敷治疗慢性阻塞性肺疾病稳定期临床观察[J].西部中医药,2017,30(3):115-118.
[3]Zhou-Suckow Z,Duerr J,Hagner M,et al.Airway mucus,inflammation and remodeling:emerging links in the pathogenesis of chronic lung diseases[J].Cell Tissue Res,2017,367(3):537-550.
[4]宋一平,崔德建,茅培英,等.慢性阻塞性肺疾病大鼠模型气道重塑病理组织学表现和细胞外基质变化的研究[J].感染、炎症、修复,2000,1(1):51-55.
[5]Postma DS,Timens W.Remodeling in asthma and chronic obstructive pulmonary disease[J].Proc Am Thorac Soc,2006,3(5):434-439.
[6]Brightling CE.Chronicobstructive pulmonary disease phenotypes,biomarkers,and prognostic indicators[J].Allergy Asthma Proc,2016,37(6):432-438.
[7]杨彦伟,王培东,黄文通,等.益气健脾化痰方治疗COPD稳定期临床观察及对血清 TGF-β1、b-FGF的影响[J].四川中医,2016,34(4):72-75.
[8]Li Y,Li JS,Li WW,et al.Long-term effects of three Tiao-Bu Fei-Shen therapies on NF-κB/TGF-β1/Smad2 signaling in rats with chronic obstructive pulmonary disease[J].BMC Complement Altern Med,2014,14(1):140.
[9]Suzuki H,Yagi K,Kondo M,et al.c-Skiinhibits the TGF-beta signaling pathway through stabilization ofinactive Smad complexeson Smad-binding elements[J].Oncogene,2004,23(29):5068-5076.
[10]邓虎,王晓旭,毛相裕,等.TGF-β1/Smads信号转导通路在慢性阻塞性肺疾病中的研究进展[J].世界中西医结合杂志,2014,9(12):1350-1354.
[11]蔡婷婷,许浦生.慢性阻塞性肺疾病患者痰中IL-17、TGF-β1、IL-10水平与肺功能、生活质量的关系[J].热带医学杂志,2014,14(8):1017-1020.
[12]管频,陈娟,冯光球,等.COPD患者肺组织中Smad蛋白、TGF-β1表达与气道重塑的关系[J].海南医学,2014,25(12):1720-1722.
[13]Yang YC,Zhang N,Van Crombruggen K,et al.Transforming growth factor-beta1 in inflammatory airway disease:a key forunder standing inflammation and remodeling[J].Allergy,2012,67(10):1193-1202.

