蝎毒多肽干预CML K562细胞Hedgehog通路上游活化因子的分子机制研究
张伟锋,杨文华
蝎毒多肽提取物(PESV)是中药全蝎的有效成分[1]。前期研究表明,PESV可以抑制小鼠白血病细胞的生长、诱导白血病细胞凋亡,并能降低白血病细胞的黏附能力,从而抑制白血病的进展[2],但其具体的作用机制与靶点尚未清晰。Hedgehog(Hh)信号通路主要存在于人类胚胎发育时期,随着年龄的增长逐渐失去活性[3]。近年来研究表明,肿瘤的发生与Hh通路的再次活化密切相关,Hh通路的活化可能导致肝癌、胃癌、乳腺癌等多种肿瘤的发生[4-5]。其在白血病的发病中亦起重要作用,Irvine等[6]研究表明,Hh通路与慢性粒细胞白血病(CML)的发病相关,Hh通路抑制剂可以通过靶向CML干/祖细胞,提高CML的治疗反应。本研究旨在为进一步探讨PESV是否可以通过调控Hh通路的活化来达到抑制CML的作用。
1 资料与方法
1.1 一般资料 (1)主要试剂。RPMI 1640、FBS(美国Gibco公司),Trizol kit、PCR试剂盒及SYBR Green荧光燃料MIX(美国Invitrogen公司),反转录试剂盒RevertAid First Strand cDNA Synthesis Kit(美国MBI公司),兔抗人Shh抗体、兔抗人Smo抗体及兔抗人Ptch抗体(武汉博士德公司),β-actin单克隆抗体(Santa Cruz,USA),HRP标记的二抗试剂盒(北京博奥森生物公司),PVDF膜(孔径为0.22 μm,美国Millipore公司),医用X射线胶片(美国柯达公司)。引物序列,Shh:上游5′-TGCTAGGGATCGGTGGATAG-3′,下游 5′-ACAAGT⁃CAGCCCAGAGGAGA-3′;Smo:上 游 5′-TGGT⁃CACTCCCCTTTGTCGTCAC-3′,下游5′-GCACGGTATCGG⁃TAGTTCTTGTAGC-3′;Ptch:上 游 5′-TTCCAGTTAAT⁃GACTCCCAAGCAAATG-3′,下游 5′-GCGACACTCTGAT⁃GAACCACCTC-3′;β-actin:上游 5′-CGTGCTGCTGACC⁃GAGG-3′,下游5′-GAAGGTCTCAAACATGATCTGGGT-3′。(2)主要仪器。培养瓶、96孔培养板(Corning Incorporated)、超净工作台(苏净集团)、5%CO2恒温培养箱(Thermo Forma)、倒置显微镜(Olympus)、电子天平(Sartorius)、微量加样器(Gilson)、酶标仪(BIO-RAD)、低温离心机(Sigma)。
1.2 药物制备 人慢性粒细胞白血病细胞系K562细胞,由中国医学科学院血液学研究所提供。PESV系将蝎毒粗毒应用分子筛层析技术提纯所得,真空干燥后制成干粉,为相对分子量6 000~7 000的多肽混合物,纯度为89.1%;甲磺酸伊马替尼粉剂(GLEEVEC)由中国医学科学院血液学研究所提供,使用前以生理盐水溶解,针头式滤器过滤除菌,稀释到分组所需浓度。
1.3 方法
1.3.1 细胞的培养及分组处理 常规复苏冻存细胞,用完全生长培养基在37℃,5%CO2的条件下常规培养,3~4d传代一次;收集对数生长期细胞以1×105/mL浓度接种于24孔培养板,每孔200 μL细胞悬液,分别加入低、中及高浓度(10、20及40 mg/L)PESV 20 μL(低、中、高剂量组),GLEEVEC(2 g/L)20 μL(GLEEVEC组),生理盐水20 μL(阴性对照组),每组均设3个复孔,共培养48h。
1.3.2 Real-time PCR检测Shh、Smo、Ptch基因mRNA的表达 取上述细胞,各自吹打后,用移液器吸取细胞悬液,置于无菌无RNase的2 mL Eppendorf管中,1 800 r/min离心5 min,用DEPC水配制的l×PBS洗2次,轻柔悬浮细胞,调节细胞浓度调整为5.0×105/mL,应用Trizol法提取细胞总RNA,逆转录成cDNA,将获得的cDNA模板稀释后用于Real-time PCR,20 μL反应体系包含PCR Mixes 10 μL,上下游引物(10 μmol/L)各0.5 μL,cDNA模板2 μL,dH2O 7μL,反应条件:95 ℃预变性5 min;95℃变性30 s,60℃退火30 s,72℃延伸30 s,40个循环;72 ℃终延伸5 min。设β-actin为内参,采用2-ΔCt法进行定量分析,计算目的基因与β-actin相对表达量,实验重复3次。
1.3.3 Western blot检测Shh、Smo、Ptch蛋白的表达 收集各组K562细胞,1 000 r/min离心5 min,1 mL冷PBS重悬计数;再次离心后用冷PBS洗涤沉淀2次,1 000 r/min离心5 min并转移至1.5 mL EP管;按1×106细胞/100 μL的比例加细胞裂解液,混匀后冰浴放置30 min。4℃,12 000 r/min离心10 min;取上清,应用BCA法进行蛋白浓度测定。样本煮沸后,在十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)中进行电泳,电泳后转膜,0.5%脱脂牛奶室温封闭PVDF膜60 min,分别加入Shh、Smo、Ptch一抗4℃孵育过夜,次日1×TBST洗膜3次,加入二抗室温孵育60 min,1×TBST洗膜3次,加ECL显影、定影后拍照,实验重复3次。
1.3.4 各组K562细胞BCR/ABL基因mRNA及其融合蛋白P210bcr/abl的表达 应用Real-tmie PCR和Western blot检测PESV及GLEEVEC对K562细胞融合基因及融合蛋白的表达情况,PCR引物:上游5′-TGTTGACTGGCGTBATGAAGTP⁃GCTTGG-3′,下游 5′-TTCAGAAGCTTCTCCCTGACAT-3′;β-actin:上游5′-GGCATGGGTCAGAAGGATTCC-3′,下游5′-ATGTCACGCACGATTTCCCGC-3′。实验步骤同 1.3.2、
1.3.3 ,实验重复3次。1.4 统计学方法 采用SPSS 20.0统计软件进行统计学处理。符合正态分布的计量资料用均数±标准差(±s)表示,2组间比较采用t检验,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
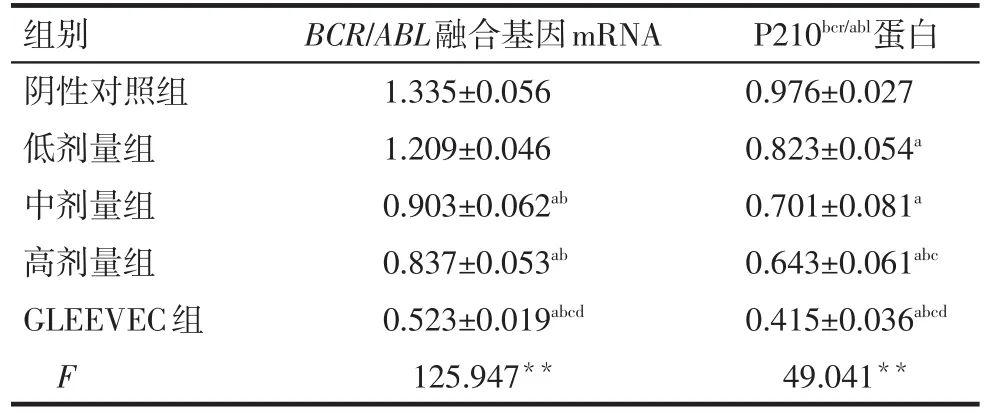
2.1BCR/ABL融合基因mRNA及P210bcr/abl蛋白的表达 与阴性对照组比较,PESV各剂量对K562细胞BCR/ABL融合基因mRNA及P210bcr/abl蛋白的表达均有不同程度的抑制作用,其中高剂量组表达下降最为明显(P<0.05),但低剂量组BCR/ABL融合基因mRNA的表达差异无统计学意义;各剂量组BCR/ABL融合基因mRNA水平和P210bcr/abl蛋白表达水平均高于GLEEVEC组(P<0.05),见表1,图1、2。
2.2Shh、Smo、PtchmRNA的表达 与阴性对照组比较,中、高剂量组Shh、Smo、Ptch基因相对表达水平均降低,低剂量组仅Smo基因相对表达水平降低(P<0.05);与GLEEVEC组比较,中、高剂量组Shh、Smo、Ptch基因相对表达水平差异均无统计学意义,见表2、图3。
Tab.1 The mRNA expressions of BCR/ABL gene and P210bcr/ablin five groups表1 各组BCR/ABL融合基因mRNA水平和P210bcr/abl蛋白的表达 (n=3,±s)
Tab.1 The mRNA expressions of BCR/ABL gene and P210bcr/ablin five groups表1 各组BCR/ABL融合基因mRNA水平和P210bcr/abl蛋白的表达 (n=3,±s)
**P<0.01,a与阴性对照组比较,b与低剂量组比较,c与中剂量组比较,d与高剂量组比较,P<0.05
组别阴性对照组低剂量组中剂量组高剂量组GLEEVEC组F BCR/ABL融合基因mRNA 1.335±0.056 1.209±0.046 0.903±0.062ab 0.837±0.053ab 0.523±0.019abcd 125.947**P210bcr/abl蛋白0.976±0.027 0.823±0.054a 0.701±0.081a 0.643±0.061abc 0.415±0.036abcd 49.041**
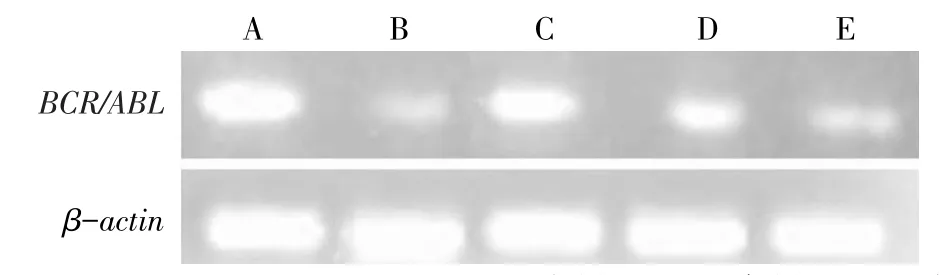
Fig.1 BCR/ABL mRNA expressions in five groups图1 各组BCR/ABL融合基因mRNA
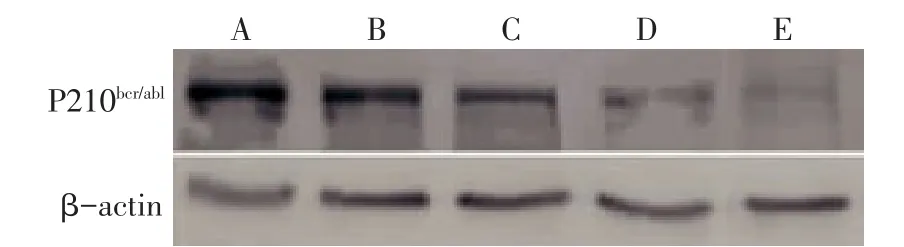
Fig.2 P210bcr/ablexpressions in five groups图2 各组P210bcr/abl蛋白表达
Tab.2 The relative expressions of Shh,Smo and Ptch gene mRNA in five groups表2 各组Shh、Smo、Ptch基因mRNA相对表达量(n=3,±s)

Tab.2 The relative expressions of Shh,Smo and Ptch gene mRNA in five groups表2 各组Shh、Smo、Ptch基因mRNA相对表达量(n=3,±s)
*P<0.05,**P<0.01;a与阴性对照组比较,b与低剂量组比较,P<0.05
组别阴性对照组低剂量组中剂量组高剂量组GLEEVEC组F Shh 1.813±0.316 1.611±0.252 1.134±0.204ab 1.029±0.197ab 0.951±0.217ab 7.144*Smo 2.136±0.187 1.890±0.096a 1.293±0.076ab 1.214±0.101ab 1.221±0.083ab 41.732**Ptch 0.933±0.051 0.903±0.036 0.557±0.039ab 0.542±0.053ab 0.511±0.046ab 63.829**
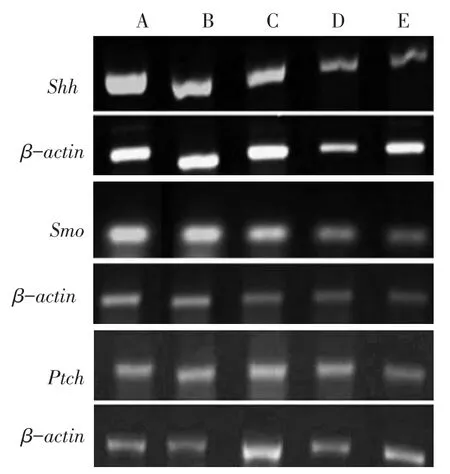
Fig.3 Comparison of Shh,Smo and Ptch mRNA expressions between five groups图3 各组Shh、Smo、Ptch基因mRNA表达比较
2.3 各组Shh、Smo、Ptch蛋白的表达 与阴性对照组比较,中、高剂量组Shh、Smo、Ptch蛋白在K562细胞中的表达水平均降低(P<0.05),低剂量组表达差异则无统计学意义;与GLEEVEC组比较,中、高剂量组Shh、Smo、Ptch蛋白相对表达水平差异均无统计学意义,但低剂量组均升高(P<0.05),见表3、图4。
Tab.3 The relative contents of Shh,Smo and Ptch proteins in five groups表3 各组Shh、Smo、Ptch蛋白相对含量(n=3,±s)

Tab.3 The relative contents of Shh,Smo and Ptch proteins in five groups表3 各组Shh、Smo、Ptch蛋白相对含量(n=3,±s)
*P<0.05,**P<0.01;a与阴性对照组比较,b与低剂量组比较,P<0.05
组别Shh/β-actin Smo/β-actin Ptch/β-actin阴性对照组低剂量组中剂量组高剂量组GLEEVEC组F 0.521±0.053 0.477±0.053 0.356±0.070ab 0.361±0.083ab 0.347±0.079ab 4.134*0.826±0.088 0.770±0.096 0.601±0.039ab 0.593±0.047ab 0.577±0.046ab 8.816*0.333±0.057 0.278±0.066 0.203±0.049ab 0.194±0.063ab 0.147±0.042ab 5.199*
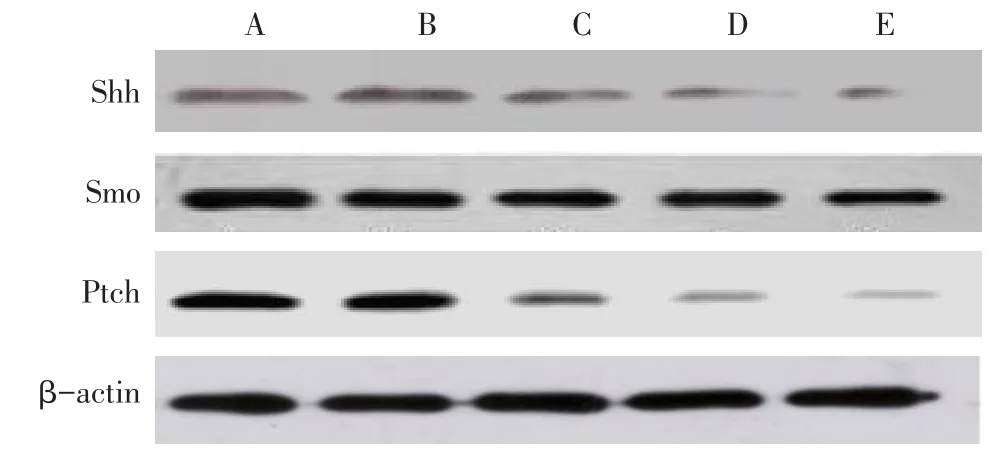
Fig.4 Comparison of Shh,Smo and Ptch protein expressions between five groups图4 各组Shh、Smo、Ptch蛋白表达比较
3 讨论
K562细胞是从CML患者中分离的白血病细胞株,具有Ph染色体及BCR/ABL融合基因的特征性表达,而后者已被临床作为CML的重要诊疗依据,因此本实验选择K562细胞作为研究载体。Hedgehog信号通路主要由Hh配体、跨膜受体蛋白Ptc、G蛋白偶联受体样蛋白Smo、核转录因子蛋白Gli组成;当细胞外存在Hh配体时,Hh和Ptc的相互作用能解除Ptc对Smo的抑制作用,使Smo可与相关受体结合,抑制蛋白激酶A活性,从而使Gli以全长进入到细胞核中,启动Hh靶基因的表达[7]。Turner等[8]最新研究表明,Hedgehog通路在CML中高表达,与本研究结果一致。
目前,络氨酸激酶抑制剂(TKIs)在CML的治疗中已经发挥着重要作用。第一代TKI药物GLEEVEC是CML治疗的首选,但临床仍有相当一部分患者对GLEEVEC不耐受,有血细胞减少、肝功能损伤、胃肠道反应等不良反应[9];虽然这些不良反应可能是可控的,但是严重干扰了患者的规范化治疗,影响到患者的长期生存甚至对TKIs产生耐药[10],急需寻求与TKIs疗效相当或者联合应用可以减毒增效的药物,因此,中药及其提取物成为研究热点。
PESV的抗白血病效应不仅可以通过下调白血病干细胞膜上P-gp、细胞质内ALDH、PI3K及细胞核中多药耐药基因1(MDR1)、核因子(NF)-κB的表达水平,增强白血病细胞对阿霉素(ADM)的敏感度[11];还能够抑制白血病KG1a干细胞增殖,对柔红霉素(DNR)损伤的KG1a干细胞有诱导凋亡和分化的作用,其机制可能与上调KG1a干细胞的PTEN、tie-2基因表达有关[12],同时PESV也可以通过抑制模型小鼠体内BCR/ABL融合基因及P210bcr/abl表达水平进而阻断CML的进展,但是其相关作用机制尚未明确。本研究结果显示,PESV可抑制K562细胞BCR/ABL融合基因及P210bcr/abl蛋白的表达,中、高剂量组与GLEEVEC组相比差异有统计学意义,提示PESV虽然可以抑制该融合基因及蛋白的表达,但抑制程度较GLEEVEC弱。而本课题组前期研究表明PESV对K562细胞增殖的抑制与GLEEVEC相当,考虑原因可能与PESV的作用靶点复杂相关。但关于Hh信号通路的研究结果显示,其上游活化因子Shh、Smo、Ptch基因的mRNA和蛋白在K562细胞中均存在高表达,验证CML的发病确实与该通路密切相关,应用PESV干预之后,Shh、Smo、Ptch的表达水平均有不同程度的下降,其中PESV中高剂量组与BCR/ABL融合基因靶向药物GLEEVE效果相当,提示PESV可以通过降低上游活化因子的表达来抑制Hh通路的活化,达到抗CML的效应,且与GLEEVE效应相当。
CML的Hh通路相关的研究目前尚处于体外实验阶段,但其取得的良好结果可以为体内实验提供研究基础,而PESV和Hh通路在TKIs耐药的CML方面的研究也需进一步探讨。
[1]国家药典委员会.中国药典.10版[S].北京:中国医药科技出版社,2015:143.National Pharmacopoeia Commission.Chinese Pharmacopoeia,Tenth Edition[S].Beijing:China Medical Science and Technology Press,2015:143.
[2]杨文华,吕俊秀,杨向东,等.蝎毒多肽提取物对白血病小鼠E-钙黏蛋白、CD49d和CXCR4表达的影响[J].时珍国医国药,2010,21(2):259-261.Yang WH,Lv JX,Yang XD,et al.Effects of PESV on the expression of E-cadherin,CD49d and CXCR4 in leukemia mice[J].Lishizhen Medicine and Materia Medica Research,2010,21(2):259-261.doi:10.3969/j.issn.1008-0805.
[3]Lum L,Beachy PA.The Hedgehog response network:sensors,switches,and routers[J].Science,2004,304(5678):1755-1759.doi:10.1126/science.1098020.
[4]孙婧,菅天孜,王珂,等.Hedgehog信号通路临床研究进展[J].医学综述,2017,23(4):625-628.Sun J,Jian TZ,Wang K,et al.Clinical research progress of hedgehog signaling pathways[J].Medical Recapitulate,2017,23(4):625-628.doi:10.3969/j.issn.1006-2084.
[5]任徽,郭华,陈明伟,等.Hedgehog信号通路通过上皮细胞间质转分化调控乳腺癌细胞侵袭[J].西安交通大学学报(医学版),2017,38(1):48-52.Renh,Guoh,Chen MW,et al.Hedgehog signaling pathway regulates the invasion of breast cancer cells via epithelial-mesenchymal transition[J].Journal of Xi’an Jiaotong University(Medical Sciences),2017,38(1):48-52.
[6]Irvine DA,Zhang B,Kinstrie R,et al.Deregulated hedgehog pathway signaling is inhibited by the smoothened antagonist LDE225(Sonidegib)in chronic phase chronic myeloid leukaemia[J].Sci Rep,2016,6:25476.doi:10.1038/srep25476.
[7]Wilson CW,Chuang PT.Mechanism and evolution of cytosolic Hedgehog signal transduction[J].Development,2010,137(13):2079-2094.doi:10.1242/dev.045021.
[8]Turner KA,Rothe K,Woolfson A,et al.Drug-insensitive CML stem/progenitor cell highly express key regulators of the hedgehog pathway and inhibition of the hedgehog pathway enhances their response to TKI treatment[C].ASH,2016,abstract 4236.
[9]王奎鹏,余海滨,杨景柯,等.47例伊马替尼不良反应分析[J].肿瘤基础与临床,2017,30(3):222-224.Wang KP,Yu HB,Yang JK,et al.Analysis of 47 cases of adverse drug reactions induced by imatinib[J].Journal of Basic and Clinical Oncology,2017,30(3):222-224.doi:10.3969/j.issn.1673-5412.
[10]Steegmann JL,BaccaraniM,Breccia M,etal.European LeukemiaNet recommendations for the management and avoidance of adverse events of treatment in chronic myeloid leukaemia[J].Leukemia,2016,30(8):1648-1671.doi:10.1038/leu.2016.104.
[11]杨向东,杨文华,刘宝山,等.蝎毒多肽提取物对白血病细胞株K562/A02荷瘤鼠耐药性的影响[J].肿瘤防治研究,2016,43(3):181-187.Yang XD,Yang WH,Liu BS,et al.Reversion impact of peptide extract from scorpion venom on multidrugresistance of leukemia stem cell line K562/A02 in vivo[J].Cancer Research on Prevention and Treatment,2016,43(3):181-187.doi:10.3971/j.issn.1000-8578.
[12]杨向东,李红玉,李德冠,等.蝎毒多肽对白血病细胞株KG1a干细胞活性的影响[J].中华中医药杂志,2015,30(4):1278-1281.Yang XD,Li HY,Li DG,et al.Study on the effects of PESV on the viability of leukemia stem cells line KG1a[J].China Journal of Traditional Chinese Medicine and Pharmacy,2015,30(4):1278-1281.

