黄芪甲苷对异丙肾上腺素诱导大鼠心肌肥厚的保护作用研究
段立鸣,孙玉红,王方
心肌肥厚(cardiac hypertrophy,CH)是心脏为维持适当收缩功能对各种病理状态的一种适应性反应,然而长期的心肌肥厚可导致扩张型心肌病甚至心衰,极大增加了心源性猝死的风险[1]。近年来有研究证实,氧化应激信号分子活性氧(reactive oxygen species,ROS)与病理性心肌肥厚的发生发展密切相关,并且异丙肾上腺素(isoproterenol,ISO)诱导的大鼠心肌肥厚过程也是通过ROS途径实现的[2]。黄芪做为重要的补气类中药,在中医临床治疗心肌肥厚中广泛使用,其主要成分为有多糖、皂苷类等。多项研究证实,黄芪甲苷对ISO诱导的大鼠心肌肥厚具有一定的保护作用,主要体现在抗炎、提高机体免疫功能、降低心肌细胞钙离子浓度等方面[3-5]。但黄芪甲苷对心肌肥厚型大鼠的保护机制是否与氧化应激反应有关目前尚鲜见报道,基于以上背景,本研究拟从氧化应激反应层面作为切入点,探讨黄芪甲苷对ISO诱导的心肌肥厚模型大鼠心肌保护作用的机制。
1 材料与方法
1.1 实验材料 健康SPF级SD大鼠24只,体质量180~200 g,购自南京医科大学实验动物中心;黄芪甲苷购自上海纯优生物有限公司,纯度为98%;ISO购自上海禾丰制药公司;二氯荧光素双醋酸盐(DCFH-DA)、裂解液相关试剂、BCA及ECL购自Sigma公司;乌拉坦购自上海展云化工有限公司;NADPH氧化酶4(NOX4)抗体、GAPDH抗体及心房钠尿肽(atrial natriuretic peptide,ANP)抗体购自Novus Biological公司;脱脂奶粉购自BD公司;BCA蛋白浓度测定试剂盒购自碧云天,聚偏氟乙烯膜(PVDF)购自Millipore公司;显影、定影剂购自日本柯达公司;X射线胶片购自富士公司;Trizol试剂、cDNA第一链合成试剂盒购自Thermo scientific公司;总RNA提取试剂盒购自天根生化科技有限公司;相关引物序列委托生工生物工程(上海)股份有限公司合成。
1.2 动物分组及处理 大鼠饲养于22~25℃,相对湿度50%~70%的环境中,每天循环12h光照,2d后随机分为4组:ISO组[ISO 3 mg/(kg·d)腹腔注射,之后与黄芪甲苷组等体积生理盐水灌胃]、黄芪甲苷组[与ISO组等体积生理盐水腹腔注射,之后黄芪甲苷溶液5 mg/(kg·d)灌胃]、黄芪甲苷+ISO组[ISO 3 mg/(kg·d)腹腔注射,黄芪甲苷溶液5 mg/(kg·d)灌胃],对照组(与ISO组等体积的生理盐水腹腔注射,与黄芪甲苷组等体积生理盐水灌胃)每组6只,连续灌胃14d[6]。第14天给药后禁食12h,称体质量后腹腔注射20%乌拉坦麻醉,开胸取心脏组织,去除大血管及心外膜脂肪组织,去除右心及左心房,保留左心室及室间隔作为左心室的范围,用预冷的生理盐水清洗干净后滤纸吸干水分,称取左心室质量,计算左心室质量指数(左心室质量/体质量)。部分左心室组织置于10%中性福尔马林中固定,用于组织学研究(HE染色);其余组织一部分用于检测心肌线粒体ROS水平;另一部分立即液氮速冻后转移至-80℃保存,用于Western blot及PCR检测。
1.3 HE染色 左心室组织经10%中性福尔马林固定,乙醇梯度脱水,常规石蜡包埋及切片(4 μm),400倍显微镜下拍照,每张切片随机读取不少于10个视野,每个视野选取10个心肌细胞(要求尽量呈圆形),并测量其截面积,应用IPP 6.0软件测量并分析。
1.4 心肌细胞线粒体ROS生成速率测定 取大鼠左心室组织,采用差速离心法提取线粒体[7-8],考马斯亮蓝法测定线粒体蛋白含量。本研究以二氯荧光素(DCF)为探针检测线粒体ROS生成,二氢二氯荧光素(DCFH)被ROS氧化后,生成的DCF荧光强度随时间呈线性增加,表明来源于线粒体的ROS以恒定速率产生。取0.5 mg线粒体蛋白,加入测定介质(130 mmol/L KCl,5 mmol/L MgCl2,20 mmol/L NaH2PO4,20 mmol/L Tris-HCl,30 mmol/L Glucose,pH=7.4)和底物(启动呼吸):2 mmol/L Malate和2 mmol/L Glutamate、5 μmol/L DCFH-DA。首先,测定本底荧光强度随时间变化的数据,计算线性回归直线斜率,以反映DCFH自氧化所产生的DCF的荧光强度变化;5 min后,加入线粒体,测定线粒体样本荧光强度随时间变化的线性回归直线斜率;最后计算ROS生成速率。具体计算公式:实际线粒体产生活性氧速率=线粒体样本荧光强度/时间回归直线斜率-本底荧光强度/时间回归直线斜率。线粒体ROS的生成速率单位:fluorescence units/(s·mg)pro,简写为u/(s·mg)。
1.5 Western blot法检测心肌NOX4和ANP表达水平 取部分冻存心肌组织加入裂解液于冰上匀浆并裂解15 min,4℃、17 500 r/min离心30 min后取上清,BCA法测定蛋白浓度。取100 μg蛋白,70 ℃下水浴5 min,10%SDS-PAGE电泳分离,电转至PVDF膜,3%BSA在37℃下封闭1h,孵育抗NOX4(1∶1 000),抗ANP(1∶1 000),抗GAPDH(1∶5 000)抗体,4 ℃过夜。次日washing液洗涤4次,每次5 min;孵育辣根过氧化酶标记的二抗(1∶5 000)120 min后,washing液洗涤3次,每次10 min;最后ECL孵育5 min后曝光,凝胶成像系统进行扫描并分析,所得数据以内参GAPDH做均一化处理后以对照组数据作为参照进行分析。
1.6 逆转录实时荧光定量PCR(RT-qPCR)检测心肌ANP mRNA的表达水平 取100 mg心肌组织,按照试剂盒说明提取总RNA,逆转录生成cDNA后进行qPCR,25 μL的反应体系包含反应液12.5 μL,上、下游引物(10 μmol/L)各0.75 μL、cDNA 模 板 1 μL,ddH2O 10 μL。 ANP 引 物 :上 游 5′-TCCTCTTCCTGGCCTTTTGGC-3′,下游 5′-AGACGGGTT⁃GCTTCCCCAGTC-3′;内参β-actin引物:上游5′-TTGCCGA⁃CAGGATGCAGAAGGA-3′,下游5′-AGGTGGACAGCGAG⁃GCCAGGAT-3′。反应条件:95℃10 min;94℃ 15 s,60℃40 s,40个循环。通过熔解曲线分析初步鉴定PCR反应的特异性。数据的收集由Light Cycler 96 system定量仪自带软件完成,采用2-ΔΔCt法进行数据分析,以对照组数据作为参照。
1.7 统计学方法 所有数据使用SPSS 19.0进行统计学处理,符合正态分布的计量资料以均数±标准差(±s)表示;组间比较采用单因素方差分析,组间多重比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 黄芪甲苷对ISO诱导心肌肥厚大鼠左心室质量指数的影响 在给药14d后,各组大鼠体质量差异无统计学意义(F=0.52,P>0.05),但各组间左心室质量指数变化明显;ISO组左心室质量指数明显高于对照组,而经ISO+黄芪甲苷处理后,左心室质量指数较ISO组明显下降(P<0.05);黄芪甲苷组与对照组相比,左心室质量指数差异无统计学意义。见图1。
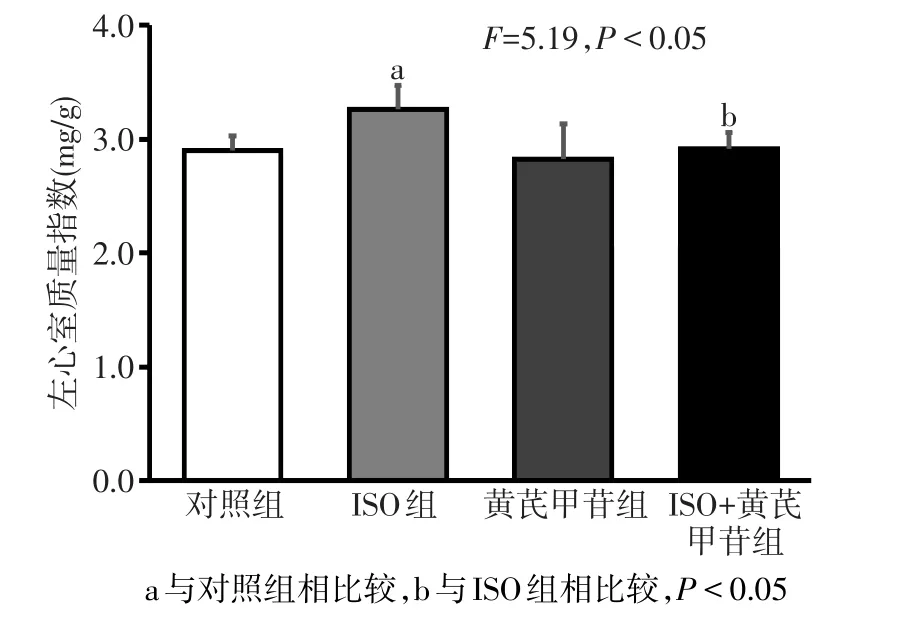
Fig.1 Comparison of rat left heart index between four groups图1 各组大鼠左心室质量指数比较
2.2 黄芪甲苷对心肌横截面积的影响 HE染色结果显示ISO组心肌细胞明显较对照组肥大,并可见心肌纤维断裂。ISO组与对照组相比,心肌细胞横截面积明显增大,ISO+黄芪甲苷处理后,大鼠心肌横截面积较ISO组显著减小,黄芪甲苷组与对照组相比,大鼠心肌横截面积差异无统计学意义。见图2、3。

Fig.2 The results of HE staining of left ventricular tissues in four groups(×400)图2 各组大鼠左心室组织HE染色结果(×400)
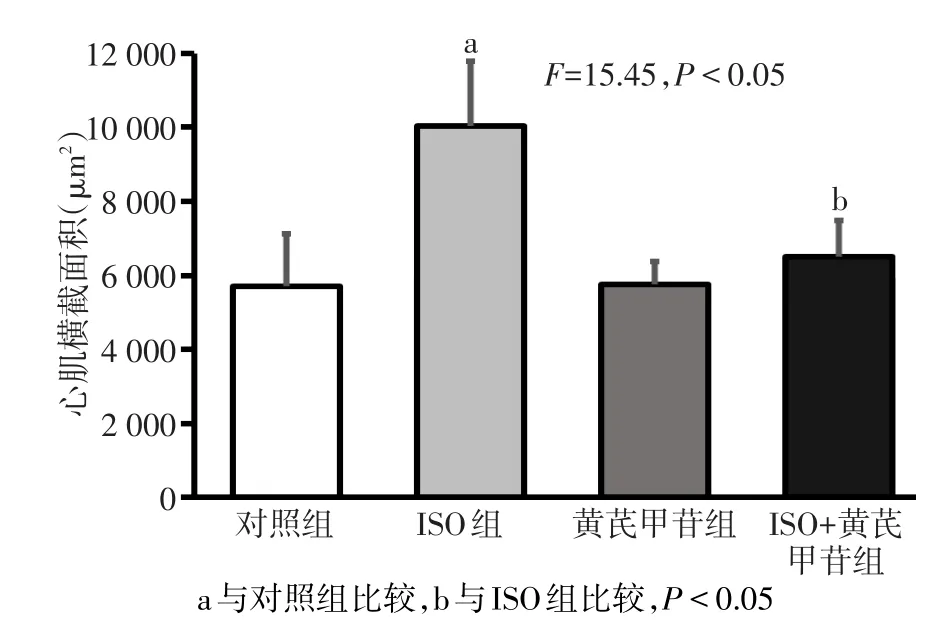
Fig.3 Comparison of rat myocardial cross-section between four groups图3 各组大鼠心肌横截面积比较
2.3 各组心肌线粒体ROS生成速率的变化 各组间ROS速率差异有统计学意义(F=11.74,P<0.05)。ISO组大鼠心肌线粒体ROS生成速率较对照组显著增加,而ISO+黄芪甲苷明显降低了ISO处理后线粒体内ROS的生成。黄芪甲苷组与对照组相比,ROS生成速率差异无统计学意义。见图4。
2.4 心肌NOX4表达变化 与对照组相比,ISO组大鼠心肌NOX4表达水平显著增加(P<0.05);而经过黄芪甲苷处理后,可显著降低ISO诱导的NOX4的过表达(P<0.05);黄芪甲苷组和对照组相比,NOX4表达差异无统计学意义(P>0.05)。见图5。
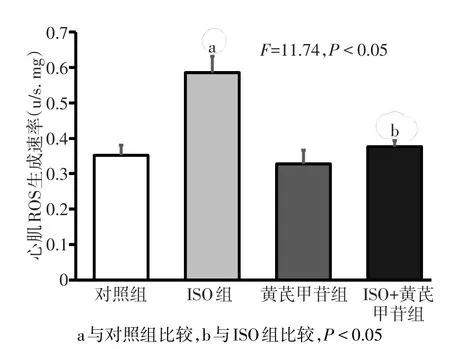
Fig.4 The ROS production rate of myocardial mitochondrial in four groups图4 各组心肌线粒体ROS生成速率

Fig.5 The protein expression levels of rat myocardial NOX4 in four groups图5 各组大鼠心肌NOX4表达水平
2.5 心肌ANP mRNA及蛋白的表达变化 ISO组心肌ANP mRNA及蛋白表达水平较对照组明显升高,而经过ISO和黄芪甲苷共同处理后,ANP mRNA及蛋白表达量较ISO组明显下降;对照组与黄芪甲苷组ANP mRNA及蛋白表达水平差异无统计学意义。见图6、7。
3 讨论
心肌肥厚是心脏对人体各种原因刺激(如感染、自身免疫、吸烟等)的一种代偿反应,在心肌肥厚早期,心功能可以得到一定改善,一定程度上起到保护心脏的作用,但长期的心肌肥厚可增加心肌耗氧量、降低心肌顺应性,进而导致心力衰竭并增加心源性猝死的风险[9]。可见,心肌肥厚严重威胁着人类的生命健康,深入研究心肌肥厚发病及发展的病理机制,寻求有效改善心肌肥厚、保护心肌的临床治疗策略是当前心血管研究领域的重要课题。目前,对于心肌肥厚的治疗主要使用β-受体阻滞剂或血管紧张素转换酶抑制剂(ACEI)类药物、利尿剂及cAMP正性肌力药物等内科治疗,外科则主要以左心室辅助装置及心脏置换等一些方式[10-11],并已取得一定的临床疗效,但也随之带来了诸多不良反应。近年来,中药治疗心肌肥厚有着疗效确切、安全性高的优势,在临床中亦广泛应用,尤其以黄芪最为常用。作为黄芪的有效成份之一,黄芪甲苷对心肌肥厚的治疗和保护作用已被越来越多的学者所重视和研究。
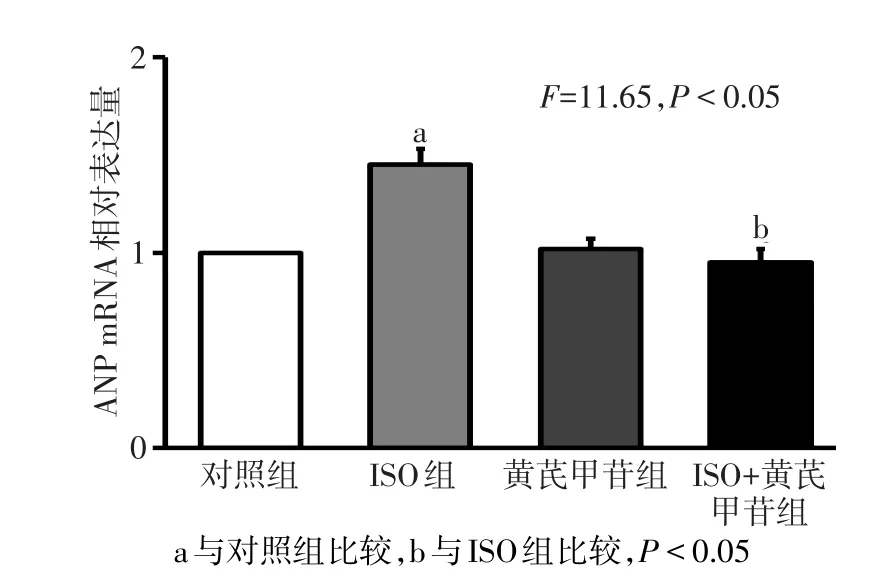
Fig.6 The mRNA expression levels of rat ANP in four groups图6 各组大鼠ANP mRNA相对表达水平
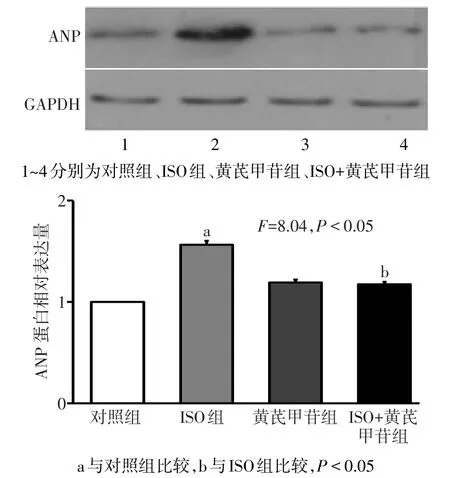
Fig.7 The protein expression levels of rat ANP in four groups图7 各组大鼠ANP蛋白表达水平
大量研究表明,氧化应激是导致心血管系统结构、功能异常的重要原因之一,与其他病理生理机制相互影响,共同促进了心肌肥厚的发生和发展[12]。近年来,有研究表明,在过量血管紧张素Ⅱ、去甲肾上腺素、肿瘤坏死因子等神经激素影响下,还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶被异常激活,促使线粒体产生过量的ROS,在高血压及心肌肥厚的发生机制中起重要作用[13]。作为NADPH氧化酶家族(NOXS)中的一个亚型,NOX4在心肌缺氧、心肌缺血、慢性压力负荷的情况下表达增多[14-15]。MacCarthy等[16]报道,左心室肥厚心肌组织中内皮依赖舒张因子(EDRF)功能受损,导致心肌收缩功能障碍,NADPH氧化酶活性增强,使活性氧生成增多。ANP是由心房肌细胞合成并释放的肽类激素,其主要作用是使血管平滑肌舒张和促进肾脏排钠、排水。当心房壁受牵拉时(如血量过多、头低足高位、中心静脉压升高和身体浸入水中)均可刺激心房肌细胞释放ANP。丁弘等[17]认为,ANP表达与心功能不全密切相关。
本课题组研究结果表明,黄芪甲苷可明显降低ISO诱导的大鼠左心室质量指数的增加,减小心肌横截面积,并能够明显降低线粒体内ROS的生成。并且本研究还发现,在大鼠心肌NOX4表达水平方面,黄芪甲苷可显著降低ISO诱导的NOX4的表达,且经过黄芪甲苷预处理后,ANP mRNA及蛋白表达量明显下降,提示黄芪甲苷对心肌肥厚的保护作用很可能是通过降低NOX4表达,抑制大鼠心肌氧化应激反应来实现的。在未来的心血管疾病治疗中,改善氧化应激反应的药物可能会成为治疗的一个重要环节,具有广阔的研究及应用前景。
[1]Li Q,Lian C,Zhou R,et al.Pretreatment with xenon protected immature rabbit heart from ischaemia/reperfusion injury by opening of the mitoKATP channel[J].Heart Lung Circ,2013,22(4):276-283.doi:10.1016/j.hlc.2012.10.016.
[2]Suh,Pistolozzi M,Shi X,et al.Alterations in NO/ROS ratio and expression of Trx1 and Prdx2 in isoproterenol-induced cardiac hypertrophy[J].Acta Biochimica Et Biophysica Sinica,2017,49(11):1022-1028.doi:10.1093/abbs/gmx102.
[3]Xu XL,Jih,Gu SY,et al.Modification of alterations in cardiac functionandsarcoplasmicreticulumbyastragalosideⅣ in myocardial injury in vivo[J].Eur J Pharmacol,2007,568(1/2/3):203-212.doi:10.1016/j.ejphar.2007.04.007.
[4]赵振霞,赵振敏,李彤.黄芪注射液对病毒性心肌炎患者氧化应激和炎性反应影响[J].中国实验方剂学杂志,2015,21(23):176-179.Zhao ZX,Zhao ZM,Li T.Effect of Huangqi injection on oxidative stress and inflammatory response in patients with viral myocarditis[J].Chinese Journal of Experimental Traditional Medical Formulae,2015,21(23):176-179.doi:10.13422/j.cnki.syfjx.2015230176.
[5]何海洋,王洪新,张晶,等.黄芪甲苷抑制心肌肥厚的机制与TLR-4/NF-κB信号通路相关[J].中成药,2013,35(6):1111-1116.He HY,Wang HX,Zhang J,et al.AstragalosideⅣ inhibits myocardial hypertrophy via TLR-4/NF-κB signaling pathway[J].Chinese Traditional Patent Medicine,2013,35(6):1111-1116.doi:10.3969/j.issn.1001-1528.2013.06.001.
[6]唐斌,张金国,谭洪勇,等.黄芪甲苷对慢性心衰大鼠心肌纤维化及能量代谢的影响[J].中国病理生理杂志,2017,33(3):411-416.Tang B,Zhang JG,Tan HY,et al.Effects of astragalosideⅣon myocardial fibrosis and energy metabolism in chronic heart failure rats[J].Chinese Journal of Pathophysiology,2017,33(3):411-416.doi:10.3969/j.issn.1000-4718.201703.005.
[7]刘艳丽,刘奔,屈扬扬,等.氧化应激和钙/钙调蛋白依赖性蛋白激酶Ⅱ参与β肾上腺素受体持久激动引起的大鼠心肌肥厚[J].生理学报,2013,65(1):1-7.Liu YL,Liu B,Qu YY,et al.Oxidative stress and calcium/calmodulin-dependent protein kinaseⅡcontribute to the development of sustained adrenergic receptorstimulated cardiac hypertrophy in rats[J].Acta Physiologica Sinica,2013,65(1):1-7.
[8]Gao Q,Pan HY,Qiu S,etal.Atractyloside and 5-hydroxydecanoate block the protective effect of puerarin in isolated rat heart[J].Life Sci,2006,79(3):217-224.doi:10.1016/j.lfs.2005.12.040.
[9]Park WJ,Jeongd,Oh JG.Tenascin-C in cardiac hypertrophy and fibrosis :friend or foe?[J].J Am Coll Cardiol,2017,70(13):1616-1617.doi:10.1016/j.jacc.2017.08.014.
[10]Efthimiadis GK,Pagourelias ED,Gossios T,et al.Hypertrophic cardiomyopathy in 2013:Currentspeculations and future perspectives[J].World J Cardiol,2014,6(2):26-37.doi:10.4330/wjc.v6.i2.26.
[11]黄纬凌,杨俊.肥厚型心肌病治疗新进展[J].临床心血管病杂志 ,2016,32(8):766-768.Huang WL,Yang J.Progress of hypertrophic cardiomyopathy therapy[J].Journal of Clinical Cardiology,2016,32(8):766-768.doi:10.13201/j.issn.1001-1439.2016.08.003.
[12]Mushtaq S,Ali T,Javed Q,et al.N-Acetyl cysteine inhibits endothelin-1-induced ROS dependent cardiac hypertrophy through superoxide dismutase regulation[J].Cell J,2015,17(2):355-360.doi:10.22074/cellj.2016.3746.
[13]de Cavanagh EM,Ferder M,Inserra F,et al.AngiotensinⅡ,mitochondria,cytoskeletal,and extracellular matrix connections:an integrating viewpoint[J].Am J Physiol Heart Circ Physiol,2009,296(3):H550-H558.doi:10.1152/ajpheart.01176.2008.
[14]Maejima Y,Kuroda J,Matsushima S,et al.Regulation of myocardial growth and death by NADPH oxidase[J].J Mol Cell Cardiol,2011,50(3):408-416.doi:10.1016/j.yjmcc.2010.12.018.
[15]Ago T,Kuroda J,Pain J,et al.Upregulation of Nox4 by hypertrophic stimuli promotes apoptosis and mitochondrial dysfunction in cardiac myocytes[J].Circ Res,2011,106(7):1253-1264.doi:10.1161/CIRCRESAHA.109.213116.
[16]MacCarthy PA,Grieve DJ,Li JM,et al.Impaired endothelia regulation of ventricular relaxation in cardiac hypertrophy:role of reactive oxygen species and NADPH oxidase[J].Circulation,2001,104(24):2967.doi:http://doi.org/10.1161/hc4901.100382.
[17]丁弘,徐欣,冯秋婷,等.ANP在大鼠高血压进展为心力衰竭中的作用[J].现代生物医学进展,2015,15(35):6844-6847.Dingh,Xu X,Feng QT,et al.The effect of ANP in high blood pressure progression to heart failure in rat[J].Progress in Modern Biomediclin,2015,15(35):6844-6847.doi:10.13241/j.cnki.pmb.2015.35.011.

