菌株Lactobacillus casei-16发酵豆浆的抗氧化特性研究
唐宇,张将,高原,李唤宇,张雨晴,宫悦,妥彦峰
(大连工业大学食品学院,辽宁大连116034)
随着社会的发展,健康在人们的眼中变得越来越重要,如何活的更加健康已经成为人们的重要议题。而很多研究发现,氧化对健康造成了很严重的影响。氧化损伤在很多常见疾病中均起到一定的作用,如癌症、炎症、免疫性疾病、心血管疾病等[1]。而且氧化也会导致机体处于亚健康的状态[2]。人体内氧化损伤主要是由氧化应激反应(自由基)造成的,人体内95%的自由基为氧自由基[3]。
大豆原产于中国,现在已经是世界上产量最高的农作物之一[4]。而大豆中含有的大豆异黄酮是能够对人体起到多种的调节和保护作用的物质,具有多种功能特性,其中就包含抗氧化作用[5]。除此之外大豆蛋白水解也能够产生具有抗氧化活性的多种肽分子混合物[6]。因此大豆可以作为一种良好的抗氧化食物。吴非等[7]发现发酵豆制品的抗氧化活性明显高于非发酵豆制品;乳酸菌和霉菌发酵都能够使豆乳的抗氧化活性提高,不同菌株提高的程度不同。翟齐啸等[8]发现乳酸菌发酵可以通过改变豆乳中糖苷和苷元类物质的组成来提高酸豆乳对镉暴露导致氧化损伤的保护作用。徐寅等[9]对Streptococcus thermophilusgrx90发酵豆乳的抗氧化活性进行研究,发现发酵豆乳的体外抗氧化性显著的高于未发酵豆乳。
本试验菌株为大连工业大学大连市益生菌功能研究重点实验室保存的5株菌,通过测定菌株发酵的效率、菌株发酵豆浆产β-葡萄糖苷酶活力的特性及豆浆清除DPPH自由基的特性,选出一株发酵豆浆综合性能最好的菌株。提取其有效成分,用高效液相色谱分析发酵前后苷元型大豆异黄酮含量的变化、进行氧化自由基吸收能力测定(Oxygen Radical Absorbance Capacity,ORAC)及细胞抗氧化实验等进一步分析发酵豆浆提取物的抗氧化效果。
1 材料与方法
1.1 材料与试剂
大豆为大连市市售大豆;发酵菌株为大连工业大学大连市益生菌功能研究重点实验室保存菌株,如表1所示;HepG-2肝癌细胞,由国家海洋食品工程中心林松毅教授提供;亚甲蓝购自美国Aladdin公司;冰醋酸(色谱纯)购自天津科密欧化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH)、大豆苷、大豆苷元、染料木苷、染料木素、4-硝基-β-D-吡喃葡萄糖苷(p-Nitrophenyl-β-D-glucopyranosidep-Nitrophenyl,pNPG)、乙腈(色谱纯)、甲醇(色谱纯)、水溶性维生素E(Trolox)、荧光素钠(Fluorescein sodium,FL)、2,2-偶氮二(2-甲基丙基咪) 二盐酸盐(2,2 ′-Azobis (2-amidinopropane) dihydrochloride,AAPH)均购自于美国Sigma公司;杜尔贝科改良伊格尔培养基(dulbecco′s modified eagle medium,DMEM)购自于美国Gibco公司。

表1 试验使用菌株Table 1 The strains of the experiment
1.2 主要仪器设备
KG-SX-500灭菌锅:上海精密实验设备有限公司;SW-CJ-2FD超净工作台:苏净集团苏州安泰空气技术有限公司;FQC生化培养箱:上海一恒科学仪器有限公司;S210-k精密pH计:梅特勒-托利多仪器有限公司;5804R冷冻离心机:德国Eppendorf公司;1510酶标仪:美国Thermo Fisher Scientific公司;FD-IC-5D冷冻干燥器:北京博医实验仪器有限公司;ScanVac真空浓缩仪:丹麦Labogene公司;MCO-18AIC CO2培养箱:日本SANYO公司;Waters 2695高效液相仪、PDA检测器:美国Waters公司;200-PRO荧光酶标仪:瑞士Tecan公司;CKX41倒置电子显微镜:日本OLYMPUS公司。
1.3 方法
1.3.1 菌株富集培养
试验所用菌株均为-80℃保存(大连工业大学大连市益生菌功能特性研究重点实验室提供)。冻存菌株37℃解冻,振荡均匀后,取0.1 mL接种于5 mL的MRS液体培养基中37℃培养18 h,连续传代2次后,于4℃保存待用。
1.3.2 豆浆发酵
用去离子水清洗大豆后,加入豆重2倍的水浸泡12 h,再加入4倍干豆重去离子水,进行磨浆。用双层纱布对磨好的豆浆进行过滤。再将过滤后的豆浆,放入高压蒸汽灭菌锅中,在105℃条件下,灭菌15 min。待豆浆冷却后接种豆浆体积分数2%的菌液,于37℃发酵,发酵时间分别为6、12、18、24 h。测定不同发酵时间的pH值、β-葡萄糖苷酶活力、DPPH自由基清除能力,筛选出具有良好发酵特性及自由基清除能力的菌株,用于进一步试验。
1.3.3 β-葡萄糖苷酶活性测定
本文参考Zhai等[10-11]的方法,以4-硝基-β-D-吡喃葡萄糖苷(pNPG)为底物测定酶活力测定。分别取5株菌发酵 6 h、12 h、18 h、24 h的豆浆各 0.1 mL 加入0.2 mL 5 mmol/L pNPG(0.1 mol/L pH7.0,PBS缓冲溶液),37°C水浴加热30 min,然后立即加入0.4 mL 4℃0.5 mol/L Na2CO3溶液终止反应。于4℃条件下,10 000 r/min离心20 min,测定上清液405 nm吸光值。另外,取相同条件的反应液(0.1 mL豆浆、0.2 mL pNPG溶液)立即置于沸水浴中加热5 min灭活后加入5.0 mL 1 mol/L Na2CO3溶液,作为空白对照。以对硝基苯酚为标准品,测定不同浓度对硝基苯酚溶液在波长400 nm处的吸光度值,以浓度为横坐标、OD400为纵坐标绘制标准曲线。酶活力单位表示为U,是每分钟催化形成一个微摩尔对硝基苯酚所需要的酶量。
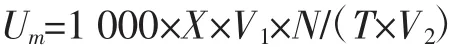
式中:Um为单位体积样品中β-葡萄糖苷酶活力,mU/mL;X为标准曲线计算后的对硝基苯酚浓度,μmol/L;V1为总反应液体积,L;N 为稀释倍数;T 为反应时问,min;V2为样品体积mL。
1.3.4 清除DPPH自由基的能力
测定DPPH自由基的清除能力,是一种常用的抗氧化特性测定法方法。试验中通过测定5种菌不同发酵时间(6、12、18、24 h)清除 DPPH 自由基的能力来分析发酵豆浆的抗氧化能力,方法参照Yin J Y[12]的方法并加以修改;分别取5 mL豆浆和发酵豆浆与蒸馏水5 mL按照1∶1混合,在10 000 r/min,8℃条件下离心10 min。取1 mL离心上清液,加入1 mL 0.2 mmol/L DPPH自由基乙醇溶液,室温下(20℃~25℃)放入黑暗的环境下反应30 min;4 000 r/min离心10 min取上清,于517 nm测上清液吸光度。
按公式计算DPPH自由基清除率:DPPH自由基清除率/%=[1-(Ai-Aj)/Ac]×100,式中:Ai为 1 mL DPPH+1 mL样品的吸光度;Aj为1 mL蒸馏水+1 mL样品的吸光度;Ac为1 mL DPPH+1 mL蒸馏水的吸光度。
1.3.5 发酵豆浆有效成分的提取
综合分析发酵豆浆pH值、DPPH自由基清除率、β-葡萄糖苷酶活性的结果,从参与豆浆发酵的5株菌种中,筛选出一株发酵豆浆综合性能最好的菌株,进行豆浆的大量发酵并提取有效成分。
参考Yu-Fei的方法[13],将发酵24 h豆浆和未发酵的豆浆于-30℃预冻,然后用冻干机冻干,用80%乙醇或水作提取液对豆浆冻干物进行重溶,每克冻干产物,加20 mL的提取液,于室温超声萃取6 h,超声功率为100 W。将超声完毕的提取液离心取上清,条件为4℃,10 000 r/min离心10 min。乙醇提取液用真空浓缩仪冻干,水提取液用冻干机冻干,将提取物密封保存于-80℃冰箱中。
1.3.6 高效液相色谱测定大豆异黄酮
大豆苷元和染料木素是起主要抗氧化作用的大豆异黄酮,大豆苷和染料木苷是它们对应的糖苷配体,通过测定发酵前后,这4种大豆异黄酮含量的变化来分析发酵豆浆抗氧化能力的改变。
将1.3.5中得到的提取物作为样品分析其大豆异黄酮含量的变化,以4种大豆异黄酮(大豆苷、大豆苷元、染料木苷、染料木素)标准品用色谱级甲醇配制成浓度为 10、20、50、80、100 μg/mL 的标准液。用高效液相色谱仪分别测出这4种大豆异黄酮的样品图,以峰面积为横坐标、样品浓度为纵坐标,绘制标准曲线[14],并得到回归方程。液相中所有试剂均需用0.22 μm滤膜过滤,以保证仪器的安全使用。
试验采用Waters2695高效液相色谱仪,搭配2998PDA检测器,色谱柱:SymmetryC18(5μm,4.6mm×250 mm);流动相:A为0.5%冰醋酸水溶液,B为乙腈,梯度洗脱条件如表2所示;流速为1.000 mL/min;柱温为30℃;进样量为20 μL;检测波长为260 nm。

表2 梯度洗脱条件Table 2 The condition of the gradient elution
1.3.7 ORAC抗氧化能力指数测定
参考Huailing Wang等的方法[15-17]将1.2.5中得到的样品稀释至 0.2、0.15、0.1 mg/mL,取 20 μL 样品加入到黑色96孔板中,再加入200 μL 0.96 μmol/L荧光素钠(FL)。自动混匀37℃孵育5 min。加入20 μL 119.4 mmol/L AAPH,测量荧光值,激发波长485 nm,发射波长538 nm,2 min测定一次,共60个循环,测定温度为30℃。试验中所有试剂均用75 mM pH 7.4的PBS溶解。试验所得的各微孔不同时间点的绝对荧光强度数据与其初始时间的荧光强度相比,折算成相对荧光强度f,以相对荧光强度采用近似积分法计算荧光衰退曲线下面积(AUC)。式中:f0表示初始相对荧光强度;fn表示第n个测定点相对荧光强度。ORAC计算公式为:
样品相对ORAC值=(AUC样品-AUC空白)/AUC对照
式中:样品组为 200 μL FL+20 μL AAPH+20 μL样品;空白组为 200 μL FL+20 μL AAPH+20 μL PBS;对照组为 200 μL FL+40 μL PBS。
以 Trolox(6.25、12.5、25、37.5、50 μmol/L)浓度为横坐标,以其相对ORAC值为纵坐标绘制标准曲线。将样品的相对ORAC代入曲线,得出与该浓度下的样品具有相同ORAC值的Trolox浓度,经换算使样品ORAC以Trolox当量(微摩Trolox当量/g)表达。
1.3.8 提取物保护HepG2细胞AAPH氧化损伤试验
以人肝癌细胞HepG2为对象进行发酵豆浆提取物的细胞抗氧化试验。首先进行提取物的细胞毒性试验。将HepG2肝癌细胞接种到96孔板中,接种细胞浓度为4×105个细胞/mL,接种量为每孔100 μL,培养24 h(5%CO2,37℃)后,用pH7.4的PBS迅速清洗 2次,加入无胎牛血清细胞培养基,在培养基中加入提取物,使其终浓度分别为 125、250、500 μg/mL,以未加提取物的作为对照。培养24 h(5%CO2,37℃)后,用pH7.4的PBS迅速清洗2次,以亚甲蓝染色法测定HepG2肝癌细胞存活率。亚甲蓝染色法参考WOLFE[18]并加以修改:加入 50 μL 亚甲蓝染液(98%HBSS、1.25% 戊二醛、0.6 g亚甲蓝),37℃孵育1 h。吸去亚甲蓝染液,去离子水轻轻浸没,清洗6次。手甩干,剩余水分超净台风干。然后每孔加入100 μL脱色液(50%乙醇、49%PBS、1%冰醋酸),室温下利用孔板振荡器振荡20 min。测定在570 nm的吸光值。计算存活率:
存活率/%=样品组吸光值/对照组吸光值×100
确定AAPH对HepG2肝癌细胞的半致死浓度:将HepG2肝癌细胞接种到96孔细胞培养板,接种细胞浓度为 2×105个细胞/mL,接种量为每孔 100 μL,培养24h(5%CO2,37℃)后,用pH7.4的PBS迅速清洗 2 次,加入无胎牛血清DMEM培养基,在培养基中加入AAPH溶液(无胎牛血清DMEM培养基),使其终浓度分别为 50、60、70、75、80、85、90、100 mmol/L,以未加AAPH的作为对照,培养2 h(5%CO2,37℃)后,用pH7.4的PBS迅速清洗2次,以亚甲蓝染色法测定HepG2肝癌细胞存活率。
提取物对HepG2肝癌细胞AAPH氧化损伤的保护:将HepG2肝癌细胞接种到96孔细胞培养板,接种细胞浓度为2×105个细胞/mL,接种量为每孔100 μL,培养 24 h(5%CO2,37℃)后,用 pH7.4的 PBS 迅速清洗2次,加入无胎牛血清DMEM培养基,在培养基中加入提取物(终浓度 125、250、500 μg/mL),37 ℃孵育1 h后,用pH7.4的PBS迅速清洗2次,添加无胎牛血清DMEM培养基和AAPH(浓度为半致死浓度)。培养2 h(5%CO2,37℃)后,以不添加 AAPH 和提取物的为空白,以添加AAPH不添加提取物的作为对照,以亚甲蓝染色法测定HepG2肝癌细胞存活率结果。
1.4 统计分析
试验中所有试验至少重复3次,方差分析及差异显著性分析(p<0.05)采用SPSS20.0统计分析软件进行分析,图表采用OriginPro 8.5进行绘制。
2 结果与讨论
2.1 发酵豆浆pH测定结果
不同菌株发酵豆浆pH值变化情况见表3。
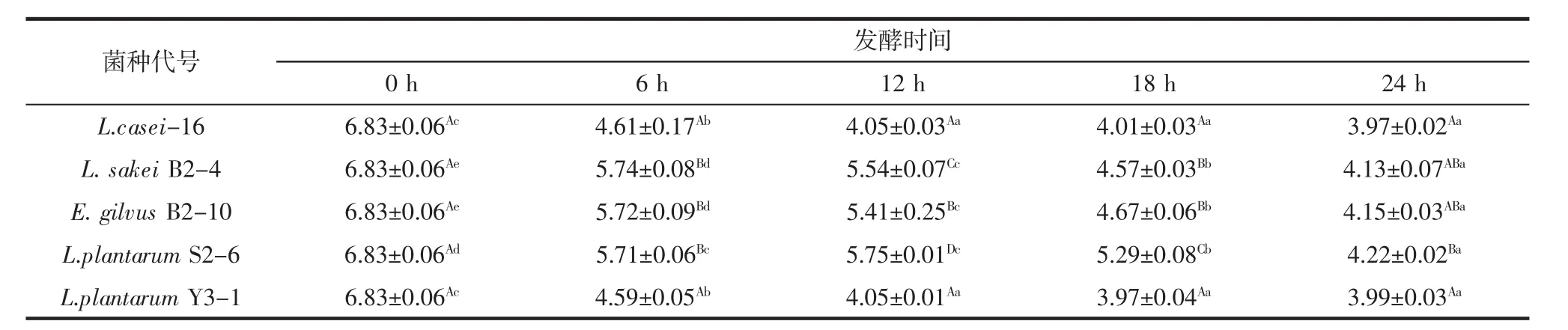
表3 不同菌株发酵豆浆pH值变化情况Table 3 The pH of the soymilk fermented by the different strains
如表3所示,在5株菌分别发酵豆浆过程中,经菌株 L.sakei B2-4、E.gilvus B2-10、L.plantarum S2-6 发酵的豆浆pH值下降较缓慢:菌株L.casei-16、L.plantarum Y3-1发酵豆浆12 h,发酵豆浆的pH值基本稳定,与发酵18、24 h后豆浆的pH相比无显著差异(p>0.05):菌株 L.sakei B2-4、E.gilvus B2-10 发酵豆浆 24 h时,发酵豆浆pH达到最低值,与L.casei-16、L.plantarum Y3-1发酵豆浆12 h的pH值无显著差异(p>0.05)。菌株L.casei-16、L.plantarum Y3-1发酵豆浆产酸速度较快。
2.2 β-葡萄糖苷酶测定结果分析
大豆中存在的大豆异黄酮包含糖苷型(9种)和苷元型(3种)两类,其中起主要抗氧化作用的染料木素(genistein)和大豆苷元(daidzein)均为苷元型大豆异黄酮,但大豆中异黄酮主要以糖苷形式存在,苷元型的大豆异黄酮仅占大豆中异黄酮总量的2%~3%[19-20],β-葡萄糖苷酶能够水解糖苷型异黄酮末端β-D-糖苷键,可以使糖苷型大豆异黄酮转化为苷元型[21],因此发酵菌株β-葡萄糖苷酶的活性越高,糖苷型大豆异黄酮转化为苷元型大豆异黄酮的效率越高,所以可以通过测定发酵豆浆中菌株产β-葡萄糖苷酶的活力,来判断菌体发酵豆浆的潜在抗氧化能力。
本试验中5株乳酸菌均能在发酵豆浆过程中产生β-葡萄糖苷酶,但各菌株间所产β-葡萄糖苷酶活性存在差异。不同菌株发酵豆浆不同阶段的β-葡糖糖苷酶活性见表4。

表4 不同菌株发酵豆浆不同阶段的β-葡糖糖苷酶活性Table 4 The β-glucosidase activity of the soymilk fermented by the 5 strains in different time mU/mL
由表4可知,随着发酵时间延长,菌株L.casei-16发酵豆浆的β-葡萄糖苷酶活性有一定增强,证明L.casei-16在0至24 h发酵阶段能够持续产酶。且当发酵时间为24 h时,其所产β-葡萄糖苷酶的活性显著(p<0.05)高于其它4菌株所产β-葡萄糖苷酶活性。因此推测L.casei-16发酵豆浆中苷元型大豆异黄酮含量较高,抗氧化活性较强。
2.3 DPPH自由基清除率
5株乳酸菌发酵豆浆对DPPH自由基清除能力见表5。
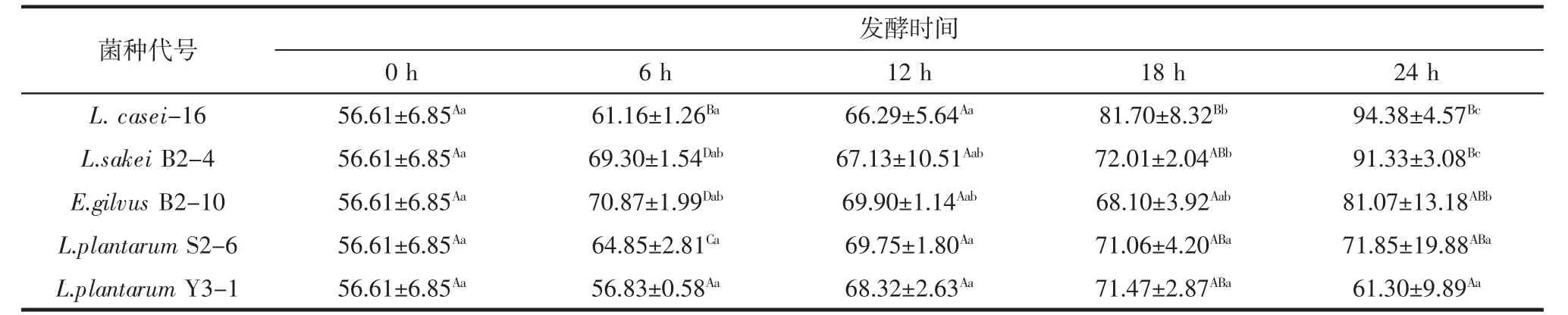
表5 不同菌株发酵豆浆DPPH自由基清除率Table 5 The DPPH free radical scavenging of the soymilk fermented by the different strains%
不同菌株发酵豆浆清除DPPH自由基清除能力存在差异,且随发酵时间延长,发酵豆浆清除DPPH自由基清除能力发生变化。L.plantarum Y3-1发酵豆浆6 h至24 h,与未发酵豆浆相比,清除DPPH自由基清除能力未发生显著变化(p>0.05):菌株L.casei-16发酵豆浆 18 h、24 h,L.sakei B2-4 发酵豆浆 24 h,E.gilvus B2-10发酵豆浆24 h的DPPH自由基清除率显著高于(p<0.05)未发酵豆浆的清除率,而在这些发酵时间段,以上各菌的β-葡萄糖苷酶活性也较高,推断在此阶段发酵豆浆中苷元型大豆异黄酮含量较高。综合分析L.casei-16发酵豆浆清除DPPH自由基的能力最好。
根据菌株发酵豆浆产酸、β-葡萄糖苷酶活性及DPPH自由基清除率结果,选择菌株L.casei-16进行后续研究。
2.4 高效液相色谱测定大豆异黄酮结果分析
2.4.1 大豆异黄酮标准曲线
采用高效液相色谱测定了大豆中普遍存在的4种大豆异黄酮,即大豆苷、染料木苷、大豆苷元、染料木素4种标准品的出峰时间,分别为9.865、10.455、24.707min和31.780 min,如图1所示。

图1 4种大豆异黄酮标准品的色谱图Fig.1 HPLC chromatogram of the isoflavones profile of 4 standard isoflavones
以峰面积作横坐标,标准品浓度为纵坐标作标准曲线得出4种大豆异黄酮的标准曲线分别为:
染料木苷:Y=0.019X+1.226,R2=0.999
大豆苷:Y=0.034X-0.271,R2=0.994
染料木素:Y=0.006X+2.622,R2=0.999
大豆苷元:Y=0.011X+2.519,R2=0.990
2.4.2 发酵豆浆中大豆异黄酮含量
分别利用80%乙醇和水作为提取剂,分别提取菌株L.casei-16发酵豆浆、及未发酵豆浆提取物,通过高效液相色谱分析醇提物和水提物中4种大豆异黄酮的含量,结果如表6所示。
大豆异黄酮易溶于乙醇、甲醇及丙酮等有机溶剂。无论是菌株L.casei-16发酵豆浆还是未发酵豆浆,醇提物中大豆异黄酮含量均高于水提物中大豆异黄酮含量。
从表6可以看出:豆浆发酵后苷元型大豆异黄酮染料木素和大豆苷元的含量较未发酵豆浆中的含量均有显著(p<0.05)提高,证明菌株L.casei-16可以通过发酵提高豆浆中苷元型大豆异黄酮的含量。
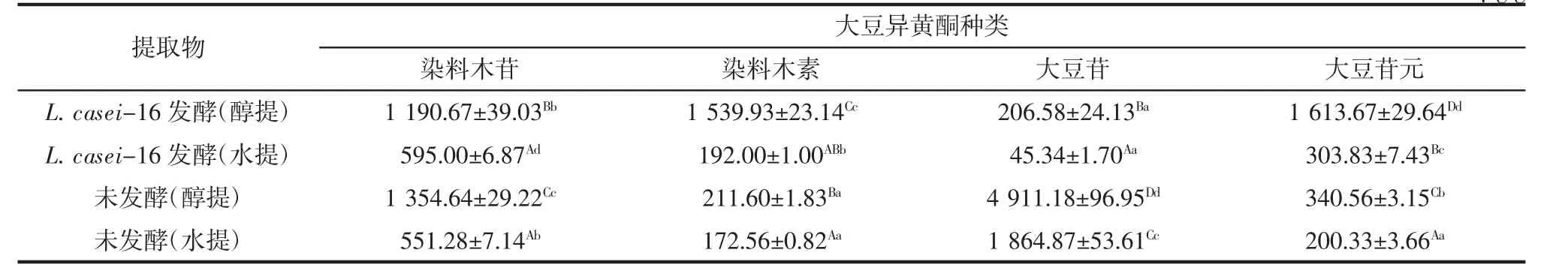
表6 豆浆提取物中大豆异黄酮含量Table 6 The concentration of the soybean isoflavone in the soybean milk extracts μg/g
2.5 ORAC抗氧化指标
ORAC即抗氧化能力指数是通过荧光衰退曲线的保护面积与标准抗氧化物质的保护面积相比得出。在目前抗氧化研究中为人们所常用的一种方法,该方法的准确性、精密度及重复性相较于其他的抗氧化方法有一定的优势。该方法以偶氮类化合物AAPH作为过氧自由基来源,荧光素钠(FL)为荧光指示剂,维生素E水溶性类似物Trolox为定量标准,使用荧光微孔板分析仪进行分析[16]。
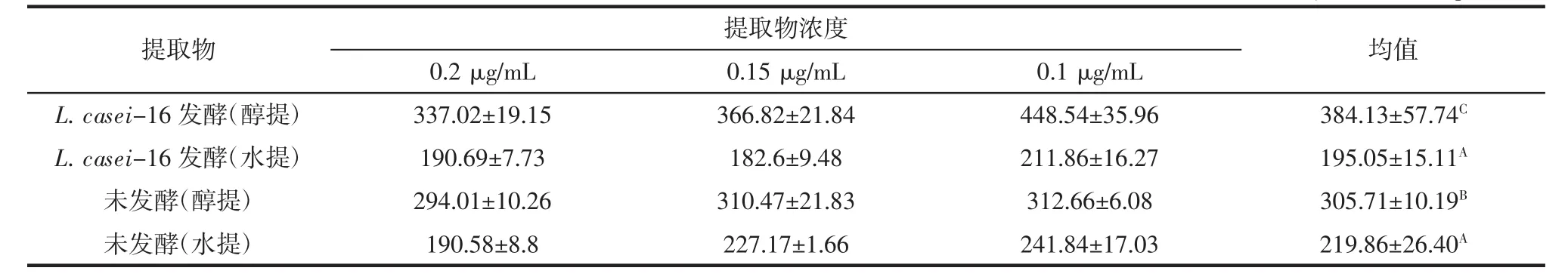
表7 4种提取物的ORAC值Table 7 The ORAC of the 4 extracts μmol Trolox/g提取物
本试验中,以Trolox浓度为横坐标,以对应的相对ORAC值为纵坐标,获得回归方程:Y=0.747X-7.817,R2=0.997。
测定豆浆的荧光值,经换算得到的ORAC值如表7所示。
如表7所示,L.casei-16发酵豆浆醇提取物的ORAC值显著(p<0.05)高于水提取物的ORAC值和未发酵醇提物的ORAC值;对比L.casei-16发酵豆浆醇提取物和水提物的ORAC结果可以判断,易溶于甲醇的苷元型大豆异黄酮是发酵豆浆抗氧化物质的重要组分之一;对比L.casei-16发酵豆浆醇提取物与未发酵豆浆醇提物的ORAC结果,结合液相色谱分析结果,发酵提高了豆浆中抗氧化活性成分染料木素(genistein)和大豆苷元(daidzein)的含量。无论是菌株L.casei-16发酵豆浆还是未发酵豆浆,醇提物中苷元型大豆异黄酮含量均高于水提物中苷元型大豆异黄酮含量含量,这可能解释了醇提物的ORAC值均高于水提物ORAC值的原因。

表8 不同浓度提取物对HepG2肝癌细胞存活率的影响Table 8 The survival rate of the HepG2 cell at different concentrations of the extracts%
2.6 细胞抗氧化实验结果
ORAC虽然能很好的体现提取物的抗氧化性,但是也有一定的局限性,ORAC属于体外化学实验,只能单纯的测定出提取物中直接起抗氧化作用物质的抗氧化能力,而不能反映细胞内的抗氧化机理的复杂性。有些本身不具有抗氧化性的物质,却可以通过调控机体生理作用来提高机体的抗氧化性,因此测定抗氧化最可靠的方法是人体实验或小鼠实验,但机体实验从方便和经济的角度来说并不算优秀。因此细胞实验成为一种较为理想的实验方法,它相较于体外化学实验更接近于机体细胞的实际情况,相较于人体实验或小鼠实验更加便捷经济[22-23]。
进行细胞实验的前提是提取物对HepG2肝癌细胞没有毒性,检验L.casei-16发酵豆浆醇提取物、水提物及未发酵豆浆醇提物、水提物对HepG2肝癌细胞的毒性,每种提取物选择3个浓度梯度(500、250、125 μg/mL),结果如表 8 所示。
由表8可知4种提取物的各浓度梯度对HepG2肝癌细胞均无细胞毒性。
2,2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)是常用的活性氧(reactive oxygen species,ROS)诱导剂,能够在机体内稳定促进ROS生成,使机体内产生过量的ROS,导致机体产生氧化损伤[24-25]。因此本试验以AAPH作为氧化剂,建立HepG2肝癌细胞的氧化损伤模型验证4种提取物在机体内的抗氧化效果。不同浓度AAPH处理2 h的HepG2肝癌细胞致死率如图2所示。

图2AAPH对HepG2肝癌细胞致死实验结果Fig.2 The survival rate of the HepG2 cell at different concentrations of AAPH

表9 不同浓度提取物对AAPH半致死浓度下细胞存活率的影响Table 9 The survival rate of the HepG2 cells damaged by AAPH at different concentrations of the extracts%
由图2可知,当终浓度为85 mmol/L时,HepG2肝癌细胞的存活率为(48.87±3.48)%,最接近50%,因此细胞抗氧化实验中AAPH的半致死浓度选择为85 mmol/L
不同浓度的4种提取物对HepG2肝癌细胞氧化损伤模型的影响结果如表9所示。
未用提取物处理的细胞的存活率与未发酵豆浆水提物处理过的细胞的存活率没有显著差异(p>0.05),表明未发酵豆浆水提物没有抑制氧化损伤的效果:未发酵豆浆醇提物仅在终浓度为250 μg/mL时,有抑制氧化损伤的效果。而经不同浓度的L.casei-16发酵豆浆醇提物和水提物处理的细胞存活率显著(p<0.05)高于未用提取物处理的细胞的存活率,证明了L.casei-16发酵豆浆醇提物和水提物均有抑制AAPH氧化损伤HepG2肝癌细胞的效果。
结合液相分析的结果来看,L.casei-16发酵豆浆醇提物中染料木素、大豆苷元的含量要显著(p<0.05)高于未发酵豆浆醇提物中的含量,说明了染料木素和大豆苷元是主要抗氧化活性成分[25]。L.casei-16发酵豆浆的醇提物及水提物均显著(p<0.05)提高了AAPH损伤HepG2肝癌细胞的存活率,同样浓度下L.casei-16发酵豆浆醇提物和水提物的抗氧化能力无显著性差异(p>0.05)。但L.casei-16发酵豆浆的醇提物的苷元型大豆异黄酮含量均显著(p<0.05)高于L.casei-16发酵豆浆的水提物含量。因此推测出除苷元型大豆异黄酮发挥清除自由基的功能,可能存在其它L.casei-16发酵豆浆的产物,也起到了保护HepG2肝癌细胞免受AAPH损伤的效果。其中可能性最大的应该是大豆多肽。乳酸菌可以分解大豆蛋白形成多肽,而大豆多肽具有抗氧化性[26-27]。
L.casei-16发酵豆浆醇提物和水提物的终浓度为500 μg/mL 时的细胞抗氧化效果显著(p<0.05)的高于终浓度为250、125 μg/mL时的效果,而终浓度为250、125 μg/mL 时,抗氧化效果无显著差异(p>0.05)。这说明浓度在250 μg/mL以下时,抗氧化作用的效果较差。
结合ORAC的结果来看,L.casei-16发酵豆浆醇提物的ORAC抗氧化效果和细胞抗氧化效果均显著(p<0.05)高于未发酵豆浆醇提物的效果。L.casei-16发酵豆浆水提物和未发酵豆浆水提物的ORAC效果无显著(p>0.05)差异,而L.casei-16发酵豆浆水提物的细胞抗氧化效果均显著(p<0.05)高于未发酵豆浆水提物的效果。具体原因有待进一步的研究。
3 结论
菌株L.casei-16发酵豆浆具有良好的抗氧化效果。通过L.casei-16发酵,豆浆中染料木素和大豆苷元的含量增加,从而使发酵豆浆抗氧化活性增强;L.casei-16发酵豆浆也可能产生其它代谢产物,具有抗氧化活性,还有待进一步研究。
参考文献:
[1]高冬,任成蓉,宋光运.氧化-抗氧化状态与临床疾病的相关性[J].海峡预防医学杂志,2015(2):24-26
[2]周光清,赵新军.亚健康与机体慢性氧化应激反应的相关性[J].广东医学,2014,35(13):2028-2030
[3]孙晓明.氧化应激与急性肝损伤[J].大家健康,2014(22):94
[4]谢雄泽,藕冉,姜妍,等.世界大豆需求与生产动向分析——PS&D Online50年统计数据[J].大豆科技,2015(2):30-37
[5]句连云,饶春平,高赟.大豆异黄酮的营养探究 [J].考试周刊,2012(71):196
[6]刘明,倪辉,吴永沛.大豆抗氧化活性肽研究进展 [J].食品科学,2006,27(12):897-901
[7]吴非,刘丽平,曾婷.发酵豆制品的抗氧化活性研究 [J].食品与发酵工业,2008,34(11):53-56
[8]翟齐啸.乳酸菌减除镉危害的作用及机制研究[D].无锡:江南大学,2015
[9]徐寅,黄玉军,陈霞,等.乳酸菌发酵豆乳体内外抗氧化效应研究[J].中国乳品工业,2012(8):16-19
[10]Zhai Q,Xiao Y,Tian F,et al.Protective effects of lactic acid bacteria-fermented soymilk against chronic cadmium toxicity in mice[J].RSC Advances,2015,5(6):4648-4658
[11]Donkor O N,Shah N P.Production of β-Glucosidase and Hydrolysis of Isoflavone Phytoestrogens by Lactobacillus acidophilus,Bifidobacterium lactis,and Lactobacillus casei in Soymilk[J].Journal of food science,2008,73(1):M15-M20
[12]Yin J Y,Nie S P,Zhou C,et al.Chemical characteristics and antioxidant activities of polysaccharide purified from the seeds of Plantagoasiatica L[J].Journal of the Science of Food and Agriculture,2010,90(2):210-217
[13]Chen Y F,Lee S L,Chou C C.Fermentation with Aspergillus awamori enhanced contents of amino nitrogen and total phenolics as well as the low-density lipoprotein oxidation inhibitory activity of black soybeans[J].Journal of agricultural and food chemistry,2011,59(8):3974-3979
[14]Xiao Y,Wang L,Rui X,et al.Enhancement of the antioxidant capacity of soy whey by fermentation with Lactobacillus plantarum B1-6[J].Journal of Functional Foods,2015,12:33-44
[15]Wang H,Guo X,Hu X,et al.Comparison of phytochemical profiles,antioxidant and cellular antioxidant activities of different varieties of blueberry(Vaccinium spp.)[J].Food chemistry,2017,217:773-781
[16]续洁琨,姚新生,栗原博.抗氧化能力指数 (ORAC)测定原理及应用[J].中国药理学通报,2006,22(8):1015-1021
[17]徐维盛,张桂雨,刘静,等.ORAC法评价16种茶叶的抗氧化能力[J].食品安全质量检测学报,2014(1):241-246
[18]Wolfe K L,Liu R H.Cellular antioxidant activity (CAA)assay for assessing antioxidants,foods,and dietary supplements[J].Journal of agricultural and food chemistry,2007,55(22):8896-8907
[19]郝青南,马超,马兵钢.大豆异黄酮的生理功能及其分离检测方法研究进展[J].中国医药生物技术,2007,2(5):383-386
[20]张玉梅,高旭年.紫外分光光度法测定大豆总异黄酮的含量[J].中国食品卫生杂志,2000,12(4):7-9
[21]许晶,张永忠,孙艳梅.β-葡萄糖苷酶的研究进展 [J].食品研究与开发,2005,26(6):183-186
[22]Liu R H,Finley J.Potential cell culture models for antioxidant research[J].Journal of agricultural and food chemistry,2005,53(10):4311-4314
[23]Frankel E N,Meyer A S.The problems of using one-dimensional methods to evaluate multifunctional food and biological antioxidants[J].Journal of the Science of Food and Agriculture,2000,80(13):1925-1941
[24]温斐婷,成向荣,陈侃俊,等.槲皮素-AAPH氧化产物结构鉴定及其对HepG2细胞氧化还原状态的影响 [J].安徽农业科学,2016,44(17):34-38,43
[25]蒋明哲,汤鋆,王惠华.应用高效液相色谱法测定保健食品中大豆异黄酮的含量[J].浙江预防医学,2010,22(3):91-92
[26]崔宪,刘容旭,姜帆,等.植物乳杆菌发酵对大豆分离蛋白功能性质影响研究[J].食品工业科技,2016,37(3):177-180,186
[27]陈美珍,余杰,郭慧敏.大豆分离蛋白酶解物清除羟自由基作用的研究[J].食品科学,2002,23(1):43-47

