黄曲霉核糖体蛋白基因在不同生长时期的表达分析
耿龙泼 王鑫旺 黄路华 邓基利 汪世华 张峰
(福建农林大学生命科学学院 福建省病原真菌与真菌毒素重点实验室,福州 350002)
黄曲霉是一种常见的腐生真菌,它在纬度为16°-35°的温带地区极易从土壤中分离得到[1]。黄曲霉能以菌核的形式存在于土壤中并且抵御极端环境,而后产生分生孢子在炎热干旱的环境条件下爆发[2]。黄曲霉作为人、动物和植物的共同病原菌,可引起人和动物的曲霉病。有报道称北美地区65%的儿童曲霉病是由黄曲霉引起的[3]。此外,黄曲霉还会侵染花生、玉米、棉籽、坚果、茶叶等作物[4]。全世界约有25%的谷物因污染真菌而不可食用,其中以黄曲霉的污染较为严重[5]。
黄曲霉除了自身能引起曲霉病和污染粮食作物的危害外,其另一个主要的危害是在生长发育的过程中产生的次级代谢产物黄曲霉毒素(Aflatoxin,AFT)。黄曲霉毒素是聚酮化合物衍生的二呋喃香豆素,其合成由靠近3号染色体端粒处的一个含29个基因的基因簇调控[6]。黄曲霉毒素在酸性和中性条件下较为稳定,难溶于水,而易溶于有机溶剂,且具有荧光特性[7]。常见的黄曲霉毒素有AFB1、AFB2、AFG1、AFG2、AFM1、AFM2等, 其 中 AFB1可以耐高温,并且AFB1也是毒性和致癌性较强的物质[8-9]。研究表明,当黄曲霉的分生孢子和菌核的发育受到影响时,菌株几乎失去毒素合成的能力[10]。此外,当黄曲霉的分生孢子产量增多时,菌株的毒素合成量也有所提高[11]。这暗示黄曲霉的生长发育能够影响其毒素的产生。
核糖体蛋白作为核糖体的主要组成成分,除了在细胞内蛋白质生物合成中发挥着重要作用外,还具有其他的生物学功能。有研究表明抗黄曲霉品种的花生种子在发育时核糖体蛋白L41的表达比敏感品种中多,说明核糖体蛋白与植物的抗逆境能力息息相关[12]。也有研究表明核糖体蛋白L13可以结合去乙酰化酶SirT1,促进其泛素化,从而抑制细胞周期和细胞凋亡[13]。在蛋白质组水平对黄曲霉可变剪接的检测结果发现,核糖体蛋白L32存在着不同的剪接方式,这暗示了黄曲霉核糖体蛋白的不同表达方式可能在细胞中担负着不同的生物学功能[14]。利用稳定的同位素标记法对产毒和非产毒状态的黄曲霉总蛋白进行标记,分析发现核糖体蛋白L27的表达量存在差异,说明黄曲霉特定核糖体蛋白的表达量与其产毒存在着重要联系[15]。
基于此,我们通过荧光定量RT-PCR对黄曲霉各个发育时期的74个核糖体蛋白mRNA进行定量,以期找出与黄曲霉生长发育紧密联系的核糖体蛋白,为今后揭示核糖体蛋白调控黄曲霉生长发育的机制奠定基础。
1 材料与方法
1.1 材料
本研究所用的黄曲霉菌株为Aspergillus flavusNRLL3357(由中山大学贺竹梅教授惠赠)。将少量黄曲霉孢子接种于PDA(Difco)培养基上,于37℃黑暗恒温培养5 d后收集孢子,制备成孢子悬液。取106个孢子均匀涂布于铺有玻璃纸的Wickerham[16]培养基上,分别于37℃黑暗恒温培养1 d、3 d、7 d后收集样品,命名为菌丝期、孢子期、菌核期,每组3个平行,样品收集后用液氮迅速冷冻,于-80℃保存备用。
黄曲霉核糖体蛋白mRNA序列从NCBI(National Center for Biotechnology Information)网站获得,荧光定量PCR引物设计使用软件Primer 5.0,引物合成由北京六合华大基因科技股份有限公司完成。
1.2 方法
1.2.1 总RNA的提取 称取0.15 g菌体,加入1 mL冰上预冷的Trizol(Invitrogene),再加入0.2 mL直径1.5 mm的磁珠,在组织破碎仪上65 Hz震荡破碎90 s,5 000 r/min低温离心2 min。取上清,加入200 μL氯仿,剧烈震荡1 min,冰上放置10 min,12 000 r/min低温离心15 min。取500 μL上清液至新的EP(RNase free)管中,加入500 μL异丙醇,颠倒混匀,冰上放置10 min,12 000 r/min低温离心15 min。弃上清,加入1 mL 75%的乙醇(DEPC水配制)洗涤沉淀,10 000 r/min低温离心5 min。弃上清,静置晾干沉淀,加入30 μL DEPC水溶解沉淀,使用琼脂糖凝胶和Nanodrop 2000分光光度计检测总RNA的质量和纯度,-80℃保存备用。
1.2.2 逆转录合成cDNA 取2 μg的RNA加入2 μL oligo(dT)18(10 mmol/L)引物并用DEPC水补齐至15 μL,70℃变性5 min,迅速转移至冰上,冷却2 min。向上述溶液中加入 0.5 μL RTase(Promega)、0.2 μL RNase Inhibitor(TaKaRa)、1.5 μL dNTP、5 μL RT buffer 和 2.8 μL DEPC 水,混匀,42℃反转录反应2 h,即得到cDNA。
1.2.3 荧光定量RT-PCR 将上述反转录得到的cDNA稀释10倍用于荧光定量RT-PCR反应,体系为 :3 μL cDNA,1 μL 引物 F(5 μmol/L),1 μL 引物R(5 μmol/L),5 μL 2×SYBR Green Mix(ABI),总体积10 μL。荧光定量RT-PCR扩增条件如下:预变性,95℃ 7 min;PCR 反应,95℃ 15 s,56℃ 15 s,72℃ 45 s,循环40次。在72℃采集和记录荧光。然后保持95℃ 15 s,60℃ 1 min,每10 s 加0.5℃直到95℃扩增结束。反应在ABI StepSnePlus 实时荧光定量PCR仪上进行。选择β-tubulin作为内参基因,每组样品3个平行,目标基因的相对表达量采用2-ΔΔCt法计算[17]。使用GraphPad Prism 5进行统计和显著性分析,Tukey多重比较用于显著性分析,如果P<0.05,则认为显著。
1.2.4 黄曲霉核糖体蛋白基因功能预测 Gene Ontology功能分析数据在DAVID网站获得(https://david.ncifcrf.gov/),GO功能富集分析使用OmicShare工具(www.omicshare.com/tools)。
2 结果
2.1 黄曲霉不同生长时期的菌落形态
黄曲霉孢子在Wickerham培养基上37℃黑暗条件下培养1 d后,孢子在培养基上萌发生长出白色的菌丝,为黄曲霉的菌丝期(图1)。当培养到第3天时,菌落呈现出绿色,显微镜观察发现此时的菌丝会长出分生孢子头,为黄曲霉的孢子期(图2)。当培养到第7天时,培养基的营养成分大部分被利用完,部分菌丝会凋亡,此时的菌落呈现出灰绿色。当用75%的酒精喷洗掉菌落表面的孢子和菌丝,可以明显看到形成的具有抗逆性的黑灰色菌核,为黄曲霉的菌核期(图3)。
2.2 荧光定量RT-PCR分析结果
对提取的各时期的总RNA检测显示完整性好且质量符合要求后,反转录获得cDNA,用于荧光定量RT-PCR检测。荧光定量RT-PCR检测结果表明,在所有检测的核糖体蛋白基因中,没有一个基因的表达量在3个时期是恒定的。如果以菌丝期作为参照,在孢子期共有54个核糖体蛋白基因的表达量上调,而在菌核期有57个核糖体蛋白基因的表达量上调,其中在孢子期、菌核时期表达量均上调的基因有42个(图4-A)。但是,与菌丝期相比,只有2个核糖体蛋白的基因表达量在孢子期下调,而在菌核期表达量下调的核糖体蛋白基因有12个,在孢子期、菌核时期表达量均下调的基因有2个(图4-B)。由此可见,黄曲霉核糖体蛋白的表达量与菌株的生长发育密切相关,且在孢子期参与生命活动的核糖体蛋白数目最多,菌核期次之,菌丝期最少。
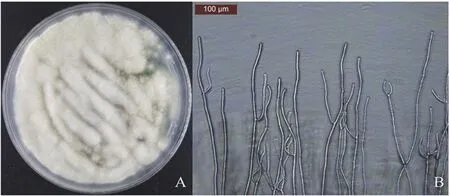
图1 黄曲霉菌丝时期的菌落形态

图2 黄曲霉孢子时期的菌落形态
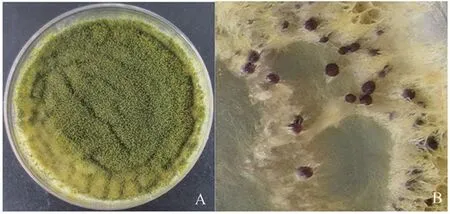
图3 黄曲霉菌核时期的菌落形态
通过进一步分析发现,多数核糖体蛋白基因从菌丝期发展到孢子期和菌核期后发生了明显上调,且大致可以分为以下两类:(1)在孢子期和菌核期有42个基因的表达量均上调,且存在显著差异(P<0.05)。它们可以分为3种情况:第一种情况是相比菌丝期表达量上调,但在孢子期、菌核期之间表达量无显著差异的基因有9个,其中核糖体大亚基蛋白基因有2个,核糖体小亚基蛋白基因有7个(图5-A)。第二种情况是在孢子期的表达量比菌核期多的基因有9个,其中核糖体大亚基蛋白基因有4个,核糖体小亚基蛋白基因有5个(图5-B)。第3种情况是在菌核期的表达量比孢子期多的基因共有24个,其中核糖体大亚基蛋白基因有15个(图5-C),核糖体小亚基蛋白基因有9个(图5-D)。值得一提的是,大亚基L9、L25p、L27、L31的表达量是菌丝期的数十倍。(2)共有27个核糖体蛋白基因的表达量只在孢子期或菌核期单一时期上调,且存在显著差异(P<0.05)。有12个基因的表达量只在孢子期出现上调(图6-A),有15个基因的表达量只在菌核期出现上调(图6-B)。有趣的是,这15个只在菌核期表达上调的基因在菌丝期、孢子期的表达量都没有明显的差异。
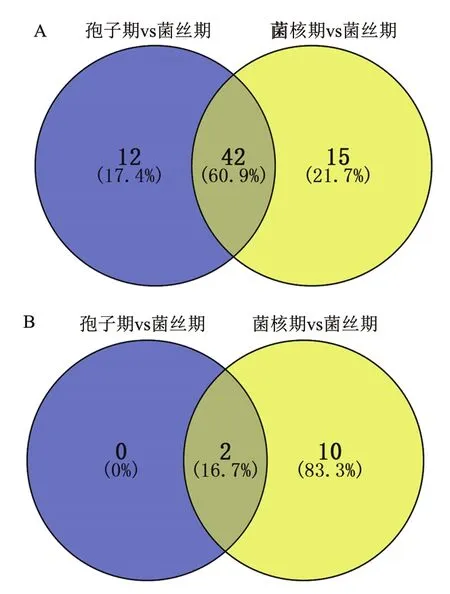
图4 差异表达基因在不同时期的分布
此外,与菌丝期相比,L13、S0在孢子期、菌核期的表达量均有所降低,且存在显著差异(P<0.05)。虽然L17、S2、S10在菌丝期、孢子期的表达量没有明显差异,但在菌核期的表达量却有所降低,且存在显著差异(P<0.05)(图7)。除了这5个基因之外,L2、L5、L7、L8、L12、S3、S6等7个基因在孢子期表达上调,但是在菌核期明显下调,且存在显著差异(P<0.05)。
2.3 黄曲霉核糖体蛋白基因功能富集分析
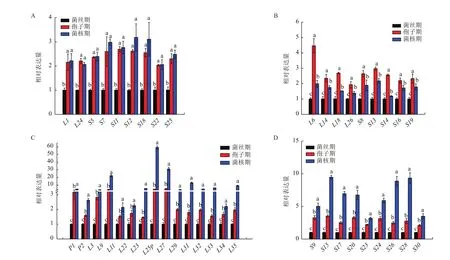
图5 孢子期和菌核期表达量均上调的核糖体蛋白基因的表达分析
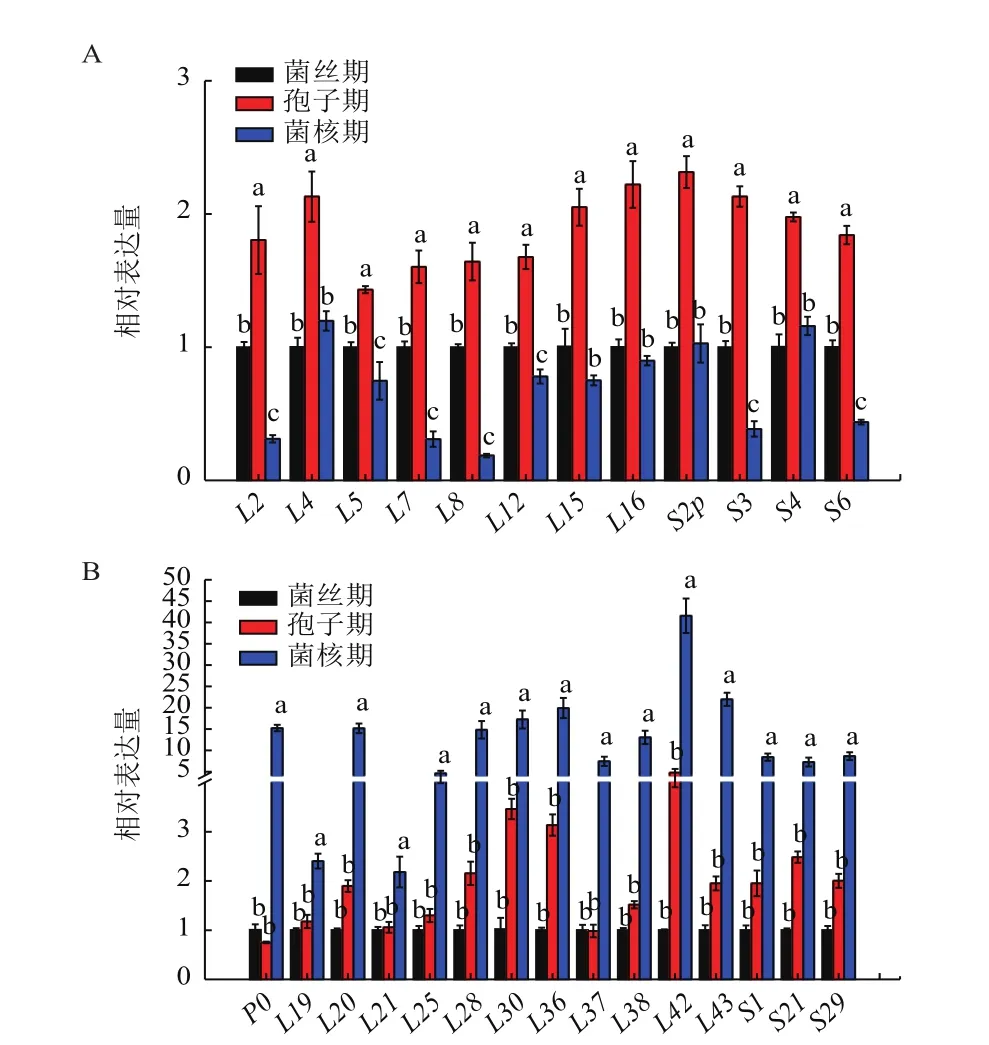
图6 孢子期或菌核期表达量上调的核糖体蛋白基因的表达分析
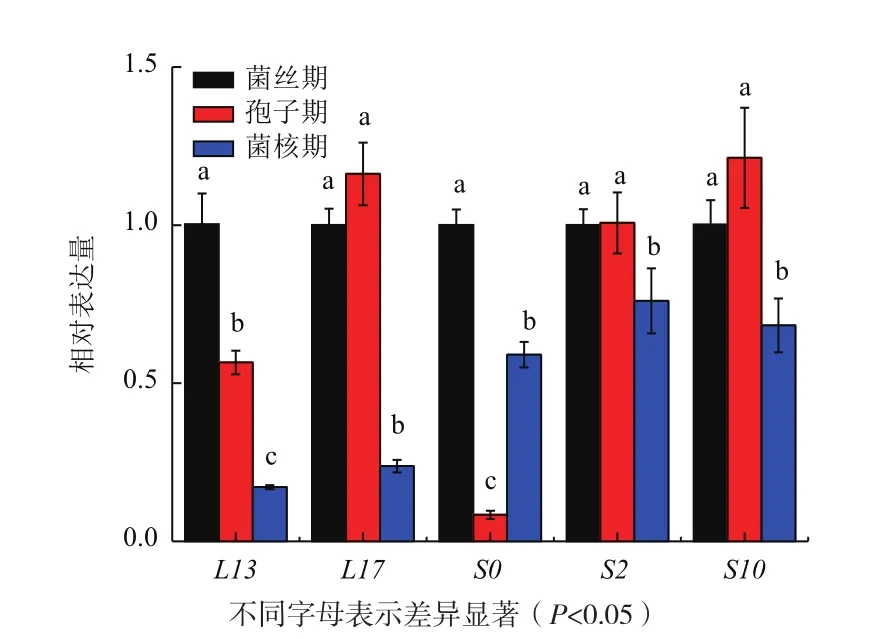
图7 表达量下调的核糖体蛋白基因的表达分析
对黄曲霉核糖体蛋白基因进行GO分类,得到包括分子功能,细胞组分和生物过程3部分,共9个类别的结果(表1)。总共富集得到2种分子功能,即结构分子活性功能(6个基因)和结合功能的(3个基因),其中S15既具有结构分子活性又具有结合功能。富集得到包含细胞、细胞部分、大分子复合物、细胞器和细胞器部分的5种细胞组分,其中L17、S0、S1、S15、S20在这5种细胞组分中均有出现。富集得到包括细胞过程和代谢过程在内的2种生物过程,P1、P2、L12、L21、L27、L34、S12、S24均参与这2种生物过程。值得注意的是,L21在所得到的分类中均有出现,而S15同时出现在分子功能和细胞组分的分类中。这暗示上述两种核糖体蛋白可能具有较为重要的作用。
3 讨论
核糖体蛋白作为核糖体的主要组成成分,除了在细胞内蛋白质生物合成中发挥着重要作用外,还具有其他的核糖体外生物学功能。为了探究黄曲霉核糖体蛋白与其生长发育之间的关系,我们利用荧光定量RT-PCR对黄曲霉菌丝期、孢子期、菌核期的74个核糖体蛋白基因的表达量进行分析,结果表明在黄曲霉生长发育的不同时期,核糖体蛋白基因的表达量存在明显差异。
荧光定量RT-PCR结果表明,以菌丝期作为参照,共有54个核糖体蛋白基因的表达量在孢子期出现上调,在菌核期表达量上调的核糖体蛋白基因也有57个,且都存在显著差异(P<0.05)。引起这一现象的原因可能是黄曲霉完成其初始生长阶段,以孢子的形成为代表的发育阶段开始进行,菌体的发育及代谢的增多需要多种效应基因的响应,因而在孢子期和菌核期表达量上调的基因数量增多。如GO功能分析得到的分子功能中发挥结合功能的L1、L9、S15的表达量在孢子期或菌核期出现上调,这些核糖体蛋白的增多能够结合rRNA形成更多的核糖体来发挥功能。参与细胞过程和代谢过程的P1、P2、L12、L21、L27、L34、S12、S24的表达量在孢子期或菌核期也出现上调。此外,有研究表明糖体蛋白L11、L23、S7能够诱导细胞凋亡[18-20],这3个基因的表达量在黄曲霉的孢子期和菌核期均出现上调,可能与菌体的逐渐衰老凋亡有关。

表1 黄曲霉核糖体蛋白基因GO分类
与菌丝期相比,有2个核糖体蛋白基因的表达量在孢子期是下调的,而到了菌核时期表达量下调的核糖体蛋白基因有12个。引起这一变化的原因可能是随着发育的进行菌体内活性氧水平逐渐升高,高水平的活性氧促进了菌核的形成,但菌体中的氧化应激引起了内质网应激反应,在核糖体蛋白基因的表达上表现出效应[21-22],因而使得在表达的核糖体蛋白基因减少。此外,有实验表明核糖体蛋白L7的表达量下调明显与细胞的衰老有关[23]。黄曲霉进入菌核期后,核糖体蛋白L7的表达量出现明显下调,可能与该时期菌体的衰老有关。李红艳[24]发现核糖体蛋白S3的表达减少导致细胞凋亡而引起果蝇幼虫发育的迟缓。当黄曲霉进入生长发育的孢子期,核糖体蛋白S3的表达量明显比菌丝期上调,而进入生长发育缓慢的菌核期后,核糖体蛋白S3的表达量明显下调,暗示了核糖体蛋白S3在果蝇和黄曲霉中可能发挥相同的作用。
用可引起DNA损伤的重金属镉处理香鱼肝细胞,荧光定量RT-PCR检测结果表明核糖体蛋白P0的表达增加,表明核糖体蛋白P0与DNA的损伤修复有关[25]。黄曲霉进入菌核期后,核糖体蛋白P0的表达量明显上调,可能是这一时期菌体中高水平的活性氧引起DNA的损伤,因而使得具有修复功能的蛋白P0的表达量上调。在应激条件下,去乙酰化酶SirT1可以增强细胞的自我修复,延长细胞寿命,而核糖体蛋白L13可以结合SirT1,促进其泛素化降解[13]。在黄曲霉的孢子期和菌核期,核糖体蛋白L13的表达量逐渐出现下调,可能与响应应激及延长菌体寿命有关。
虽然本研究从转录水平证实了黄曲霉核糖体蛋白与其生长发育之间存在着紧密联系,但每个核糖体蛋白在生长发育过程中的具体作用还有待进一步的鉴定。
4 结论
本研究通过对黄曲霉菌丝期、孢子期、菌核期的74个核糖体蛋白基因的表达量分析发现,没有一个被检测的核糖体蛋白基因的表达量在三个时期都是恒定的。分析结果表明在孢子期参与生命活动的核糖体蛋白数目最多,菌核期次之,菌丝期最少。对黄曲霉核糖体蛋白基因进行GO功能分析表明,9个基因富集于2种分子功能,10个基因富集于5种细胞组分,有8个基因参与到细胞过程和代谢过程的生物过程中。可见核糖体蛋白与黄曲霉的生长发育具有紧密联系,而其在生长发育中具体的调控机制还有待进一步的研究。
[1] Scheidegger KA, Payne GA. Unlocking the secrets behind secondary metabolism:A review ofAspergillus flavusfrom pathogenicity to functional genomics[J]. Journal of Toxicology-Toxin Reviews,2003, 22(2-3):423-459.
[2] Amaike S, Keller NP.Aspergillus flavus[J]. Annu Rev Phytopathol, 2011, 49:107-133.
[3] Steinbach WJ. Pediatric aspergillosis:disease and treatment differences in children[J]. Pediatr Infect Dis J, 2005, 24(4):358-364.
[4] Fountain JC, Scully BT, Ni X, et al. Environmental influences on maize-Aspergillus flavusinteractions and aflatoxin production[J].Front Microbiol, 2014, 5:40.
[5] 罗自生, 秦雨, 徐艳群, 等. 黄曲霉毒素的生物合成、代谢和毒性研究进展[J]. 食品科学, 2015, 36(3):250-257.
[6] 王后苗, 廖伯寿, 雷永, 等. 黄曲霉菌主要真菌毒素次级代谢与调控的研究进展[J]. 微生物学通报, 2014, 41(7):1425-1438.
[7] 劳文艳, 林素珍. 黄曲霉毒素对食品的污染及危害[J]. 北京联合大学学报:自然科学版, 2011, 25(1):64-69.
[8] Roze LV, Hong SY, Linz JE. Aflatoxin biosynthesis:current frontiers[J]. Annu Rev Food Sci Technol, 2013, 4 :293-311.
[9] 沈青山, 周威, 莫海珍, 等. 黄曲霉毒素污染控制的研究进展[J]. 食品科学 , 2016, 37(09):237-243.
[10] Cary JW, Harris-Coward PY, Ehrlich KC, et al. NsdC and NsdD affectAspergillus flavusmorphogenesis and aflatoxin production[J]. Eukaryot Cell, 2012, 11(9):1104-1111.
[11]Chang PK, Scharfenstein LL, Luo M, et al. Loss of msnA, a putative stress regulatory gene, inAspergillus parasiticusandAspergillus flavusincreased production of conidia, aflatoxins and kojic acid[J]. Toxins(Basel), 2011, 3(1):82-104.
[12] 严海燕, 宗成志, 马国华, 等. 核糖体蛋白L41与黄曲霉抗性的关系[J]. 华北农学报, 2011, 26(6):16-19.
[13] 郑怡. 核糖体蛋白L13与去乙酰化酶SirT1之间的关系及其生物学功能的研究[D]. 上海:华东师范大学, 2013.
[14] Chang K, Georgianna D, Heber S, et al. Detection of alternative splice variants at the proteome level inAspergillus flavus[J]. J Proteome Res, 2010, 9(3):1209-1217.
[15] Georgianna DR, Hawkridge AM, Muddiman DC, et al. Temperaturedependent regulation of proteins inAspergillus flavus:whole organism stable isotope labeling by amino acids[J]. J Proteome Res, 2008, 7(7):2973-2979.
[16] Chang PK, Scharfenstein LL, Mack B, et al. Deletion of theAspergillus flavusorthologue ofA. nidulansfluGreduces conidiation and promotes production of sclerotia but does not abolish aflatoxin biosynthesis[J]. Appl Environ Microbiol, 2012, 78(21):7557-7563.
[17] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J]. Methods, 2001, 25(4):402-408.
[18] Calvo AM, Cary JW. Association of fungal secondary metabolism and sclerotial biology[J]. Front Microbiol, 2015, 6:62.
[19] Zhang Y, Wolf GW, Bhat K, et al. Ribosomal protein L11 negatively regulates oncoprotein MDM2 and mediates a p53-dependent ribosomal-stress checkpoint pathway[J]. Mol Cell Biol, 2003, 23(23):8902-8912.
[20] Zhang Y, Shi Y, Li X, et al. Inhibition of the p53-MDM2 interaction by adenovirus delivery of ribosomal protein L23 stabilizes p53 and induces cell cycle arrest and apoptosis in gastric cancer[J]. J Gene Med, 2010, 12(2):147-156.
[21] Chen D, Zhang Z, Li M, et al. Ribosomal protein S7 as a novel modulator of p53-MDM2 interaction:binding to MDM2,stabilization of p53 protein, and activation of p53 function[J].Oncogene, 2007, 26(35):5029-5037.
[22] Georgiou CD, Patsoukis N, Papapostolou I, et al. Sclerotial metamorphosis in filamentous fungi is induced by oxidative stress[J]. Integr Comp Biol, 2006, 46(6):691-712.
[23] Malhotra JD, Kaufman RJ. Endoplasmic reticulum stress and oxidative stress:a vicious cycle or a double-edged sword?[J].Antioxid Redox Signal, 2007, 9(12):2277-2293.
[24] Seshadri T, Uzman J, Oshima J, et al. Identification of a transcript that is down-regulated in senescent human fibroblasts. Cloning,sequence analysis, and regulation of the human L7 ribosomal protein gene[J]. J Biol Chem, 1993, 268(25):18474-18480.
[25] 李红艳. 核糖体蛋白S3表达减少对果蝇发育的影响[J]. 重庆师范大学学报:自然科学版, 2014, 31(3):21-25.
[26] Lu X, Chen J, Huang Z, et al. Influence of acute cadmium exposure on the liver proteome of a teleost fish, ayu(Plecoglossus altivelis)[J]. Mol Biol Rep, 2012, 39(3):2851-2859.

