PEG功能化1,3-二唑盐的合成及在水相Heck反应中的研究
, ,
(浙江工业大学 化学工程学院,浙江 杭州 310014)
目前,环境问题日益严峻,减少三废的排放、节约能耗和实现可持续发展等理念都将成为科学家们设计新的化学反应体系的初衷.无毒试剂、溶剂和催化剂的应用甚至是无溶剂反应的开发成为研究的热点[1].水具有资源丰富、无毒、低挥发性、安全及与大多数有机产物容易分离等特点,将水作为溶剂在很多有机合成上得到成功的应用[2].此外,水作为反应介质往往由于其独特的物理化学性质从而提高化学反应的活性和选择性[3-4].
钯催化交叉偶联形成碳—碳键和碳—杂键是现代有机合成的一类重要反应之一,广泛用于药物、天然产物和功能材料等方面[5].为了提高钯的催化效率和反应的选择性,这些反应大多数需要一些大位阻和富电性的配体参与,主要是一些含膦、氮和卡宾的化合物,但这些化合物极不稳定[6].N-杂环卡宾(NHCs)具有很强的给电子能力,在空气和水中稳定性高,而且容易修饰,活性可调,是最具有应用前景的配体[7-8].同时,在NHCs的结构上,修饰亲水性的基团如羧基、磺酸基、胺基和羟基等官能团[9-11],或者将其负载在水溶性的有机聚合物上,可以增加其水溶性,从而应用于水相钯催化的交叉偶联反应[12].但是,目前为止这些水溶性的NHCs配体大多数应用于催化Suzuki反应,只有极少数用于催化Heck反应[13-14].基于此,笔者设计并合成了4种PEG功能化1,3-二唑盐(L1-L4),将其作为NHCs前体和Na2PdCl4原位生成钯卡宾络合物用于纯水相的Heck反应的催化研究.
1 实验部分
1.1 试剂与仪器
所有反应在氮气氛围中进行,试剂和溶剂均为国产试剂,使用前均无需特殊处理,所用仪器为:SHIMADZU GC-2010 Plus气相色谱仪,Thermo Trace GC Ultra-ISQ 气质联用仪,Bruker DRX 500核磁共振仪等.
1.2 PEG功能化1,3-二唑盐L1-L4的合成
PEG功能化1,3-二唑盐L1-L4的合成式为以制备PEG功能化咪唑盐L1为例,操作过程如下:
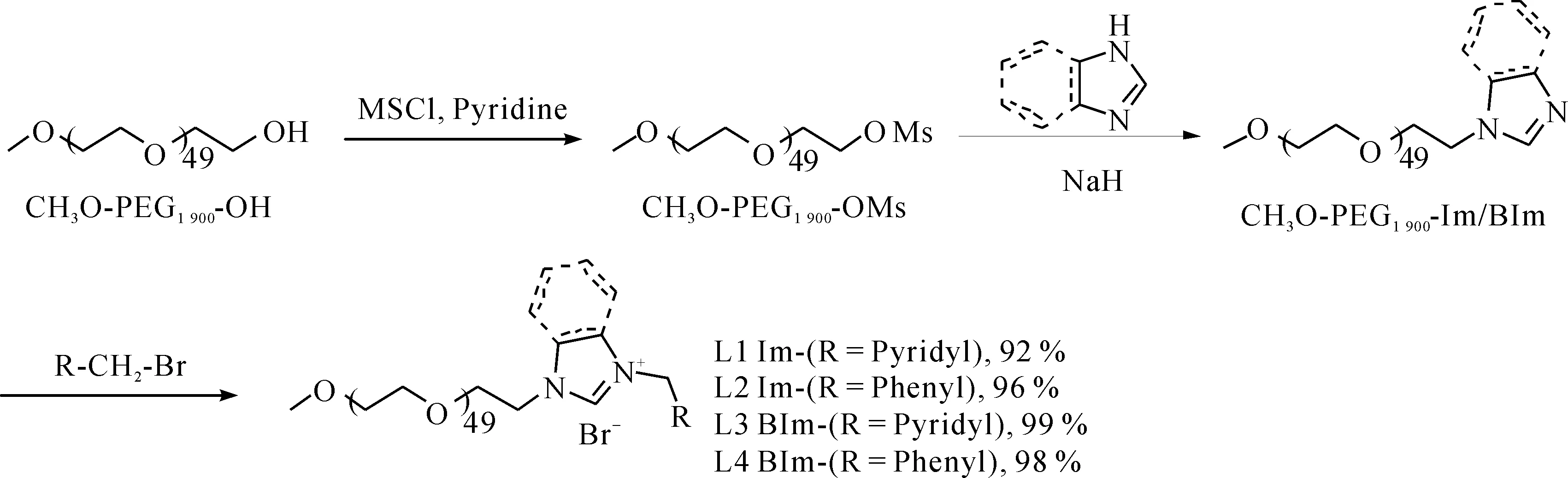
1) 在500 mL三口烧瓶中加入单甲基化的PEG1 900(CH3O-PEG1 900-OH)(38.0 g,20 mmol)、甲磺酰氯(4.58 g,40 mmol)、200 mL二氯甲烷,将烧瓶置于冰水浴中搅拌溶清.氮气保护下,缓慢滴加吡啶(3.16 g,40 mmol)溶于40 mL二氯甲烷的溶液,滴加过程中保持反应液温度<10 ℃,滴毕,室温下搅拌反应24 h后,将反应瓶置于冰水浴中,用NaOH水溶液(质量分数20%),调节至弱碱性(pH为8~9).分出有机层,水层用100 mL二氯甲烷萃取,合并有机相后,依次用饱和NaHCO3水溶液,饱和NaCl水溶液洗涤数次,无水Na2SO4干燥,过滤,滤液真空浓缩回收溶剂,残液滴加至甲基叔丁基醚中,析出固体,过滤,重复处理2次,35 ℃下真空干燥6 h,得到CH3O-PEG1 900-OMs白色固体38.3 g,收率96%.产物表征如下:1H NMR (500 MHz, CDCl3) δ 4.34~4.32 (m, 2H, CH2OMs),3.74~3.44 (m,198H, PEG-H),3.33 (s,3H, PEG-OCH3),3.04 (s,3H, OSO2CH3);13C NMR (125 MHz, CDCl3) δ 71.9~68.2 (CPEG),60.7,58.2,36.8.
2) 在氮气保护下,往250 mL三口烧瓶中加入干燥的THF 120 mL、咪唑(0.89 g,13 mmol),待温度升至40 ℃,分批加入NaH(0.80 g,20 mmol,质量分数60%),至不再有氢气放出后,加入CH3O-PEG1 900-OMs(19.7 g,10 mmol),升温至回流,反应24 h后,反应液冷却至室温,过滤,除去不溶物,母液真空浓缩回收溶剂,残液滴加至甲基叔丁基醚中,析出固体,过滤,重复处理2次,35 ℃下真空干燥6 h,得到CH3O-PEG1 900-Im,米白色固体18.2 g,收率93%.产物表征如下:1H NMR (500 MHz, CDCl3) δ 7.50 (s, 1H, CHimid),6.96 (s, 1H, CHimid),6.95(s, 1H, CHimid),4.05(t,J=5.2 Hz,2H, OCH2),3.68(t,J=5.2 Hz,2H, NCH2),3.58~3.42(m,196H, PEG-H),3.30(s,3H, PEG-OCH3);13C NMR(125 MHz, CDCl3) δ 136.8,128.2,118.8,71.2~69.8(CPEG),58.2,46.2.
按照上述方法,用苯并咪唑代替咪唑类似的制得CH3O-PEG1 900-BIm.米白色固体,收率95%.产物表征如下:1H NMR (500 MHz, CDCl3) δ 7.94 (s, 1H, CHimid),7.71 (d,J=7.0 Hz,1H, CHAr),7.35 (d,J=7.2 Hz, 1H, CHAr),7.20 (m, 2H, CHAr),4.28 (t,J=5.2 Hz, 2H, OCH2), 3.76 (t,J=5.2 Hz, 2H, NCH2),3.71~3.42 (m,196H, PEG-H),3.30 (s,3H, PEG-OCH3);13C NMR (125 MHz, CDCl3) δ 143.3,143.1,133.3,122.1,121.3,119.6,109.1,71.3~68.9 (CPEG),58.4,44.4.




1.3 PEG功能化1,3-二唑盐催化合成二苯乙烯类化合物的典型过程
以苯乙烯和对溴苯乙酮的反应为例,在15 mL的Young管中,依次加入四氯钯酸钠(0.147 g,0.000 5 mmol,0.1%水溶液)、PEG功能化1,3-二唑盐(0.106 g,0.000 5 mmol,1%水溶液),混合均匀后,加入乙醇钠(0.136 g,2 mmol)、水1.25 mL(共1.5 mL)在60 ℃下密封搅拌30 min.之后,再加入对溴苯乙酮(0.199 g,1 mmol)、苯乙烯(0.125 g,1.2 mmol),在氮气保护下100 ℃磁力搅拌反应12 h.反应采用气相色谱法(GC)检测,反应结束后,用乙酸乙酯(10 mL×5)萃取反应液,合并有机相,旋转蒸发除去溶剂后得到粗产品,而后经过柱层析分离纯化(乙酸乙酯/石油醚为洗脱剂),得到目标产物.产物的结构通过1H NMR,13C NMR和GC-MS表征确认.GC分析的条件为:DB-5色谱柱(30 m×0.32 mm(内径)×0.25(m(液膜厚度);柱温:起始温度为80 ℃,保持2 min,以25 ℃/min的速度程序升温至280 ℃,保持6 min;载气为N2,流速1.0 mL/min,分流比30∶1,FID检测器.
产物表征如下:
(反)-4-乙酰基二苯乙烯(Ⅲa)为淡黄色固体;熔点141~142 ℃;1H NMR (500 MHz, CDCl3): δ 7.97 (d,J=8.3 Hz,2H),7.61 (d,J=8.3 Hz,2H),7.56 (d,J=7.5 Hz,2H),7.42~7.39 (m,2H),7.34~7.31(m,1H),7.25(d,J=16.4 Hz,1H),7.15 (d,J=16.4 Hz,1H),2.63(s,3H);13C NMR (125 MHz, CDCl3): δ 197.5,142.0,136.7,136.0,131.5,128.9,128.8,128.3,127.5,126.8,126.5,26.6;GC-MS (EI):m/z222 (M+,55),207 (100).
(反)-4-醛基二苯乙烯(Ⅲb)为黄色固体;熔点111~112 ℃;1H NMR (500 MHz, CDCl3) δ 10.01 (s,1H),7.89 (d,J=8.2 Hz,2H),7.68 (d,J=8.2 Hz,2H),7.57 (d,J=7.4 Hz,2H),7.41(t,J=7.6 Hz,2H),7.33(t,J=7.4 Hz,1H),7.28(d,J=16.4 Hz,1H),7.16(d,J=16.4 Hz,1H);13C NMR(125 MHz, CDCl3) δ 191.6,143.5,136.6,135.4,132.2,130.3,128.9,128.5,127.4,126.9;GC-MS (EI):m/z208 (M+,90),179(100).
(反)-4-硝基二苯乙烯(Ⅲc)为黄色固体;熔点157~158 ℃;1H NMR (500 MHz, CDCl3):δ 8.13 (d,J=8.8 Hz,2H),7.55(d,J=8.8 Hz,2H),7.47(d,J=7.5 Hz,2H),7.32 (t,J=7.5 Hz,2H),7.25(t,J=7.3 Hz,1H),7.19(d,J=16.3 Hz,1H),7.06(d,J=16.3 Hz,1H);13C NMR (125 MHz, CDCl3) δ 146.8,143.9,136.2,133.4,128.9,128.8,127.0,126.9,126.3,124.2; GC-MS (EI):m/z225(M+,55),179(100).
(反)-4-三氟甲基二苯乙烯(Ⅲd)为白色固体;熔点131~133 ℃;1H NMR (500 MHz, CDCl3) δ 7.69~7.60 (m,4H),7.57 (d,J=7.4 Hz,2H),7.42 (t,J=7.6 Hz,2H),7.35 (t,J=7.3 Hz,1H),7.23 (d,J=16.4 Hz,1H),7.15 (d,J=16.4 Hz,1H);13C NMR (125 MHz, CDCl3) δ 140.8,136.6,131.2,129.2 (q,J=32.2 Hz),128.8,128.3,127.1,126.8,126.6,125.6(q,J=3.8 Hz),124.3 (q,J=270.0 Hz); GC-MS (EI):m/z248(M+,91),179(100).
(反)-4-氟二苯乙烯(Ⅲe)为白色固体;熔点120~121 ℃;1H NMR (500 MHz, CDCl3) δ 7.37 (m,4H),7.25 (m,2H),7.16 (m,1H),6.93 (m,4H).13C NMR (125 MHz, CDCl3) δ 162.3 (d,J=246.3 Hz),137.2,133.5 (d,J=3.8 Hz),128.7,128.5,128.0 (d,J=7.5 Hz),127.7,127.5,126.4,115.6 (d,J=21.3 Hz); GC-MS (EI):m/z198.14(M+,100).
(反)-4-氯二苯乙烯(Ⅲf)为白色固体;熔点127~129 ℃;1H NMR (500 MHz, CDCl3) δ 7.56~7.50 (m,2H),7.49~7.43 (m,2H),7.39 (t,J=7.7 Hz,2H),7.36~7.32 (m,2H),7.32~7.28 (m,1H),7.14~7.04 (m,2H);13C NMR (125 MHz, CDCl3) δ 137.0,135.9,133.2,129.3,128.9,128.8,127.9,127.7,127.4,126.6; GC-MS (EI):m/z214(M+,63),216(M++2,21),179(100).
(反)-4-溴二苯乙烯(Ⅲg)为白色固体;熔点137~138 ℃;1H NMR (500 MHz, CDCl3) δ 7.54~7.49 (m,4H), 7.44~7.36 (m,4H),7.31 (t,J=7.4 Hz,1H),7.13 (d,J=16.4 Hz,1H),7.06 (d,J=16.4 Hz,1H);13C NMR (125 MHz, CDCl3) δ 137.0,136.3,131.8,129.4,128.7,128.0,127.9,127.4,126.6,121.3; GC-MS (EI):m/z258(M+,46),260(M++2,47),179(100).
(反)-1,2-二苯乙烯(Ⅲh)为白色固体;熔点121~122 ℃;1H NMR (500 MHz, CDCl3) δ 7.57 (d,J=7.5 Hz,4H),7.41 (t,J=7.5 Hz,4H),7.32 (d,J=7.4 Hz,2H),7.17 (s,2H).13C NMR (125 MHz, CDCl3) δ 137.3,128.7,127.6,126.5; GC-MS (EI):m/z180(M+,100).
(反)-4-甲基二苯乙烯(Ⅲi)为白色固体;熔点118~119 ℃;1H NMR (500 MHz, CDCl3) δ 7.55 (d,J=8.3 Hz,2H),7.46 (d,J=8.3 Hz,2H),7.40 (t,J=7.7 Hz,2H),7.29 (t,J=7.2 Hz,1H),7.21 (d,J=7.9 Hz,2H),7.16~7.08 (m,2H),2.40 (s,3H).13C NMR (125 MHz, CDCl3) δ 137.5,134.6,129.4,128.65,128.62,127.7,127.4,126.43,126.40,21.3; GC-MS (EI):m/z194(M+,79),179(100).
(反)-4-胺基二苯乙烯(Ⅲj)为淡黄色固体;熔点149~151 ℃;1H NMR (500 MHz, CDCl3) δ 7.49 (d,J=7.5 Hz,2H),7.32 (t,J=7.7 Hz,2H),7.28 (d,J=8.4 Hz,2H),7.18 (t,J=7.3 Hz,1H),7.06 (d,J=16.4 Hz,1H),6.89 (d,J=16.4 Hz,1H),6.56 (d,J=8.4 Hz,2H),5.33 (s,2H);13C NMR (125 MHz, CDCl3) δ 148.8,138.0,129.1,128.6,127.7,126.5,125.8,124.7,122.8,113.9; GC-MS (EI):m/z195(M+,100).
(反)-3-醛基二苯乙烯(Ⅲk)为黄色固体;熔点102~103 ℃;1H NMR (500 MHz, CDCl3)δ 10.07 (s,1H),8.04 (s,1H),7.77(t,J=6.9 Hz,2H),7.58~7.52(m,3H),7.41(t,J=7.6 Hz,2H),7.32(t,J=7.3 Hz,1H),7.23(d,J=16.4 Hz,1H),7.16(d,J=16.4 Hz,1H);13C NMR (125 MHz, CDCl3) δ 192.3,138.4,136.8,136.7,132.3,130.5,129.4,128.9,128.8,128.2,127.2,127.1,126.7; GC-MS (EI):m/z208(M+, 88),179(100).
(反)-2-醛基二苯乙烯(Ⅲl)为黄色液体;1H NMR (500 MHz, CDCl3) δ 10.35 (s,1H),8.07 (d,J=16.2 Hz,1H),7.87 (d,J=7.8 Hz,1H),7.75 (d,J=7.8 Hz,1H),7.63~7.57 (m,3H),7.48~7.45 (m,1H),7.41 (d,J=7.6 Hz,2H),7.35~7.32 (m,1H),7.08 (d,J=16.2 Hz,1H);13C NMR (125 MHz, CDCl3) δ 192.7,140.0,136.9,134.0,133.7,133.0,132.3,128.8,128.3,127.6,127.2,127.0,124.8; GC-MS (EI):m/z208(M+,100).
(反)-2-苯乙烯基萘(Ⅲm)为白色固体;熔点145~146 ℃;1H NMR (500 MHz, CDCl3) δ 7.91~7.81 (m,4H),7.80 (d,J=8.6 Hz,1H),7.63 (d,J=7.5 Hz,2H),7.55~7.50 (m,2H),7.45 (t,J=7.6 Hz,2H),7.36~7.31 (m,3H);13C NMR (125 MHz, CDCl3) δ 137.4,134.8,133.7,133.1,129.0,128.8,128.75,128.3,128.0,127.7,127.6,126.6,126.5,126.3,125.9,123.5; GC-MS (EI):m/z230(M+,100).
(反)-3-苯乙烯基吡啶(Ⅲn)为白色固体;熔点79~81 ℃;1H NMR (500 MHz, CDCl3) δ 8.74 (s,1H),8,54~8.50 (m,1H),7.86~7.84 (m,1H),7.55 (d,J=7.4 Hz,2H),7.40(t,J=7.6 Hz,2H),7.33~7.29 (m,2H),7.18 (d,J=16.4 Hz,1H),7.09 (d,J=16.4 Hz,1H);13C NMR (125 MHz, CDCl3) δ 148.6,136.7,133.0,132.7,130.9,128.8,128.2,126.7,124.9,123.5; GC-MS (EI):m/z181(M+,42),180(100).
(反)-3-苯乙烯基喹啉(Ⅲo)为白色固体;熔点99~101 ℃;1H NMR (500 MHz, CDCl3) δ 9.15 (s,1H),8.19 (s,1H),8.11 (d,J=8.5 Hz,1H),7.84 (d,J=8.2 Hz,1H),7.72~7.68 (m,1H),7.60 (d,J=7.5 Hz,2H),7.57 (t,J=3.8 Hz,1H),7.42 (t,J=7.6 Hz,2H),7.34 (t,J=3.7 Hz,1H),7.35 (d,J=16.5 Hz,1H),7.26 (d,J=16.4 Hz,1H);13C NMR (125 MHz, CDCl3) δ 149.5,147.5,136.8,132.3,130.9,130.3,129.3,129.2,128.8,128.3,128.1,127.8,127.0,126.7,125.2; GC-MS (EI):m/z231(M+,76),230(100).
2 结果与讨论
2.1 反应条件的优化
选用对溴苯乙酮Ⅰa与苯乙烯2的偶联反应作为模型反应,分析了反应的最佳条件,其反应方程式为

首先在底物Ⅰa的投料量为1 mmol,Na2PdCl4用量为0.001 mmol,配体L1用量为0.001 mmol,水为反应溶剂的条件下,考察了不同碱对反应的影响,结果见表1.在没有碱参与时,检测不到任何产物,反应无法进行.在所有试验的碱类中,乙醇钠的活性最高,在12 h内对溴苯乙酮的转化率高达97%(表1,组7);NaOH,Na2CO3和K2CO3在同样的时间内能够达到中等的转化率,而且阳离子对此反应无明显影响(表1,组4~6).考虑到乙醇钠水解的产物正是氢氧化钠和乙醇,所以笔者做了一组对比实验(表1,组8),发现加入等摩尔比的乙醇后反应转化率从原先的68%提高到了88%,说明乙醇的加入能明显提高此反应体系的催化活性,但鉴于与乙醇钠相比活性仍旧略低,故选用乙醇钠作为后续反应的碱.笔者发现氮气氛围对反应有利,当反应在氮气保护下进行时,对溴苯乙酮Ⅰa可100%转化(表1,组9).然后,继续考察了配体的用量对反应的影响.研究结果表明:若不加配体,反应的转化率只有25%(表1,组10),这说明配体具有稳定钯催化剂的作用.当配体与Na2PdCl4的摩尔比为1~1.5时,反应转化率基本不变,但继续增加配体的用量,反而对反应不利;如当配体与Na2PdCl4的摩尔比2时,反应转化率仅为68%(表1,组11).
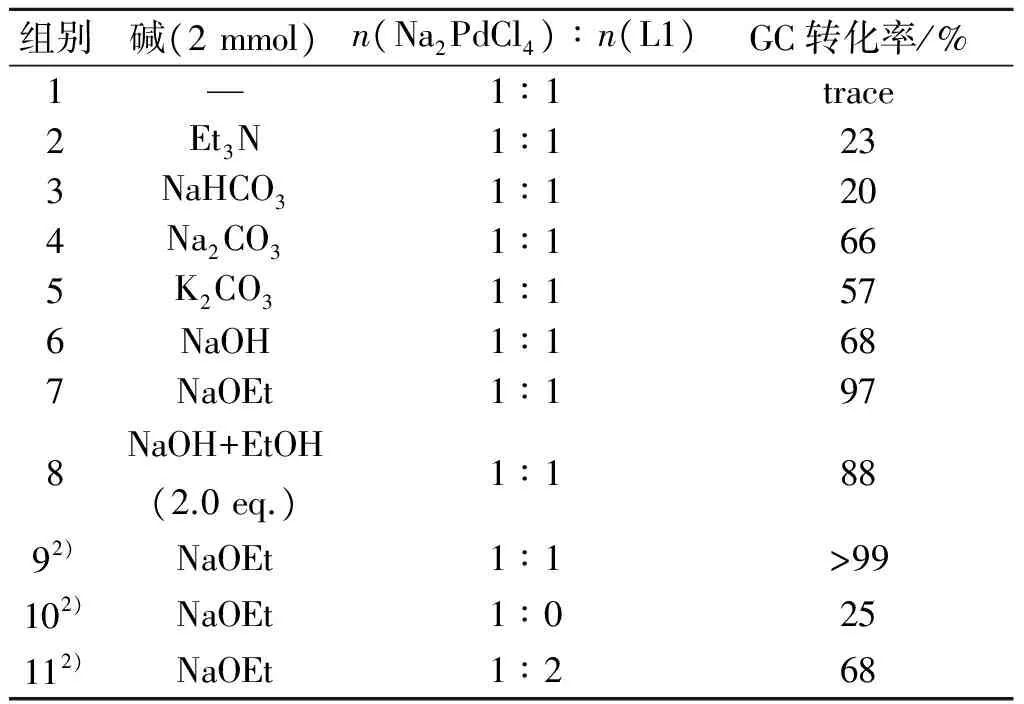
表1 碱对水相Heck反应的影响1)Table 1 Effect of base on aqueous Heck reaction
注:1) 反应条件:4-溴苯乙酮Ⅰa(1.0 mmol),苯乙烯Ⅱ(1.2 mmol),碱(2.0 mmol),Na2PdCl4(0.001 mmol,0.1%水溶液),L1 (0~0.002 mmol,1%水溶液),1.5 mL H2O,100 ℃,12 h,加入原料前,混合液先在60 ℃下预处理0.5 h;2) 氮气氛围.
在获得上述优化条件的基础下,研究了4种不同配体L1~L4的催化性能,其中Na2PdCl2与L的摩尔比均为1,结果见表2.发现当催化剂Na2PdCl2/L的用量为0.001 mmol时,均能获得非常高的转化率(>95%),这表明L1~L4均有很好的催化活性(表2,组1~4).但随着催化剂用量的逐渐降低,配体L对Pd催化活性的影响开始出现显著的差异.如Na2PdCl2/L的用量降低至0.000 5 mmol时,以L1,L3和L4为配体的催化体系,底物4-溴苯乙酮的转化率基本保持不变,而L2下降为85%(表2,组5~8).进一步将Na2PdCl2/L的用量降低至0.000 1 mmol时,底物4-溴苯乙酮的转化率均出现不同程度的下降,但L1下降最小,仍可达89%,而L2,L3和L4分别下降为68%,75%和62%(表2,组9~12).为了便于对比,通过TON来定量比较4种配体的催化活性.计算结果表明,同类型咪唑配体L1的催化活性是L2的1.3倍,同类型苯并咪唑配体L3的催化活性是L4的1.2倍,考虑到L1和L3均含有吡啶环,表明在配体中引入吡啶环能使催化剂更稳定和提高催化性能.而L1的催化活性是L2的1.2倍,表明咪唑母核优于苯并咪唑母核.因此,最后选用L1作为反应的配体,进行进一步研究.同时考虑到L1为0.000 1 mmol的催化量时,反应12 h未能反应完全,故选用0.000 5 mmol的催化量进行底物拓展.

表2 不同配体对水相Heck反应的影响1)Table 2 Effect of ligands on aqueous Heck reaction
注:1)反应条件: 4-溴苯乙酮Ⅰa (1.0 mmol), 苯乙烯Ⅱ(1.2 mmol), NaOEt (2.0 mmol), Na2PdCl4(0.001~0.000 1 mmol, 0.1%水溶液), L1 (0.001~0.000 1 mmol, 1%水溶液),1.5 mL H2O, 100 ℃, 12 h,加入原料前,混合液先60oC预处理0.5 h.
2.2 底物拓展
在上述优化的条件下,笔者考察了一系列带有不同取代基的芳基溴化物和苯乙烯的偶联反应情况,即实验结果如表3所示,偶联反应的转化率与底物苯环上取代基的电荷性质有重要关系,一般规律是吸电子基团取代有利于反应的进行,表现出反应的收率较高.而给电子基团取代不利于反应的进行,表现出反应速度较慢,需要通过增加催化剂用量或升高反应温度来得到较好的收率.如对位是乙酰基、醛基和硝基等强吸电子取代时,反应在催化剂用量为0.05%,100 ℃下反应12 h,可到较高的收率95%~98%(表3,组1~3).对于对位是三氟甲基、氟、氯、溴等取代时,吸电子能力相对较弱,只需通过升高温度至120 ℃,便可得到偶联产物Ⅲd~Ⅲg的收率在87%~94%(表3,组4~7).而对位是氢、甲基等给电子取代时,需要升高温度至120 ℃的同时增加催化剂用量至0.1%,反应12 h,才能得到中等以上的收率(表2,组8和9).需要特别指出的是,当对位是胺基取代时,虽然也是给电子基团,但反应在优化条件下,便可得到87%的收率(表3,组10).这可能是因为对溴苯胺在水中形成氢键,削弱了胺基的给电子能力.除了以上取代基的电荷效应外,取代基的位置对反应速度也有一定的影响.如对位醛基在优化条件下的收率高达98%,间位醛基在优化条件的收率有所降低为89%,而邻位醛基通过升高温度和增加催化剂用量后,也只得到中等的收率为51%(表3,组2,11,12),这种反应收率的差异正是位阻效应所导致的.

此外,笔者还考察了反应体系对多环和杂环芳基溴化物的催化性能.从表3中可以看出:2-溴萘的活性比溴苯的活性高,同样为0.1%的催化量,120 ℃下反应12 h,对应产物的收率相差近10%(表3,组13).3-溴吡啶和3-溴喹啉作底物时,只需升高反应温度至120 ℃,便可以达到较高的收率,分别为97%和86%(表3,组14和15).
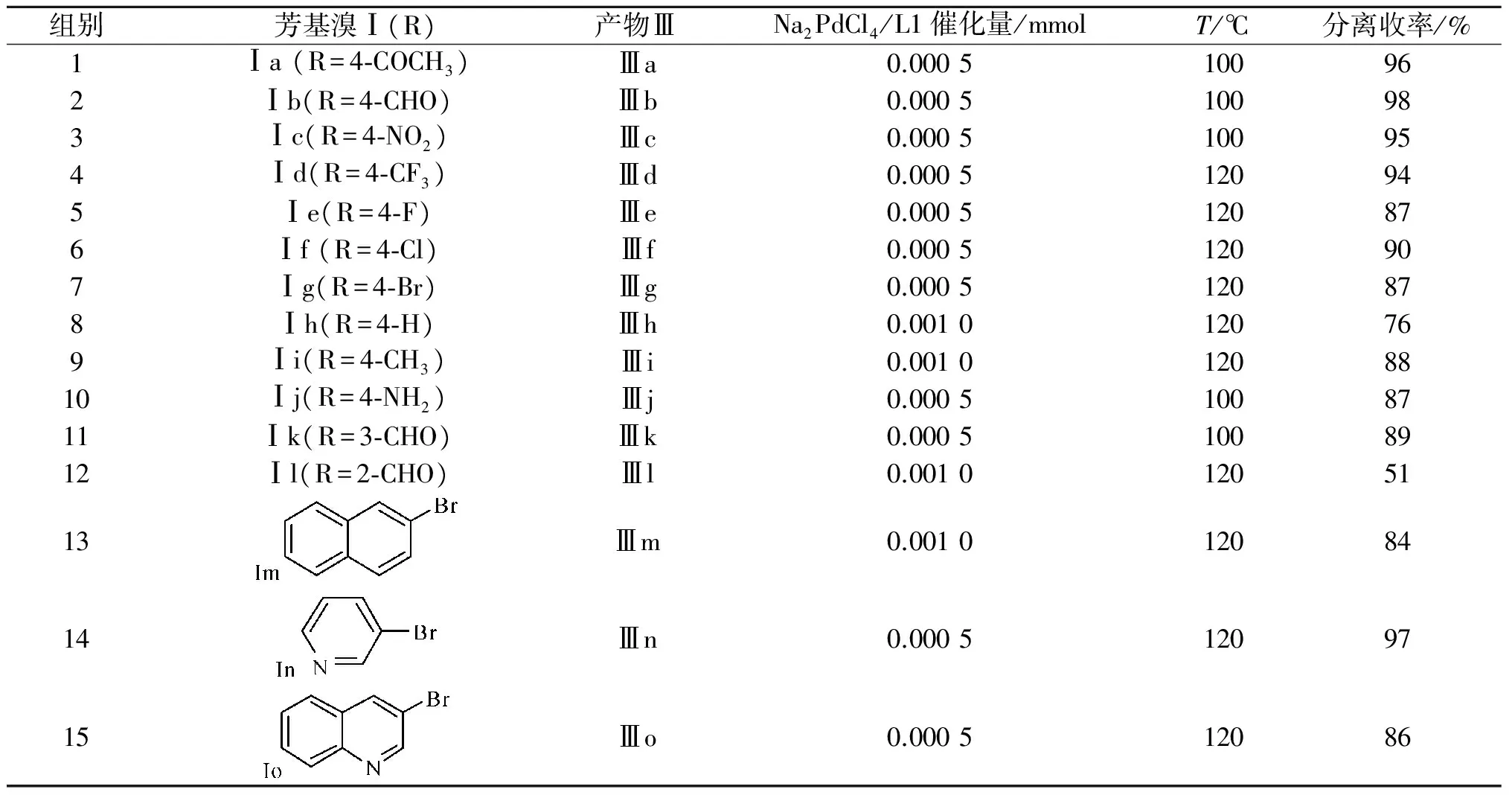
表3 溴代芳烃与苯乙烯的Heck反应1)Table 3 Heck reaction between substituted aryl bromides and styrene
注:1) 反应条件:芳基溴Ⅰ(1 mmol),苯乙烯Ⅱ(1.2 mmol), NaOEt(2 mmol), Na2PdCl4(0.000 5~0.001 mmol,0.1%水溶液),L1(0.000 5~0.001 mmol,1%水溶液),1.5 mL H2O, 100 ℃,N2,12 h,加入原料前,混合液先60 ℃预处理0.5 h;2) 分离收率(包括1,1-二苯乙烯).
3 结 论
以单甲基化的聚乙二醇(M=1 900)为起始原料,成功制备了一系列功能化的1,3-二唑盐(L1~L4),并将其在线生成卡宾钯用于催化纯水相Heck反应.实验结果表明,L1的催化性能最好,对于模型反应,TON值最高可达8 900,而且该催化剂对底物的适用性较好,都能得到中等以上的收率.相比于传统的卡宾钯催化Heck反应,本方法具有催化剂用量少、产物分离简便、收率高和环境友好等优点.
参考文献:
[1] 李郁锦,夏烈,高建荣.吩嗪类化合物的绿色合成研究[J].浙江工业大学学报,2013,41(3):286-288.
[2] 李郁锦,徐芳,徐凤双,等.水促进水杨醛与活泼亚甲基化合物的反应研究[J].浙江工业大学学报,2014,42(6):632-635.
[3] BUTLER R N, COYNE A G. Water: nature’s reaction enforcer-comparative effects for organic synthesis “in-water” and “on-water”[J]. Chemical reviews,2010,110(10):6302-6337.
[4] SIMON M O, LI C J. Green chemistry oriented organic synthesis in water[J]. Chemical society reviews,2012,41(4):1415-1427.
[5] TORBORG C, BELLER M. Recent applications of palladium-zatalyzed coupling reactions in the pharmaceutical, agrochemical, and fine chemical industries[J]. Advanced synthesis & catalysis,2009,351(18):3027-3043.
[6] 孙楠,骆佳丽,江晋,等.Cu(TFA)2催化N-甲基芳胺和α-重氮-β-酮酸对硝基苄酯的N-H插入反应研究[J].浙江工业大学学报,2014,42(1):81-87.
[7] VELAZQUEZ H D, VERPOORT F. N-heterocyclic carbene transition metal complexes for catalysis in aqueous media[J]. Chemical society reviews,2012,41(21):7032-7060.
[8] LEVIN E, IVRY E, DIESENDRUCK C E, et al. Water in N-heterocyclic carbene-assisted catalysis[J]. Chemical reviews,2015,115(11):4607-4692.
[9] LI L, WANG J Y, ZHOU C S, WANG R H, et al. pH-responsive chelating N-heterocyclic dicarbene palladium(II) complexes: recoverable precatalysts for Suzuki-Miyaura reaction in pure water[J]. Green chemistry,2011,13(8):2071-2077.
[10] GODOY F, SEGARRA C, POYATOS M, et al. Palladium catalysts with sulfonate-functionalized-NHC ligands for Suzuki-Miyaura cross-coupling reactions in water[J]. Organometallics,2011,30(4):684-688.
[11] JORDAN J P, GRUBBS R H. Small-molecule N-heterocyclic-carbene-containing olefin metathesis catalysts for use in water[J]. Angewandte chemie international edition,2007,46(27):5152-5155.
[12] MEISE M, HAAG R. A highly active water-soluble cross-coupling catalyst based on dendritic polyglycerol N-heterocyclic carbene palladium complexes[J]. Chemsuschem,2008,1(7):637-642.
[13] LIU Y L, WANG Y, LONG E. PEG-modified N-heterocyclic carbene ligands for highly efficient and recyclable Pd-catalyzed Heck reaction in water[J]. Transition metal chemistry,2014,39(1):11-15.
[14] GULCEMAL S, KAHRAMAN S, DARAN J C, et al. The synthesis of oligoether-substituted benzimidazolium bromides and their use as ligand precursors for the Pd-catalyzed Heck coupling in water[J]. Journal of organometallic chemistry,2009,694(22):3580-3589.

