小麦淀粉合成关键酶基因和相关蛋白表达对不同施磷量的响应
李春艳,张润琪,付凯勇,李 超,朱长安,李 诚
(1.石河子大学农学院/新疆兵团绿洲生态农业重点实验室,新疆石河子 832000;2.新疆盛源种业有限责任公司,新疆五家渠 831300)
小麦是中国主要的粮食作物之一,其产量和品质对国家粮食和食品安全有举足轻重的战略意义。磷素是小麦生长过程中重要的大量元素之一,对小麦产量和淀粉品质形成有重要作用。深入细化研究磷素在小麦淀粉产量和品质形成中的作用,可有效缓解磷矿资源日益匮乏及过量施用磷肥造成的环境和经济问题,为小麦生产“减肥、增效、提质”提供理论依据。
普通小麦籽粒中淀粉约占干重的60%~70%。淀粉的生物合成是一个复杂的过程,涉及多种酶的共同作用。腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)是淀粉合成的关键酶,无机磷酸与3-PGA的比例会影响其活性,并影响淀粉的生物合成过程[1]。颗粒结合淀粉合成酶(GBSS)主导直链淀粉的延长,也可能对支链淀粉侧链的延长有一定的作用[2]。GBSS I存在于造粉体中,几乎完全是颗粒结合酶[3]。淀粉粒结合蛋白(SGPs)主要包括淀粉粒表面的和镶嵌在淀粉颗粒内部的蛋白[4]。目前,已在小麦中检测到4种主要的淀粉粒结合蛋白:SGP-1、SGP-2、SGP-3和Waxy蛋白,各SGP分别对应不同的淀粉合成相关酶[5]。通过改良蛋白提取方法,结合2D电泳、质谱、TEM免疫杂交和突变体材料,Benmoussa等[6]从玉米淀粉粒蛋白中鉴别出结构蛋白、膜蛋白以及与淀粉合成重要相关的酶类(GBSS、AGPase等)。Matsushima等[7-8]通过水稻突变体发现与淀粉粒增大和质体发育有关的蛋白SSG4和SSG6,并将其定位于水稻胚乳质体的被膜。除此之外,关于淀粉合成/代谢过程的重要基因和蛋白的研究正在逐步深入[9-11]。但小麦生长过程中施用不同水平的磷肥对胚乳可溶性蛋白和淀粉粒结合蛋白有何影响尚未见报道。因此,本研究从小麦籽粒灌浆进程、关键酶基因表达、酶活性、蛋白含量和谱带特征以及胚乳微观特性等角度入手,研究不同施磷量对小麦籽粒发育的影响,以期为小麦生产中磷肥的合理施用以及深入研究小麦淀粉的生物合成机理提供理论依据。
1 材料与方法
1.1 试验材料与田间管理
供试材料为新疆主栽冬小麦品种新冬20号,种子由石河子大学麦类作物研究所提供。新冬20号具有广泛的适应性,产量潜力较高(7 500~8 250 kg·hm-2),抗逆性较强。试验于2014 年10 月至2015 年6 月在石河子大学农学院试验站进行。试验地0~20 cm土壤有机质15.4 g·kg-1,碱解氮63 mg·kg-1,速效磷15 mg·kg-1,速效钾208 mg·kg-1。试验地前茬为小麦,收获后种植向日葵,并将向日葵作为绿肥压青,压青时施入75 kg·hm-2尿素作为基肥。试验设3个磷素(以P2O5计)水平:0 kg·hm-2(对照,记作CK)、105 kg·hm-2(常规施磷,低磷,记作LP)和210 kg·hm-2(过量施磷,高磷,记作HP),随机区组设计,每处理3次重复。所用磷肥为过磷酸钙,含P2O515.57%,于小麦返青期一次性开沟条施。小麦行距20 cm,在两行中间开沟,沟深5~10 cm。对照开沟,但不施肥。冬前滴灌水3次,返青期至成熟期滴灌水6次,每隔10~12 d滴灌1次,拔节期和扬花期各追施尿素75 kg·hm-2。尿素为市售产品,N含量46%。6月28日种子成熟后收获。
1.2 样品采集
小麦开花后,选择穗形一致的主茎标记开花期,分别于开花后7、14、21、28、35 d取样。从标记穗子中随机摘取150穗,剥出穗中部籽粒,一部分烘干至恒重,备用;一部分用铝箔纸包裹,立即置于液氮速冻5 min,并在-80 ℃超低温冰箱保存,备用。
1.3 籽粒灌浆速率测定
以开花后天数为自变量,每次取样所得平均单粒重(由千粒重折合)为因变量,用Logistic方程y=K/(1+ae-bt)对灌浆过程进行拟合[12],式中,K为最大单粒重,t为开花后天数,a和b为常数。由Logistic方程推导出一系列灌浆参数包括籽粒灌浆速率最大值Vmax和籽粒灌浆速率最大值出现时间Tmax。
1.4 淀粉合成关键酶活性测定
AGPase活性测定参照Nakamura等[13]的方法;GBSS活性测定参照Schaffer等[14]的方法。
1.5 agp和gbss基因相对表达量检测
1.5.1 引物设计
根据NCBI公布的小麦 agp1、 agp2、 gbss1和 gbss2基因序列设计引物,引物由生工生物工程(上海)股份有限公司合成。以小麦actin基因(NCBI:DN551593)作为内参基因。通过梯度PCR验证引物特异性并优化PCR条件。PCR反应体系:cDNA模板0.5 μL,10×PCR反应缓冲液2 μL,dNTPs 1.25 μL,上游引物和下游引物各0.5 μL,TaqDNA聚合酶0.75 μL,双蒸水4.5 μL。反应条件:94 ℃ 5 min,94 ℃ 35 s,退火30 s,72 ℃ 30 s,35个循环,72 ℃10 min。具体引物序列见表1。
1.5.2 RNA提取和cDNA合成
RNA提取采用Fruit-mate(TaKaRa,9192,Japan)和RNAiso plus(TaAaRa,9108,Japan)试剂盒提取,按说明书操作。琼脂糖凝胶电泳检验总RNA质量。使用TIANScript cDNA第一链合成试剂盒(Tiangen,KR104-02,China)合成cDNA,用合成的cDNA作为模板扩增actin基因以检验其质量。
表1实时荧光定量PCR引物序列
Table1PrimersusedtodetectdifferentialgeneexpressionbyusingQuantitativePCR

基因Gene上游引物序列(5′-3′)Forwardprimersequence下游引物序列(5′-3′)Reverseprimersequence退火温度/℃Annealingtemperatureagp1AGAAGCGGCAAGGGAGACCCTAATACATCAAGGGAGAAAA60agp2TCAAACAAGGAGGGAGTGGCAGAGGTTGTCGCAGA60gbss1GACACTATCGTGGAAGGCAAGTTGACCATCTCATGGTACGC60gbss2CACAGAATGCCAGAGGCATAGGAACAGATGGGAATCACTCCA60actinGGAAAAGTGCAGAGAGACACGTACAGTGTCTGGATCGGTGGT60
1.5.3 实时荧光定量PCR
使用SYBR Premix ExTaq试剂盒(TaKaKa,RR420A,Japan)和实时荧光定量PCR仪(Roche LightCycler 480 Ⅱ)检测各基因的扩增情况,具体操作按说明书进行。
1.6 胚乳可溶性蛋白和淀粉粒结合蛋白的提取及含量测定
胚乳可溶性蛋白和淀粉粒结合蛋白的提取参照Peng等[15]的方法;蛋白质含量测定参考刘子凡[16]的考马斯亮蓝G-250法,用牛血清白蛋白绘制标准曲线;SDS-PAGE聚丙烯酰胺凝胶电泳参照高正等[17]的考马斯亮蓝R-250染色法进行。
1.7 胚乳横切面的甲苯胺蓝染色及扫描电镜观察
胚乳横切面的甲苯胺蓝染色方法参照余静等[18]的文献。用于扫描电镜观察的样品处理程序:取不同处理的籽粒约3 mm厚的横切片置于带盖小瓶,加入5 mL磷酸钠缓冲液配制的4%(v/v)戊二醇溶液,4 ℃固定24 h,室温静置 1 h,再用磷酸钠缓冲液漂洗3次,每次10 min,用系列浓度(35%、50%、70%、85%、95%)酒精脱水,每次10 min,再用100%酒精脱水3次,每次10 min,经E3100 CO2临界点干燥仪(Quorum Technologies-Ringmer,East Sussex,UK)干燥及离子溅射仪(Denton Vacuum-Moorestown,NJ,USA)镀金膜后,用扫描电镜(Hitachi S570,Hitachi High Technologies,Tokyo,Japan)观察拍照,加速电压10 kV。
1.8 统计分析
采用Microsoft Office Excel 2013和SPSS 17.0统计软件整理分析数据,采用Microsoft Office Excel 2013和Adobe Photoshop软件绘制图表。每项指标重复测定3次。采用独立t检验法比较2个样本平均数,采用Duncan新复极差法进行多重比较,显著水平为0.05。
2 结果与分析
2.1 小麦粒重及灌浆速率的变化
由表2可知,3种施磷水平下,小麦品种新春20号在相同取样时期的粒重差异显著。花后7 d 和14 d,低磷处理下的粒重显著低于对照;花后7、21和35 d,高磷处理小麦粒重显著高于低磷和对照;花后28 d和35 d,低磷处理的粒重显著高于对照。说明籽粒灌浆后期磷肥对粒重的促进作用逐渐增强。
由表3可知,不同施磷处理对籽粒灌浆速率最大值出现时间无明显影响,均为花后16 d。低磷处理下,小麦籽粒灌浆最大积累速率显著高于对照和高磷处理。
表2不同磷素水平下小麦籽粒的单粒重
Table2Singlegrainweightofwheatunderdifferentphosphorustreatmentsmg

处理 Treatment7DAA14DAA21DAA28DAA35DAACK6.94±0.12b16.01±0.06a31.4±0.07c38.02±0.01b40.8±0.02cLP6.74±0.013c14.74±0.01c32.01±0.02b38.20±0.05a41.0±0.03bHP7.34±0.09a15.6±0.02b32.21±0.01a37.8±0.05c41.4±0.08a
表中数据为“平均值±标准误”,同列数据后不同小写字母表示在5%水平差异显著。DAA:开花后天数。表4同。
Values are “mean±standard error” of three replications.Values followed by different letters within columns are significantly different atP<0.05.DAA:Days after anthesis.The same in table 4.
表3不同磷素水平下小麦籽粒灌浆速率特征参数
Table3Parametersofgrainfillingrateofwheatunderdifferentphosphorustreatments

处理Treatment回归方程RegressionequationR2Vmax/(mg·d-1)Tmax/dCKy=41.673/(1+21.604e-0.196t)0.998∗∗2.042b15.678aLPy=41.730/(1+25.313e-0.205t)0.994∗∗2.137a15.778aHPy=42.248/(1+21.151e-0.194t)0.991∗∗2.048b15.739a
Vmax:籽粒灌浆速率最大值;Tmax:籽粒灌浆速率最大值出现时间。
Vmax:The maximum grain-filling rate;Tmax:The time reaching the maximum grain-filling rate.
2.2 不同磷处理对agp和gbss基因相对表达量的影响
由图1可知,花后7、14和28 d,低磷处理下 agp1基因的相对表达量显著高于对照,同时显著或极显著高于高磷处理;而高磷处理下 agp1基因的相对表达量在花后14、21 和28 d 显著或极显著低于对照(图1A)。低磷处理下, agp2基因的相对表达量在花后7 d和14 d均极显著高于对照和高磷处理。花后21 d和35 d,高磷处理下 agp2基因相对表达量极显著高于对照(图1B)。低磷处理下, gbss1基因相对表达量在花后7~35 d 均显著或极显著高于对照(图1C),除花后14 d外,均显著或极显著高于高磷处理;花后14 d 和21 d该基因的相对表达量在对照和高磷处理间差异不显著。除花后21 d外,低磷处理下 gbss2基因的相对表达量均显著或极显著高于对照和高磷处理;高磷处理下,花后7 d和14 d该基因相对表达量极显著低于对照(图1D)。
2.3 不同磷处理对小麦籽粒AGPase和GBSS活性的影响
AGPase是小麦合成、贮存多糖过程的限速酶。由图2可知,不同施磷处理下,小麦籽粒中AGPase活性均呈“M”型变化趋势,花后7、21和28 d,各处理AGPase活性无显著差异;花后14 d,低磷处理下AGPase活性极显著高于高磷处理;花后35 d,高磷处理下AGPase活性显著低于对照和低磷处理。GBSS主要负责直链淀粉合成。花后7 d,不同处理间GBSS活性差异不显著;花后14 d,低磷处理下GBSS活性分别显著或极显著高于对照和高磷处理;花后21 d,施磷处理下GBSS活性均极显著高于对照。花后28 d和35 d,低磷和高磷处理下GBSS活性差异显著,与对照无显著差异(图2)。
2.4 不同施磷水平对小麦淀粉粒结合蛋白和胚乳可溶性蛋白含量的影响
由表4可知,花后14 d,高磷处理淀粉粒结合蛋白含量显著高于对照和低磷处理;花后21 d,低磷处理淀粉粒结合蛋白含量显著高于对照和高磷处理;花后28 d,对照处理淀粉粒结合蛋白含量显著高于施磷处理;花后35 d高磷处理淀粉粒结合蛋白含量最高。

*和**分别代表0.05和0.01水平上对照和施磷处理间差异显著;以小麦actin基因CNCBI编号:DN551593)作为内参基因。下图同。
* and ** represent the significance of probability at 0.05 and 0.01 levels between CK and P treatment,respectively;Wheat actin gene CNCBI Accession No. DN551593) was used as the reference control. The same in Fig.2.
图1不同磷处理下小麦胚乳agp和gbss基因相对表达量的变化
Fig.1Relativeexpressionofagpandgbssgenesinwheatendospermunderdifferentphosphorustreatments

图2 不同磷处理下小麦籽粒AGPase和GBSS活性
小麦籽粒AGPase主要存在于胚乳可溶性部分,该酶是由2个大亚基和2个小亚基组成的异源四聚体。2个大亚基分子质量为55~60 kD,2个小亚基分子质量为50~55 kD,大亚基是酶活性的调节中心,而小亚基是酶活性的催化中心[19]。本研究通过聚丙烯酰氨凝胶电泳分析,经浓缩分离的胚乳可溶性蛋白条带分子质量均小于72 kD,其中2条分子质量在60 kD左右,另外3条清晰的条带分别出现在26~43、34~26和17 kD左右。推测分子质量在72~55 kD的蛋白可能与AGPase有关(图3)。施磷处理下,花后7 d 胚乳可溶性蛋白条带的表达量均明显弱于对照;花后35 d,3种处理下分子质量为26~34 kD的条带(黑色箭头)均较其他取样时期明显。
表4不同磷水平下小麦淀粉粒结合蛋白含量
Table4Contentofstarchgranule-boundproteinunderdifferentphosphorustreatments

×10-3 μg·mg-1

图3 不同施磷水平下小麦胚乳可溶性蛋白凝胶电泳
2.5 不同施磷水平对小麦胚乳微观特性的影响
由图4可知,花后21 d,甲苯胺蓝染色显示对照和高磷处理下胚乳中被染色的细胞核(图中红色箭头所示)数量多于低磷处理。低磷和高磷处理下甲苯胺蓝着色较深低。低磷处理下小麦胚乳中可以观察到明显的颗粒状淀粉粒,而相同放大倍数下,对照和高磷处理下的淀粉粒则不明显。对照籽粒断面细胞排列紧密,胚乳外层栅栏状细胞与内层胚乳细胞结合紧密,两者分层不明显(图4A);低磷和高磷处理下胚乳外部栅栏状细胞形态明显,细胞排列较松散,与内胚乳细胞结合不紧密,两者分层明显(图4B和图4C),而低磷处理此现象较高磷处理更明显。
扫描电镜结果显示,不同磷处理下胚乳淀粉粒形态未发生明显变化,均由透镜状的A型淀粉粒(直径大于10 μm)和球形的B型淀粉粒(直径小于10 μm)组成。淀粉粒均镶嵌于蛋白基质中。低磷处理下蛋白基质较少,主要存在于淀粉粒间,部分附着在淀粉粒表面,淀粉粒与蛋白质结合较疏松(图4E);而对照和高磷处理的蛋白质基质很多,形成完整的蛋白质包被鞘,淀粉粒深陷在包被中,淀粉粒和蛋白质结合较紧密(图4D和图4F),其中高磷处理下的此现象更明显。
3 讨 论
淀粉是小麦籽粒中含量最多的物质,与小麦的产量与品质有直接关系[20-21]。本研究发现新冬20号籽粒灌浆不同时期磷素对粒重的影响存在处理间差异;花后7 d和14 d,低磷处理粒重显著低于对照。前期研究亦表明,花后7 d低磷处理下淀粉粒的形态与对照差异明显,且平均粒径显著低于对照[22],可能是该施磷水平促进了小麦灌浆前期的营养生长,并为灌浆后期籽粒的营养积累储备了能量。在籽粒灌浆后期(花后28~35 d),相同取样时期高磷和低磷处理下小麦籽粒的成熟度高于对照,且施磷后总淀粉、支链淀粉和直链淀粉含量显著高于对照,并以低磷处理下最高[23]。此结果与籽粒灌浆关键时期淀粉合成相关酶AGPase和GBSS的活性和酶基因表达量的趋势一致。淀粉合成的第一步是由G-1-P和ATP在AGPase作用下生成腺苷二磷酸葡萄糖(ADPG),ADPG是淀粉合成的直接前体,因此,AGPase是淀粉合成的限速酶[1]。GBSS则主导直链淀粉的延长[2]。AGPase和GBSS活性和酶基因表达量的提高对淀粉的合成与积累有重要作用。小麦籽粒灌浆过程中胚乳细胞的分裂、增殖以及充实对磷素的需求可能存在一个临界范围,准确把握不同小麦品种籽粒灌浆过程中对磷素需求的适宜范围可以增加磷肥的有效利用率并提高小麦产量。
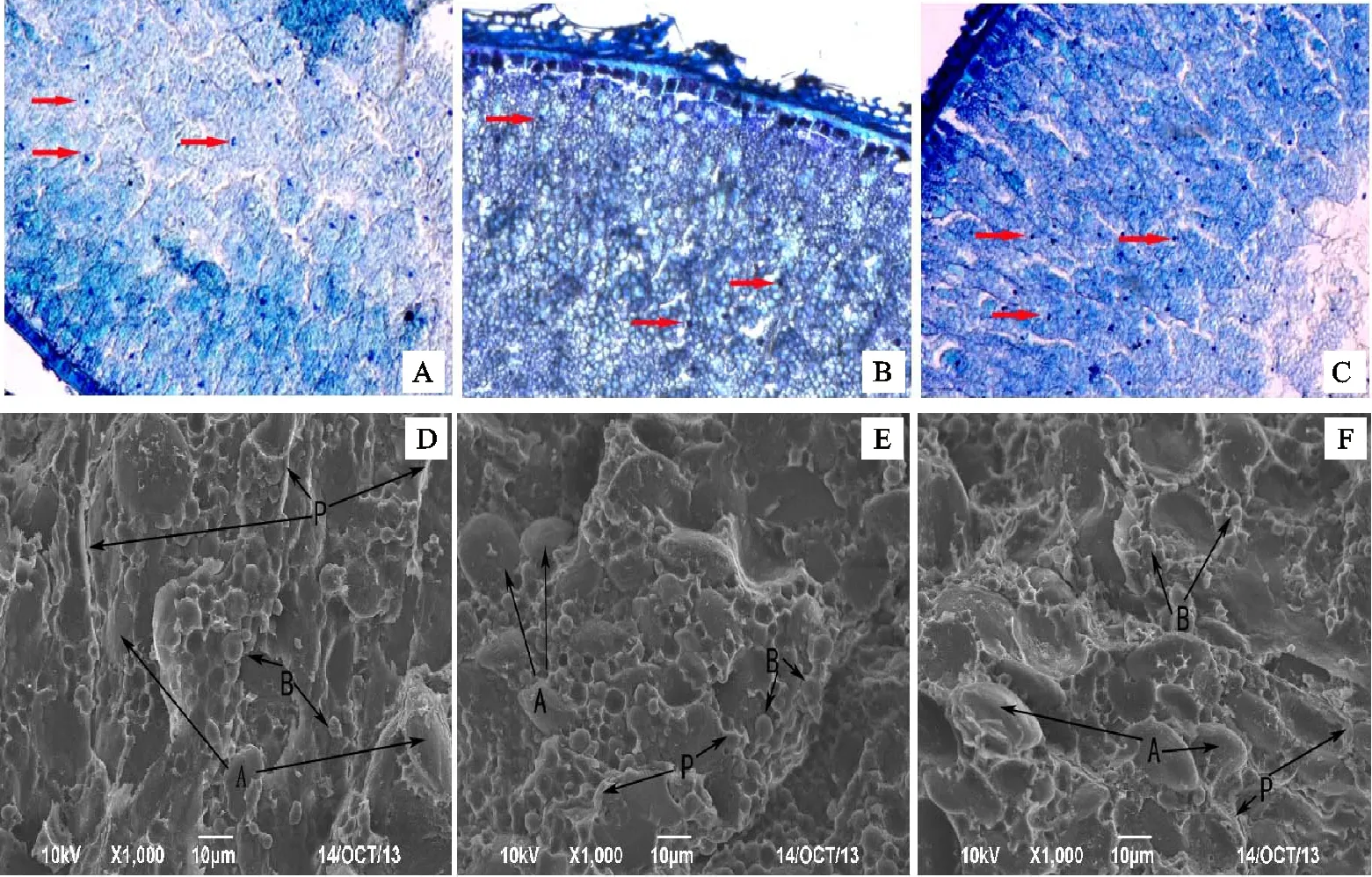
A、B、C:胚乳横切面甲苯胺蓝染色(×130);D、E、F:胚乳横切面扫描电镜图片(×1 000);A、D:CK处理;B、E:LP 处理; C、F:HP 处理。电镜扫描图D、E、F中A指示为A型淀粉粒,B指示B型淀粉粒;P指示蛋白基质。
A,B and C:Cross sections stained by toluidine(×130); D,E and F:Cross sections observed by scanning electron microscopy(×1 000); A and D were samples from CK treatment; B and E were samples from LP treatment; C and F were samples from HP treatment.Within the SEM figures D,E,and F,‘A’ indicates the A type starch granules; ‘B’ indicates the B type starch granules; ‘P’ indicates the protein matrix.
图4花后21d不同磷处理下小麦籽粒横切面的差异
Fig.4Crosssectionsofwheatgrainat21DPAunderdifferentphosphorustreatments
小麦、玉米、高粱和谷子等禾本科作物淀粉粒表面均能观察到微孔,是淀粉粒本身的属性特征。Han等[24]通过特异性蛋白探针(CBQCA)处理淀粉粒并用激光共聚焦显微镜观察到淀粉粒通道内存在蛋白。玉米中关于淀粉粒通道蛋白的研究已有报道,但小麦中鲜见报道。Benmoussa等[6]从玉米淀粉粒通道蛋白中鉴别出与淀粉合成相关的酶类(GBSS、AGPase等),认为玉米淀粉粒微通道可能是淀粉质体微管的残留物,对淀粉合成中ADPG的运输有重要作用,便于淀粉聚合物和颗粒的合成。本研究中,不同磷处理下各时期淀粉粒结合蛋白谱无明显差异(因无显著差异故图片未显示),均呈5条主要的谱带,且分子质量均大于60 kD,分别对应SGP-A1、SGP-B1、SGP-D1、SGP-2、SGP-3和Waxy蛋白[5]。花后35 d时淀粉粒结合蛋白的含量以高磷处理最高,胚乳可溶性蛋白也以高磷处理下花后28~35 d的表达量最高,此结果与扫描电镜观察籽粒横切面的蛋白基质状态一致。说明施磷处理对小麦籽粒淀粉和蛋白质的合成均有重要影响,而与淀粉合成相关的酶类(AGPase、GBSS等)又可促进淀粉的合成,其中可能包括淀粉粒通道蛋白。石河子大学农学院冬小麦课题组研究发现,低磷和高磷处理下淀粉粒微通道结构较对照更加明显[23],参照玉米中的研究[6],推测磷处理下淀粉粒的通道蛋白组分发生了变化,GBSS、AGPase含量增加,促进了淀粉的生物合成。该假设需进一步研究验证。
前人研究表明,小麦淀粉粒甲苯胺蓝染色结果的深浅与支链淀粉的精细结构和淀粉粒的晶体结构有关。支链淀粉分支链较短[25],分支化程度高[25-26],淀粉粒结构片层密度较低[27],可能使甲苯胺蓝分子容易进入淀粉粒内部结合蛋白质[28]和带负电荷的磷酸酯[29]将小麦淀粉染成蓝色。本研究中,与低磷和高磷处理比较,对照处理下甲苯胺蓝染色较浅。石河子大学农学院冬小麦课题组前期研究表明,花后21 d,不同磷素处理下新冬20号小麦籽粒支链淀粉结构中A链的比例表现为HP>LP>CK,淀粉粒的结晶度表现为CK>HP>LP[21],说明施磷处理导致淀粉粒结构松散。此外,石河子大学农学院冬小麦课题组通过激光共聚焦显微镜发现,低磷和高磷处理下的淀粉粒内部的微通道结构发生了变化[23];再结合该课题组研究发现,高磷和低磷处理下淀粉粒直径显著小于对照[22],小淀粉粒的比表面积大于大淀粉粒,可以结合更多的蛋白,因此,低磷和高磷处理下甲苯胺蓝染色较CK颜色深。综上所述,通过甲苯胺蓝染色淀粉粒可以在一定程度上推测淀粉粒内部的结构。
参考文献:
[1] MACDONALD P W,STROBEL G A.Adenosine diphosphate-glucose pyrophosphorylase control of starch accumulation in rust-infected wheat leaves [J].PlantPhysiology,1970,46(1):126.
[2] RAHMAN S,LI Z,BATEY I,etal.Genetic alteration of starch functionality in wheat [J].JournalofCerealScience,2000,31(1):91.
[3] IZUMO A,FUJIWARA S,SAKURAI T,etal.Effects of granule-bound starch synthase I-defective mutation on the morphology and structure of pyrenoidal starch in Chlamydomonas [J].PlantScience,2011,180(2):238.
[4] RAHMAN S,KOSARHASHEMI B,SAMUEL M S,etal.The major proteins of wheat endosperm starch granules [J].FunctionalPlantBiology,1995,22(5):793.
[5] YAMAMORI M,ENDO T R.Variation of starch granule proteins and chromosome mapping of their coding genes in common wheat [J].TheoreticalandAppliedGenetics,1996,93(1-2):275.
[6] BENMOUSSA M,HAMAKER B R,HUANG C P,etal.Elucidation of maize endosperm starch granule channel proteins and evidence for plastoskeletal structures in maize endosperm amyloplasts [J].JournalofCerealScience,2010,52(1):22.
[7] MATSUSHIMA R,MAEKAWA M,KUSANO M,etal.Amyloplast membrane protein SUBSTANDARD STARCH GRAIN6 controls starch grain size in rice endosperm [J].PlantPhysiology,2016,170(3):1445.
[8] MATSUSHIMA R,MAEKAWA M,KUSANO M,etal.Amyloplast-localized SUBSTANDARD STARCH GRAIN4 protein influences the size of starch grains in rice endosperm [J].PlantPhysiology,2014,164(2):623.
[9] FEIKE D,SEUNG D,GRAF A,etal.The starch granule-associated protein EARLY STARVATION1(ESV1) is required for the control of starch degradation in Arabidopsis thaliana leaves [J].PlantCell,2016,28(6):1472.
[10] SHAIK S S,OBATA T,HEBELSTRUP K H,etal.Starch granule re-structuring by starch branching enzyme and glucan water dikinase modulation affects caryopsis physiology and metabolism [J].PLoSONE,2016,11(2):e0149613.
[11] YU H T,WANG T.Proteomic dissection of endosperm starch granule associated proteins reveals a network coordinating starch biosynthesis and amino acid metabolism and glycolysis in rice endosperms [J].FrontiersinPlantScience,2016,7:707.
[12] 王晓慧,张 磊,刘双利,等.不同熟期春玉米品种的籽粒灌浆特性[J].中国农业科学,2014,47(18):3560.
WANG X H,ZHANG L,LIU S L,etal.Grain filling characteristics of maize hybrids differing in maturities [J].ScientiaAgriculturaSinica,2014,47(18):3560.
[13] NAKAMURA Y,YUKI K,PARK S Y.Carbohydrate metabolism in the developing endosperm of rice grains [J].PlantCellPhysiology,1989,30(6):833.
[14] SCHAFFER A A,PETREIKOV M.Sucrose-to-starch metabolism in tomato fruit undergoing transient starch accumulation [J].PlantPhysiology,1997,113(3):739.
[15] PENG M,GAO M,ESM A A,etal.Separation and characterization of A-and B-type starch granules in wheat endosperm [J].CerealChemistry,1999,76(3):375.
[16] 刘子凡.种子学实验指南[M].北京:化学工业出版社,2011:34.
LIU Z F.Seed science:A laboratory manual [M].Beijing:Chemical Industry Press,2011,34.
[17] 高 正,王晓龙,张晓科,等.小麦HMW-GS检测方法的优化及应用[J].麦类作物学报,2013,33(5):931.
GAO Z,WANG X L,ZHANG X K,etal.Optimization and application of the detection method of HMW-GS in common wheat [J].JournalofTriticeaeCrops,2013,33(5):931.
[18] 余 静,冉从福,李学军,等.陕糯1号与非糯小麦西农1330 胚乳发育及淀粉形态、粒径分析 [J].中国农业科学,2014,47(22):4413.
YU J,RAN C F,LI X J,etal.Study on endosperm development and morphological features of starch granules in waxy wheat Shannuo 1 and non-waxy wheat Xinong 1330 [J].ScientiaAgriculturaSinica,2014,47(22):4413.
[19] JOHNSON P E,PATRON N J,BOTTRILL A R,etal.A low-starch barley mutant,Ris 16,lacking the cytosolic small submit of ADP-Glucose pyrophosphorylase,reveals the importance of the cytosolic isform and the identity of the plastidial small subunit [J].PlantPhysiology,2003,131(2):684.
[20] NI Y,WANG Z,YIN Y,etal.Starch granule size distribution in wheat grain in relation to phosphorus fertilization [J].JournalofAgriculturalScience,2012,150(1):45.
[21] LI C Y,LI C,ZHANG R Q,etal.Effect of phosphorus on the characteristics of starch in winter wheat [J].Starch/Stärke,2013,65(9):801.
[22] 付凯勇,徐芳芳,史晓艳,等.不同磷素水平对小麦淀粉粒形态及品质特性的影响[J].石河子大学学报(自然科学版),2015,33(4):413.
FU K Y,XU F F,SHI X Y,etal.Effect of phosphorus on the morphology and quality characteristics of starch granules in wheat [J].JournalofShiheziUniversity(NaturalScience),2015,33(4):413.
[23] ZHANG R Q,LI C,FU K Y,LI C,LI C Y.Phosphorus alters starch morphology and gene expression related to starch biosynthesis and degradation in wheat grain [J].FrontiersinPlantScience,2017,8:2252.
[24] HAN X Z,HAMAKER B R.Location of starch granule-associated proteins revealed by confocal laser scanning microscopy [J].JournalofCerealScience,2002,35(1):109.
[25] YOO S H,JANE J.Structural and physical characteristics of waxy and other wheat starches [J].CarbohydratePolymers,2002,49(3):297.
[26] 李春燕,封超年,王亚雷,等.不同小麦品种支链淀粉链长分配及其与淀粉理化特性的关系 [J].作物学报,2007,33(8):1240.
LI C Y,FENG C N,WANG Y L,etal.Chain length distribution of debauched amylopectin and its relationship with physicochemical properties of starch in different wheat cultivar [J].ActaAgronomicaSinica,2007,33(8):1240.
[27] JANE J,CHEN Y Y,LEE L F,etal.Effects of amylopectin branch chain length and amylose content on the gelatinization and pasting properties of starch [J].CerealChemistry,1999,76(5):629.
[28] SVIHUS B,UHLEN A K,HARSTAD O M.Effect of starch granule structure,associated components and processing on nutritive value of cereal starch:A review [J].AnimalFeedScienceandTechnology,2005,122(3):303.
[29] BALDWIN P M.Starch granule-associated proteins and polypeptides:A review [J].Starch/Stärke,2015,53(10):475.

