外源NO对镧胁迫下燕麦幼苗叶片抗坏血酸-谷胱甘肽循环的影响
刘建新,欧晓彬,王金成,刘秀丽,李博萍
(甘肃省高校陇东生物资源保护与利用省级重点实验室/陇东学院生命科学与技术学院,甘肃庆阳 745000)
中国是稀土储量最丰富的国家,稀土开发利用造成的生态破坏与环境污染备受关注[1]。镧(La)是稀土元素中性质最活泼的一种,其在地壳中的丰度也最大,占稀土总丰度的14.1%。稀土在冶金、石油、纺织和农业等领域的广泛应用使储量丰富和性质活泼的La元素大量进入环境并产生积累,造成农业生态环境污染和作物生长发育受阻[2]。有研究报道,La胁迫下,黑麦草(Loliumperenne)[3-4]和燕麦(Avenanuda)[5]幼苗活性氧过量积累,导致细胞膜氧化损伤,碳、氮代谢紊乱,矿质元素吸收受阻,光合作用下降,生长发育受抑;高浓度La抑制烟草(Nicotianatabacum)叶绿体的光化学反应[6]和光合碳同化酶活性[7],使烟草光合速率和干物质积累量下降[8],黄瓜(Cucumissativus)细胞膜脂酸比发生改变[9]、类囊体结构遭受破坏和光合活性降低[10],水稻(Oryzasativa)矿质营养吸收分配变化[11]和抗氧化防御系统活性下降[12]。因此,探索提高农作物对La胁迫的抗性途径具有重要现实意义。
一氧化氮(nitric oxide,NO)是生物体内的一种气体信号分子,在增强植物对重金属胁迫抗性方面具有重要作用[13]。研究表明,外源NO可明显缓解Cu、Cd胁迫对番茄(Lycopersiconesculentum)生长发育的抑制作用[14],并通过提高活性氧清除能力和维持矿质元素平衡,缓解Cd胁迫对番茄幼苗叶片光合机构的破坏[15]。锰胁迫下,NO通过调控抗氧化系统减轻了水稻(Oryzasativa)的膜脂过氧化程度[16]。La胁迫下,外施NO可增强黑麦草幼苗超氧化物歧化酶和抗坏血酸过氧化物酶活性,提高叶片光化学效率,促进碳、氮代谢正常运转和矿质元素吸收[3-4];外施NO还可维持La胁迫下燕麦幼苗活性氧代谢的平衡,缓解La胁迫对K、Ca、Mg、Fe吸收及植株生长的抑制[5]。抗坏血酸-谷胱甘肽循环(ascorbate-glutathione cycle,AsA-GSH)是植物清除活性氧的酶促催化系统,在植物抵抗逆境胁迫伤害方面发挥着重要作用[17]。肖 强等[18]研究发现,NO可阻断高浓度La处理下水稻超氧化物歧化酶活性和还原型谷胱甘肽含量的下降及H2O2含量的上升,从而缓解La引起的氧化胁迫。李晓云等[19]报道,外源NO 参与了Cu胁迫下番茄幼苗根系的AsA-GSH循环调节,减缓了Cu胁迫对根系的毒害。燕麦(Avenanuda)是禾本科燕麦属一年生小杂粮作物,具有喜阴凉、耐贫瘠、抗盐、耐旱等生态学特性,是生态脆弱地区不可替代的特色粮饲兼用型作物[20]。外源NO能否调控La胁迫下燕麦AsA-GSH循环代谢,从而缓解La诱导的氧化伤害,目前尚未见报道。本试验拟研究外源NO供体硝普钠(Sodium nitroprusside, SNP)对La胁迫下燕麦幼苗叶片过氧化氢(H2O2)产生及AsA-GSH循环中抗氧化物质和相关代谢酶活性的影响,探讨La胁迫下NO调控AsA-GSH循环代谢的机理,旨在为减轻稀土重金属对植物的伤害提供新途径。
1 材料与方法
1.1 试验材料
试验于2015年4-7月在甘肃省高校陇东生物资源保护与利用省级重点实验室日光温室进行。供试燕麦品种为定莜6号,由甘肃省定西市旱作农业科研推广中心提供。氯化镧(LaCl3·2.5H2O)提供La3+,NO供体为SNP{[Na2Fe(CN)5]NO},均购自Sigma公司。
1.2 镧胁迫浓度和SNP处理浓度的筛选
选饱满一致的健康燕麦种子,用0.5% NaClO表面消毒后播种在21个培养皿(直径12 cm)中,基质为珍珠岩,浇水后在25 ℃、150 μmol·m-2·s-1和14 h/10 h(光照/黑暗)条件下培养;待幼苗2叶1心时将21个培养皿分为7组,每组3皿,分别用浓度为0、25、50、100、200、400、800 μmol·L-1氯化镧(LaCl3·2.5H2O)溶液冲洗幼苗根部3次,每皿浇灌相应浓度的氯化镧溶液15 mL;在上述条件下培养12 d,取幼苗倒数第2~3片展开叶,测定丙二醛(MDA)含量,以MDA含量显著高于对照(0 μmol·L-1LaCl3·2.5H2O)的最低浓度作为氯化镧处理浓度。在选出的氯化镧溶液中分别添加0、10、25、50、100、150、200、250、300 μmol·L-1SNP溶液,用上述方法在同样条件下培养12 d后,测定幼苗倒数第2~3片叶的MDA含量,以MDA含量最低的SNP浓度作为进一步进行氯化镧和SNP交叉处理的浓度。
1.3 试验设计
精选的燕麦种子播种在装满珍珠岩的塑料盆(口径20 cm,高14 cm)中,每盆播约300粒,浇水后置温室培养,温度18~35 ℃,湿度65%~87%,光照度480~730 μmol·m-2·s-1,幼苗1叶1心时选150株健壮植株转移至4 L水培箱中,用1/2 Hoagland溶液培养,培养一周后换成Hoagland完全营养液,此后每周更换一次营养液;当幼苗2叶1心时进行LaCl3·2.5H2O和SNP交叉处理:(1)对照(CK),Hoagland营养液;(2)La处理,含1.2中筛选出的La浓度的Hoagland营养液;(3)La + SNP,含1.2中筛选出的 La和SNP的Hoagland营养液;(4)SNP,含1.2中筛选出的 SNP的Hoagland营养液。为防止PO43-与La3+形成沉淀,配制Hoagland 营养液时省略了磷酸二氢盐,以每日向幼苗叶面喷施等量0.5 mmol·L-1KH2PO4溶液替代。每个处理重复3次,随机排列。处理期间每天更换处理液,电动气泵连续通气,pH调节至6.0±0.32。处理12 d后,分别取幼苗倒数第2~3片叶,液氮速冻后-80 ℃下保存,用于相关指标测定。
1.4 测定指标与方法
1.4.1 H2O2和MDA含量的测定
称取0.50 g样品,用5 mL 50 mmol·L-1磷酸缓冲液(PBS,pH 7.0)冰浴研磨,12 000 r·min-1、4 ℃离心30 min,上清液为待测提取液。H2O2含量测定参照Sergiev等[21]的方法,MDA含量测定按Predieri等[22]的方法。
1.4.2 AsA、DHA、GSH、GSSG含量的测定
称取1.00 g样品,用4 mL 6%三氯乙酸冰浴研磨,13 000 r·min-1冷冻离心10 min,取上清液按Kampfenkel等[23]的方法测定还原型抗坏血酸(AsA)和脱氢抗坏血酸(DHA)含量。称取1.00 g 样品用3.75 mL、0.1 mol·L-1PBS(pH 8.0,含5 mmol·L-1EDTA)和1 mL 25%磷酸冰浴研磨,15 000 r·min-1冷冻离心30 min后取上清液,按Hissin等[24]的方法测定还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)含量。
1.4.3 MDHAR、DHAR、APX、GR活性的测定
称取1.00 g 样品,用6 mL 50 mmol·L-1pH 7.0 PBS(含2 mmol·L-1EDTA、2 mmol·L-1DTT、20%甘油、2% PVP)冰浴研磨,10 000 r·min-1冷冻离心30 min,取上清液测定单脱氢抗坏血酸还原酶(MDHAR)、脱氢抗坏血酸还原酶(DHAR)、抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)活性。MDHAR和DHAR活性按Ma等[25]的方法测定波长在340 nm和265 nm吸光值OD的变化,以1 min内OD340值变化0.01为一个MDHAR活性单位(U),以1 min内OD265值变化0.01为一个DHAR活性单位(U)。APX活性按陈建勋等[26]的方法测定,以1 min内OD290变化0.01为1个酶活单位(U)。GR活性按Foyer等[27]的方法测定OD340值,以1 min内OD340变化0.01为一个酶活单位(U)。
1.4.4 La含量的测定
取氯化镧和SNP交叉处理12 d的幼苗50株,用5 mol·L-1EDTA溶液浸泡15 min后用蒸馏水淋洗干净,直尺测量自根结至主根尖长度和最高叶尖高度,分别作为根长和株高。将幼苗从根结处分成根系和地上部,于105±1 ℃杀青20 min,70 ℃烘干至恒重。将烘干根系和地上部磨细过0.18 mm尼龙筛,分别称取0.250 g在微波消化系统中用10 mL HNO3-HClO4(v∶v=8∶1)消化并定容至50 mL,采用电感耦合等离子体原子发射光谱仪(DRE型,美国Lee man公司)测定La含量。
1.5 数据统计分析
采用SPSS 20.0进行方差分析、Duncan法进行多重比较。
2 结果与分析
2.1 氯化镧和硝普钠处理浓度的筛选
从图1可见,氯化镧(LaCl3·2.5H2O)处理浓度为25~100 μmol·L-1时,燕麦幼苗叶片MDA含量与CK(0 μmol·L-1)无显著差异,200~800 μmol·L-1氯化镧处理显著提高了燕麦叶片的 MDA含量。因此,氯化镧胁迫浓度选择200 μmol·L-1。在200 μmol·L-1氯化镧胁迫下,10~300 μmol·L-1SNP处理燕麦叶片的MDA含量呈先降后升趋势,以100 μmol·L-1SNP处理的MDA含量下降幅度最大,且显著低于未添加SNP处理,所以进一步的试验中SNP浓度选用100 μmol·L-1。

图柱上不同字母表示处理间差异显著(P<0.05)。下同。
Different letters above columns represent significant difference at 0.05 level among treatments.The same in other figures.
图1不同浓度氯化镧胁迫及硝普钠处理下燕麦幼苗叶片的丙二醛含量
Fig.1MDAcontentofoatleavesunderdifferentLaCl3·2.5H2OandSNPtreatments
2.2 不同处理对燕麦幼苗叶片H2O2和MDA含量的影响
由图2可知, La胁迫较CK显著提高了燕麦幼苗叶片的H2O2和MDA含量,增幅分别为88.8%和64.7%;La + SNP处理与单独La处理相比,H2O2和MDA含量分别下降了25.3%和31.0%,差异显著;SNP单独处理的H2O2和MDA含量分别比CK降低了40.8%和38.9%,差异显著。说明外源NO能够抑制燕麦幼苗叶片的H2O2积累对膜脂的过氧化伤害。

CK、La、La+SNP、SNP 分别表示0 μmol·L-1、200 μmol·L-1LaCl3·2.5H2O、200 μmol·L-1LaCl3·2.5H2O+100 μmol·L-1SNP、100 μmol·L-1SNP处理。下同。
CK,La,La+SNP and SNP represent the treatments of control,200 μmol·L-1LaCl3·2.5H2O,200 μmol·L-1LaCl3·2.5H2O + 100 μmol·L-1SNP and 100 μmol·L-1SNP,respectively. The same in other table and figures.
图2不同处理对镧胁迫下燕麦幼苗叶片H2O2和丙二醛含量的影响
Fig.2EffectofdifferenttreatmentonH2O2andMDAcontentinleavesofoatseedlings
2.3 不同处理对燕麦幼苗生长和植株La含量的影响
从表1可见,与CK相比,La处理显著降低了燕麦幼苗的根长、株高、根系和地上部干重,分别下降35.5%、29.7%、35.1%和29.9%;显著提高了根系和地上部La含量,分别提高12.7倍和20.1倍;与La处理相比,La+SNP处理显著提高了燕麦幼苗根长、株高及根系和地上部干重,分别提高35.2%、22.0%、22.0%和20.3%,根系La含量没有显著变化,地上部La含量显著降低;单独SNP处理除显著提高了燕麦幼苗地上部干重外,其他被测指标与CK均无显著差异。
表1外源NO对La胁迫下燕麦幼苗生长及植株La含量的影响
Table1EffectofexogenousNOongrowthandlanthanumcontentinoatseedlingsunderLastress

处理Treatment根长Rootlength/cm株高Plantheight/cm每株干重Dryweightperplant/mg根系Root地上部Shoot根系La含量RootLacontent/(mg·g-1DW)地上部La含量ShootLacontent/(mg·g-1DW)CK13.15±0.59a17.25±0.39a11.22±0.30a20.24±0.97b7.72±0.16b3.65±0.06cLa8.48±0.63c12.13±0.47c7.28±0.46c14.19±1.11d105.56±2.26a76.84±1.71aLa+SNP11.46±0.26b14.80±0.26b8.88±0.26b17.07±0.29c107.08±4.14a63.05±3.07bSNP13.98±0.48a17.46±0.65a11.35±0.41a22.93±0.59a7.66±0.31b3.71±0.15c
同列数据后不同字母表示处理间差异在0.05水平显著。
Values within same column followed by different small letters are significantly different at 0.05 level.
2.4 不同处理对燕麦幼苗叶片抗氧化物质含量的影响
2.4.1 AsA、DHA、GSH和GSSG含量的变化
从图3可见,La胁迫下燕麦幼苗叶片AsA、DHA、GSH、GSSG含量与CK相比显著提高,分别提高51.4%、96.2%和2.75倍、5.43倍;La+SNP处理的AsA、DHA、GSH、GSSG含量与单独La处理相比分别下降了26.7%、44.7%、42.7%、58.6%,差异达显著水平;SNP单独处理的AsA和DHA含量较CK分别提高了39.1%和40.2%,差异显著;GSH和GSSG含量显著下降,分别降低了22.2%和20.3%。

图3 不同处理对燕麦幼苗叶片AsA、DHA、GSH和GSSG含量的影响
2.4.2 AsA/DHA和GSH/GSSG的变化
La胁迫下燕麦幼苗叶片AsA/DHA和GSH/GSSG显著下降,分别比CK下降了22.8%和41.7%(图4);La + SNP处理的AsA/DHA和GSH/GSSG较单独La处理显著提高,分别提高了32.5%和38.4%;SNP单独处理的AsA/DHA和GSH/GSSG与CK相比无显著差异。
2.5 不同处理对燕麦幼苗叶片AsA-GSH循环相关代谢酶活性的影响
由图5可知, La胁迫显著提高了燕麦幼苗叶片的MDHAR、DHAR、APX和GR活性,分别比CK提高了84.6%、49.9%、60.1%和115.1%;La + SNP处理的MDHAR、DHAR、APX和GR活性分别比La单独处理提高了49.6%、28.5%、21.3%和54.1%,差异显著;SNP单独处理的MDHAR、DHAR和GR活性与CK相比显著提高,增幅分别为81.4%、32.8%和174.2%,而APX活性与CK无显著差异。
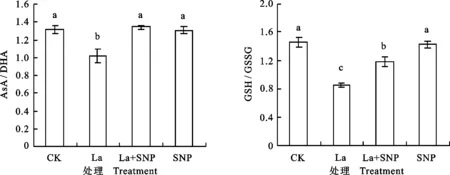
图4 不同处理对燕麦幼苗叶片AsA/DHA和GSH/GSSG的影响

图5 不同处理对燕麦幼苗叶片MDHAR、DHAR、APX和GR活性的影响
3 讨 论
抗坏血酸和谷胱甘肽是AsA-GSH循环中两种主要的抗氧化物质,AsA在APX催化下清除H2O2的同时自身被氧化成单脱氢抗坏血酸(MDHA),MDHA可被MDHAR重新还原成AsA,MDHA也可通过非酶促歧化生成DHA,DHA由GSH提供电子在DHAR催化下还原为AsA,而GSH则被氧化成GSSG[17],GSSG可由GR催化NADPH提供电子还原重新形成GSH[19]。因此,AsA、DHA、GSH、GSSG含量及AsA/DHA、GSH/GSSG比值的变化与植物重金属胁迫耐性密切相关。本试验结果表明,La胁迫在诱导燕麦叶片AsA、DHA和GSH、GSSG含量提高的同时,却导致AsA/DHA和GSH/GSSG降低;外施SNP能够有效减缓La胁迫燕麦叶片AsA、DHA和GSH、GSSG含量增幅,并提高AsA/DHA和GSH/GSSG,却使正常生长条件下的燕麦叶片AsA、DHA含量提升,GSH、GSSG含量下降,而AsA/DHA和GSH/GSSG保持不变。另外,AsA和DHA含量以单一La与单一SNP处理高于La + SNP处理,其原因可能与相关代谢酶活性有关,在La + SNP处理下显著高于单一La与单一SNP处理的DHAR活性催化DHA还原生成更多AsA,从而可能使La + SNP处理的DHA含量低于单一La与单一SNP处理,而La + SNP处理下显著高于单一La与单一SNP处理的APX活性催化AsA更多生成MDHA,而使AsA含量低于单一La与单一SNP处理。而GSH和GSSG含量表现为单一La处理>La+SNP处理>CK>单一SNP处理,推测可能是燕麦在遭受La胁迫后为了加强抗氧化防御合成了更多的GSH[30],而添加SNP后因NO本身可作为抗氧化物质直接与活性氧作用[28]或激活抗氧化防御能力[4,15],从而降低氧化伤害后减少了GSH的合成,即使在细胞正常代谢条件下产生的活性氧清除也可能如此;另一方面,SNP处理提高正常和La胁迫下燕麦的DHAR活性还会加速GSH向GSSG转化,使GSH含量下降,结果使GSH含量为单一La处理>La+SNP处理>CK>单一SNP处理。而SNP处理提高了正常和La胁迫下燕麦的GR活性,促进GSSG向GSH转化,使GSSG含量也表现为单一La处理>La+SNP处理>CK>单一SNP处理。由此表明,NO参与La胁迫下燕麦幼苗AsA-GSH循环中AsA和GSH氧化还原平衡的调节,这与Panda等[31]的外源NO能够抑制镉诱导的水稻AsA和GSH含量升高的结果一致,但与李晓云等[19]的外源NO降低铜胁迫下番茄根系AsA和GSH含量而提高DHA和GSSG含量的结果有所不同,这可能与胁迫类型、胁迫强度或植物种类、组织器官有关。
MDAR、DHAR、APX和GR是AsA-GSH循环系统中的关键酶,对AsA和GSH的再生及AsA-GSH循环有效运转具有重要作用。有研究表明,外源NO能够提高铜胁迫下番茄幼苗根系的MDHAR和DHAR活性,降低APX和GR活性[19]。NaCl胁迫下NO显著提高了黑麦草幼苗叶片的APX、GR和DHAR活性,却对MDAR活性无显著影响[32]。本试验结果表明,La胁迫下燕麦叶片MDHAR、DHAR、APX和GR活性显著提高,外施SNP能提高正常生长和La胁迫下燕麦叶片的MDHAR、DHAR和GR活性及La胁迫下的APX活性,却对正常生长条件下的APX活性影响不大。说明外源NO能够通过提高MDHAR、DHAR、APX和GR活性促进La胁迫燕麦幼苗AsA-GSH循环的有效运转,这与NO处理能够提高低温胁迫下枇杷(Eriobotryajaponica)叶片APX、GR、DHAR和MDAR活性的结果一致[33]。NO对MDHAR和DHAR活性的提高,有效抑制MDHA的歧化并促进MDHA与DHA向AsA的转化,维持细胞充足的AsA库源,使AsA/DHA提高,从而增强活性提高的APX对H2O2的清除能力;NO对GR活性的提高促进GSSG的还原,提高GSH/GSSG,从而保证AsA-GSH循环的有效运转。
综上所述,外源NO可抑制La胁迫下La从根系向地上部的转运,并通过激活MDHAR、DHAR、APX和GR活性,促进AsA和GSH再生,提高AsA/DHA和GSH/GSSG比值,从而减轻La胁迫诱导的H2O2等活性氧积累对燕麦幼苗的伤害,降低La胁迫对幼苗生长的抑制程度。
参考文献:
[1] 常 青,郭 伟,潘 亮,等.镧-铅复合污染下AM真菌对玉米生长和镧、铅吸收的影响[J].环境科学,2017,38(9):3916.
CHANG Q,GUO W,PAN L,etal.Effects of arbuscular mycorrhizal fungi on the growth and uptake of La and Pb by maize grown in soil with La and Pb combined contamination [J].EnvironmentalScience,2017,38(9):3916.
[2] 金姝兰,黄益宗.稀土元素对农田生态系统的影响研究进展[J].生态学报,2013,33(16):4838.
JIN S L,HUANG Y Z.A review on rare earth elements in farmland ecosystem [J].ActaEcologicaSinica,2013,33(16):4838.
[3] 刘建新,王金成,王瑞娟,等.硝普钠对镧胁迫下黑麦草幼苗叶片碳氮代谢和抗氧化系统的影响[J].中国稀土学报,2012,30(3):365.
LIU J X,WANG J C,WANG R J,etal.Effects of SNP on carbon and nitrogen metabolism and antioxidant system in ryegrass seedling leaves under lanthanum stress [J].JournalofTheChineseSocietyofRareEarths,2012,30(3):365.
[4] 刘建新,王金成,王瑞娟,等.硝普钠对镧胁迫下黑麦草幼苗光合特性及矿质元素吸收的影响[J].环境科学学报,2012,32(11):2898.
LIU J X,WANG J C,WANG R J,etal.Effects of sodium nitroprusside on photosynthetic characteristics and mineral element contents inLoliumperenneL. seedlings under lanthanum stress [J].ActaScientiaeCircumstantiae,2012,32(11):2898.
[5] 刘建新,王金成,刘秀丽.外源NO对镧胁迫下燕麦幼苗活性氧代谢和矿质元素含量的影响[J].草业学报,2017,26(5):135.
LIU J X,WANG J C,LIU X L.Effect of exogenous nitric oxide on active oxygen metabolism and mineral contents in oat seedlings under lanthanum stress [J].ActaPrataculturaeSinica,2017,26(5):135.
[6] 陈为钧,魏正贵,陶 冶,等.镧对烟草叶绿体光化学反应的影响[J].作物学报,2001,27(4):506.
CHEN W J,WEI Z G,TAO Y,etal.Effects of La(NO3)3on photosynthetic light reaction in chloroplast of tobacco plants [J].ActaAgronomicaSinica,2001,27(4):506.
[7] CHEN W J,GU Y H,WANG S B,etal.Effect of lanthanum on RuBPcase activity of tobacco seedlings [J].JournaloftheChineseRareEarthSociety,2000,18(3):258.
[8] CHEN W,TAO Y,GU Y,etal.Effect of lanthanide chloride on photosynthesis and dry matter accumulation in tobacco seedlings [J].BiologicalTraceElementResearch,2001,79(2):169.
[9] 史 萍,曾福礼,邓汝温.镧对黄瓜幼苗叶片细胞透性及膜脂的影响[J].中国稀土学报,2004,22(2):61.
SHI P,ZENG F L,DENG R W.Effects of lanthanum on permeability and membrane lipid composition in cucumber seedling leaves [J].JournaloftheChineseRareEarthSociety,2004,22(2):61.
[10] 王立丰,李良壁,白克智,等.高浓度LaCl3抑制黄瓜(CucumissativusLinn)光系统Ⅱ(PSⅡ)活性[J].中国稀土学报,2005,23(6):770.
WANG L F,LI L B,BAI K Z,etal.Inhibitory effect of high concentration LaCl3on photosystemⅡ activity of cucumber(CucumissativusLinn) [J].JournaloftheChineseRareEarthSociety,2005,23(6):770.
[11] XIE Z B,ZHU J G,CHU H Y,etal.Effect of lanthanum on rice production,nutrient uptake,and distribution [J].JournalofPlantNutrition,2002,25(10):2315.
[12] XIAO Q,RU Q M,WU F H,etal.Nitric oxide alleviation for oxidative stress caused by lanthanum in rice leaves [J].JournaloftheChineseRareEarthSociety,2007,25(6):745.
[13] 夏海威,施国新,黄 敏,等.一氧化氮对植物重金属胁迫抗性的影响研究进展[J].生态学报,2015,35(10):3139.
XIA H W,SHI G X,HUANG M,etal.Advances on effects of nitric oxide on resistances of plants to heavy metal stress [J].ActaEcologicaSinica,2015,35(10):3139.
[14] 崔秀敏,吴小宾,李晓云,等.铜、镉毒害对番茄生长和膜功能蛋白酶活性的影响及外源NO的缓解效应[J].植物营养与肥料学报,2011,17(2):349.
CUI X M,WU X B,LI X Y,etal.Responses of growth,functional enzyme activity in biomembrane of tomato seedlings to excessive copper,cadmium and the alleviating effect of exogenous nitric oxide [J].JournalofPlantNutritionandFertilizer,2011,17(2):349.
[15] 张义凯,崔秀敏,杨守祥,等.外源NO对镉胁迫下番茄活性氧代谢及光合特性的影响[J].应用生态学报,2010,21(6):1432.
ZHANG Y K,CUI X M,YANG S X,etal.Effects of exogenous nitric oxide on active oxygen metabolism and photosynthetic characteristics of tomato seedlings under cadmium stress [J].ChineseJournalofAppliedEcology,2010,21(6):1432.
[16] SRIVASTAVA S,DUBEY R S.Nitric oxide alleviates manganese toxicity by preventing oxidative stress in excised rice leaves [J].ActaPhysiologiaePlantarum,2012,34(2):819.
[17] MILLER G,SUZUKI N,CIFTCI-YILMAZ S,etal.Reactive oxygen species homeostasis and signalling during drought and salinity stresses [J].PlantCellandEnvironment,2010,33(4):453.
[18] 肖 强,茹巧美,吴飞华,等.一氧化氮对水稻叶片中由镧引起的氧化胁迫的缓解作用[J].中国稀土学报,2007,25(6):745.
XIAO Q,RU Q M,WU F H,etal.Nitric oxide alleviation for oxidative stress caused by lanthanum in rice leaves [J].JournaloftheChineseRareEarthSociety,2007,25(6):745.
[19] 李晓云,王秀峰,吕乐福,等.外源NO对铜胁迫下番茄幼苗根系抗坏血酸-谷胱甘肽循环的影响[J].应用生态学报,2013,24(4):1023.
LI X Y,WANG X F,LÜ L F,etal.Effects of exogenous nitric oxide on ascorbate-glutathione cycle in tomato seedlings roots under copper stress [J].ChineseJournalofAppliedEcology,2013,24(4):1023.
[20] QIAO Y M.Effects of seeding density on quantitative characters of oat [J].PrataculturalScience,2002,19(1):31.
[21] SERGIEV I,ALEXIEVA V,KARANOV E.Effect of spermine,atrazine and combination between them on some endogenous protective systems and stress markers in plants [J].ComptesRendusdeI'AcademieBulgaredesSciences,1997,51(2):121.
[22] PREDIERI S,NORMAN H A,KRIZEK D T,etal.Influence of UV-B radiation on membrane lipid composition and ethylene of evolution in 'Doyenne d'Hiver' pear shoots grown in vitro under different photosynthetic photo fluxes [J].EnvironmentalandExperimentalBotany,1995,35(35):151.
[23] KAMPFENKEL K,VANMONTAGU M,INZE D.Extraction and determination of ascorbate and dehydroascorbate from plant tissue [J].AnalyticalBiochemistry,1995,225(1):165.
[24] HISSIN P J,HILF R.A fluorometric method for determination of oxidized and reduced glutathione in tissues [J].AnalyticalBiochemistry,1976,74(1):214.
[25] MA F W,CHENG L L.The sun-exposed peel of apple fruit has higher xanthophylls cycle-dependent thermal dissipation and antioxidants of the ascorbate-glutathione pathway than the shaded peel [J].PlantScience,2003,165(4):819.
[26] 陈建勋,王晓峰.植物生理学实验指导(第二版)[M].广州:华南理工大学出版社,2006:70-71.
CHEN J X,WANG X F.Plant physiology experimental guidance [M].Guangzhou:South China University of Technology Press,2006:70-71.
[27] FOYER C H,HALLIWELL B.Presence of glutathione and glutathione reductase in chloroplasts:A proposed role in ascorbic acid metabolism [J].Planta,1976,133(1):23.
[28] BESSONBARD A,PUGIN A,WENDEHENNE D.New insights into nitric oxide signaling in plants [J].AnnualReviewofPlantBiology,2008,59(1):24.
[29] 王丽娜,杨凤娟,王秀峰,等.外源NO对铜胁迫下番茄幼苗生长及其抗氧化酶编码基因mRNA转录水平的影响[J].园艺学报,2010,37(1):47.
WANG L N,YANG F J,WANG X F,etal.Effects of exogenous nitric oxide on growth and transcriptional expression of antioxidant enzyme mRNA in tomato seedlings under copper stress [J].ActaHorticulturaeSinica,2010,37(1):47.
[30] ARAVIND P,PRASAD M N V.Mojulation of cadmium-induced oxidative stress inCeratophyllumdemersumby zinc involves ascorbate-glutathione cycle and glutathione metabolism [J].PlantPhysiologyandBiochemistry,2005,43(2):107.
[31] PANDA P,NATH S,CHANU T T,etal.Cadmium stress-induced oxidative stress and role of nitric oxide in rice(OryzasativaL.) [J].ActaPhysiologiaePlantarum,2011,33(5):1737.
[32] 刘建新,王 鑫,李博萍.外源一氧化氮供体SNP对NaCl胁迫下黑麦草幼苗叶片抗坏血酸-谷胱甘肽循环的影响[J].草业学报,2010,19(2):82.
LIU J X,WANG X,LI B P.Effects of exogenous nitric oxide donor SNP on ascorbate-glutathione cycle metabolism in ryegrass seedling leaves under NaCl stress [J].ActaPrataculturaeSinica,2010,19(2):82.
[33] 吴锦程,陈建琴,梁 杰,等.外源一氧化氮对低温胁迫下枇杷叶片AsA-GSH循环的影响[J].应用生态学报,2009,20(6):1395.
WU J C,CHEN J Q,LIANG J,etal.Effects of exogenous NO on ascorbate-glutathione cycle in loquat leaves under low temperature stress [J].ChineseJournalofAppliedEcology,2009,20(6):1395.

