鸡传染性支气管炎病毒N蛋白的表达及ELISA诊断试剂盒的研制与应用
亓丽红,黄 兵,吴家强,宋玲玲,王友令,马秀丽,于可响,刘 涛,艾 武,徐怀英
(山东省农业科学院 家禽研究所,山东 济南 250023)
鸡传染性支气管炎病毒(IBV)引起鸡急性高度接触性传染病,以呼吸道症状、蛋种鸡产蛋量下降、蛋品质下降、肾脏病变及胃肠炎变化为主要特征,是目前危害国际养禽业的主要疾病之一。由于IBV血清型多,且新的血清型不断涌现,而各型间交叉保护率低,新的变异株不断出现,组织嗜性也多变,给诊断和防治带来一定困难[1-5]。
IBV含有3种结构蛋白,即纤突蛋白S、膜蛋白M和核衣壳蛋白N。N蛋白占病毒总蛋白量的40%,主要作用是包裹核酸,与病毒的复制有关[6]。N蛋白还能免疫识别相关靶位,在细胞免疫和体液免疫中起作用。在进化过程中N蛋白比S1蛋白相对保守,因此我们通过对N蛋白进行表达,以此作为群特异性诊断抗原,建立了检测不同IBV抗体水平的间接ELISA诊断试剂盒。自建试剂盒选择原核表达载体pET-32 a(+)构建重组表达质粒进行融合表达并纯化,解决了IBV全病毒纯化困难的问题。检测鸡传染性支气管炎病毒抗体的间接ELISA试剂盒,成本低廉、操作简便、快速,尤其适合批量样品的检测,大大提高了鸡传染性支气管炎血清学诊断的效率[7-10]。
1 材料与方法
1.1 病毒、试剂及药品
IBV-LC2、表达载体pET32 a、大肠杆菌BL21均为山东省农业科学院家禽研究所禽病诊断与免疫重点实验室保存。限制性内切酶SalⅠ、EcoRⅤ及Trizol RNA提取试剂购自TaKaRa公司;反转录酶(AMV)、RNA酶抑制剂及dNTP混合物购自Promage公司;酶标HRP-羊抗鸡IgG(工作浓度为1∶3 000)购自SouthernBiotech公司;rTaqDNA聚合酶、DNA分子量标准(Marker)购自宝生物工程(大连)有限公司;IBV ELISA检测试剂盒购自IDEXX公司,其他试剂均为国产或进口分析纯。
1.2 IBV N蛋白的扩增及重组表达载体的构建
参照GenBank已公布的IBV-LC2N基因(DQ377139)序列,设计一对特异性引物,正链引物为5′-CCGATATCATGGCAAGCGGTAAAGCA-3′(EcoRⅤ位点),负链引物为5′-CCGTCGACACTC AAAGTTCATTCTCTCC-3′(SalⅠ位点),扩增片段大小为1 230 bp。引物合成由生工生物工程(上海)有限公司完成。提取核酸,进行RT-PCR。PCR循环参数为:94 ℃变性2 min后,经94 ℃ 1 min,50 ℃ 60 s,72 ℃ 2 min,共30个循环,最后于72 ℃延伸10 min。将载体pET32 a和PCR产物进行EcoR V、SalⅠ双酶切并回收。用T4 DNA连接酶将二者进行16 ℃过夜连接,转化表达宿主菌感受态细菌BL21,37 ℃温箱培养16~20 h。挑取单菌落扩大培养,提取质粒,用EcoR V、SalⅠ进行双酶鉴定。将阳性重组质粒送上海博亚生物技术有限公司测序。
1.3 重组表达质粒在宿主菌中的诱导表达
将鉴定为阳性的重组菌接种于4 mL LB(含100 μg·mL-1Amp)试验培养基中,待37 ℃振荡过夜,取出1 mL,离心,去上清,菌体接种于100 mL含Amp的 LB(100 μg·mL-1)培养基中。37 ℃ 200 r·min-1振荡培养至D600=0.6,加IPTG至终浓度为1.0 mmol·L-1,继续诱导培养至4 h,10 000 r·min-1离心5 min,收集菌体,加适量裂解缓冲液,于冰浴中超声破碎,10 000 r·min-1离心5 min,收集上清。加入等体积SDS-PAGE上样缓冲液,煮沸3~5 min。每孔上样15 μL,进行SDS-PAGE电泳。用染色液 R-250染色,后放入脱色液中脱色。
1.4 表达产物的Western-blot检测
将表达产物进行SDS-PAGE电泳,待电泳分离后,切出含待转膜蛋白的凝胶转至硝酸纤维素膜。用含10%小牛血清的PBST洗液浸泡硝酸纤维膜,37 ℃封闭2 h。用洗液1∶100倍稀释鸡抗IBV阳性血清,将硝酸纤维素膜浸泡其中,反应1 h,洗液洗膜3次,每次5 min。加入新配置的DAB显色液,避光反应15 min。显色完成后,将硝酸纤维素膜移至蒸馏水中终止显色。
1.5 表达的融合蛋白的纯化
按照His-Bind蛋白纯化柱使用说明进行表达蛋白的纯化。将破碎好的重组菌进行SDS-PAGE电泳,电泳结束后取下凝胶,先用双蒸水洗涤,然后浸入4 ℃预冷的250 mmol·L-1的KCl溶液中显色5~10 min,最后用双蒸水洗涤。将目的蛋白条带切下,放入2 mL的Eppendorf管中,加少量的PBS洗涤数次,加少量的PBS,用玻璃棒将其捣细,反复冻融数次,8 000 r·min-1离心10 min,吸取上清,SDS-PAGE电泳进行纯度鉴定,核酸蛋白分析仪测定蛋白浓度。经SDS-PAGE验证后将纯化后的蛋白分装放入-20 ℃保存备用。
1.6 间接ELISA最佳工作浓度及临界值的确定
用包被缓冲液将IBV N重组蛋白进行倍比稀释,包被ELISA反应板,每孔80、40、20、10、5、2.5 μg·mL-1包被ELISA反应板,IBV阳性血清和阴性血清经大肠杆菌裂解液处理后分别作1∶25,1∶50,1∶100,1∶200,1∶400,1∶800系列稀释;进行间接ELISA测定。TMB底物显色,硫酸终止反应;测定光波长450 nm的D值。在最佳工作条件下,对收集的20份无IBV抗体鸡血清进行间接ELISA测定,确定阴阳性临界值。
1.7 间接ELISA的特异性、重复性试验和抗原保存期试验
用IBV-N蛋白建立的间接ELISA方法分别检测NDV、AIV、EDS-76、IBDV、ILTV等阳性血清及IBV阴性血清进行交叉反应性测定,每样本2个重复。用2次包被的酶标板,检测10份IBV阳性血清和10份阴性血清,每个样品重复检测5次,测定其变异系数。纯化的重组N蛋白以最佳工作浓度包被封闭后,待其干燥后装入含干燥剂的包装袋中4 ℃保存,后隔12个月取出用已知阴阳性血清按所建立的方法进行检测。
1.8 与IDEXX公司的ELISA试剂盒检测的对比
临床应用检验的样品80份。应用自制ELISA试剂盒和进口IDEXX试剂盒同时检测送检样品,比较试剂盒的符合率。
1.9 间接ELISA方法的初步应用
将免疫雏鸡所孵出的12日龄的雏鸡分别在免疫前、免疫H120后5、9、21和28 d采血,分离血清,间接ELISA测定,分析母源抗体的消长情况。
2 结果与分析
2.1 载体的构建
阳性重组表达质粒经EcoR V、SalⅠ双酶切产生5.9 kb的载体条带和约1.23 kb的外源基因片段。并将阳性重组表达质粒命名为PET32 a-LC2-N。结果见图1。测序结果显示插入方向正确,插入片断为 1 230个核苷酸,编码410个氨基酸。推测IBV-LC2-N蛋白分子量为45.1 ku,融合伴侣分子量为20.4 ku,整个表达融合蛋白为65.5 ku。

1为EcoR V、SalⅠ双酶切质粒pET-LC2-N;2为DNA分子质量标准;3为EcoR V、SalⅠ双酶切质粒pET-LC2-N;4为DNA分子质量标准图1 pET32 a-LC2-N重组质粒酶切鉴定的结果
2.2 表达产物的SDS-PAGE与Western-blotting分析
将含有阳性重组载体的大肠杆菌在IPTG诱导下表达,产物经 SDS-PAGE检测,在大约65 ku处可见表达条带,与预期蛋白大小相一致,而空载体菌诱导后,没有出现此蛋白条带(图2)。将目的蛋白进行纯化(图3)。Western-blotting分析发现该融合蛋白能与鸡抗IBV阳性血清进行反应,具有良好的免疫原性,确定了65.5 ku的蛋白为重组的N蛋白(图4)。
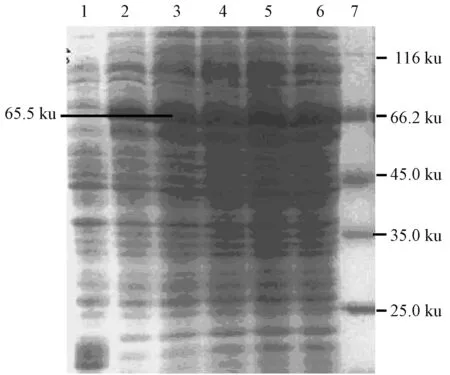
1为pET-32 a诱导表达4 h;2~6为pET-32 a-IBV-N-BL21诱导表达4 h;7 为蛋白质分子质量标准图2 重组蛋白的诱导表达
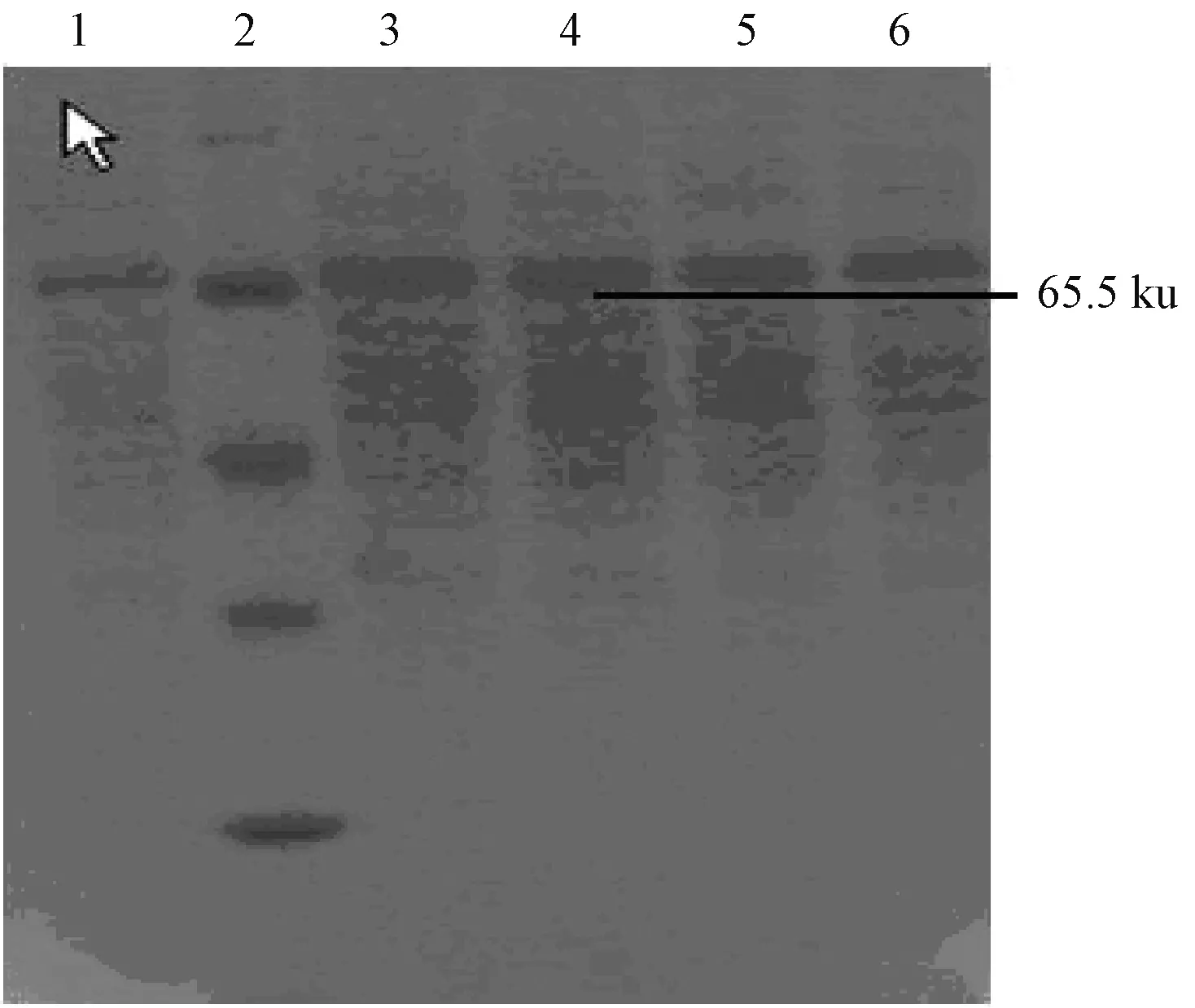
1为纯化的重组蛋白;2为蛋白质分子质量标准;3~6为纯化的重组蛋白图3 重组蛋白的纯化
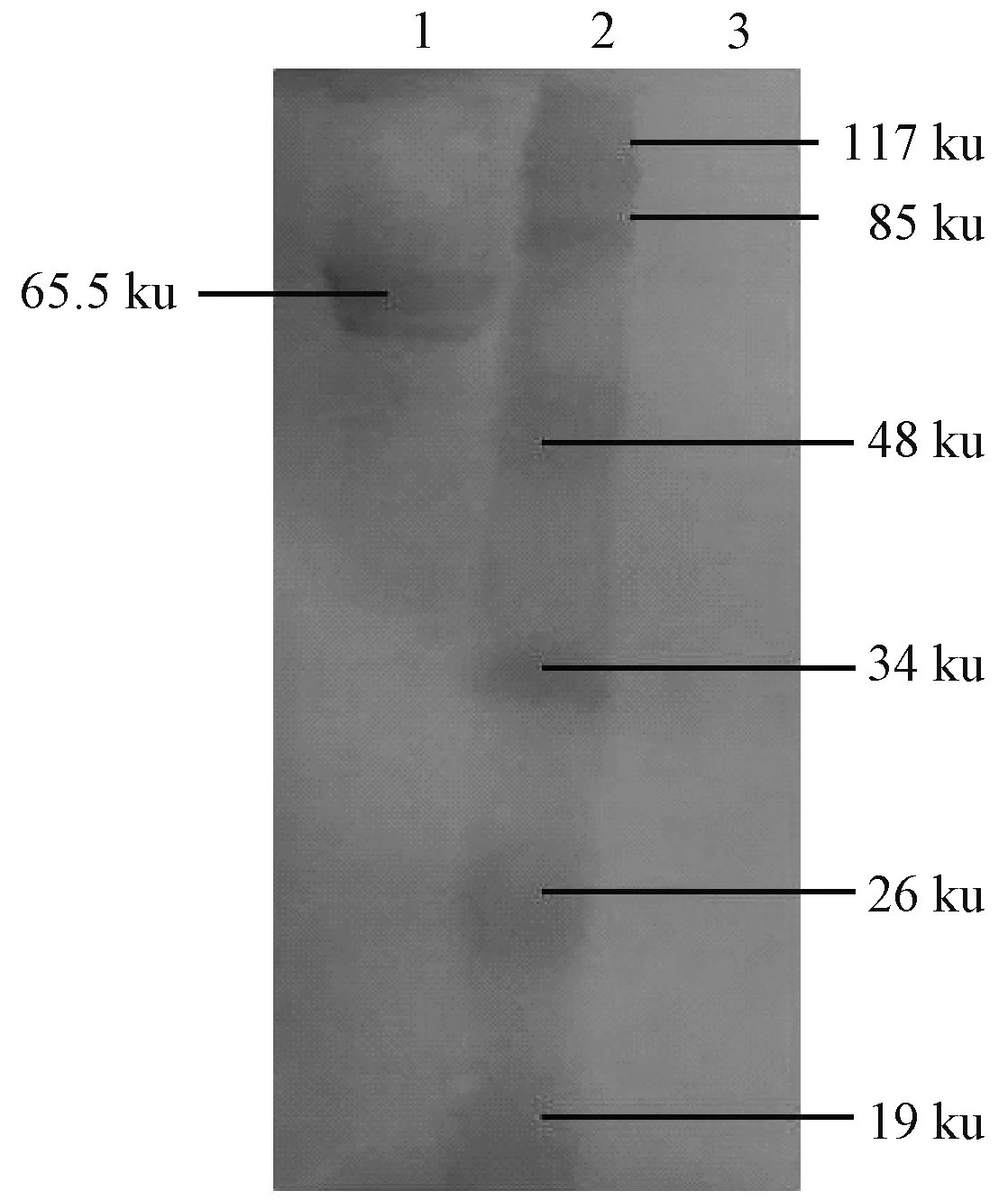
1为重组蛋白;2为蛋白质分子质量标准;3为pET-32(+)空载体图4 重组蛋白的Western-blot 检测
2.3 间接ELISA最佳工作浓度及临界值的确定
间接ELISA方阵实验结果(表1)取阳性血清D450在1.0左右,阴性血清D450在 0.297左右,且阳性血清D450/阴性血清D450即P/N值大于2.1的抗原浓度和血清稀释度为最佳工作浓度,结果如表1所示。从表1~2可以看出,抗原最佳浓度为20 μg·mL-1,血清最佳稀释浓度为1∶200。
2.4 间接ELISA的特异性、重复性试验和抗原保存期的确定
用IBV-N蛋白建立的间接ELISA方法分别检测NDV、AIV、EDS-76、IBDV、ILTV等阳性血清及IBV阴性血清进行交叉反应性测定,结果均为阴性,表明该方法与上述病毒无交叉反应。用2次包被的酶标板,检测10份IBV阳性血清和10份阴性血清,每个样品重复检测5次,测定其变异系数结果表明,变异系数最大为4.80%,最小为0.8%。20份血清变异系数都较小,具有较好的重复性。隔12个月取出用已知阴阳性血清按所建立的方法进行检测。结果显示,包被本发明的重组N蛋白保存12个月仍可用于检测。

表1 不同抗原包被量和血清稀释度对D450值的影响
注:P代表阳性血清;N代表阴性血清。

表2 不同抗原包被量和血清稀释度对P/N值的影响
2.5 自制ELISA试剂盒与中和进口IDEXX试剂盒的对比
临床应用检验的样品80份。应用自制ELISA试剂盒和进口IDEXX试剂盒同时检测送检样品,比较试剂盒的符合率。其中自制ELISA试剂盒检出阳性血清为50份,阳性检出率为62.5%,进口IDEXX试剂盒检出阳性血清47份,阳性检出率为58.75%,2种方法的符合率为96.25%(表3)。

表3 血清样品的检测结果与IDEXX公司的ELISA试剂盒比较
2.6 间接ELISA方法的应用
用该试剂盒对雏鸡免疫 IBV H120前及免疫后5、9、21及28 d鸡的抗体滴度进行检测,免疫7 d后开始出现免疫抗体,然后抗体水平不断升高,到21 d抗体水平达到最高峰,随后抗体水平逐渐下降,28 d时抗体检测为阳性,抗体持续到28日龄(图5)。
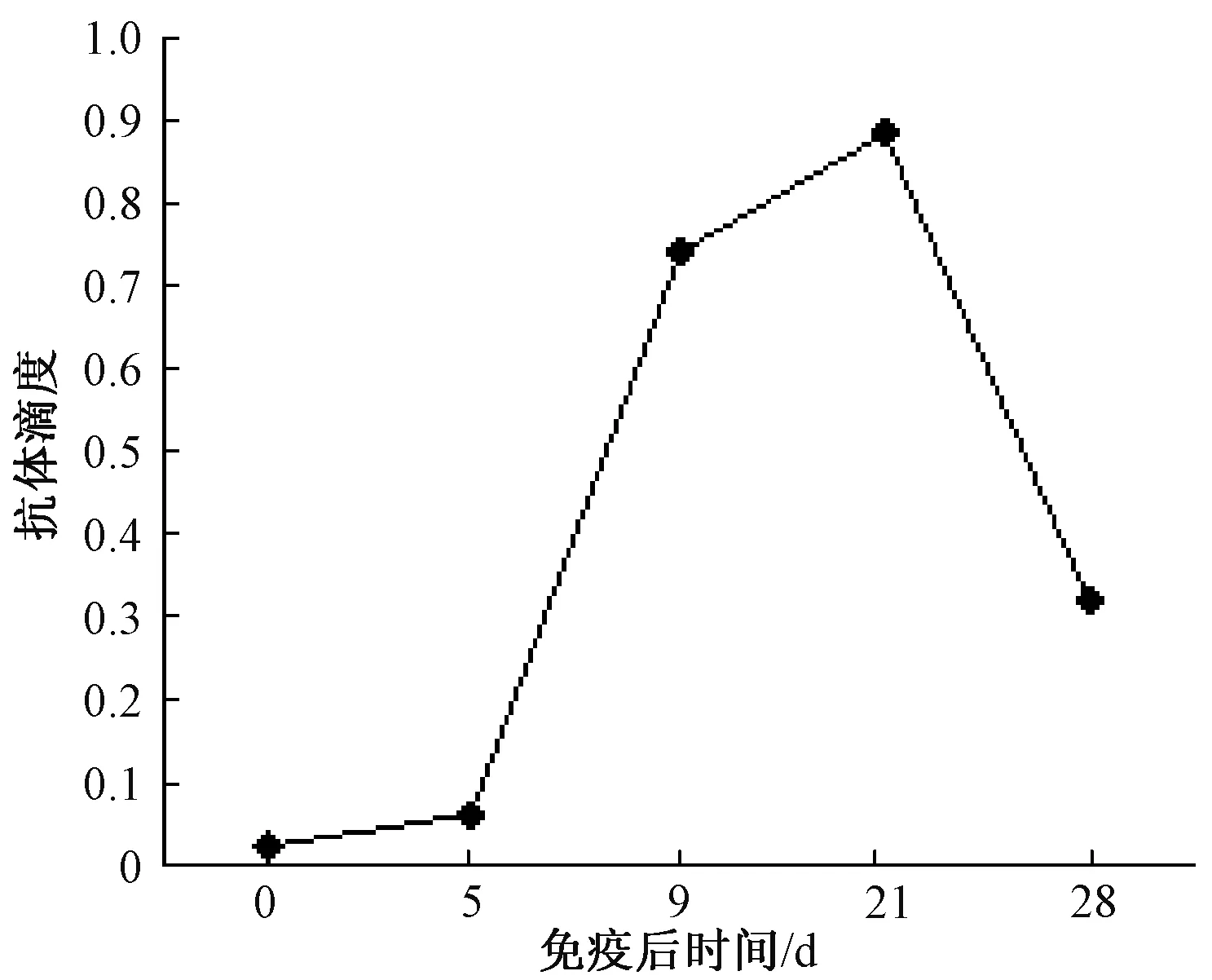
图5 SPF雏鸡免疫后抗体的消长规律
3 小结与讨论
IBV核衣壳蛋白又称核蛋白(N蛋白),具有很好的抗原性和免疫原性,在细胞免疫和体液免疫中起着重要作用。体外表达的N蛋白能引起免疫应答,能使免疫鸡增速产生抗IBV抗体,可诱导鸡对IBV气管感染的免疫保护作用。用N蛋白免疫鸡后,可激活T辅助细胞,同时可增强B淋巴细胞产生抗体的能力。加上N蛋白具有高保守性,这使得N蛋白及其抗体在IBV诊断方面显示出优势。核蛋白占病毒总蛋白量大,而且核蛋白为非糖基化蛋白,由于它能检测群抗体应答,可以作为IBV群特异性诊断抗原。本研究在利用RT-PCR成功获得了IBVN基因的基础上,利用原核表达载体pET-32 a成功地表达了N蛋白,并证实了其具有良好的反应原性。以此重组N蛋白建立了N-ELISA,经特异性、重复性试验证实了建立的N-ELISA具有良好的应用价值。
通过自制试剂盒来检测免疫H120的IBV抗体消长变化,可知,在免疫7 d后,机体开始产生抗体,然后抗体水平不断升高,到21 d抗体水平达到最高峰,随后抗体水平逐渐下降,抗体持续到28 d,符合IBV弱毒疫苗抗体的消长规律,说明该试剂盒的检测结果可以适用于IBV免疫后的抗体水平检测。自制试剂盒的包被抗原区别于IDEXX的包被抗原IBV。自建试剂盒检测血清时做200稀释。IDEXX试剂盒检测样品时,血清样品是做500倍稀释,用这2种方法对80份血清样本进行检测,比较它们的检测结果发现,自建试剂盒检测D值普遍都比IDEXX试剂盒的D值高。出现这样的差异可能是由于血清稀释度不同造成的,也可能与2种试剂盒的包被抗原不同有关。通过比较实验结果表明自制试盒质量可靠,结果确实,是一种敏感、快速的临床检测方法。但自制试剂盒其成本低,可以用于大批量检测,是我们急需研制的国产同类试剂盒,以提高我国对IBV的检测水平[8,11]。
参考文献:
[1] 刘程. 鸡传染性支气管炎病毒RT-PCR和RT-LAMP检测方法的建立 [D]. 成都:四川农业大学,2012:9-23.
[2] BANDE F, ARSHAD S S, OMAR A R, et al. Global distributions and strain diversity of avian infectious bronchitis virus: a review [J]. Animal Health Research Reviews, 2017, 18(1):70-83.
[3] SEGER W, GHALYANCHI LANGEROUDI A, KARIMI V, et al. Prevalence of avian infectious bronchitis virus in broiler chicken farms in south of Iraq, 2014—2015 [J]. Veterinary Research Forum, 2016, 7(4):317-321.
[4] ZANATY A, ARAFA A S, HAGAG N, et al. Genotyping and pathotyping of diversified strains of infectiousbronchitis viruses circulating in Egypt [J]. World Journal of Virology, 2016, 5(3):125-134.
[5] HEMIDA M G, AL-HAMMADI M A, DALEB A H S, et al. Molecular characterization and phylogenetic analyses of virulent infectious bronchitis viruses isolated from chickens in Eastern Saudi Arabia [J]. Virusdisease, 2017, 28(2):189-199.
[6] 李敏, 李俐睿, 岳建国, 等. 鸡传染性支气管炎病毒重组N蛋白克隆表达与免疫原性检测 [J]. 四川畜牧兽医,2017, 44(4):24-27.
[7] MODIRI HAMADAN A, GHALYANCHILANGEROUDI A, HASHEMZADEH M, et al. Genotyping of Avian infectious bronchitis viruses in Iran (2015—2017) reveals domination of IS-1494 like virus [J]. Virus Research, 2017, 240:101-106.
[8] 王俞丹, 杨保收, 陈冰, 等. 鸡IBV鉴别诊断ELISA方法的研究 [J]. 黑龙江畜牧兽医,2016(3):116-117.
[9] SULTANKULOVA K T, KOZHABERGENOV N S, STROCHKOV V M, et al. New oligonucleotide microarray for rapid diagnosis of avian viral diseases [J]. Virology Journal, 2017, 14(1):69.
[10] BATRA A, MAIER H J, FIFE M S. Selection of reference genes for gene expression analysis by real-time qPCR in avian cells infected with infectious bronchitis virus [J]. Avian Pathology, 2017, 46(2):173-180. doi: 10.1080/03079457.2016.1235258. Epub 2016 Dec 7.
[11] TSAI C T, TSAI H F, WANG C H. Detection of infectious bronchitis virus strains similar to Japan in Taiwan[J]. Journal of Veterinary Medical Science, 2016, 78(5):867-871.
——一道江苏高考题的奥秘解读和拓展

