鲍内脏多糖体内抗氧化及增强小鼠免疫活性
魏好程,邵 杰,何传波,李 漫,熊何健*
自由基是人体生命活动中各种生化反应的中间代谢产物,因其单电子的结构而表现出极其活泼的不稳定性[1],人体内自由基的过量积累会造成机体在分子水平、细胞水平及组织器官水平的各种不可逆的氧化损伤[2],引起机体免疫功能下降,导致机体衰老。食品中含有多种抗氧化物质,生命组织中也存在多种内源性抗氧化物质协同维持机体内生命过程中自由基的平衡。
近年来,科学家不断地从海洋生物中发现一些具有抗氧化活性和增强机体免疫力的化合物,其中多糖类物质因易被生物体吸收,通过清除体内自由基,表现出较强的抗氧化作用和其他生物活性而受到人们的关注。鲍是我国极具经济价值的水产品之一,近年来因人工养殖技术鲍产量得以大幅提升,2015年我国鲍养殖量12.8万 t,其中福建省鲍产量10.0万 t,经济产值已经超过100亿 元,鲍产业已成为福建省海洋渔业的重要支柱产业之一[3]。鲍在加工过程中会产生约自身体质量35%的内脏下脚料,常被直接丢弃,不仅污染环境,而且造成资源浪费[4]。鲍内脏包含肝胰腺、肾脏、性腺等内脏组织,还含有鲍消化后的产物。酶解后的鲍内脏含有丰富的消化酶、蛋白肽、多糖和脂肪酸等生理活性物质,是海洋活性功能物质的良好来源[5-6],鲍内脏的精深加工已成为产业发展的迫切需求。
已有研究表明,鲍脏器中存在多种清除自由基、促进淋巴细胞增殖、抑制肿瘤细胞生长的活性成分,表现出抗氧化、增强机体免疫和抗癌等功能活性。王姣等[7]研究表明鲍内脏多糖(abalone visceral polysaccharides,AVP)对1,1-二苯基-2-三硝基苯肼自由基和羟自由基具有良好的清除作用。陈秀琴[8]运用酶解法发现鲍内脏蛋白肽也能很好地体外清除自由基活性,表现出良好抗氧化功效。苏永昌等[9]采用不同种类蛋白酶酶解提取鲍内脏多糖后发现,胃蛋白酶对鲍内脏多糖提取效果最好,得到的各组多糖均表现出良好的抗氧化作用,而何传波等[10]利用碱性蛋白酶制备的鲍内脏蛋白肽,表现出较好的体内抗氧化活性。程婷婷等[11]从鲍脏器中分离纯化出一种多糖,表现出一定的体外抗肿瘤活性。朱莉莉[12]、王莅莎[13]等分别从鲍内脏中分离提取的鲍内脏多糖,能显著抑制H22肝癌细胞生长,以及对HeLa和K562细胞具有一定程度的抑制作用,表现出抗肿瘤活性和增强免疫活性。相关研究报道多聚焦于鲍内脏多糖和多肽的功能活性研究,但功能活性实验多停留在体外实验和细胞实验阶段,关于鲍内脏多糖对动物体内实验的相关报道还很有限。
本研究在课题组已有的二次酶解技术工艺制备鲍内脏多糖的基础上,结合前期已取得的体外抗氧化研究结果[7,14],开展鲍内脏多糖体内抗氧化及增强小鼠免疫活性的研究,以期为鲍的综合利用及产业发展提供实验依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性KM小鼠、SPF级雄性BALB/C小鼠,体质量(18±2)g,均购于上海斯莱克实验动物有限责任公司,许可证号SCXK(沪)2012-0002。分笼饲养,每天光照12 h,动物房环境温度20~25 ℃,相对湿度50%~60%,自由进食进水,每天更换饲料、饮水和垫料,进行7 d适应性喂养。
鲍内脏多糖由集美大学食品与生物工程学院功能性食品研究实验室自制。经高效液相色谱检测,实验用鲍内脏多糖样品含有甘露糖、葡萄糖胺、半乳糖胺、葡萄糖、半乳糖、木糖、岩藻糖7 种单糖,总糖含量49.6%。
总超氧化物歧化酶(total superoxide dismutase,T-SOD)测试盒、丙二醛(malondialdehyde,MDA)测试盒、还原型谷胱甘肽(glutathione,GSH)测试盒、蛋白质羰基测试盒、考马斯亮蓝测试盒 南京建成试剂有限公司。
1.2 仪器与设备
JDC-0.2真空冷冻干燥机 厦门柏嘉生物科技有限公司;RNF0460-011多功能卷式膜小试设备 厦门福美科技有限公司;UV-8000A紫外-可见分光光度计 上海尤尼柯仪器有限公司;Ultimate 3000高效液相色谱仪美国DIONEX公司。
1.3 方法
1.3.1 体内抗氧化活性动物实验分组及给药实验设计
实验参照[2012]107号《关于印发抗氧化功能评价方法等9 个保健功能评价方法的通知》中抗氧化功能评价方法[15],将70 只KM小鼠适应环境后,随机分为7 组,每组10 只,设定为空白对照组、模型对照组、阳性对照组、鲍内脏多糖低剂量组、中剂量组和高剂量组。各剂量组给药剂量参照《抗氧化功能评价方法》[15]、Finkel[16]和罗晓航[17]等动物实验剂量设定方法,略作调整。中剂量组给药剂量设定为人体临床用量的10 倍(小鼠),高剂量组给药剂量设定为人体临床用量20 倍,低剂量组给药剂量设定为人体临床用量的5 倍。其中,阳性对照组抗坏血酸为人体摄入量的5 倍,即10 mg/kg剂量VC溶液每天灌胃0.5 mL,鲍内脏多糖低、中、高剂量组分别以200、400、800 mg/kg剂量每天灌胃0.5 mL,空白对照组和模型对照组每天灌胃等体积的0.5 mL生理盐水。
1.3.2 乙醇氧化损伤模型动物实验设计
参照《抗氧化功能评价方法》中乙醇氧化损伤模型造模方法[15],实验期间小鼠自由摄食和饮水,每天上午8:00进行灌胃。小鼠连续灌胃30 d后,除空白组外,其他各组小鼠禁食16 h后一次性给予体积分数50%乙醇溶液12 mL/kg剂量灌胃处理,6 h后将小鼠处死解剖,取出肝脏,在冰冷的生理盐水中漂洗,除去血液,滤纸吸干表面水分后用生理盐水低温匀浆,制备匀浆液,2 000 r/min离心10 min,留上清液,待测。
1.3.3 体内抗氧化活性指标测定
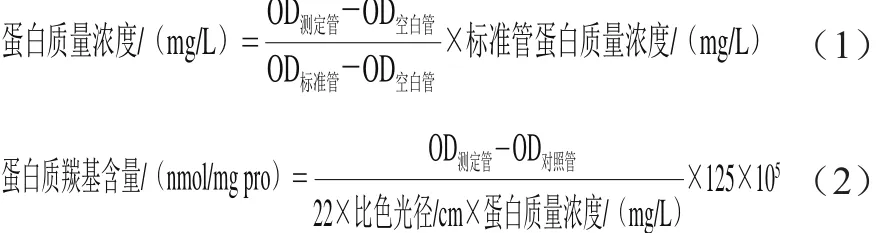
SOD活力采用黄嘌呤氧化酶法测定。MDA含量测定采用硫代巴比妥酸法测定。GSH含量采用硫代二硝基苯甲酸显色分光光度法测定。其中样本蛋白质量浓度采用考马斯亮蓝显色分光光度法测定,根据式(1)计算;蛋白质羰基含量采用分光光度法测定,根据式(2)计算。以上4 项指标检测操作均严格按照试剂盒说明书进行。
1.3.4 增强免疫力动物实验分组及给药实验设计
实验选择正常动物模型,将60 只BALB/C小鼠适应环境后,随机分为6 组,每组10 只,设定为空白对照组、阳性对照组、鲍内脏多糖低剂量组、中剂量组和高剂量组。其中空白对照组每天灌胃0.5 mL生理盐水,阳性对照组以25 mg/kg剂量盐酸左旋咪唑每天灌胃0.5 mL,鲍内脏多糖低、中、高剂量组分别每天以200、400、800 mg/kg剂量灌胃0.5 mL。实验期间小鼠自由摄食和饮水,每天上午8:00进行灌胃,连续灌胃30 d后称质量,各组小鼠根据检测指标方法进行相应处理取样,各动物模型实验设计参照1.3.1节所述。
1.3.5 增强免疫力功能指标测定
免疫力活性功能评价采用免疫器官指数、细胞免疫、体液免疫和非特异性免疫中单核-巨噬细胞功能进行综合评价。其中体质量和免疫器官指数采用称质量法测定;迟发型变态反应(delayed type hypersensitivity,DTH)测定采用足跖增厚法;血清溶血素抗体水平测定采用血凝法;小鼠碳廓清实验采用校正吞噬指数法,各项检测方法参照《增强免疫力功能评价方法》[18]要求进行。
1.4 数据分析
实验数据均以 ±s表示,使用SPSS 17.0软件的单因素方差分析(One-way ANOVA)中的邓肯氏多重比较分析差异显著性。
2 结果与分析
2.1 鲍内脏多糖对小鼠体质量的影响
按照1.3.1节方法,灌胃30 d前后,分别对各实验组小鼠进行体质量测量,实验数据如表1所示。
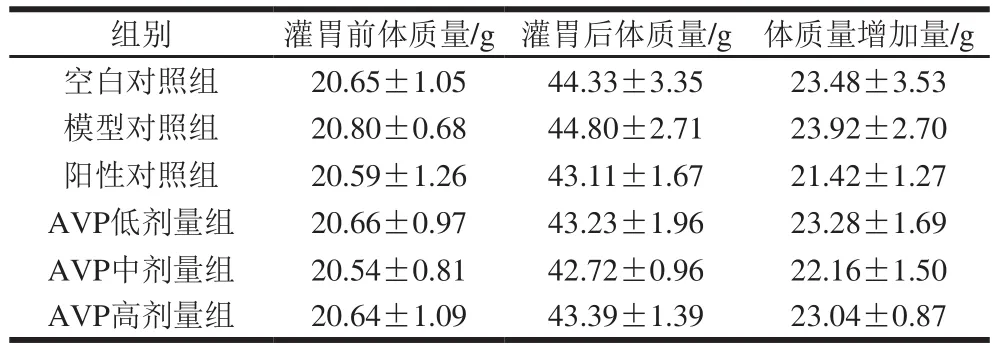
表1 鲍内脏多糖对小鼠体质量的影响(n=10)Table 1 Effect of AVP on body weight of mice (n= 10)
由表1可知,各实验组小鼠灌胃前体质量无显著差异(P>0.05),表明实验用小鼠体质量个体差异不显著,实验具有统计学意义。连续灌胃30 d后,各组小鼠之间的体质量均无显著差异(P>0.05),各组小鼠灌胃前后体质量的增加量也无显著差异(P>0.05)。表明鲍内脏多糖对小鼠体质量无显著影响,对小鼠毒副作用较小。
2.2 鲍内脏多糖对乙醇氧化损伤模型小鼠肝脏中SOD活力和GSH、MDA、蛋白质羰基含量的影响
基于不同原理的各种抗氧化活性检测和评价方法,能从不同机理反映抗氧化活性物质的多种功能特性[19]。但由于抗氧化反应的多样性和复杂性,加之各种方法自身局限性,尚未形成一种标准方法[20]。本实验在课题组已有的鲍内脏多糖体外抗氧化实验的基础上[7],选择SOD活力和GSH、MDA、蛋白质羰基含量作为体内抗氧化活性综合评价指标。乙醇氧化损伤模型动物实验各组小鼠肝脏中SOD活力和GSH、MDA、蛋白质羰基含量变化如表2所示。

表2 鲍内脏多糖对小鼠肝脏中SOD活力和GSH、MDA、蛋白质羰基含量的影响(n= 10)Table 2 Effect of AVP on SOD activity, GSH, MDA and protein carbonyl content in liver of mice (n= 10)
SOD是一种源于生命体的活性物质,是生物体内重要的抗氧化酶,可以保护细胞免受自由基攻击[21-22]。而GSH在生物体内作为一种还原剂能消除机体内的过氧化氢及脂质过氧化物,可以防止细胞膜与其他生物组织免受过氧化损伤[23-24]。MDA是脂质过氧化的主要产物,能引起蛋白质、核酸等生命大分子的交联聚合,具有细胞毒性,其含量与细胞氧化损伤的程度呈正相关[25]。机体内蛋白质羰基作为蛋白质氧化的产物,是体内蛋白质遭到自由基攻击的重要标志,其含量间接反映了机体内蛋白质抵抗自由基攻击的能力[26-27]。
由表2可知,模型对照组小鼠肝脏内SOD活力、GSH含量极显著低于空白对照组(P<0.01),而MDA和蛋白质羰基含量极显著均高于空白对照组(P<0.01),表明乙醇氧化损伤动物造模实验设计成功。
乙醇氧化损伤模型小鼠经鲍内脏多糖中、高剂量灌胃处理后,小鼠肝脏中SOD活力均极显著高于模型对照组(P<0.01)、GSH含量均显著高于模型对照组(P<0.05)。同时,数据表明鲍内脏多糖各处理组中小鼠肝脏SOD活力、GSH含量与灌胃剂量呈现正相关性。鲍内脏多糖中剂量组小鼠肝脏SOD活力比乙醇氧化损伤模型对照组小鼠肝脏中SOD活力提高了20.6%,而GSH含量提高了1.02 倍。表明鲍内脏多糖能增强小鼠体内SOD活力和提高GSH含量,减轻超氧阴离子自由基损伤,帮助氧化损伤机体GSH含量恢复正常水平,提高机体的抗氧化能力。
经鲍内脏多糖、中、高剂量灌胃处理后,小鼠肝脏中MDA含量均极显著低于模型对照组(P<0.01),蛋白质羰基含量均显著低于模型对照组(P<0.05)。同时,数据表明鲍内脏多糖处理组小鼠肝脏中MDA含量、蛋白质羰基含量与灌胃剂量呈现负相关性。鲍内脏多糖中剂量组小鼠肝脏中MDA含量比乙醇氧化损伤模型对照组小鼠肝脏中MDA含量降低了56.2%,而蛋白质羰基含量降低45.4%。表明鲍内脏多糖都具有清除体内氧自由基、拮抗氧自由基对蛋白质的攻击、降低体内脂质过氧化程度和蛋白质的氧化损伤程度的作用。
另外,鲍内脏多糖中剂量组小鼠肝脏中GSH含量、MDA含量和蛋白质羰基含量3 项检测指标与相对应的阳性对照组无显著差异(P>0.05),鲍内脏多糖高剂量组中SOD活力与相对应的阳性对照组无显著差异(P>0.05),这表明鲍内脏多糖具有良好的体内抗氧化活性。
2.3 鲍内脏多糖对小鼠免疫力的影响
免疫功能与健康密切相关,增强机体的免疫功能是疾病治疗和机体康复的重要途径。在增强免疫力功能评价中有多种指标和方法从不同角度反映供试样品体内增强小鼠免疫力的能力。本实验中鲍内脏多糖对增强小鼠免疫力的影响如表3所示。
免疫器官指数包括胸腺或脾脏的相对质量,可反映机体免疫细胞的生长发育、增殖及功能状态。DTH是由致敏性T细胞介导的一种细胞免疫反应,是细胞免疫的体内检测法,其通过测定小鼠的局部肿胀程度(足跖增厚)可以反映DTH的反应强度。血清溶血素水平反映机体形成抗体的能力,揭示小鼠体内B细胞增殖分化产生抗绵羊红细胞(sheep red blood cell,SRBC)抗体(溶血素)的水平,以此来评价机体的体液免疫功能[28]。碳廓清法常被用来检测机体的非特异性免疫功能,反映机体单核-巨噬细胞的吞噬能力。增强机体免疫力功能评价中常采用免疫器官指数、细胞免疫、体液免疫和非特异性免疫作为功能活性物质增强免疫力的一项综合指标[29]。

表3 鲍内脏多糖对小鼠免疫器官指数、DTH、血清溶血素抗体水平和碳廓清能力的影响(n=10)Table 3 Effect of AVP on immune organ indices, DTH, serum hemolysin and carbon clearance in mice (n= 10)
由表3可知,鲍内脏多糖低、中、高各剂量组与空白对照组相比均能够显著提高小鼠脾脏指数和小鼠胸腺指数(P<0.05)。鲍内脏多糖各剂量组小鼠的足跖肿胀程度、溶血素抗体水平均极显著地高于空白对照组(P<0.01),吞噬指数显著高于空白对照组(P<0.05)。其中,鲍内脏多糖中剂量组小鼠脾脏指数和胸腺指数比空白对照组分别提高21.9%和152%;小鼠足跖增厚度比空白对照组提高了40.3%;小鼠血清溶血素抗体水平比空白对照组提高了49.3%;小鼠单核-巨噬细胞碳廓清吞噬指数提高了10%。比较鲍内脏多糖不同剂量组的各项指标发现,除了免疫器官指数和吞噬指数外,其余指标均呈现量效关系,且效果优于阳性对照。研究表明鲍内脏多糖能够提高小鼠免疫器官指数、提高小鼠足跖肿胀程度、提高小鼠血清的抗体水平和提高小鼠的吞噬指数,从免疫器官指数、细胞免疫、体液免疫以及非特异性免疫方面均表现出有良好的增强免疫力活性功能。
3 讨 论
通过乙醇氧化损伤模型实验,鲍内脏多糖可显著提高模型小鼠肝脏SOD活性、显著提高小鼠体内GSH含量、显著降低小鼠体内MDA和蛋白质羰基含量。对辅助清除氧化模型小鼠体内超氧阴离子、保护细胞膜结构和功能完整性、减少细胞损伤和降低体内脂质过氧化和蛋白质氧化损伤方面均有良好作用。
鲍内脏多糖低、中、高剂量组与提高乙醇氧化损伤模型小鼠SOD活性和提高GSH含量呈显著正相关性;与降低小鼠体内MDA和蛋白质羰基含量呈显著负相关性。中剂量鲍内脏多糖处理组小鼠体内抗氧化指标除SOD活力外其他与阳性对照组无显著差异,高剂量组小鼠SOD活力与阳性对照组无显著差异,这与课题组先前开展的鲍内脏多糖体外抗氧化活性研究中鲍内脏多糖对H2O2损伤的LO2细胞中GSH-Px、SOD活力和MDA含量的影响与多糖剂量呈显著正相关性和高剂量处理组两项指标均优于阳性对照组的结果基本一致[7],表明鲍内脏多糖通过促进机体和细胞内抗氧化酶活性,减少有毒过氧化产物实现抗氧化作用,与Zhai Li等[30]在川芎嗪衍生物的作用机理是一致的。根据《抗氧化功能评价方法》中结果判定依据,动物实验中脂质氧化产物、蛋白质氧化产物、抗氧化酶、抗氧化物质4 项指标中3 项阳性,可判定该受试样品抗氧化功能动物实验结果阳性,表明鲍内脏多糖具有一定的抗氧化活性。
在增强小鼠免疫力功能评价中,鲍内脏多糖能够极显著提高小鼠脾脏指数和小鼠胸腺指数、足跖增厚,极显著提高小鼠溶血素抗体水平,显著提高小鼠吞噬指数;在免疫器官指数、细胞免疫、体液免疫以及非特异性免疫方面均表现出有良好的增强免疫力活性功能,并且与多糖灌胃剂量呈现一定的量效关系;参照《增强免疫力功能评价方法(征求意见稿)》中结果判定方法,正常小鼠动物模型中4 项指标为阳性,可判定该受试样品增强小鼠免疫力结果阳性,表明鲍内脏多糖具有增强小鼠免疫力功能。
食品加工技术对生物活性多糖结构和功能特性的影响是十分显著的[31],目前多采用较为温和的生物酶解技术进行活性物质提取。本研究利用酶解技术提取的鲍内脏多糖和刘娜等[5]利用酶解技术提取的鲍性腺多糖分别在乙醇氧化损伤模型小鼠和高脂血症大鼠中表现出良好的体内抗氧化能力结果一致。另外,本研究所用的鲍内脏多糖采用工业化生产工艺流程制备,鲍内脏多糖的成分还相对复杂,与先前分离纯化的单一活性多糖在体外抗氧化活性功能上还具有差异性[7],保健功能因子的分离、纯化及各组分活性验证还需大量数据支持。实验结果为鲍内脏的有效利用提供了理论依据,可以极大地减少优质海洋生物资源的浪费和环境污染,对提高鲍产品提升经济价值、完善产业链起到积极的推动作用。
参考文献:
[1] 王爽, 张高帆, 陈欣悦, 等. 小球藻蛋白的制备及其水解肽的抗氧化研究[J]. 中国食品学报, 2017, 17(2): 92-100. DOI:10.16429/j.1009-7848.2017.02.013
[2] KO S C, KIM D Y, JEON Y J. Protective effect of a novel antioxidative peptide purified from a marine Chlorella ellipsoidea protein against free radical-induced oxidative stress[J]. Food and Chemical Toxicology, 2012, 50: 2294-2302. DOI:10.1016/j.fct.2012.04.022.
[3] 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2016: 33.
[4] 王大海. 海水养殖业发展规模经济及规模效率研究[D]. 青岛: 中国海洋大学, 2014: 6-7.
[5] 刘娜, 朱蓓薇, 孙黎明, 等. 鲍鱼性腺多糖的体内抗氧化活性[J].大连工业大学学报, 2011, 30(3): 177-179. DOI:10.3969/j.issn.1674-1404.2011.03.006.
[6] 项发晖, 叶丹榕, 白伟娟, 等. 鲍鱼性腺中甾醇类化合物的皂化分离工艺优化[J]. 食品工业科技, 2017, 38(1): 193-199.
[7] 王姣, 魏好程, 何传波, 等. 鲍内脏多糖的抗氧化活性[J]. 食品科学,2017, 38(15): 115-121. DOI:10.7506/spkx1002-6630-201715019.
[8] 陈秀琴. 鲍鱼内脏酶解蛋白质制备抗氧化肽的研究[D]. 福州: 福建农林大学, 2013: 35-36.
[9] 苏永昌, 刘淑集, 王茵, 等. 鲍鱼内脏多糖的提取及其抗氧化活性研究[J]. 吉林农业, 2010(10): 170-171.
[10] 何传波, 邵杰, 魏好程, 等. 鲍内脏蛋白肽抗氧化和免疫调节活性[J].食品科学, 2018, 39(5): 206-212. DOI:10.7506/spkx1002-6630-201805031.
[11] 程婷婷, 李冬梅, 刘娜, 等. 一种鲍鱼脏器多糖的鉴定及活性研究[J]. 中国海洋药物, 2008, 27(2): 9-13. DOI:10.3969/j.issn.1002-3461.2008.02.003.
[12] 朱莉莉, 孙黎明, 李冬梅, 等. 鲍鱼内脏蛋白多糖体内对H22肝癌的抑制作用[J]. 营养学报, 2009, 31(5): 478-481; 485. DOI:10.3321/j.issn:0512-7955.2009.05.015.
[13] 王莅莎, 朱蓓薇, 孙黎明, 等. 鲍鱼内脏多糖的体外抗肿瘤和免疫调节活性研究[J]. 大连工业大学学报, 2008, 27(4): 289-293.DOI:10.3969/j.issn.1674-1404.2008.04.001.
[14] 王姣, 魏好程, 何传波, 等. 鲍内脏酶解工艺条件的优化[J]. 食品安全质量检测学报, 2015, 6(8): 3177-3185.
[15] 国家食品药品监督管理总局. 国食药监保化[2012]107号《关于印发抗氧化功能评价方法等9 个保健功能评价方法的通知》[EB/OL]. (2012-04-23) [2017-07-18]. http://www.sda.gov.cn/WS01/CL0847/71257.html.
[16] FINKEL T, HOLBROOK N J. Oxidants, oxidative stress and the biology of ageing[J]. Nature, 2000, 408: 239-247.DOI:10.1038/35041687.
[17] 罗晓航. PEF结合酶法提取鲍鱼脏器粗多糖及其抗氧化活性研究[D]. 福州: 福建农林大学, 2012: 60-61.
[18] 国家食品药品监督管理总局. 食药监保化函[2012]470号关于征求修订《增强免疫力功能评价方法(征求意见稿)》等意见的函[EB/OL]. (2012-11-02) [2017-07-18]. http://www.sda.gov.cn/WS01/CL0782/75859.html.
[19] 刘志东, 郭本恒, 王荫榆. 抗氧化活性检测方法的研究进展[J].天然产物研究与开发, 2008(3): 563-567. DOI:10.3969/j.issn.1001-6880.2008.03.045.
[20] 张文彬, 龚海英, 张丽, 等. 天然产物抗氧化活性体内外评价方法[J].武警后勤学院学报(医学版), 2013, 22(11): 1035-1038.
[21] MURRY C E, JENNINGS R B, REIMER K A. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium[J].Circulation, 1986, 74(5): 1124-1136.
[22] ZHANG Y C, ZHANG Q, LI H, et al. Prognostic factors for late mortality after liver transplantation for benign end-stage liver disease[J]. Chinese Medical Journal, 2011, 124(24): 4229-4235.
[23] 张静丽, 王宏勋, 张雯, 等. 灵芝、枸杞多糖复合抗氧化作用[J]. 食品与机械, 2004, 20(6): 11-12; 46. DOI:10.3969/j.issn.1003-5788.2004.06.005.
[24] VOLPI N, TARUGI P. Influence of chondroitin sulfate charge density,sulfate group position, and molecular mass on Cu2+-mediated oxidation of human low-density lipoproteins: effect of normal human plasmaderived chondroitin sulfate[J]. Journal of Biochemistry, 1999, 125(2):297-304. DOI:10.1093/oxfordjournals.jbchem.a022286.
[25] ABE K, KIMURA H. The possible role of hydrogen sulfide as an endogenous neuromodulator[J]. The Journal of Neuroscience, 1996,16(3): 1066-1071.
[26] SAITO K, JIN D H, OGAWA T, et al. Antioxidative properties of tripeptide libraries prepared by the combinatorial chemistry[J].Journal of Agricultural and Food Chemistry, 2003, 51(12): 3668-3674.DOI:10.1021/jf021191n.
[27] DÁVALOS A, MIGUEL M, BARTOLOMÉ B, et al. Antioxidant activity of peptides derived from egg white proteins by enzymatic hydrolysis[J]. Journal of Food Protection, 2004, 67(9): 1939-1944.DOI:10.4315/0362-028X-67.9.1939.
[28] 李晓梅, 鞠玉琳. 中药“FH”对小鼠血清溶血素和淋巴细胞转化的影响[J]. 延边大学农学学报, 2005, 27(3): 197-200. DOI:10.3969/j.issn.1004-7999.2005.03.009.
[29] FIDLER I J, KLEINERMAN E S. Therapy of cancer metastasis by systemic activation of macrophages: from bench to the clinic[J]. Research in Immunology, 1993, 144: 284-287. DOI:10.1016/0923-2494(93)80109-C.
[30] ZHAI Li, ZHANG Peng, SUN Renyuan, et al. Cytoprotective effects of CSTMP, a novel stilbene derivative, against H2O2-induced oxidative stress inhuman endothelial cell[J]. Pharmacological Reports, 2011,63(6): 1469-1480. DOI:10.1016/S1734-1140(11)70711-3.
[31] 聂少平, 施晓丹. 食品加工技术对生物活性多糖结构和功能特性的影响[J]. 中国食品学报, 2016, 16(11): 9-16. DOI:10.16429/j.1009-7848.2016.11.002.

