微核胞质分裂阻滞细胞(CB-MNT)方法学探讨和比较
毕洁 王如刚
外周淋巴细胞微核胞质分裂阻滞细胞(CB-MNT)是一种微核实验法[1],反映细胞遗传学毒性的最敏感指标,作为职业性放射性作业接触辐射损伤评价非常有意义的指标。微核胞质分裂阻滞细胞法微核实验已在放射,毒理学领域应用[2]。据报道, 采用CB-MNT实验法检测外周血的淋巴细胞自发微核率(MNF)较比常规法敏感,检测染色体断片与落后的准确率更高[3],更快速、简便。对此于2016年 4 月对微核检测的(CB-MNT)方法学做进一步研究探讨,并比较两种方法检测的放射人员的淋巴细胞自发微核率(MNF)。
1 材料与方法
1.1 样本来源 选取参加北京市疾病预防控制中心(CDC)职业健康体检的85名从事放射线作业的在岗人员,且血、尿、肝肾功能正常者。其中男52名,女43名,18~55岁,平均年龄(37.30±9.25)岁,平均放射工龄为(9.22±10.57)年。分别采用常规培养法(C-MNT)和微核胞质分裂阻滞的2种培养方法检测微核淋巴细胞。
1.2方法
1.2.1仪器: LRH恒温培养箱,净化工作台、冷冻离心机、显微镜系统
1.2.2试剂: 微核培养基(RPMI1640培养基)、甲醇、冰醋酸、KCl低渗液、细胞松弛素B、二甲基亚GIemsa染液、二甲基亚砜(DMSO)。
1.2.3Cyt-B配制: 将Cyt-B用二甲基亚砜(DMSO)配成2 mg/mL的储存液,-20 ℃保存,用时融化后,生理盐水稀释(10∶1),加入培养基中。
1.2.4细胞培养: 取800 μL静脉血接种于4 mL RPMI1640中混匀,置于(37±0.5)℃隔水式恒温培养箱,常规法组直接培养72 h收获;CB法组在细胞培养至40 h在净化工作台中加入Cyt-B松胞素,继续培养至68~72 h收获。
1.2.5制片与染色: 收获细胞后,以1 500 r/min离心5 min,弃掉培养上清;加入37 ℃预温的0.075 mol/L KCl 5 mL,充分混匀后,立即加入1 mL新鲜配制的甲醇:冰醋酸(3∶1)混匀,低渗预固定,1 500 r/min离心5 min,弃上清液;加5 mL固定液固定20 min,经1 500 r离心,固定20 min,可重复一次后,离心弃上清液,留沉渣悬液0.5 mL垂直滴片,干燥后进行Giemsa染色。制备成完整的淋巴细胞微核片。
1.3镜检指标 (1)常规法观察转化的单核淋巴细胞[4];(2)CB法观察转化双核淋巴细胞:此时胞体较大,细胞浆丰富清晰,双核是经第一次有丝分裂所致,形成位于同一个细胞内两个独立且核膜完整的细胞核[5],两核之间有很细的物质相连,不宽于主核直径的1/4,两个核的大小接近,染色深浅相同;(3)微核的判断标准:微核位于已经转化的完整细胞胞浆中,呈圆形或椭圆形,,游离于胞质中,或与主核相切,直径小于主核的1/16~1/3,染色深浅与主核相同或略浅,无折光性;(4)观察细胞:高倍镜40 x计数CB法计数500个双核淋巴细胞;常规法计数1 000个转化的淋巴细胞,以千分率表示。
1.4统计学方法 资料数据采用SPSS 19.0 软件分析,数据用计算每组平均值和标准差(x±s)表示,采用配对样本t检验,显著性界值P<0.05。
2 结果
2.1常规法和CB法制片细胞形态比较 常规法的淋巴细胞易破裂,细胞之间界限不清,易堆积;CB法的双核细胞胞膜完整,边界清晰,分散均匀,胞质丰富,双核微核淋巴细胞胞体膨大,均被染成紫红色,微核染色略浅,易于辨认,图2 中A图双核细胞中可见2个微核,B、C、D图中可见 1个微核(图1和2)。
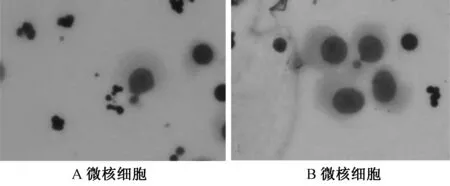
图1 常规法制片:单核淋巴细胞微核
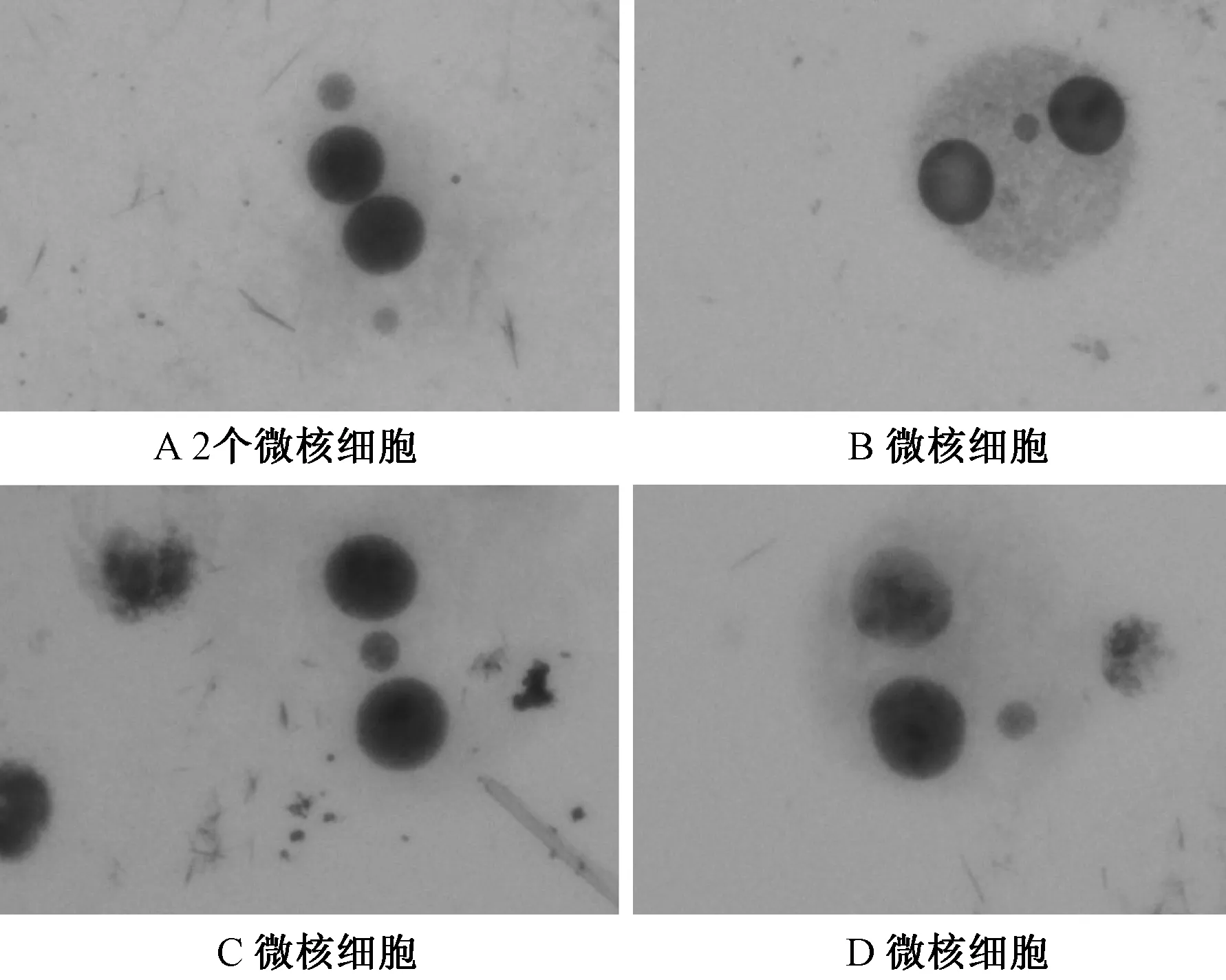
注:外周血淋巴细胞微核(Giemsa染色,×40)图2 CB法制片:双核淋巴细胞微核
2.2CB-MNT组 与C-MNT组 培养外周淋巴细胞微核比较两组的微核自发率 MNF具有明显差异(t=-6.17P<0.01,表1)。
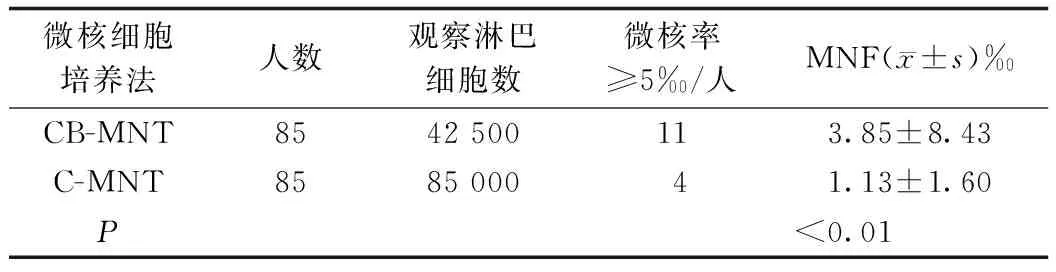
表1 CB-MNT 与C-MNT放射人员微核细胞自发率比较
注:MNF 微核细胞自发率(‰), CB-MNT法=微核数/500个CB双核细胞,C-MNT法=微核数/1 000个单核淋巴细胞。
3 讨论
3.1微核制片直接影响微核分析结果,与微核实验制片质量有关,如何去除红细胞而又保证淋巴细胞膜的完整性是制片关键。实验室的低渗温度选择25~30 ℃,加入低渗液混匀即刻加入固定液,无需放置一段时间,这样可破坏大多数红细胞。采用(3∶1)固定液预固定使淋巴细胞得到适当膨胀并稳定,克服了常规法低渗程度不稳定,细胞有易破碎、形态不完整和成堆倾向。低渗操作时混匀要轻柔,避免把膨胀的淋巴细胞弄碎。各步离心后,应留存0.5 mL上清,先混匀,再加入各种液体,避免混匀时间过长。
3.2获得较多数量的双核细胞用于分析,是CB-MN法的关键。实验室培养40 h,加入Cyt-B浓度为6 g/mL,68 h收获。获得了多量(45.0%~64.0%) 双核细胞,此时获得双核细胞比例最高,和SURASERANIVONGSE等[6]研究结果一致。研究推荐诱发双核细胞的Cyt-B最适浓度为6 g/mL[7],适宜的浓度可以抑制细胞运动和胞质分裂,刺激胞核分裂,影响双核细胞的产量。过高或过低可引起双核细胞减少或核膜破裂,致无法识别双核细胞。且研究显示Cyt-B本身是一种霉菌Hdd的代谢产物,溶于二甲基亚砜(DMSO)中,低温保存(-40~-70 ℃)。Cyt-B在细胞的有丝分裂中可阻止胞质分裂而不影响核分裂,它不是诱变剂,并不会诱发微核和染色体畸变[8],微核主要来源于细胞分裂后期滞后的染色体断片。实验证实使用Cyt-B是安全的[9],对外周微核自发率无明显影响。
3.3加入Cyt-B必须准确,应用度量精确的微量加样器。Cyt-B的配制、储存与实验过程中要注意避光,否则容易效价下降,影响双核细胞的数量和完整性。微核胞质分裂阻滞细胞(CB-MNT)方法是检测微核染色体断裂或总体染色体丢失的生物学标志物的方法[10]。 目前外周淋巴细胞微核测定法多采用常规法和CB法,通过表1常规法和CB法比较显示,CB法的微核自发率明显高于常规法,这与相关报道一致[11]。
3.4因绝大多数淋巴细胞完成第1次有丝分裂需要48 h,此时细胞处于有丝分裂高潮。但常规法是72 h培养,大部分细胞已完成2次或以上有丝分裂,此时有丝分裂次数多,微核已经丢失;而CB法在培养40~44 h之间加入试剂松弛素B阻滞胞质分裂,松胞素使大部分淋巴细胞停留在第1次有丝分裂阶段,微核不易丢失;常规法因只能判断淋巴细胞是否转化,不能识别第1次有丝分裂细胞而欠准确,而胞质分裂阻断法克服了这一不足,获得大量双核CB细胞,较常规法对毒性物质更灵敏,大大提高了微核分析结果准确率。
通过研究,可见CB法观察细胞仅为常规法的50%,每个标本只需计数500个双核淋巴细胞,且双核淋巴细胞胞体膨大,比转化的单淋巴细胞容易识别,这样节约阅片时间,提高工作效率。实验表明微核胞质分裂阻滞细胞CB-MNT法操作简便,易于观察,效率更高,具有良好的可靠性和重复性,其敏感性及准确性均优于常规法。CB-MNT已成为一项标准细则细胞遗传学检测实验方法,作为接触放射作业人员的必检项目[12],在职业辐射有害环境对人体遗传毒性效应的评价中,建议实验室可作为优先选择的实验方法。
参考文献
[1] FENECH M. The cytokinesis-block microuncleus technique. A detailed description of the method and its application to genotoxicity studies in human populations[J]. Mutation Research,1993,285(1):35.
[2] MIGLIORE L,NIERI M,AMODIO S,et al. The Human Lymphocyte micronucleus assay:a comparison between whole-blood and separated-lymphocyte cultures[J].Mutat Res,1989,227(3):167-172.
[3] 顾祖慰维,CHANNA R.细胞松弛素B 在微核试验中的应用[J].卫生毒理学杂志,1993,7(2):105-106.
[4] 白玉书,陈德清.人类辐射细胞遗传学[M].北京:人民卫生出版社,2006:103.
[5] 刘毓谷. 卫生毒理学基础[M].北京:人民卫生出版社,1997: 53-81.
[6] SURASERANIVONGSE S,CHOWVANAYOTIN S,PIRAYAVARAPORN S, et al.Comparison of effectiveness between gas flow 1 and 21,min(-1) for general anesthesia in infants and children[J].J Med Assoc Thai,2004,87(11):1343-1348.
[7] JOKSIC G,PETROVIC S,ILIC Z. Age-related changes in radiation-induced micronuclei among healthy adults [J].Braz J Med BiolRes,2004,37 (8): 1111-1117.
[8] 邢燕. 南京市放射工作人员外周血淋巴细胞染色体畸变和微核率分析[J].中国辐射卫生,2010,19(2):176-178.
[9] 马亚萍,原福胜,杨建军,等.体外双核淋巴细胞微核试验方法的改进[J].山西医科大学学报,2000,31(4):378.
[10] 曹家,林真,余争平.微核试验:原理、方法及其在人群监测和毒性评价中的应用[M].北京:军事医学科学出版社,2000:1-2.
[11] 唐钧,朱瑞娟,周元陵,等.双核细胞与常规微核法在人群监护中的对比[J].工业卫生与职业病杂志,2000,26(4):202-203.
[12] FENECH M, CHANG W P, KIRSCH-VOLDERS M,et al. HUMN project: detailed description Of the scoring for the cytokinesis-block micronucleus assay using isolated human lymphocyte cultures[J].Mutat Res,2003,534(1-2):65-75.

