硫丹对鱼类的毒性效应研究进展
陆光华,覃冬荭,宗永臣
(1. 河海大学环境学院,江苏 南京 210098;2. 西藏农牧学院水利土木工程学院,西藏 林芝 860000)
硫丹(endosulfan)是一种合成有机氯杀虫剂,自20世纪50年代开始使用,主要用于控制各种作物(棉花、水稻、高粱、大豆、烟草、茶叶、咖啡等)害虫。硫丹的化学名称为1,2,3,4,7,7-六氯双环[2.2.1]庚-2-烯-5,6-双羟甲基亚硫酸酯,包括α-硫丹和β-硫丹2 种异构体,其结构及主要理化性质见表1。技术硫丹(CAS:115-29-7)为α-硫丹和β-硫丹的混合物,二者的比例约为7∶3。硫丹的长期生产和使用导致硫丹在环境中无处不在。农业灌溉和降雨导致的土壤径流和渗透是硫丹进入水环境的主要途径,在稻田附近的水体中硫丹质量浓度高达13.5 μg/L,而在山区河流的硫丹质量浓度也达到0.7 μg/L[1]。因具有较强亲脂性,进入水环境的硫丹可以累积在水生生物体内,在鱼组织中的硫丹残留水平可达到10~400 ng/g[2],生物富集因子在2 400~11 000[3]。
硫丹具有环境持久性、生物蓄积性和远距离环境迁移能力,其对生态系统的风险和对人类健康的影响日益引起关注。2011年硫丹及其相关异构体被斯德哥尔摩公约列入持久性有机污染物(persistent organic pollutants, POPs)附件A(消除类)。我国自2014年3月26日起,除特定豁免用于防治棉花棉铃虫、烟草烟青虫的生产和使用外,禁止硫丹的生产、流通、使用和进出口。根据《中华人民共和国食品安全法》《农药管理条例》有关规定以及《关于持久性有机污染物的斯德哥尔摩公约》的履约要求,农业部拟自2018年7月1日起,撤销所有硫丹产品的农药登记证;自2019年3月27日起,禁止所有硫丹产品在农业上使用。目前世界上已经有60多个国家禁止使用硫丹。
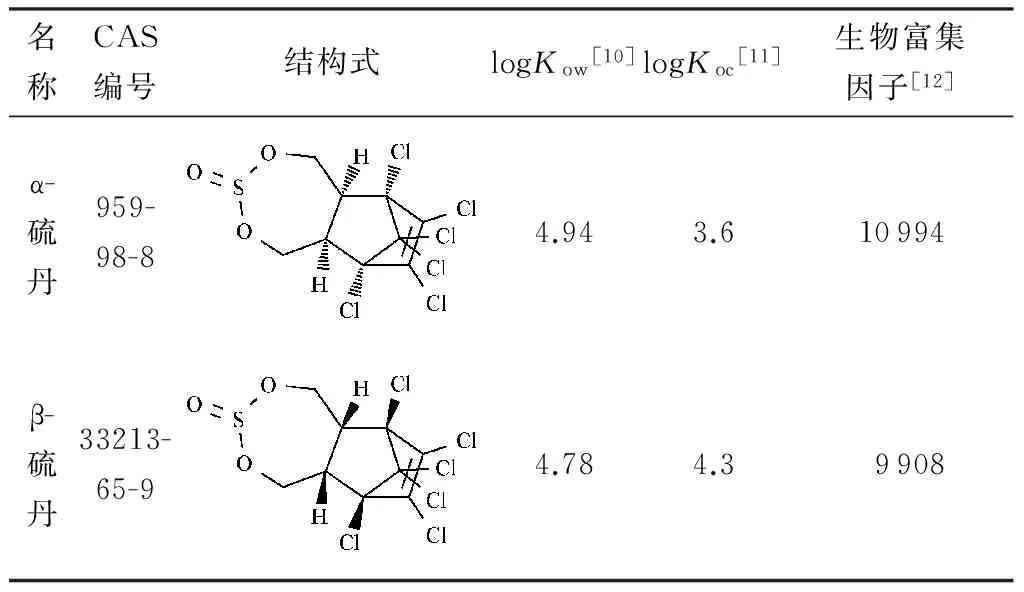
表1 2种硫丹异构体的结构式及理化性质
注:Kow为辛醇-水分配系数;Koc为标化分配系数。
很多研究表明,硫丹对水生生物、陆生生物和人类具有高毒性[4-6]。作为一种持久性有机污染物,即使天然水体中硫丹的残留浓度不高,但是长期暴露可能产生生物累积和放大效应[7],不仅影响鱼类正常的生长繁殖,也给食品安全带来潜在威胁[8]。日本规定水产品中硫丹最大残留量为4 μg/kg,而我国尚无相关限量标准[9]。
1 硫丹对鱼类的急性致死毒性
随着硫丹在全世界范围的地表水中频繁检出,其对非靶生物的毒性效应引起了广泛关注。硫丹通常对鱼类的毒性大于对水生无脊椎动物的毒性[13],它可以影响鱼类中枢神经、免疫和生殖系统,并可能导致鱼类行为异常,严重情况下可导致鱼类死亡[14]。鱼类致死毒性通常以96 h半致死浓度(ρLC50)为测试终点,表2总结了硫丹对不同鱼类的96 hρLC50数据。大多数研究针对技术硫丹进行毒性测试,受试鱼类个体通常较小,而且多数为幼鱼。从表2可见,硫丹对鱼类的急性毒性变化很大,96 hρLC50的范围为0.1~70 μg/L。毒性数据变化的主要原因是不同鱼种对硫丹的敏感性(或耐受性)不同,而鱼的个体大小、不同发育阶段、性别也对毒性测试结果有影响。一般认为,生命早期阶段的鱼比青年或成年的鱼更敏感[15],而性别差异的主要原因是由于雌鱼脂质含量高于雄鱼[16]。鱼体脂含量高有利于保护机体免受亲脂性化学品的毒性影响,因为能够达到靶器官的化学品相对更少,因此,雌鱼对亲脂性毒物的耐受性更强[16-17]。此外,对同一测试鱼种,不同的暴露方式(流动/静态/半静态)也影响毒性结果。如,Sunderam等[18]发现硫丹对彩虹鱼(Pseudomugilfurcatus)的96hρLC50值在流动暴露条件下为0.5 μg/L,而在静态条件下为11.4 μg/L。硫丹在流动暴露条件下对翠鳢(Channapunctatus)的96hρLC50值为7.75 μg/L[19],而在静态条件下为5.58 μg/L[20],由于这两个数据来自不同实验室,因此,可能存在其他方面的影响因素。此外,研究还发现,水温和碱度对硫丹暴露下虹鳟鱼的存活率有显著影响[4]。
根据我国GB/T 31270—2014《化学农药环境安全评价试验准则》的毒性划分标准,当农药对鱼类的96 hρLC50值小于0.1 mg/L时,说明该农药对鱼类有剧毒。从表2可见,硫丹对所有受试鱼类的毒性都属于剧毒。
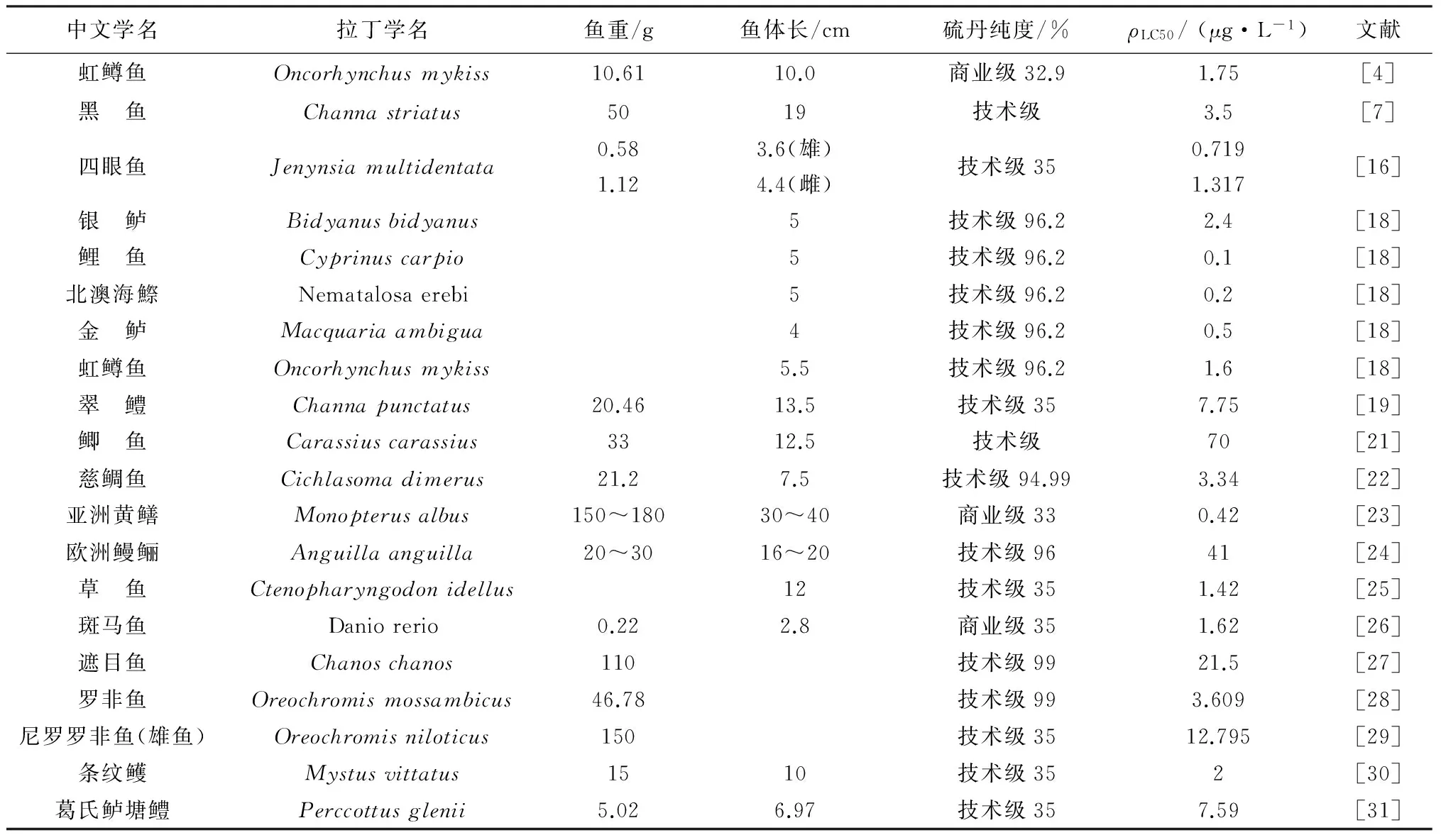
表2 硫丹对不同鱼类的96 h半致死浓度(ρLC50)数据
2 硫丹对鱼类的细胞毒性和组织病理学
细胞凋亡是维持健康细胞群体的重要细胞机制,也是胚胎发育和免疫系统活动的重要组成部分。逃避凋亡的受损细胞一般都会衰老,很多环境污染物都会诱发水生生物细胞衰老。硫丹对鱼类的细胞毒性依赖于细胞类型、暴露浓度、暴露方式(活体/离体)和暴露时间。
肝脏是鱼类重要的代谢和解毒器官,因此常用于环境污染物的细胞毒性测试。通过含1 μg/g和0.5 μg/g的硫丹喂食暴露21d,硫丹诱导了尼罗罗非鱼肝细胞破坏、血管内皮细胞破裂,并增加了黑色素吞噬细胞的聚集;而低至0.1 μg/g和0.001 μg/g的剂量暴露35d,增加了肝细胞空泡化和嗜酸性粒细胞聚集[35]。头肾是硫丹代谢过程中重要的鱼类免疫器官。将鲶鱼(Clariasgariepinus)暴露于2.884 μg/L的硫丹30d,随后在不含硫丹的水中恢复30d,发现头肾体细胞指数降低,并导致白细胞死亡[36]。此外,硫丹活体暴露可降低鱼类红细胞数量和血红蛋白浓度,使鱼处在贫血状态,同时,出现红细胞肿胀,影响其携氧能力[22-23]。
鱼类在细胞水平上的毒性响应往往伴随着组织水平上的病理学损伤,包括鳃上皮细胞增生和鳃损伤、肝水肿变性和局灶性坏死、睾丸损伤等。这些重要器官中度的病理反应在鱼类繁殖期和长时间暴露期可能变得至关重要[22]。4 μg/L的硫丹喂食暴露35 d导致大西洋鲑鱼(Salmosalar)肝脏和肠道的组织学改变,后肠病理学特征是绒毛的空泡化和融合,而在最严重的情况下,绒毛尖端上皮完整性丧失;对肝脏的主要影响是糖原消耗和脂质沉积[37]。这些变化属于典型的普遍应激反应。此外,0.16 μg/L或0.48 μg/L的硫丹对成年斑马鱼肝组织损伤表现为肝细胞肝肥大、坏死和完整性改变[38]。0.76 μg/L的硫丹暴露下四眼鱼肝脏中出现了可逆的组织学改变(如水肿变性和窦状膨胀),而在1.26 μg/L和2.1 μg/L浓度下肝脏产生了不可逆转的变化,如肝脏坏死[16]。
鳃与水环境直接接触,因此对污染物非常敏感。研究发现,18.5 μg/L的硫丹暴露96 h引起遮目鱼(Chanoschanos)鳃上继发性片段的卷曲、原发性上皮的增厚、上皮增生、次级层融合等;较高浓度(21.5 μg/L)下肝细胞出现严重坏死[27]。可见,鱼肝脏、肠、鳃等都是硫丹毒性作用的靶器官,而且组织病理学损伤程度存在明显的浓度依赖性。
3 硫丹对鱼类生理生化指标的影响
亚致死浓度的硫丹除了在个体、组织和细胞水平上对鱼类产生毒性效应以外,在分子水平上也会产生不利影响,包括代谢转化、抗氧化防御、激素调节、神经传递等生物过程的胁迫响应。表3总结了硫丹对不同鱼类生理生化指标的影响。
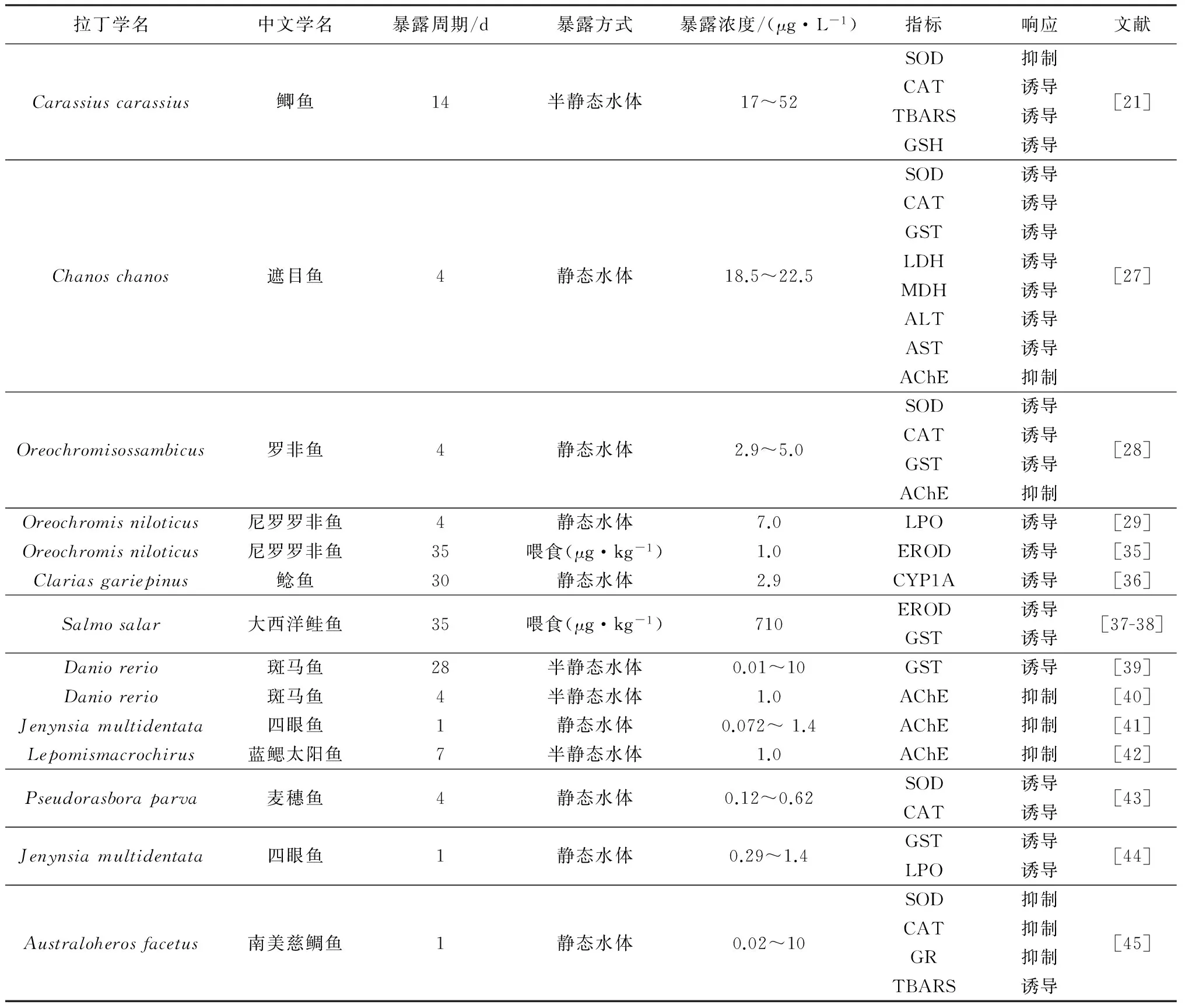
表3 硫丹暴露下鱼类生理生化指标的响应
有研究表明,硫丹对鲫鱼、南美慈鲷鱼、四眼鱼、遮目鱼、罗非鱼等抗氧化防御系统都产生了干扰效应。抗氧化防御系统常用的生物标志物包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)活性和还原型谷胱甘肽(GSH)、硫代巴比妥酸反应物质(TBARS)、脂质过氧化(LPO)含量等。SOD和CAT是敏感的抗氧化酶,不同鱼类对硫丹暴露的胁迫响应不一致,多数为诱导效应,也有抑制效应,表现出不同的响应机制。硫丹通过释放氧自由基诱导组织的氧化损伤[46],SOD和CAT的活性升高有助于清除氧自由基,保护鱼体组织免受氧化损伤。但是,强氧化剂能够克服生物的抗氧化防御系统,产生过量的H2O2损伤酶的活性位点,从而抑制SOD的催化活性[47-48]。从表3可见,硫丹增加了不同鱼类的TBARS和LPO水平,这是由于生成的活性氧(ROS)攻击细胞膜产生了抗氧化酶损伤,继而对细胞完整性和细胞功能产生影响。
细胞色素P450 1A(CYP1A)表达及其相关乙氧异吩恶唑酮—O—脱乙基酶(EROD)活性通常用来反映有机污染物Ⅰ相生物转化途径,谷胱甘肽—S—转移酶(GST)活性反映Ⅱ相生物转化和解毒途径。表3的结果显示,通过不同方式暴露的硫丹诱导了不同鱼类的CYP1A表达及EROD和GST活性。来自不同实验室的研究得到了一致的结果,表明进入鱼体内的硫丹可以进行代谢转化和解毒。不同浓度的硫丹暴露增加了遮目鱼肝、鳃和脑的乳酸脱氢酶(LDH)和苹果酸脱氢酶(MDH)的活性,表明鱼体为维持自身能量需求应激诱导了无氧代谢[27]。天冬氨酸转氨酶(ALT)和丙氨酸氨基转氨酶(AST)是相关的应激指标,通常用于诊断鱼类疾病和检测由环境污染引起的组织损伤,ALT和AST活性增加表明通过鱼糖异生反应促进天冬氨酸和丙氨酸产转化成葡萄糖以承受污染物的胁迫作用[49]。此外,研究发现雄性和雌性斑马鱼之间存在基于性别的硫丹解毒差异[39]。
乙酰胆碱酯酶(AChE)是生物神经传导中的一种关键酶,对鱼类正常行为和肌肉功能至关重要。水体暴露的硫丹显著降低了不同鱼类AChE的活性,最大抑制率达到79%[26]。AChE的抑制率达到40%就会导致鱼的行为异常,包括游泳活力降低、探索能力下降,影响逃避和捕食行为,并且可能破坏它们的生态和种间相互作用[40-42,50]。
现有研究表明,μg/L级的硫丹通过急性、亚急性或者亚慢性暴露,都对鱼类正常的生理功能产生了干扰效应。通过实验室暴露研究,筛选出敏感的鱼类分子生物学指标,对自然水体中硫丹的生态风险评估具有重要意义。
4 硫丹对鱼类的遗传、繁殖和发育毒性
体内和体外实验都已证明硫丹具有致突变和致畸效应,以前的研究主要以哺乳动物为模式生物,对水生生物的研究相对较少。DNA损伤、微核形成和染色体畸变在评估农药诱导的鱼类遗传毒性方面发挥了重要作用。
不同质量浓度(1.25、2.50、3.75、5.00、6.25 μg/L)硫丹暴露4 d导致葛氏鲈塘鳢外周血红细胞核异常率升高,并呈现较明显的剂量—效应关系,表明硫丹对葛氏鲈塘鳢具有潜在的遗传毒性[51]。Pandey等[19]采用彗星试验方法研究了硫丹对淡水硬骨鱼翠鳢的遗传毒性,4.0 μg/L的硫丹暴露4 d后,在鱼鳃和肾组织细胞观察到了明显的DNA损伤,而且鳃细胞对硫丹暴露比肾细胞更敏感。
即使在环境相关浓度暴露下,硫丹对一些敏感鱼类也会产生遗传毒性。硫丹在0.5 μg/L 或者1.0 μg/L质量浓度下暴露4 d对金头鲷(SparusaurataL.)产生了明显的染色体损伤[52]。0.02 μg/L的硫丹暴露24 h增加了南美慈鲷红细胞的核异常率,5 μg/L增加了微核形成率[49]。鱼的微核形成率、核异常率和染色体畸变率的增加常伴随着氧化胁迫效应的增强和抗氧化酶的干扰,因此,Dar等[21]推测硫丹的遗传毒性机制可能为氧化应激路径。
考虑到很多地表水环境中硫丹的赋存浓度高达μg/L级,长期暴露可能会通过影响个体生长发育、流动性、觅食成功率、繁殖能力,进而对鱼类种群健康产生严重影响。
0.5 μg/L和1 μg/L的硫丹暴露30 d,显著干扰了雄性华生小鲤(Cyprinionwatsoni)的睾酮水平,并对生殖健康产生了负面影响[53]。将日本青鳉(Oryziaslatipes)的受精卵暴露于0.01 μg/L、0.10 μg/L和1 μg/L的硫丹24 h,导致孵化时间更长,而且孵出的鱼苗个体较小,活动性降低;当这些鱼达到性成熟时,产卵量减少,孵化时间延长[54]。可见,短期暴露于环境相关浓度的杀虫剂可能会对鱼类的发育和繁殖产生长期影响。然而,Beyger等[55]将孵化78 d后的旗鱼(Jordanellafloridae)脉冲暴露于硫丹4 h,监测鱼的生长和繁殖,结果表明,浓度高达10.8 μg/L的硫丹都没有显著影响旗鱼的生长和繁殖能力。这一结果可能与暴露方式有关,该研究采用高浓度硫丹急性脉冲暴露4 h,然后将鱼转入清水,吸收进入鱼体中的硫丹可能逐渐被代谢、清除,从而恢复了正常的生理功能。
将成年斑马鱼暴露于硫丹28 d,发现0.16 μg/L暴露组斑马鱼生产的幼鱼心跳频率明显低于对照组,并出现严重的脊柱前凸、腹水等形态学变化(图1)[38]。可见,在亚致死浓度下,成年斑马鱼即使能够成功繁殖,但是后代发育异常可能影响它们的长期存活。因此,在硫丹的环境风险评估中应考虑其对鱼类的代际危害。
硫丹对生殖系统的影响主要是通过激素作用介导,而不是直接毒性作用[56]。性激素在低等脊椎动物(包括鱼类)的性别分化中起重要作用。因此,由内分泌干扰物引起的性激素水平略有变化,对水生脊椎动物的性腺发育就会产生明显的影响。硫丹通过与雌二醇竞争与雌激素受体(ER)结合,从而诱导雌激素响应[57]。但是硫丹与ER结合的亲和力低,其雌激素活性比雌二醇低105~106倍[58]。活体试验表明,硫丹通过触发雌鱼早熟发育,加快其卵巢生长[59-60]。硫丹还是一种弱的抗雄激素,可以通过调节睾丸相关转录因子和类固醇生成酶的转录表达,使雄鱼睾丸分化或发育受损[56,61]。这些研究证实了硫丹对鱼生殖轴的内分泌干扰作用,而性腺的组织病理学变化、卵黄蛋白原水平变化和两性异形可对鱼类繁殖产生严重影响[62]。
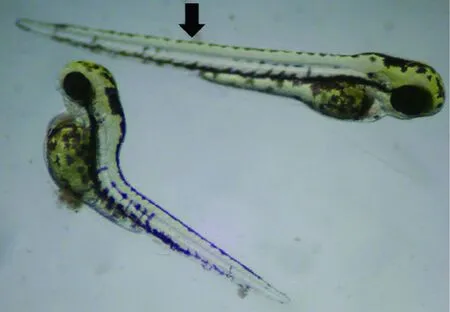
(a) 对照组与0.16 μg/L暴露组
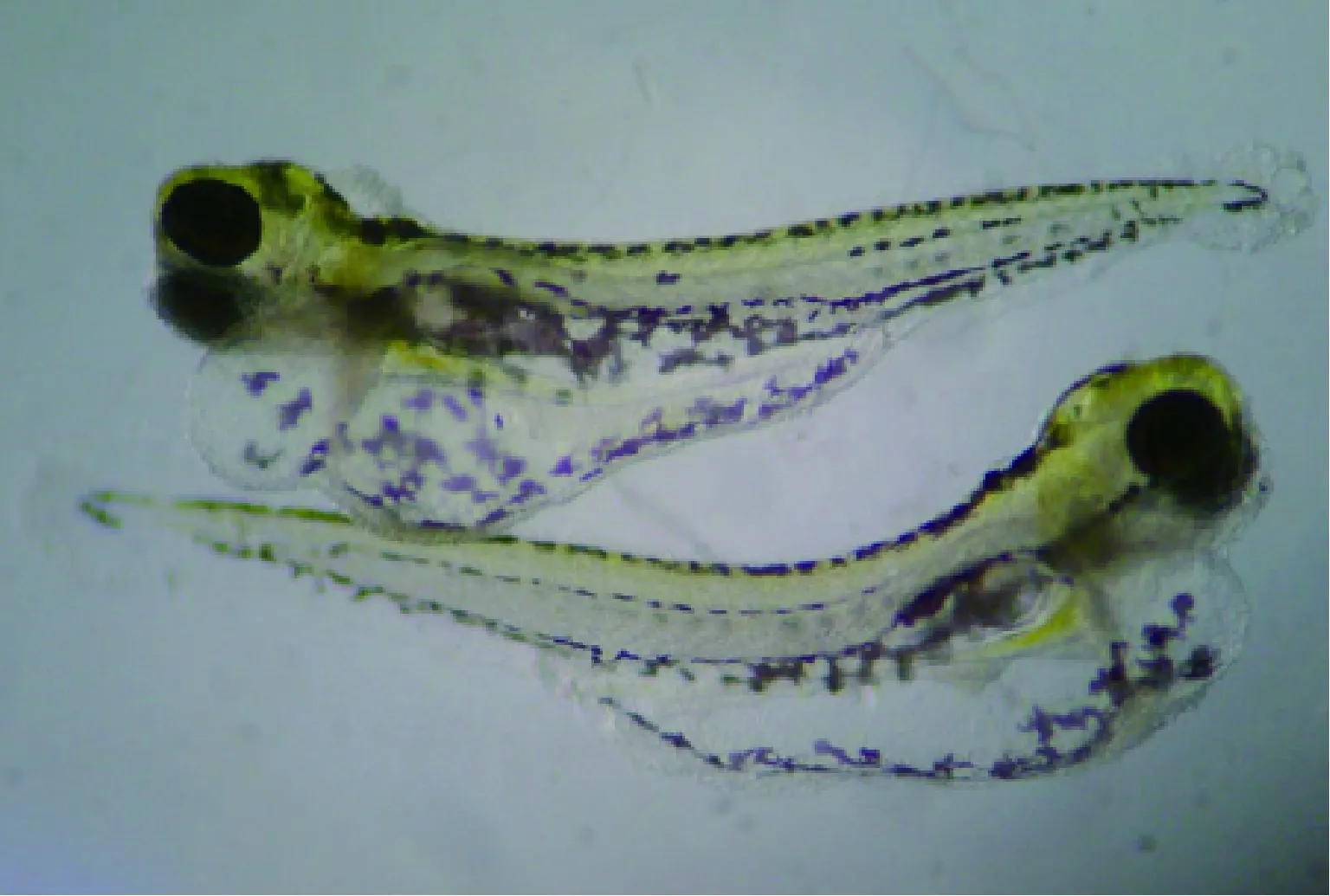
(b) 0.48 μg/L暴露组
注:(a)图箭头指向为对照组,下方为0.16 μg/L暴露组,显示了严重的脊柱前凸;(b) 图为0.48 μg/L暴露组,显示了严重腹水。
图1斑马鱼亲鱼暴露硫丹28d导致仔鱼发育异常[38]
5 结论与展望
硫丹作为新列入POPs清单的有机氯杀虫剂,目前仍有很多国家在生产和使用。硫丹具有长距离迁移能力和环境持久性,今后相当长的时间内都是重要的环境污染物,其在一些地区的环境残留可能继续升高。目前,发达国家对水产品农药残留的限量要求日益严格,这已对我国鱼类产品出口产生了巨大影响,因此,我国亟须完善水产品药物残留限量标准体系,针对硫丹等新POPs制定严格的限量标准,同时在渔业水质标准中增设相应指标。此外,还需要在源头上加强对硫丹使用的管控。
目前,有关硫丹对鱼类的毒理学研究取得了一些进展,尤其在急性毒性方面,积累了丰富的数据。现有研究成果也证实了亚致死浓度下硫丹对鱼类具有细胞毒性、遗传毒性和组织损伤,长期暴露对亲代繁殖能力和子代生长发育产生不利影响。鉴于在真实水环境中硫丹通常与其他杀虫剂共存,因此,研究硫丹与其他污染物共暴露对鱼类的联合毒性,探明是否存在协同效应,将有助于客观评价硫丹污染水体的生态风险。另外,在鱼类毒性作用机制方面,目前提出了细胞和分子机制,包括线粒体功能障碍、诱导氧化应激、应激反应信号转导途径的调节、增加细胞外信号调节激酶等,但是确定硫丹对鱼类的毒性机制需要更多实验证据。硫丹将长期在水环境中残留,因此需要加强鱼类全生命周期暴露、子代传递效应、多代繁殖影响等方面的研究,揭示水环境中硫丹持续暴露对鱼类种群健康的影响。
参考文献:
[1]BACCHETTA C,ROSSI A,ALE A,et al.Combined toxicological effects of pesticides:a fish multi-biomarker approach[J].Ecological Indicators,2014,36:532-538.
[2]BALLESTEROS M L,MIGLIORANZA K S,GONZALEZ M,et al.Multimatrix measurement of persistent organic pollutants in Mar Chiquita,a continental saline shallow lake[J].Science of the Total Environment,2014,490:73-80.
[3]US Environmental Protection Agency.Registration eligibility decision(RED):endosulfan.EPA 738-R-02-013[R].Washington D C:US Environmental Protection Agency,2002.
[4]CAPKIN E,ALTINOK I,KARAHAN S.Water quality and fish size affect toxicity of endosulfan,an organochlorine pesticide,torainbow trout[J].Chemosphere,2006,64(10):1793-1800.
[5]DEMIRCIA Ö,GÜVENB K,ASMAC D,et al.Effects of endosulfan,thiamethoxam,and indoxacarb in combination with atrazine on multi-biomarkers inGammaruskischineffensis[J].Ecotoxicology and Environmental Safety,2018,147:749-758.
[6]BAQAR M,SADEF Y,AHMAD R S,et al.Organochlorine pesticides across the tributaries of river Ravi,Pakistan:human health risk assessment through dermal exposure,ecological risks,source fingerprints and spatio-temporal distribution[J].Science of the Total Environment,2018,618:291-305.
[7]GANESHWADE R M,DAMA L B,DESHMUKH D R,et al.Toxicity of endosulfan on freshwater fishChannastriatus[J].Trends in Fish Research,2012,1:29-31.
[8]陈秀开,张望,李正高.泥鳅中硫丹残留的风险评估[J].检验检疫学刊,2013 (5):64-66.(CHEN Xiukai,ZHANG Wang,LI Zhenggao.Risk assessment of endosulfan residue in loach[J].Journal of Inspection and Quarantine,2013 (5):64-66.(in Chinese))
[9]陈宇.中国与主要国家农药残留限量标准对比分析[J].现代农业科技,2017(2):94-97.(CHEN Yu.Comparative analysis of pesticides maximum residue limits in China and major countries[J].Modern Agricultural Science and Technology,2017(2):94-97.(in Chinese))
[10]SHEN L,WANIA F.Compilation,evaluation,and selection of physical-chemical property data for organochlorine pesticides[J].Journal of Chemical & Engineering Data,2005,50(3):742-768.
[11]ÇETIN B,OZER S,SOFUOGLU A,et al.Determination of Henry’s law constants of organochlorine pesticides in deionized and saline water as a function of temperature[J].Atmospheric Environment,2006,40(24):4538-4546.
[12]JONSSON C M,TOLEDO M C F.Bioaccumulation and elimination of endosulfan in the fish yellow tetra (Hyphessobryconbifasciatus)[J].Bulletin of Environmental Contamination and Toxicology,1993,50(4):572-577.
[13]NAQVI S M,VAISHNAVI C.Bioaccumulative potential and toxicity of endosulfan insecticide to non-target animals[J].Comparative Biochemistry and Physiology Part C:Comparative Pharmacology,1993,105(3):347-361.
[14]STANLEY K A,CURTIS L R,SIMONICH S L M,et al.Endosulfan I and endosulfan sulfate disrupts zebrafish embryonic development[J].Aquatic Toxicology,2009,95(4):355-361.
[15]吕军,汪雪格,刘伟,等.松花江流域主要干支流纵向连通性与鱼类生境[J].水资源保护,2017,33(6):155-160.(LYU Jun, WANG Xuege, LIU Wei, et al.Longitudinal connectivity and fish habitat of main tributaries in Songhuajiang River Basin[J].Water Resources Protection, 2017,33(6):150-160.(in Chinese))
[16]BALLESTEROS M L,BIANCHI G E,CARRANZA M,et al.Endosulfan acute toxicity and histomorphological alterations in Jenynsia multidentata (Anablepidae,Cyprinodontiformes)[J].Journal of Environmental Science and Health Part B,2007,42(4):351-357.
[17]GEYER HJ,SCHEUNERT I,BRÜGGEMANN R,et al.The relevance of aquaticorganisms’ lipid content to the toxicity of lipophilic chemicals:toxicity of Lindane to different fish species[J].Ecotoxicology and Environmental Safety,1994,28:56-70.
[18]SUNDERAM R I M,THOMPSON G B,CHENG D M H.Toxicity of endosulfan to native and introduced fish in Australia[J].Environmental Toxicology and Chemistry,1992,11(10):1469-1476.
[19]PANDEY S,NAGPURE N S,KUMAR R,et al.Genotoxicity evaluation of acute doses of endosulfan to freshwater teleostChannapunctatus(Bloch) by alkaline single-cell gel electrophoresis[J].Ecotoxicology and Environmental Safety,2006,65(1):56-61.
[20]HAIDER S,INBARAJ R M.Relative toxicity of technical material and commercial formulation of malathion and endosulfan to a freshwater fish,Channapunctatus(Bloch)[J].Ecotoxicology and Environmental Safety,1986,11:347-351.
[21]DAR S A,YOUSUF A R,GANAI F A,et al.Assessment of endosulfan induced genotoxicity and mutagenicity manifested by oxidative stress pathways in freshwater cyprinid fish crucian carp (CarassiuscarassiusL.)[J].Chemosphere,2015,120:273-283.
[22]DACUNA R H,VAZQUEZ G R,PIOL M N,et al.Assessment of the acute toxicity of the organochlorine pesticide endosulfan in cichlasoma dimerus (Teleostei,Perciformes)[J].Ecotoxicology and Environmental Safety,2011,74(4):1065-1073.
[23]HII Y S,LEE M Y,CHUAH T S.Acute toxicity of organochlorine insecticide endosulfan and its effect on behaviour and some hematological parameters of Asian swamp eel (Monopterusalbus,Zuiew)[J].Pesticide Biochemistry and Physiology,2007,89(1):46-53.
[24]GIMENO L,FERRANDO M D,SANCHEZ S,et al.Endosulfan effects on liver and blood of the eel,AnguillaAnguilla[J].Comparative Biochemistry and physiology Part C:Pharmacology,Toxicology and Endocrinology,1994,108(3):343-348.
[25]武焕阳,靳涛,丁诗华.硫丹对草鱼鱼种的急性毒性效应[J].水产科学,2012,31(1):37-40.(WU Huanyang,JIN Tao,DING Shihua.Acute toxicity of endosulfan to juvenile grass carpCtenopharyngodonidellus[J].Fisheries Science,2012,31(1):37-40.(in Chinese))
[26]胡国成,甘炼,吴天送,等.硫丹对斑马鱼的毒性效应[J].动物学杂志,2008,43(4):1-6.(HU Guocheng,GAN Lian,WU Tiansong,et al.Toxicological effects of endosulfan onDaniorerio[J].Chinese Journal of Zoology,2008,43(4):1-6.(in Chinese))
[27]KUMAR N,AMBASANKAR K,KRISHNANI K K,et al.Acute toxicity,biochemical and histopathological responses of endosulfan inChanoschanos[J].Ecotoxicology and Environmental Safety,2016,131:79-88.
[28]KUMAR N,PRABHU P A J,PAL A K,et al.Anti-oxidative and immuno-hematological status of Tilapia (Oreochromismossambicus) during acute toxicity test of endosulfan[J].Pesticide Biochemistry and Physiology,2011,99(1):45-52.
[30]SHARMA S,NAGPURE N S,KUMAR R,et al.Studies on the genotoxicity of endosulfan in different tissues of fresh water fishMystusvittatususing the comet assay[J].Archives of Environmental Contamination and Toxicology,2007,53(4):617-623.
[31]李思雯,肖蓉,程李芳,等.硫丹和高效氯氟氰菊酯对葛氏鲈塘鳢的急性毒性研究[J].安徽农业科学,2014,42(11):3282-3283,3286.(LI Siwen,XIAO Rong,CHENG Lifang,et al.Study on the acute toxicity of endosulfan and lambda-cyhalothrin onPerccottusglenii[J].Journal of Anhui Agricultural Sciences,2014,42(11):3282-3283,3286.(in Chinese))
[35]COIMBRA A M,FIGUEIREDO-FERNANDES A,REIS-HENRIQUES M A.Nile tilapia (Oreochromisniloticus),liver morphology,CYP1A activity and thyroid hormones after endosulfan dietary exposure[J].Pesticide Biochemistry and Physiology,2007,89(3):230-236.
[36]KUMARI U,SRIVASTAVA N,SHELLY A,et al.Inducible headkidney cytochrome P450 contributes to endosulfan immunotoxicity in walking catfish clarias gariepinus[J].Aquatic Toxicology,2016,179:44-54.
[37]GLOVER C N,PETRI D,TOLLEFSEN K E,et al.Assessing the sensitivity of Atlantic salmon (Salmosalar) to dietary endosulfan exposure using tissue biochemistry and histology[J].Aquatic Toxicology,2007,84(3):346-355.
[38]VELASCO-SANTAMARA Y M,HANDY R D,SLOMAN K A.Endosulfan affects health variables in adult zebrafish (Daniorerio) and induces alterations in larvae development[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2011,153(4):372-380.
[39]DONG M,ZHU L,SHAO B,et al.The effects of endosulfan on cytochrome P450 enzymes and glutathione S-transferases in zebrafish (Daniorerio) livers[J].Ecotoxicology and Environmental Safety,2013,92:1-9.
[40]PEREIRA V M,BORTOLOTTO J W,KIST L W,et al.Endosulfan exposure inhibits brain AChE activity and impairs swimming performance in adult zebrafish (Daniorerio)[J].Neurotoxicology,2012,33(3):469-475.
[41]BALLESTEROS M L,DURANDO P E,NORES M L,et al.Endosulfan induces changes in spontaneous swimming activity and acetylcholinesterase activity ofJenynsiamultidentata(Anablepidae,Cyprinodontiformes)[J].Environmental Pollution,2009,157(5):1573-1580.
[42]DUTTA H M,ARENDS D A.Effects of endosulfan on brain acetylcholinesterase activity in juvenile bluegill sunfish[J].Environmental Research,2003,91(3):157-162.
[43]WU H,DING S.Micronuclei and dyskaryosis of erythrocytes and oxidative stress response with endosulfan exposure in topmouth gudgeon pseudorasbora parva[J].Ecotoxicology and Environmental Safety,2016,134:179-185.
[44]BALLESTEROS M L,WUNDERLIN D A,BISTONI M A.Oxidative stress responses in different organs ofJenynsiamultidentataexposed to endosulfan[J].Ecotoxicology and Environmental Safety,2009,72(1):199-205.
[45]CRUPKIN A C,CARRIQUIRIBORDE P,MENDIETA J,et al.Oxidative stress and genotoxicity in the South American cichlid,Australoherosfacetus,after short-term sublethal exposure to endosulfan[J].Pesticide Biochemistry and Physiology,2013,105(2):102-110.
[46]HINCAL F,GÜRBAY A,GIRAY B.Induction of lipid peroxidation and alteration of glutathione redox status by endosulfan[J].Biological Trace Element Research,1995,47(1):321-326.
[47]MODESTO K A,MARTINEZ C B R.Roundup causes oxidative stress in liver and inhibits acetylcholinesterase in muscle and brain of the fishProchiloduslineatus[J].Chemosphere,2010,78(3):294-299.
[48]闫振华,孙红伟,陆光华.水体中氟西汀的赋存、累积和生物效应研究进展[J].水资源保护,2017,33(6):147-154.(YAN Zhenhua,SUN Hongwei,LU Guanghua.Advances in studies on occurrence,accumulation and biological effects of fluoxetine in water[J].Water Resources Protection,2017,33(6):147-154.(in Chinese))
[49] KUMAR N,SHARMA R,TRIPATHI G,et al.Cellular metabolic,stress,and histological response on exposure to acute toxicity of endosulfan in Tilapia (Oreochromismossambicus)[J].Environmental Toxicology,2016,31(1):106-115.
[50] GIUSI G,FACCIOLO R M,ALR,et al.Some environmental contaminants influence motor and feeding behaviors in the ornate wrasse (Thalassomapavo) via distinct cerebral histamine receptor subtypes[J].Environmental Health Perspectives,2005,113(11):1522.
[51] 郭策,韩福杰,田物,等.2种农药对葛氏鲈塘鳢外周血红细胞核异常的影响[J].安徽农业科学,2015(34):215-216.(GUO Ce,HAN Fujie,TIAN Wu,et al.Effects of two kinds of pesticides on nuclear anomalies in peripheral blood erythrocytes ofPerccottusglenii[J].Journal of Anhui Agricultural Sciences,2015(34):215-216.(in Chinese))
[52] NEUPARTH T,BICKHAM J W,THEODORAKIS C W,et al.Endosulfan-induced genotoxicity detected in the gilthead seabream,SparusaurataL.,by means of flow cytometry and micronuclei assays[J].Bulletin of Environmental Contamination & Toxicology,2006,76(2):242-248.
[53] ISLAM F U,JALALI S,SHAFQAT MN,et al.Endosulfan is toxic to the reproductive health of male freshwater fish,Cyprinionwatsoni[J].Science of Nature,2017,104 (11-12):104.
[54] GORMLEY K L,TEATHER K L.Developmental,behavioral,and reproductive effects experienced by Japanese medaka (Oryziaslatipes) in response to short-term exposure to endosulfan[J].Ecotoxicology and Environmental Safety,2003,54(3):330-338.
[55] BEYGER L,ORREGO R,GUCHARDI J,et al.The acute and chronic effects of endosulfan pulse-exposure onJordanellafloridae(Florida flagfish) over one complete life-cycle[J].Ecotoxicology and Environmental Safety,2012,76:71-78.
[56] RAJAKUMAR A,SINGH R,CHAKRABARTY S,et al.Endosulfan and flutamide impair testicular development in the juvenile Asian catfish,Clariasbatrachus[J].Aquatic Toxicology,2012,110:123-132.
[57] LEMAIRE G,MNIF W,MAUVAIS P,et al.Activation of α-and β-estrogen receptors by persistent pesticides in reporter cell lines[J].Life Sciences,2006,79(12):1160-1169.
[58] MREMA E J,RUBINO F M,BRAMBILLA G,et al.Persistent organochlorinated pesticides and mechanisms of their toxicity[J].Toxicology,2013,307:74-88.
[59] CHAKRABARTY S,RAJAKUMAR A,RAGHUVEER K,et al.Endosulfan and flutamide,alone and in combination,target ovarian growth in juvenile catfish,Clariasbatrachus[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2012,155(3):491-497.
[60] MARCON L,THOMÉ R G,MOUNTEER A H,et al.Immunohistochemical,morphological and histometrical analyses of follicular development inAstyanaxbimaculatus(Teleostei:Characidae) exposed to an organochlorine insecticide[J].Ecotoxicology and Environmental Safety,2017,143:249-258.
[62] SENTHILKUMARAN B.Pesticide-and sex steroid analogue-induced endocrine disruption differentially targets hypothalamo-hypophyseal-gonadal system during gametogenesis in teleosts:a review[J].General and Comparative Endocrinology,2015,219:136-142.

