Septin2在胃癌组织中的表达及对胃癌细胞增殖和凋亡的影响
李君君,方 磊,高 阳,时 帅,何昊宇,刘晓梅,袁彩君
锦州医科大学附属第一医院肿瘤内科 辽宁锦州 121000
胃癌是世界癌症死亡的第二大常见原因。Septin基因家族是一类具有GTPase活性的保守基因家族,参与细胞质分裂、细胞内物质转运、细胞周期调控及凋亡等重要生理过程[1-5],与多种肿瘤的发生、转移关系密切[6-9]。Septin可保护原癌基因人类表皮生长因子受体2免于泛素化并胞吞和溶酶体降解,有助于癌细胞质膜上受体的稳定。有文献[10-11]报道Septin2在胃癌组织中的表达升高,并与胃癌的不良预后密切相关。本研究通过生物信息学方法分析胃癌组织和正常组织之间Septin2 mRNA的表达差异,通过免疫组化染色验证其在蛋白水平的表达差异,通过进一步的细胞实验明确Septin2表达变化对胃癌细胞增殖和凋亡的影响,探讨其成为监测胃癌发生的生物学标记物的可能性,为胃癌的治疗提供新的潜在靶点。
1 材料与方法
1.1胃癌和正常组织中Septin2mRNA的表达差异和在线生存分析从基因表达综合数据库(GEO)中下载GSE54129数据集中的胃组织Septin2 mRNA表达谱,共132例,其中正常组织21例,癌组织111例;利用GEO2R分析工具分析对比胃癌组织和正常组织中Septin2 mRNA的表达差异。利用Kaplan-Meier Plotter(http://kmplot.com/analysis/)数据库中的胃癌数据进行在线生存分析;共631例,随访时间150个月,在随访期内死亡为终点事件;以Septin2 mRNA表达水平中位数为界分为低表达组和高表达组,分别绘制两组的生存曲线。
1.2胃癌组织中Septin2蛋白的检测采用免疫组化染色法。收集2016年锦州医科大学附属第一医院胃癌术后患者的病理蜡块共141例,其中胃正常组织23例,不典型增生组织2例,高、中、低分化腺癌组织7、50、57例,胃肠间质瘤组织2例。切片厚度4 μm,经脱苯脱蜡水化抗原修复等步骤后,将兔抗人Septin2抗体(稀释度1100)滴片,室温孵育2 h,PBS洗片后加入羊抗兔二抗(稀释度1500)室温孵育1 h,DAB显色,苏木精染核,透明封片。抗体购自美国Abcam公司。由病理科2位专家共同阅片。200倍显微镜下选择3个视野观察。按染色程度进行评分,未染色计0分,淡黄色计1分,黄色计2分,深黄色计3分;按染色区域百分比进行评分,0%~计0分,5%~计1分,25%~计2分,50%~计3分,75%~100%计4分;两项评分的乘积为最终评分。该实验获得锦州医科大学及其附属第一医院伦理委员会批准。
1.3转染Septin2对胃癌细胞生物学行为的影响
1.3.1 Septin2对胃癌细胞的转染 人胃癌细胞系SGC-7901和MNK-45购买于沈阳百思生物科技有限公司。将SGC-7901和MNK-45用含体积分数10%胎牛血清(美国Gibco公司)、100 U/mL青霉素、0.1 g/L链霉素的RPMI 1640培养基(美国HyClone公司)于体积分数5% CO2、37 ℃条件下培养,并按常规方法传代、冻存和复苏。将SGC-7901和MNK-45接种到6孔板,待细胞汇合至70%~80%,使用Lipofectamine3000(美国赛默飞世尔科技公司)将Septin2表达质粒(锦州医科大学附属第一医院脑与脊髓损伤重点实验室赠予)转染至细胞中,按说明书操作,37 ℃孵育细胞2 d, G418筛选,挑选单克隆细胞株2株进行传代培养。以未转染的细胞作为空白对照,以转染空质粒的细胞作为阴性对照。转染Septin2表达质粒的2株细胞分别为转染1组和转染2组。
1.3.2 细胞中Septin2 mRNA的检测 采用Real-time PCR法检测。收集细胞,提取细胞内总RNA,按反转录试剂盒说明将RNA反转录为cDNA,再根据SYBR染料试剂盒说明进行荧光定量PCR检测,试剂盒及SYBR荧光染料均购自大连宝生物(TaKaRa)公司。Septin2上游引物序列:5’-AGCGCTCGAGCGCCACCATGTCTCGATTCTACGATG TCTAAGC-3’,下游:5’-AGCGAGAATTCTTACACGTG GTGCCCGAGAG-3’;GAPDH上游引物序列:5’-CAAT GACCCCTTCATTGACC-3’,下游:5’-TGGAAGATGGT GATGGGATT-3’。PCR扩增体系:SYBR染料10 μL,模板cDNA 2 μL,DEPC水6 μL,上、下游引物(100 μmol/L)各1 μL。扩增条件为95 ℃预变性30 s,95 ℃变性5 s,55 ℃退火34 s,72 ℃延伸 34 s(59次循环),65 ℃终延伸5 s,0.5 ℃结束。根据2-ΔΔCt计算mRNA相对表达量。实验重复3次。
1.3.3 细胞中Septin2 蛋白的检测 采用Western blot法检测。收集细胞,按蛋白提取试剂盒说明提取细胞内总蛋白并定量。以100 g/L SDS-PAGE凝胶在110 V下进行蛋白分离电泳,然后在60 V下将蛋白转印至PVDF膜,50 g/L脱脂奶粉室温封闭1 h,加一抗(兔抗人Septin2抗体,稀释度1400;兔抗人GAPDH抗体,稀释度1500)4 ℃孵育过夜,次日加二抗(羊抗兔抗体,稀释度11 000)室温孵育1 h,ECL化学发光。实验重复3次。全蛋白提取试剂盒、超敏和化学发光试剂盒、兔抗人Septin2抗体购自Abcam公司,兔抗人GAPDH抗体购自沈阳万类生物公司。
1.3.4 细胞增殖能力的检测 MTT细胞增殖检测试剂盒购自沈阳万类生物公司。选用对数生长期的细胞,消化计数,接种于96孔板,2×103个/孔,用含体积分数10%胎牛血清的完全培养基于体积分数5% CO2、37 ℃条件下培养,分别于细胞完全贴壁24、48、72 h后取出细胞,按MTT 细胞增殖检测试剂盒提示操作,最后于490 nm处检测培养孔光密度,表示细胞增殖能力。每组设置3个复孔,实验重复3次。
1.3.5 细胞凋亡的检测 凋亡检测试剂盒购自江苏凯基公司。收集细胞并用PBS冲洗2次,加入500 μL的1×Annexin V缓冲液重悬细胞,加入5 μL FITC标记的Annexin V试剂后,于37 ℃避光孵育15 min,然后每管加入5 μL PI标记的Annexin V试剂,1 h内上流式细胞仪检测,采用Flow Jo软件分析细胞凋亡率检测结果。实验重复3次。
1.4统计学处理应用SPSS 21.0对数据进行统计分析。胃癌组织和正常组织中Septin2 mRNA在线数据比较采用两独立样本t检验,生存曲线的比较采用log-rank检验,Septin2蛋白阳性表达率的比较采用χ2检验;4组胃癌细胞Septin2蛋白、mRNA相对表达量的比较,细胞增殖抑制率、凋亡率的比较均采用单因素方差分析,两两比较采用LSD-t检验,检验水准α=0.05。
2 结果
2.1胃癌和正常组织中Septin2mRNA表达差异和在线生存分析结果GSE54129数据集中,胃正常组织和癌组织中Septin2 mRNA表达量分别为(6.42±0.25)、(8.70±0.43),胃癌组织中Septin2 mRNA表达高于正常组织(t=23.511,P<0.001)。Septin2 mRNA高表达组和低表达组生存曲线见图1,两组比较,差异有统计学意义(P<0.001),高表达组患者中位生存时间短于低表达组。
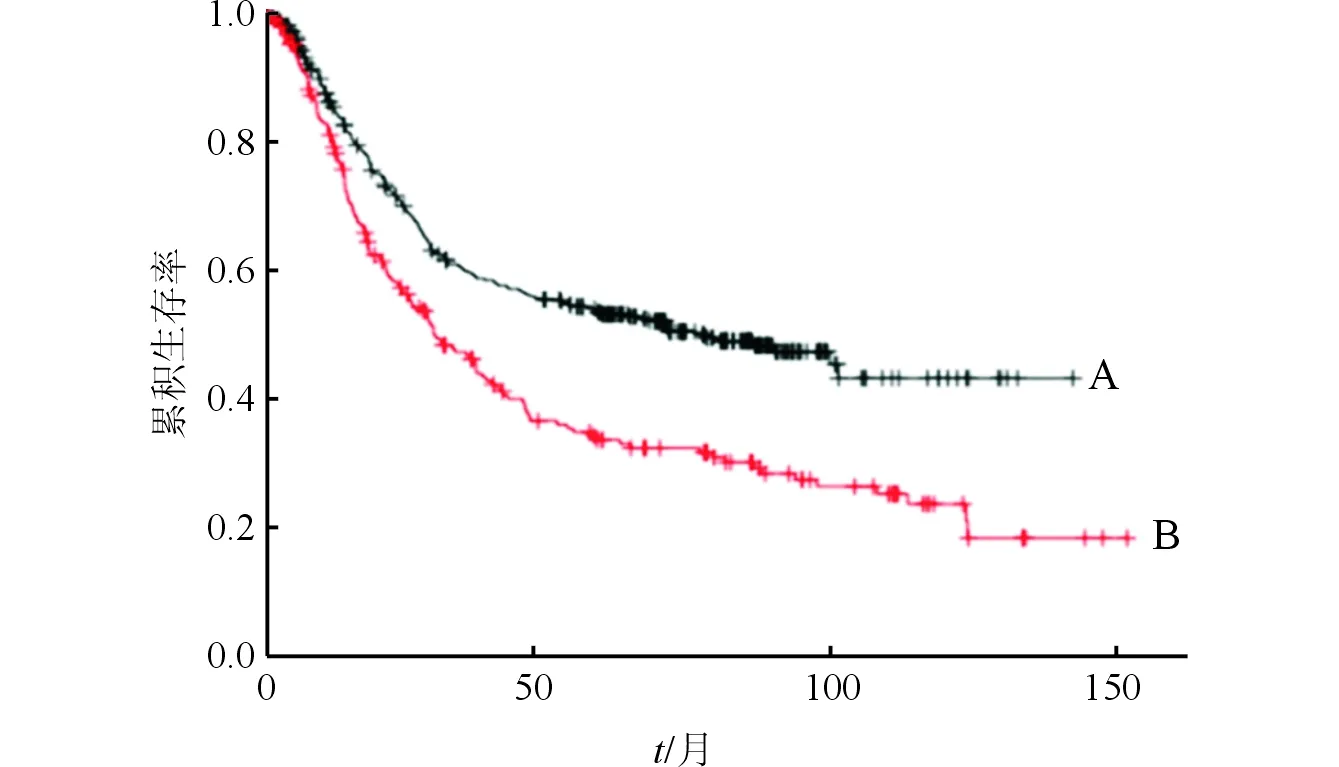
A:低表达组;B高表达组图1 Septin2 mRNA高表达组和低表达组的生存曲线


A~F:胃正常组织、不典型增生、高分化腺癌、中分化腺癌、低分化腺癌、胃肠间质瘤图2 不同胃组织中Septin2蛋白的表达(免疫组化染色,×200)
2.3转染Septin2的胃癌细胞中Septin2的表达SGC-7901和MNK-45转染Septin2表达质粒后,Septin2 mRNA和蛋白表达水平均升高,见图3、表1、表2。

1~4:SGC-7901细胞阴性对照组、空白对照组、转染1组、转染2组;5~8:MNK-45细胞阴性对照组、空白对照组、转染1组、转染2组图3 胃癌细胞Septin2蛋白的表达
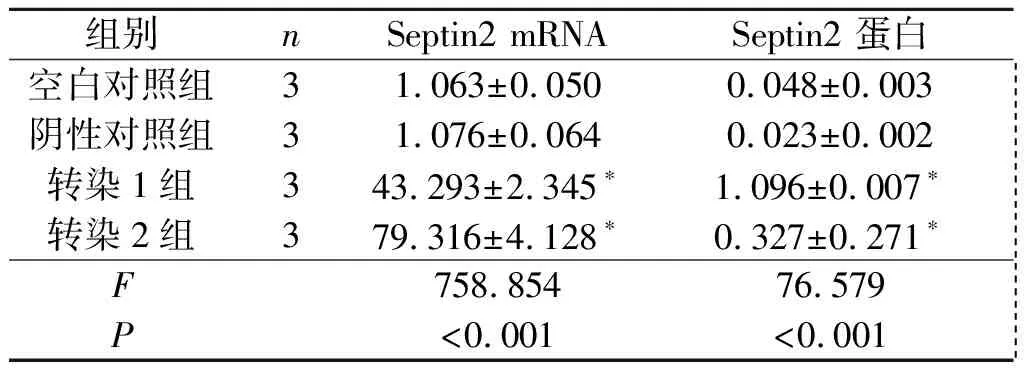
表1 4组SGC-7901细胞中Septin2 mRNA和蛋白表达的比较
*:与空白对照组和阴性对照组相比,P<0.05。

表2 4组MNK-45细胞中Septin2 mRNA和蛋白表达的比较
*:与空白对照组和阴性对照组相比,P<0.05。
2.4转染Septin2的胃癌细胞增殖能力的变化SGC-7901和MNK-45细胞转染Septin2表达质粒后,细胞增殖能力增强,见表3、表4。
2.5转染Septin2的胃癌细胞凋亡能力的变化SGC-7901和MNK-45细胞转染Septin2表达质粒后,细胞凋亡受抑,见表5。
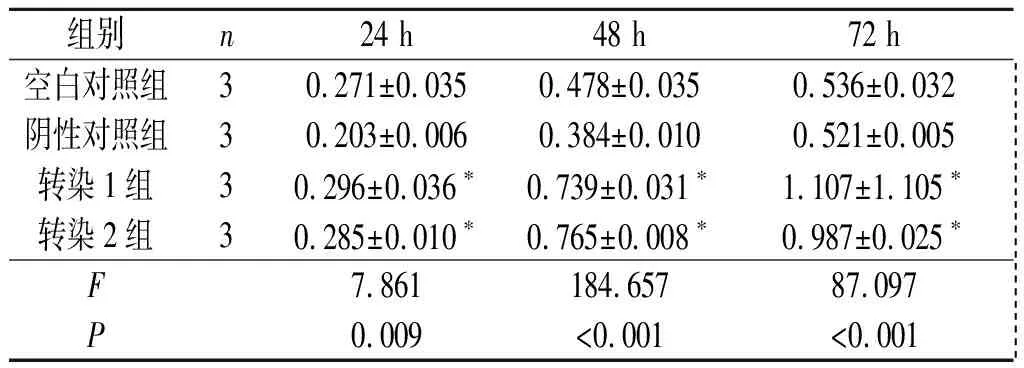
表3 4组SGC-7901细胞增殖能力的比较
*:与空白对照组和阴性对照组相比,P<0.05。
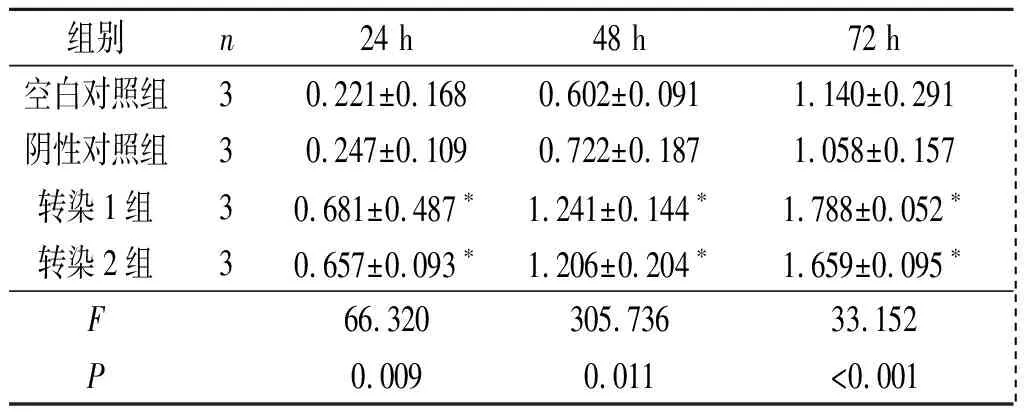
表4 4组MNK-45细胞增殖能力的比较
*:与空白对照组和阴性对照组相比,P<0.05。

表5 4组细胞凋亡率的比较 %
*:与空白对照组和阴性对照组相比,P<0.05。
3 讨论
Septin基因家族是一类具有GTPase活性的保守基因家族,目前已经发现至少13个家族成员,编码13个Septins (SEPT1~12, SEPT14),家族成员之间具有很高的同源性,仅N端和C端稍有不同,位于其中央的GTP结合位点具有GTP酶活性,是最为保守的核心结构域[12]。研究[13]表明Septin蛋白是继微管蛋白、F-actin和中间纤维蛋白之后的第4种细胞骨架成分,并在细胞内物质运输、细胞分裂、细胞周期调控与凋亡等生理过程中发挥重要作用。Septin基因功能改变与霍奇金淋巴瘤、胆管细胞癌、乳腺癌、髓样白血病等肿瘤的发生密切相关[1,6-8]。Septin对脱落的肿瘤细胞细胞膜突起的形成至关重要,因此其可能在肿瘤细胞的转移行为中发挥重要作用[9]。作为Septin基因家族的重要癌症相关成员,Septin9已被证实与卵巢肿瘤、头颈部肿瘤、前列腺肿瘤、胃肠道的发生关系密切[9]。有临床试验[14-15]证实血浆中甲基化Septin9可作为结直肠癌机会性筛查的指标。Septin6在淋巴组织中广泛表达,且表达水平较高,其表达下调与婴幼儿急性髓系白血病发生有关,被认为是混合性系统白血病的一种融合伴侣[16]。
Septin2是一种GTP结合骨架蛋白,其基因位于2号染色体上,可通过与其他Septin蛋白形成核心复合体来发挥相应的功能。目前有关Septin2与肿瘤关系的研究较少。Septin2在脑肿瘤中的表达水平呈细胞周期依赖性,在G2/M期肿瘤细胞中表达水平最高;阻断星形胶质瘤细胞中Septin2的表达,细胞质分裂进程受阻,形成多核巨细胞[17]。有报道[18]抑制肝癌细胞中Septin2的表达,可抑制肝癌细胞的增殖、侵袭,促进其凋亡。此外,有文献[19]报道乳腺癌细胞的侵袭和迁移活动需要通过Septin2基因激活MEK/ERK通路来实现。
目前,胃癌已是世界癌症死亡的第二大常见原因,将近60%的胃癌患者手术时已发生局部转移或远处转移。因此,明确胃癌发病机制以及寻求新的治疗靶点尤为重要。近年来,生物信息学技术的发展为发现癌症特征基因提供了新的思路。本研究利用生物信息学技术发现Septin2与胃癌的发生及预后有关;进一步的免疫组化和细胞实验明确了Septin2是与胃癌发生相关的癌基因,其表达上调可促进胃癌细胞的增殖,抑制其凋亡。Septin2有可能成为筛查、监测胃癌发生及判断预后的新的生物学标记物,也可能成为胃癌靶向治疗的新靶点,但其对胃癌细胞生物学行为的具体调控机制有待于进一步的探索。
[1] CONNOLLY D,ABDESSELAM I,VERDIER-PINARD PA.Septin roles in tumorigenesis[J].Biol Chem,2011,392(8/9):725
[2] HOROWITZ A,LAPOINTE JF,EID R,et al.The human septin7 and the yeast CDC10 septin prevent Bax and Copper mediated cell death in yeast[J].Biochim Biophys Acta,2013,1833(12):3186
[3] HU QC,NELSON WJ,SPILIOTIS ET.Forchlorfenuron alters mammalian Septin assembly, organization, and dynamics[J].J Biol Chem,2008,283(43):29563
[4] KIM SK,SHINDO A,PARK TJ,et al.Planar cell polarity acts through Septins to control collective cell movement and ciliogenesis[J].Science,2010,329(5997):1337
[5] KREMER BE,ADANG LA,MACARA IG.Septins regulate actin organization and cell-cycle arrest through nuclear accumulation of NCK mediated by SOCS7[J].Cell,2007,130(5):837
[6] KINOSHITA M.The septins[J].Genome Biol,2003,4(11):236
[7] LIU M,SHEN S,CHEN F,et al.Linking the septin expression with carcinogenesis[J].Mol Biol Rep,2010,37(7):3601
[8] RUSSELL SE,HALL PA.Do septins have a role in cancer?[J].Br J Cancer,2005,93(5):499
[9] ØSTEVOLD K,MELNDEZ AV,LEHMANN F,et al.Septin remodeling is essential for the formation of cell membrane protrusions(microtentacles) in detached tumor cells[J].Oncotarget,2017,8(44):76686
[10]KOCEVAR N,ODREMAN F,VINDIGIN A,et al.Proteomic analysis of gastric cancer and immunoblot validation of potential biomarkers[J].World J Gastroenterol,2012,18(11):1216
[11]MARCUS EA,TOKHTAEVA E,TURDIKULOVA S,et al.Septin oligomerization regulates persistent expression of ErbB2/HER2 in gastric cancer cells[J].Biochem J,2016,473(12):1703
[12]ANGELIS D,SPILIOTIS.Septin mutations in human cancers[J].Front Cell Dev Biol, 2016,4:122
[13]VALADARES NF,D'MUNIZ PEREIRA H,ULIAN ARAUJO AP,et al.Septin structure and filament assembly[J].Biophys Rev,2017,9(5):481
[14]SONG LL,PENG XM,LI YE,et al.The SEPT9 gene methylation assay is capable of detecting colorectal adenoma in opportunistic screening[J].Epigenomics,2017,9(5):599
[15]SONG LL,LI YE.Progress on the clinical application of the SEPT9 gene methylation assay in the past 5 years[J].Biomark Med,2017,11(6):415
[16]SENGER K,MARKA G,SOLLER K,et al.Septin 6 regulates engraftment and lymphoid differentiation potential of murine long-term hematopoietic stem cells[J].Exp Hematol,2017,55:45
[17]KIM DS,HUBBARD SL,PERAUD A,et al.Analysis of mammalian septin expression in human malignant brain tumors[J].Neoplasia,2004,6(2):168
[18]CAO LQ,SHAO ZL,LIANG HH,et al.Activation of peroxisome proliferator-activated receptor-γ(PPARγ) inhibits hepatoma cell growth via downregulation of SEPT2 expression[J].Cancer Lett,2015,359(1):127
[19]ZHANG NZ,LIU L,FAN N,et al.The requirement of SEPT2 and SEPT7 for migration and invasion in human breast cancer via MEK/ERK activation[J].Oncotarget,2016,7(38):61587

