酶法协同微波提取桑椹多糖工艺优化的研究
杨桦,邝思碧,邹宇晓,黎尔纳,*,王弘
(1.华南农业大学食品学院,广东广州510642;2.广东省农业科学院蚕业与农产品加工研究所,农业部功能食品重点实验室,广东省农产品加工重点实验室,广东广州510610)
桑椹在我国食用历史悠久,已被列入首批“药食同源”名单[1-2]。桑椹营养丰富且富含多糖、多酚、生物碱和挥发性油等功能物质,具有降血糖、降血脂、增强免疫力和抗肿瘤[3]等活性作用,深入的研究发现并证实桑椹多糖是上述活性的重要物质基础[4-5]。
多糖(polysaccharide)是一类复杂的糖类物质,广泛存在于微生物、植物的细胞壁和动物的细胞膜中。马明兰等[6]采用沸水浸提法提取桑椹多糖,精制桑椹多糖提取率可达到2.63%。有研究表明桑椹多糖有抗衰老、降血糖和护肝的功效[7]。自由基学说认为:衰老可能与代谢过程中连续产生的自由基的摧毁性连锁反应有密切关系[8]。杨联河[9]通过实验发现,桑椹多糖可显著提升衰老模型小鼠红细胞超氧化物歧化酶、过氧化氢酶和全血谷胱甘肽过氧化物酶活性水平(P≤0.05),显著降低衰老模型小鼠血浆、脑匀浆及肝匀浆中过氧化脂质的含量(P≤0.05)。桑椹多糖的摄入可显著升高酒精性肝损伤模型小鼠肝脏超氧化物歧化酶、谷胱甘肽过氧化物酶的活性,同时降低血液谷丙转氨酶、谷草转氨酶水平(P≤0.05),有效改善小鼠肝损伤状况,推测桑椹多糖对酒精性肝损伤的抑制作用可能与抗氧化机制相关[10]。传统桑椹多糖提取采用水提法,需要多次重复浸提多糖才得以释放,操作时间长,得率低。酶法提取和超声波提取是近年来发展较快的提取方法,具有提取时间短和能耗低的特点[11-12]。
本试验针对单一的酶法提取或超声波提取桑椹多糖提取率不高的问题,拟结合生物酶法和物理场处理技术,通过单因素试验与Box-Behnken设计法对桑椹多糖提取工艺进行优化,进而确定桑椹多糖的最佳提取工艺,为桑椹多糖功能食品研究提供参考依据。
1 材料和方法
1.1 材料与仪器
桑椹干:采摘八、九成熟的新鲜桑椹,放置于60℃烘箱中烘干,食品级包装袋真空包装后置于-20℃冰箱中保存备用;纤维素酶(1 800 U/mg)、果胶酶(1 000 U/mg)、胃蛋白酶(3 000 U/mg):广州市齐云生物技术有限公司;浓硫酸、苯酚、葡萄糖、无水乙醇:分析纯,广州化学试剂厂。
SQP型电子天平:赛多利斯科学仪器(北京)有限公司;HWS26型电热恒温水浴锅:上海一恒科学仪器有限公司;WD750B型微波炉:顺德格兰仕电器厂有限公司;FW100型高速万能粉碎机:天津市泰斯特仪器有限公司;UV-1800型紫外可见分光光度计:岛津企业管理(中国)有限公司;CR22G III型高速冷冻离心机:广东广州日立工机有限公司。
1.2 方法
1.2.1 桑椹粗多糖的提取工艺流程
桑椹→60℃烘干→粉碎(过20目筛)→称取桑椹粉末5 g→酶解(2.5 h,37℃)→微波萃取→减压抽滤→浓缩→四倍体积无水乙醇醇沉→4℃过夜→离心(10 000 r/min,10 min)→去上清,加水溶解沉淀→定容至50 mL→桑椹粗多糖溶液[13]
1.2.2 多糖含量的测定
采用苯酚-硫酸比色法,吸取一定体积的葡萄糖标准溶液,依次定容至2 mL;精密吸取桑椹粗多糖溶液1.25 mL,加水稀释至50 mL。分别取葡萄糖标准液稀释液、桑椹多糖稀释液1.0 mL于10 mL试管中,再取1.0 mL蒸馏水作为空白对照,分别加入5%苯酚溶液1.0 mL,再加入浓硫酸5.0 mL,混合均匀,室温静置30 min,490 nm下测其吸光值。
1.2.2.1 葡萄糖标准溶液的配制
精密称取105℃干燥至恒重的葡萄糖500 mg,加少量蒸馏水溶解,转移至500 mL容量瓶中,加蒸馏水定容,摇匀,即得浓度为1 mg/mL的葡萄糖标准溶液。
1.2.2.2 标准曲线的绘制
吸取葡萄糖标准液 0、0.5、1.0、1.5、2.0、2.5 mL,定容至25 mL,得到不同浓度的葡萄糖稀释液,分别取1.0 mL稀释液于试管中,按2.2.4的操作显色,于490nm处测定吸光值。以吸光度(A)为纵坐标,葡萄糖质量浓度(C)为横坐标,绘制标准曲线,得回归方程:A=0.009 2C+0.044 6,R2=0.990 7。
1.2.2.3 桑椹多糖提取率的计算
多糖提取率/%=(C×V×D)/(W×106)×100
式中:C为测得的样品溶液稀释液的多糖浓度,μg/mL;V为样品溶液稀释液的体积,mL;D为样品溶液的稀释倍数;W为样品的质量,g。
1.2.3 单因素试验
1.2.3.1 酶的种类对多糖提取率的影响
研究选取3种酶进行试验:果胶酶、胃蛋白酶和纤维素酶。分别称取果胶酶0.05 g,胃蛋白酶0.016 7 g,纤维素酶0.027 8 g,加少量蒸馏水溶解,分别定容至50 mL,配制成酶活力均为1 000 U/mL的酶液,4℃保存备用。
称取5 g桑椹粉置于锥形瓶中,分别加入相同体积5mL的3种不同酶液,与未加酶进行空白对照,并按料液比1∶25(g/mL)补齐蒸馏水,37℃水浴酶解2.5 h,100℃灭酶10 min,提取多糖后测量并计算多糖含量。
1.2.3.2 酶添加量对多糖提取率的影响
分别加入 0、1、3、5、7、9 mL 的纤维素酶液,37 ℃水浴酶解2.5 h,100℃灭酶10 min,研究不同酶液添加量对多糖提取率的影响。
1.2.3.3 微波处理时间对多糖提取率的影响
加入7 mL纤维素酶液,37℃水浴酶解2.5 h,100℃灭酶10 min。在微波功率为450 W,研究不同微波时间(30、60、90、120、150 s)对多糖提取率的影响。
1.2.3.4 微波功率对多糖提取率的影响
加入7 mL纤维素酶液,37℃水浴酶解2.5 h,100℃灭酶10 min。在微波时间为60 s,研究不同微波功率(150、300、450、600、750 W)对多糖提取率的影响。
1.2.4 响应面法对桑椹多糖提取条件的优化
综合单因素提取多糖的试验结果,根据Box-Benhnken[14]的中心组合试验设计原理,采用响应面法在三因素三水平上的响应面分析方法对工艺参数进行优化[15-16]。试验因素与水平设计见表1。
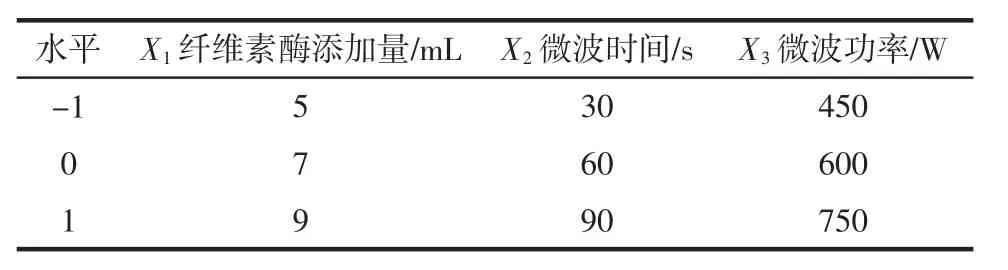
表1 响应面分析因素与水平Table 1 Factors and levels of response surface methodology
2 结果与讨论
2.1 单因素试验各因素对多糖提取率的影响
2.1.1 酶的种类对多糖提取率的影响
酶的种类对多糖提取率的影响见图1。

图1 酶的选择对多糖提取率的影响Fig.1 Effect of different kinds of enzymes on the polysaccharides extraction rate
由图1可知,与空白对照组相比,经纤维素酶处理后桑椹多糖提取率显著增加(P≤0.05),多糖提取率达到2.31%。果胶酶组的多糖提取率略有增高,但与对照组差异不显著(P≥0.05)。添加胃蛋白酶处理的桑椹对多糖提取率无明显影响。由于桑椹的细胞壁主要是由纤维素构成的,纤维素酶的处理可以破坏细胞壁中β-D-葡萄糖苷键,促进细胞壁中多糖的释放。据此,选择纤维素酶作为提取桑椹多糖所用的酶。
2.1.2 酶添加量对多糖提取率的影响
酶添加量对多糖提取率的影响见图2。
由图2可知,纤维素酶液的添加量从1 mL~7 mL(1 000 U/mL)范围内,随着酶添加量的增加,多糖提取率显著增加(P≤0.05),呈显著的量效关系,其中在7mL时达到2.42%。进一步将酶添加量增加到9 mL时,多糖提取率略有下降,这可能是桑椹多糖已基本提取完全,其它杂质进入提取液,使提取液黏度升高,扩散速度变慢,导致多糖不易溶出,酶量的增加对多糖有一定的抑制作用。因此选择纤维素酶的最佳添加量为7mL。
2.1.3 微波处理时间对多糖提取率的影响
微波辐射时间对桑椹多糖提取率的影响如图3所示。
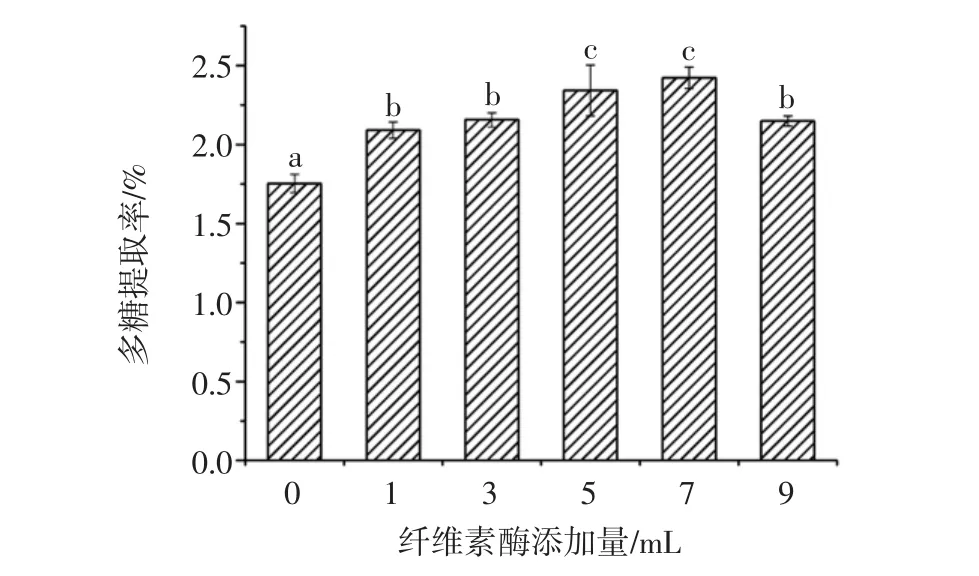
图2 酶液添加量对多糖提取率的影响Fig.2 Effect of enzyme addition on the polysaccharides extraction rate
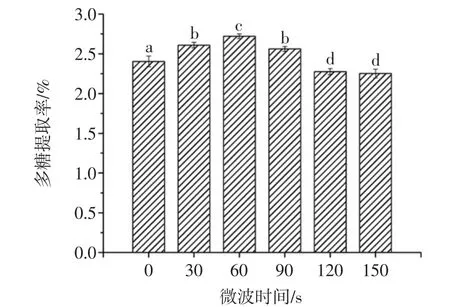
图3 微波时间对多糖提取率的影响Fig.3 Effect of wave time on the polysaccharides extraction rate
在0 s~150 s时间范围内,随着微波时间的延长,多糖提取率呈现出先上升后下降的现象,在微波时间为60 s时多糖提取率达到最高点,多糖得率为2.72%。之后逐渐下降。在一定的时间范围内增加微波处理的时间,使溶剂充分渗透到细胞内,促进细胞内多糖组分提取得率增加。微波作用的时间过短,可能提取不充分,但若微波时间过长,多糖则会有一定的降解,微波辐射时间超过60 s后,部分提取物可能被破坏,导致检测到的多糖类化合物含量有所减少。因此,选择微波的最佳时间为60 s为宜。
2.1.4 微波功率对多糖提取率的影响
微波功率对多糖提取率的影响见图4。
由图4可知,在微波功率低于600 W时,随着微波功率的增强,多糖提取率不断增加,在微波功率为600 W时达到最大,其多糖得率为2.93%,当微波功率提高到750 W时的多糖提取率略有下降,这可能是由于功率过高使提取的桑椹多糖被水解,导致多糖含量下降。而且高功率易使溶液发生爆沸而喷洒出来,造成多糖的损失和增加危险性,因此微波功率600 W为较适宜的提取功率。
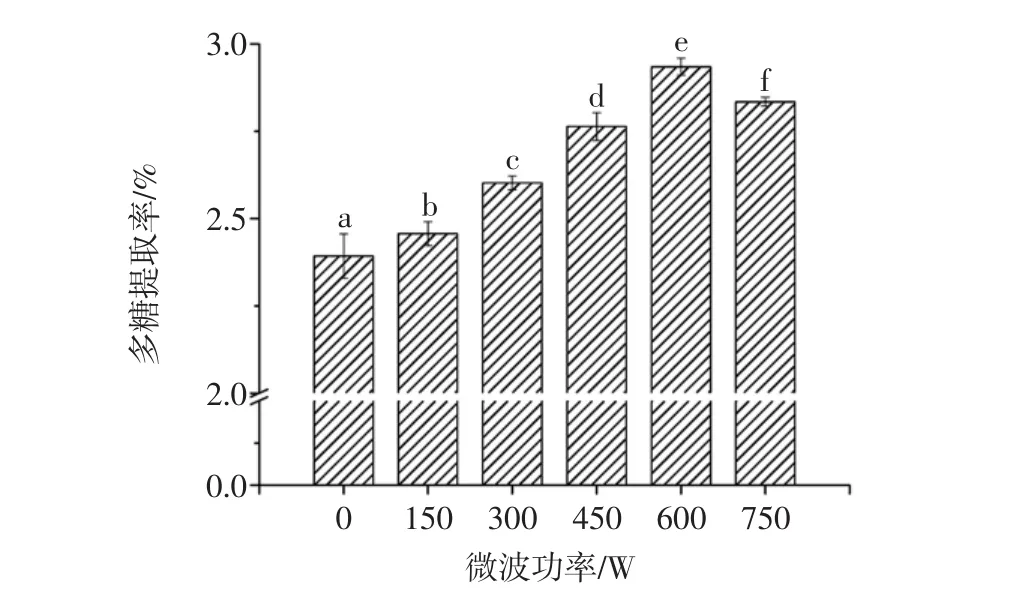
图4 微波功率对多糖提取率的影响Fig.4 Effect of wave power on the polysaccharides extraction rate
2.2 响应面试验设计与结果分析
通过查阅相关文献并结合本试验,在单因素试验结果的基础上,以X1、X2、X3为自变量,以桑椹多糖提取率为响应值,设计多因素试验,试验结果见表2。
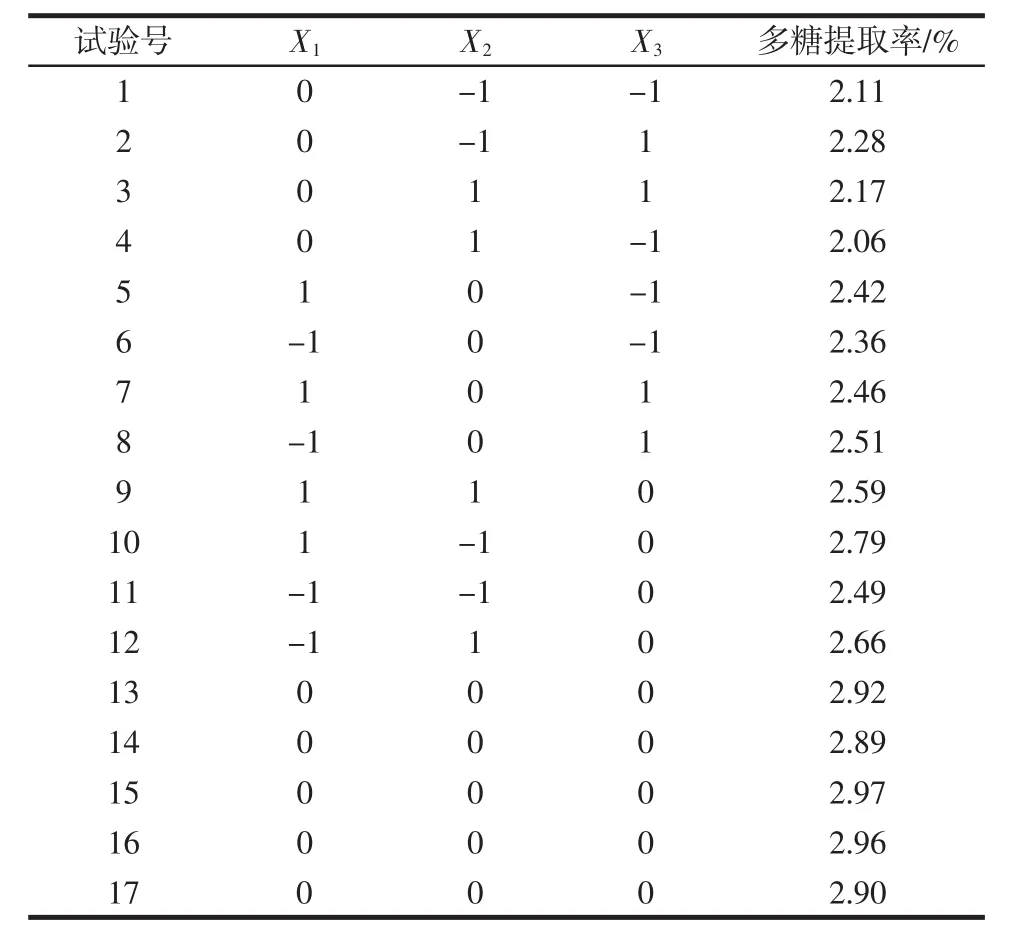
表2 响应面试验设计及结果Table 2 Response surface experimental design and result
对表2试验结果采用Design Expert 7.0统计软件进行多元回归拟合,回归分析结果见表3。
从表3 可知,整体模型“Prob>F”为<0.0001,表明该二次方程模型是高度显著的,拟合精度好,可以利用该响应面近似模型进行后续的优化设计;微波功率、酶添加量与微波时间的交互作用的“Prob>F”值都小于0.01,表明他们交互作用明显。微波时间和微波功率的二次方也为极显著影响因子。模型失拟项(Lack of Fit)指的是模型预测值与实际值不拟合的概率,该模型中失拟项“Prob>F”为 0.207 6,远大于 0.05,说明该模型的失拟项不显著,即该模型在被研究的整个回归区域内拟合较好;同时该回归模型决定系数R2=0.9905,说明相关性较好。由此可见,该回归方程可以很准确地描述各个因素与响应值之间的真实关系,可以选择该模型来分析桑椹多糖提取率的变化。
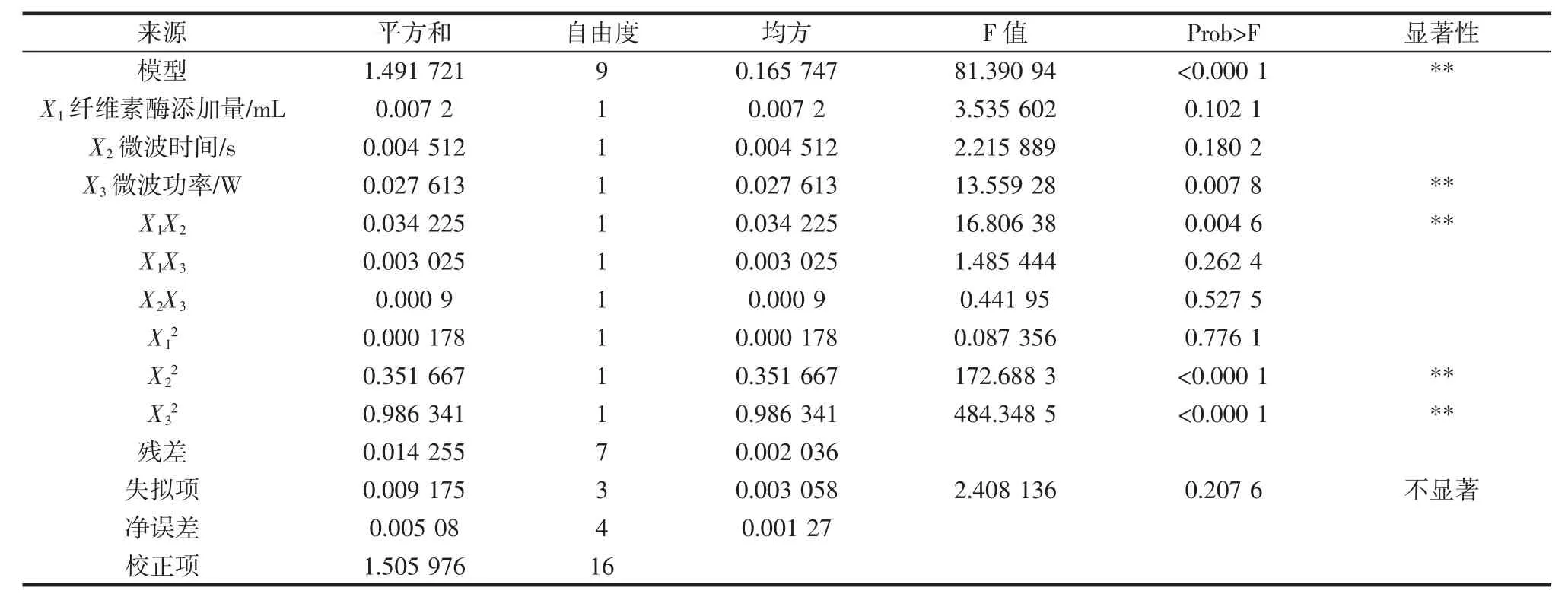
表3 多糖提取率回归分析结果Table 3 The results of variance analysis on the polysaccharides extraction
由于纤维素酶添加量、微波时间和微波功率3个因素对干桑椹多糖提取率的影响并不是简单的线性关系,采用Design Expert 7.0统计软件对表2数据进行多元回归分析,获得多糖提取率(Y)对纤维素酶添加量、微波时间、微波功率的二次多元回归方程:Y=-7.49663+0.18525X1+0.050533X2+0.02704X3-1.541 67×10-3X1X2-9.16667×10-5X1X3-3.333 33×10-6X2X3-1.625 00×10-3X12-3.211 11×10-4X22-2.151 11×10-5X32。
2.3 因素间的交互影响
纤维素酶添加量、微波时间、微波功率三因素对干桑椹多糖提取率的交互作用曲面图和等高线图,分别表示以微波功率、微波时间、纤维素酶添加量取零水平时,其余两个因素对多糖提取率的影响。
2.3.1 纤维素酶添加量与微波时间交互作用对桑椹多糖提取率的影响
纤维素酶添加量与微波时间交互作用对桑椹多糖提取率的影响见图5。
从图5可知,当微波时间在30 s~60 s时,随着微波时间的延长,桑椹多糖的提取率上升,当微波时间达60 s时,多糖提取率最高。随着微波时间的进一步延长,多糖提取率反而降低。
2.3.2 纤维素酶添加量与微波功率交互作用对桑椹多糖提取率的影响
纤维素酶添加量与微波功率交互作用对桑椹多糖提取率的影响见图6。

图5 纤维素酶添加量与微波时间交互作用对桑椹多糖提取率的影响Fig.5 Interaction among enzyme addition and wave time on the polysaccharides extraction rate in mulberry
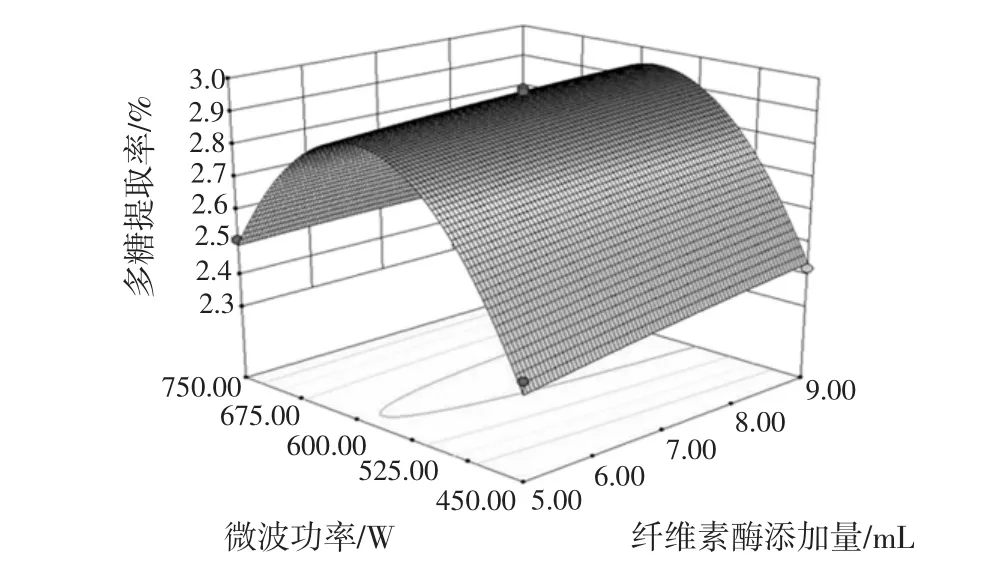
图6 纤维素酶添加量与微波功率交互作用对桑椹多糖提取率的影响Fig.6 Interaction among enzyme addition and wave power on the polysaccharides extraction rate in mulberry
从图6可知,当微波功率在450 W~600 W时,随着微波功率的提高,桑椹多糖的提取率上升,当微波功率达600 W时,多糖提取率最高。随着微波功率的进一步延长,多糖提取率反而降低。而纤维素酶添加量的增加对多糖提取率的影响则较为缓和,多糖提取率仅有小幅度的上升。
2.3.3 微波时间与微波功率交互作用对桑椹多糖提取率的影响
微波时间与微波功率交互作用对桑椹多糖提取率的影响见图7。
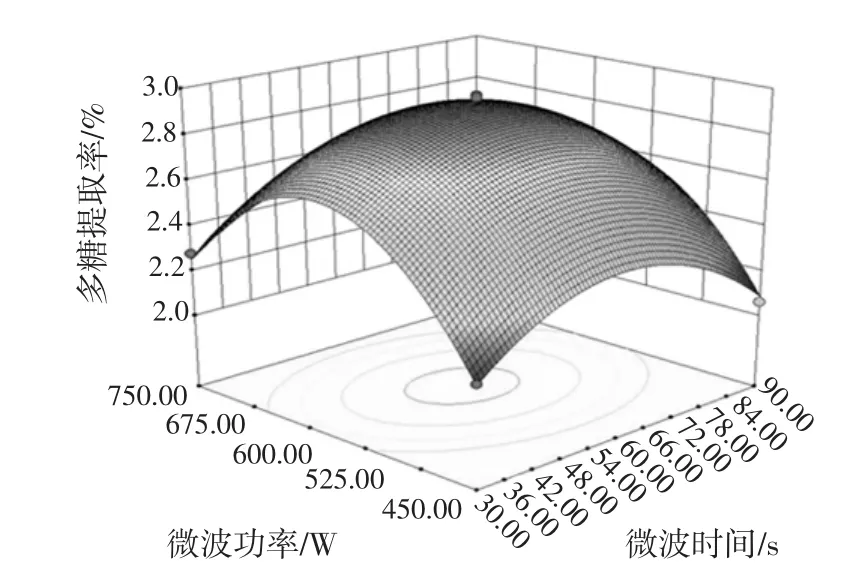
图7 微波时间与微波功率交互作用对桑椹多糖提取率的影响Fig.7 Interaction among wave time and wave power on the polysaccharides extraction rate in mulberry
图7可知,当微波时间在30 s~60 s,微波功率在450 W~600 W时,多糖提取率随着微波时间的延长而快速上升,当微波时间达到60 s,微波功率达到600 W时,多糖得率接近最高值。当进一步延长微波时间和增加微波功率时,多糖得率降低。
2.4 最佳化分析
最佳工艺:根据所建立的响应面数学模型进行参数最佳化分析,酶法协同微波提取桑椹多糖的工艺条件为:纤维素酶添加量9 mL,微波时间53.91 s,微波功率605.25 W,在此条件下干桑椹多糖提取率的理论值为2.963 8%。考虑到实际操作的可行性及简化工艺,将条件其修正为纤维素酶添加量9 mL,微波时间54 s,微波功率600 W。为了验证上述最优结果,试验结果如表4。

表4 最优试验结果验证Table 4 Validation of the optimal examination design
采用酶法协同微波提取桑椹多糖工艺,即:纤维素酶添加量9 mL,微波时间54 s,微波功率600 W。在修正条件下,得到实际多糖提取率为3.01%,多糖提取率比传统不酶解和微波处理的水提工艺(即1.2.1中无酶解和微波萃取,水提2.5 h,37℃)提高了72%,效果明显。
3 结论
本研究采用酶法协同微波提取桑椹多糖,在单因素试验的基础上,进行三因素三水平的Box-Behnken中心设计,优化了桑椹多糖的提取工艺。试验结果显示酶法协同微波提取桑椹多糖的最佳工艺为:纤维素酶添加量9 mL,微波时间54 s,微波功率600 W,在此条件下桑椹多糖的提取率为3.01%,多糖提取率比水提工艺提高了72%,效果明显。该方法为桑椹多糖的有效提取提供新思路,缩短了提取时间,为桑椹多糖的提取及其应用奠定了良好基础。
[1]王娜,范作卿,朱琳,等.桑椹的化学成分及应用研究进展[J].现代农业科技,2017(9):261-263
[2]邹宇晓,廖森泰,肖更生,等.蚕桑资源多元化开发利用新技术研究进展[J].蚕业科学,2016(4):561-569
[3]Qin C G,Yang L,Niu W N,et al.Analysis and characterisation of anthocyanins in mulberry fruit[J].Czech Journal of Food Sciences,2010,28(2):117-126
[4]Qian Z,Wu Z,Lian H,et al.Mulberry fruit prevents LPS-induced NF-κB/pERK/MAPK signals in macrophages and suppresses acute colitis and colorectal tumorigenesis in mice[J].Scientific Reports,2015,5:17348
[5]Yan F,Zhang J,Zhang L,et al.Mulberry anthocyanin extract regulates glucose metabolism by promotion of glycogen synthesis and reduction of gluconeogenesis in human HepG2 cells[J].Food&Function,2016,7(1):425-433
[6]马明兰,刘阳,蔡丽娜,等.桑葚多糖的提取研究[J].化学与生物工程,2016,33(3):39-42
[7]胡海梅.桑椹多糖提取工艺优化、组分分析及降血糖活性鉴定[D].安徽:合肥工业大学,2009
[8]Melov S.Therapeutics against mitochondrial oxidative stress in animal models of aging[J].Ann N Y Acad Sci,2002,959(1):330-340
[9]杨联河.桑椹多糖的提取与抗衰老作用研究[D].郑州:郑州大学,2005
[10]邓青芳.桑椹抗酒精性肝损伤药效作用及其物质基础研究[D].贵阳:贵州师范大学,2015
[11]傅国强,谢明勇,周鹏,等.纤维素酶法提取茶多糖[J].无锡轻工大学学报,2002,21(4):362-366
[12]Ying Z,Han X,Li J.Ultrasound-assisted extraction of polysaccharides from mulberry leaves[J].Food Chemistry,2011,127(3):1273-1279
[13]蔡锦源,熊建文,黄燕芬,等.白及多糖的超声-微波协同提取工艺及其抗氧化活性研究[J].食品工业科技,2016,37(22):274-278,284
[14]Guo X,Zou X,Sun M.Optimization of extraction process by response surface methodology and preliminary characterization of polysaccharides from Phellinus igniarius[J].Carbohydrate Polymers,2010,80(2):344-349
[15]胡晓冰,王振伟,申森,等.超声波微波协同提取超微粉碎落葵中多糖工艺优化[J].食品研究与开发,2017,38(7):45-50
[16]吴海燕,袁秋梅.超声波辅助提取蚕蛹多糖工艺的优化[J].食品研究与开发,2017,38(5):56-60

