富硒平菇多糖提取纯化及抗氧化活性研究
马玲,赵亚娜,张乐,于娟,纪海玉,滕安国,刘安军
(1.天津科技大学食品工程与生物技术学院,天津300457;2.山西农业大学食品科学与工程学院,山西太谷030801)
补硒对于机体功能的发挥以及预防部分疾病具有重要意义,与无机硒相比,有机硒的吸收利用率以及安全性较好,而有机硒大都以硒多糖和硒蛋白的形式出现。大量研究报道生物合成和化学合成的食用菌硒多糖具有较强的抗氧化活性,李华为发现富硒金针菇中的硒多糖对羟自由基的清除活性较同浓度下无机硒和多糖混合物更强[1]。Turło等研究发现硒含量高的香菇提取物具有较高的抗氧化活性[2]。Yu等发现硒化毛头鬼伞菌丝多糖体内抗氧化效果好于非硒化多糖[3]。Wang等研究得出茶叶中硒多糖组分和普通多糖相比具有更高的抗氧化活性[4]。Li等证实灰树花中分离得到的富硒多糖比普通多糖具有更高的抗氧化活性[5]。Zhu等认为硒化蛹虫草多糖具有更高的抗氧化活性[6]。但对富硒平菇中的硒多糖进行提取及抗氧化活性的研究还未见报道,因而本研究对富硒平菇中的硒多糖进行提取、分离,并对各组分不同浓度下的抗氧化活性进行比较,为富硒平菇的开发及生物活性研究提供理论依据。
1 材料与方法
1.1 材料与试剂
富硒平菇来源于山西紫团生态农业有限公司,硒的含量为622.47 mg/g干样。
无水乙醇、氯仿、正丁醇、葡萄糖、浓硫酸、氢氧化钠、牛血清白蛋白、焦性没食子酸、碳酸钠、盐酸、醋酸、三氯乙酸(trichloroacetic acid,TCA)、磷酸二氢钠、氯化铁、铁氰化钾(K3Fe(CN)6)、FeSO4、H2O2、水杨酸、邻苯三酚、ABTS、过硫酸钾、二苯代苦味酰肼自由基(DPPH)、考马斯亮蓝G-250:分析纯。
1.2 设备
DZF-6020型真空干燥箱:上海博讯实业有限公司医疗设备厂;HH-2电热恒温水浴锅:上海医疗器械五厂;SY-2000真空旋转蒸发仪:上海亚荣生化仪器厂;UV-1100分光光度计:上海美普达仪器有限公司;BP121S电子天平:北京赛多利斯仪器系统有限公司;MP220 pH计:梅特勒-托利多仪器有限公司;TDL-40B低速大容量多管离心机:上海安亭科学仪器厂;MODULYOD-230 真空冷冻干燥机:Thermo Electron,U.S.。
1.3 试验方法
1.3.1 多糖提取
富硒平菇(硒含量为622.47 mg/g干样)→干燥、脱脂→热水溶液浸提[料液比为 1 ∶20(g/mL),提取 6 h]→过滤→55℃真空浓缩→离心,弃去沉淀(2 000 r/min,10 min)→加入3倍体积乙醇→搅拌、静置过夜→离心收集沉淀(4 000 r/min,10 min)→无水乙醇洗涤→真空冷冻干燥→Sevag法除蛋白→透析(3 500 Da)→冷冻干燥→粗多糖(Se-POP)
1.3.2 分离、纯化
对所获得的粗多糖在DEAE-cellulose纤维柱中以0.1、0.5、1.5 mol/L NaCl溶液进行洗脱得到3个洗脱峰,对分离得到的3个洗脱峰进一步经过Sephadex G-100进一步纯化,得到3个分子量大小不同的组分Se-POP-1,Se-POP-2,Se-POP-3。
1.3.3 各组分中多糖含量测定
采用硫酸苯酚法测定多糖含量[7],蛋白质含量采用考马斯亮蓝法测定[8],糖醛酸含量硫酸采用咔唑比色法测定[9],硫酸基含量采用明胶—氯化钡法测定[10],硒含量采用原子荧光法测定[11],多酚含量采用福林酚法测定[12]。
1.3.4 抗氧化活性测定
1.3.4.1 对DPPH·的清除能力[13]
配制不同浓度的多糖水溶液,同时配置浓度为0.125 mmol/L DPPH甲醇溶液。取0.5 mL多糖样液和1 mL DPPH溶液于试管中,充分振摇后,暗处室温反应30 min,然后在517 nm处测定各处理的吸光值。对照为0.5 mL样液和1 mL甲醇混合液的吸光值,空白为0.5 mL DPPH溶液和1 mL甲醇混合液的测定值,无水甲醇调零。按照下式计算各样品溶液对DPPH自由基的清除率。

式中:A为样液与DPPH混合液的吸光值;Ab为样液与甲醇混合液的吸光值;A0为DPPH与甲醇混合液的吸光值。
1.3.4.2 羟自由基的清除能力[14]
取样品溶液2 mL,然后依次加入2 mL浓度为6 mmol/L的FeSO4溶液,再加入6 mmol/L H2O2溶液2 mL,充分混匀后室温静置10 min,接着加入2 mL新配制的6 mmoL/L水杨酸溶液并混匀,在37℃下放置30 min,最后在510 nm波长处测其吸光度值。同时进行空白对照(Ac)和样品对照(Aj)处理,按下式计算各测定样品溶液对羟自由基(·OH)的清除率。
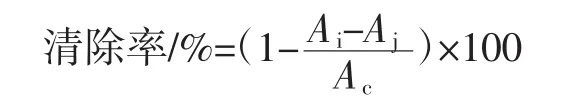
式中:Ai为样品溶液加水杨酸溶液的吸光度值;Aj为样品溶液与空白溶剂混合后的吸光值;Ac为水杨酸溶液与空白溶剂混合液的吸光值。
1.3.4.3 对ABTS+自由基的清除能力[15-16]
用2.45 mmol/L过硫酸钾配制7 mmol/L ABTS溶液,配好的溶液在室温避光放置16 h,然后将其用pH7.2的磷酸盐缓冲液稀释,使其稀释液在734 nm下吸光度值为0.70±0.02,取0.3 mL样品溶液,再加入3.7 mL稀释后的ABTS溶液,充分混合均匀后,室温下避光放置20 min,734 nm处测定各样品的吸光度值。按下式计算各待测样品对ABTS+自由基的清除率。

式中:Ai为样品溶液的测定值;A0为蒸馏水代替样品溶液后的测定值。
1.3.4.4 超氧阴离子自由基清除能力的测定[17]
取不同浓度的多糖溶液0.1 mL于试管中,以蒸馏水代替样品溶液作空白,然后在各试管中分别加入0.1 mol/L Tris-HCl缓冲溶液(pH 8.2)2.8 mL,充分混合混匀后在25℃下静置保温10 min,再加入3 mmol/L 25℃预热的邻苯三酚溶液0.1 mL,迅速混匀后在波长325 nm处测定各试管的吸光度值,每隔30秒读取1次,5 min后结束,按下式计算多糖溶液对超氧阴离子自由基的清除率。

式中:V0为空白管的自氧化速率(ΔA/min);VI为加入样品的自氧化速率(ΔA/min)。
1.3.4.5 还原能力的测定[18]
取配制好的不同浓度的多糖溶液各1 mL,加入pH 6.6,0.2 mol/L磷酸缓冲液2.5 mL,再加入2.5 mL 1g/100mL的K3Fe(CN)6溶液,混合均匀后在50℃水浴中保温20 min,然后冷水速冷,加入10 g/100 mL的三氯乙酸2.5 mL并混匀,3 000 r/min,离心10 min,取上清液1.5 mL,加入新配的0.1 g/100 mL FeCl3溶液0.2 mL,加入1 mL蒸馏水并混匀,蒸馏水调零,于700 nm处测定各样品的吸光度。
2 结果与分析
2.1 硒多糖纯化组分成分分析
按照1.3.1中的方法对富硒平菇中的多糖进行提取,采取1.3.2中的方法进行分离纯化,得到3个组分Se-POP-1,Se-POP-2,Se-POP-3,原粗多糖及各分离组分的总糖、总蛋白、糠醛酸、硫酸基、硒以及多酚的测定结果见表1。
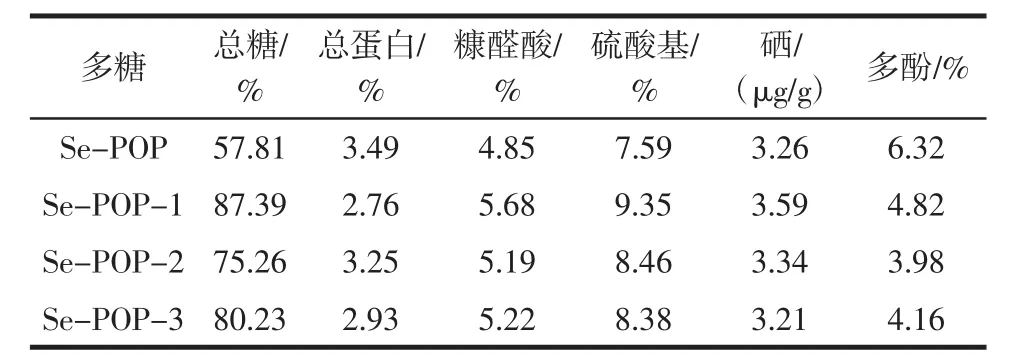
表1 富硒平菇多糖纯化组分组成Table 1 Chemical compositions of purified polysaccharide from P.ostreatus
经Sephadex G-100凝胶层析纯化冻干后的多糖产物Se-POP-1和Se-POP-2呈纯白色海绵状,易溶于水,水溶液基本无色透明,Se-POP-3呈带有微黄色的疏松絮状,易溶于水,水溶液呈透明浅黄色。由表1分析可知,纯化组分的总糖含量都较粗多糖有所提高,其中,Se-POP-1的总糖含量最高,达87.39%。3种分离组分仍有微量蛋白质检出,可能是含有结合态糖蛋白,但其蛋白含量都较粗多糖降低。糖醛酸和硫酸基含量高于粗多糖,Se-POP-1中的含量高于Se-POP-2和Se-POP-3。3种组分中硒含量与粗多糖相比变化不大,而多酚含量较粗多糖降低,Se-POP-1中略高于Se-POP-2和Se-POP-3。
2.2 DPPH自由基清除率
DPPH的醇溶液呈深紫色并在517 nm处有一强吸收,当抗氧化物质存在时,DPPH自由基在接受抗氧化剂提供的电子或氢时被还原而使DPPH吸收逐渐降低,颜色变浅,褪色程度与其接受的电子数量成定量关系,从而可以反映抗氧化剂清除DPPH自由基的能力,其已被广泛应用于评价各种抗氧化剂的自由基清除能力。不同浓度硒多糖组分对DPPH自由基清除率见图1。
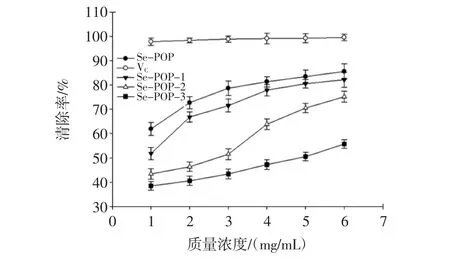
图1 不同浓度硒多糖组分对DPPH自由基清除率Fig.1 Scavenging rate for DPPH radical of Se-POP components with different concentration
从图1可知,不同浓度的富硒平菇多糖组分对DPPH自由基的清除率都随着浓度的增加而增加,在相同浓度下清除率大小顺序为Se-POP>Se-POP-1>Se-POP-2>Se-POP-3,在6 mg/mL浓度时清除率分别为85.58%、82.16%、75.16%和55.73%,但都低于同浓度下VC的清除率99.56%,粗多糖清除率较高的原因可能是其中含有较多的多酚物质或其他的抗氧化成分如有机酸、微量元素及肽,与文献[17]报道的结果一致,Se-POP-1组分清除率较高的原因与其中分子量大小及单糖组成有关,也可能与较高的含硒量有关。
2.3 羟自由基清除率
羟自由基是体内经常存在的自由基,其可以穿过细胞膜与生物大分子物质中的多糖、蛋白质、核酸、脂肪反应,造成机体损害和细胞的死亡,因而羟自由基被认为是对机体危害最大的自由基之一,因而评价抗氧化物质对羟自由基的清除率意义重大。不同浓度硒多糖组分对羟自由基清除率见图2。

图2 不同浓度硒多糖组分对羟自由基清除率Fig.2 Scavenging rate for hydroxyl free radical of Se-POP components with different concentration
从图2可知,不同浓度的富硒平菇多糖组分对羟自由基的清除率都随着浓度的增加而增加,在相同浓度下清除率大小顺序为 VC>Se-POP>Se-POP-1>Se-POP-2>Se-POP-3,粗多糖及3种分离组分清除率分别从1 mg/mL时的63.35%、46.37%、41.42%、35.78%上升到6 mg/mL时的85.21%、76.16%、71.43%、56.16%,相同浓度下粗多糖Se-POP清除率高于其他分离成分,Se-POP-1高于其它组分。
2.4 ABTS+自由基清除率
ABTS+自由基属于水溶性阳离子自由基,也被广泛应用于评价各种抗氧化剂清除自由基的能力。不同浓度硒多糖组分对ABTS+自由基清除率见图3。
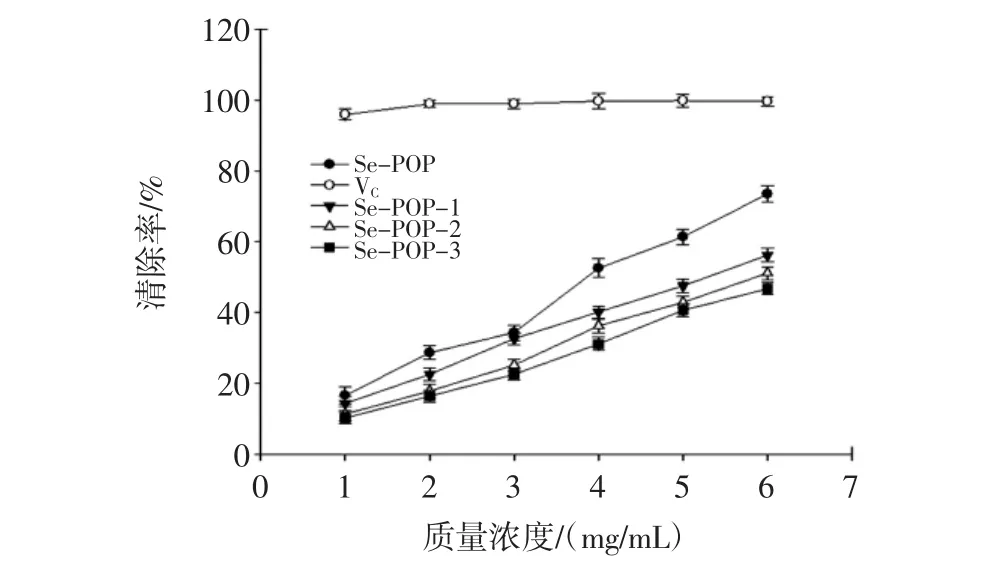
图3 不同浓度硒多糖组分对ABTS+自由基清除率Fig.3 Scavenging rate for ABTS+radical of Se-POP components with different concentration
从图3可知,不同浓度的富硒平菇多糖组分对ABTS+自由基的清除率都随着浓度的增加而呈线性上升的趋势,浓度低于3 mg/mL时几种多糖组分对ABTS+自由基的清除率差异不大,当浓度大于3 mg/mL时粗多糖的清除率显著高于其它几种组分(P<0.05),Se-POP-1的清除率又高于Se-POP-2和Se-POP-3,但差异不显著(P>0.05)。同浓度下VC的清除率仍然最高。
2.5 超氧阴离子自由基清除率
超氧阴离子自由基是由多种生物反应和光化学反应产生的一种相对较弱的氧化剂[19],超氧阴离子自由基不会直接诱导生物体体系的脂类产生氧化,但是其会分解形成更强的活性氧物质,如单线态氧和·OH,引起脂质过氧化。而且O2·-会在金属离子的作用下发生Fenton反应,生成具有高活性的·OH,从而间接的引发脂质过氧化[20-21],因此常用对O2·-的清除能力来评价天然产物的抗氧化活性。不同浓度硒多糖组分对超氧阴离子自由基清除率见图4。

图4 不同浓度硒多糖组分对超氧阴离子自由基清除率Fig.4 Scavenging rate for Superoxide anion radical of Se-POP components with different concentration
从图4可知,不同浓度的富硒平菇多糖组分对超氧阴离子自由基的清除率都随着浓度的增加而增加,在相同浓度下粗多糖清除率高于其他分离成分,在浓度为6 mg/mL时清除率都达到最大值,VC的清除率在2 mg/mL时达到最大值99.56%。文献报道结合硒的多糖对超氧阴离子自由基的清除率活性较强,硒多糖中存在的硒酸酯是促进抗氧化效果的主要因子,可能的原理是此基团改变了硒多糖中的三维结构同时增加了羟基的数量,也可能与硒本身具有的抗氧化性有关[22]。
2.6 还原力
物质通过给自由基提供电子后使自由基变为稳定的分子进而发挥抗氧化作用,还原力是综合评价抗氧化物质提供电子能力的重要指标之一。大量研究证明还原力与抗氧化活性之间存在正相关,一般还原力即OD700值越大,其抗氧化效果越强,因而通过还原力的数值可以综合评价一种物质的抗氧化效果强弱。不同浓度硒多糖组分的还原力见图5。
从图5可知,不同浓度的富硒平菇多糖组分的还原力都随着浓度的增加而缓慢上升,在相同浓度下粗多糖的还原力值仍然最大,但低于VC的还原力值。大小顺序为 VC>Se-POP>Se-POP-1>Se-POP-2>Se-POP-3,在 6 mg/mL 浓度时 OD700值分别为 2.59、0.772、0.635、0.455和0.367。

图5 不同浓度硒多糖组分的还原力Fig.5 Reduce power of Se-POP components with different concentration
3 结论
从富硒平菇中提取得到的硒多糖,经分离纯化后得到 3 个组分 Se-POP-1、Se-POP-2、Se-POP-3,不同的硒多糖组分对DPPH自由基、ABTS+自由基、羟自由基和超氧阴离子自由基的清除率都随着浓度的增加而增大,但都低于同浓度下VC的清除率,粗多糖的清除率高于各分离组分,3种分离组分对自由基清除率的大小顺序为:Se-POP-1> Se-POP-2> Se-POP-3,这与3种组分的分子量大小、单糖组成及糖链的结构不同有关,同时与其不同的硒、多酚含量也有关。
[1]李华为,赵素云,铁梅.富硒金针菇对羟自由基的清除作用[J].食品科学,2010,31(17):18-21
[2]Turło J,Gutkowska B,Herold F.Effect of selenium enrichment on antioxidant activities and chemical composition of Lentinula edodes(Berk.)Pegl.mycelialextracts[J].FoodandChemicalToxicology,2010,48:1085-1091
[3]Jie Yu,PengJu Cui,WeiLing Zeng,et al.Protective effect of selenium-polysaccharides from the mycelia of Coprinus comatus on alloxan-induced oxidative stress in mice[J].Food Chemistry,2009,117:42-47
[4]Yuanfeng Wang,Yongfu Li,Yangyang Liu,et al.Extraction,characterization and antioxidant activities of Se-enriched tea polysaccharides[J].International Journal of Biological Macromolecules,2015,77:76-84
[5]Qian Li,Wei Wang,Yun Zhu,et al.Structural elucidation and antioxidant activity a novel Se-polysaccharide from Se-enriched Grifola frondosa[J].Carbohydrate Polymers,2017,161:42-45
[6]ZhenYuan Zhu,Fei Liu,Hui Gao,et al.Synthesis,characterization and antioxidant activity of selenium polysaccharide from Cordyceps militaris[J].International Journal of Biological Macromolecules,2016,93:1090-1099
[7]Dubois M,Gilles KA,Hamilton JK,et al.Colorimetricmethod for determination of sugars and related substances[J].Analytical Chemistry,1956,28:3509-356
[8]Barbosa H,Slater NKH,Marcos JC.Protein quantification in the presence of poly (ethylene glycol)and dextran using the Bradford method[J].Analytical Chemistry,2009,395:1089-111
[9]Xie G,Schepetkin IA,Siemsen DW,et al.Fractionation and characterization of biologically-active polysaccharides from Artemisia tripartite[J].Phytochemistry,2008,69:1359-1371
[10]Lloyd A G,Dodgson KS.II.Monosaccharide sulphates[J].Biochimica et Biophysica Acta,1961,46:1169-120
[11]Navarro-Alarcon M,Ruiz-Ojeda FJ,Rosa M Herrera B,et al.Antioxidant activity of melatonin in diabetes in relation to the regulation and levels of plasma Cu,Zn,Fe,Mn,and Se in Zucker diabetic fatty rats[J].Nutrition,2013,29:785-789
[12]王振宇,刘春平.大孔树脂AB-8对苹果多酚的分离纯化[J].食品研究与开发,2009,30(4):219-24
[13]Jun Liu,Jianguang Luo,Hong Ye,et al.In vitro and in vivo antioxidant activity of exopolysaccharides from endophytic bacterium Paenibacillus polymyxa EJS-3[J].Carbohydrate Polymers,2010,82:1278-1283
[14]Fei Yuan,Rongmin Yu,Yin Yin,et al.Structure characterization and antioxidant activity of a novel polysaccharide isolated from Ginkgo biloba[J].International Journal of Biological Macromolecules,2010,46:436-439
[15]Sun Yongxu,Liu Jicheng.Structural characterization of a water-solublepolysaccharide from the roots of Codonopsis pilosula and its immunityactivity[J].InternationalJournalofBiologicalMacromolecules,2009,43:279-282
[16]Chao Li,Qiang Huang,Xiong Fu,et al.Characterization,antioxidant and immunomodulatory activities of polysaccharides from Prunella vulgaris Linn[J].International Journal of Biological Macromolecules,2015,75:298-305
[17]Ligang Song,Aimin Mei,Yajun Hu,et al.Response surface optimized extraction of carbohydrate compound from Folium Ginkgo and its bioactivity[J].Carbohydrate Polymers,2012,88:112-117
[18]Oyaizu M.Studies on products of browning reaction-antioxidative activities of products of browning reaction prepared from glucosamine[J].The Japanese Journal of Nutrition,1986,44:307-315
[19]Banerjee A,Dasgupta N,De B.In vitro study of antioxidant activity of Syzygium cumini fruit[J].Food Chemistry,2005,90(4):727-733
[20]Singh N,Rajini PS.Free radical scavenging activity of an aqueous extract of potato peel[J].Food Chemistry,2004,85(4):611-616
[21]Halliwell B.Reactive oxygen species in living systems:source,biochemistry,and role in human disease[J].The American Journal of Medicine,1991,91(3):14-22
[22]Dongfeng Wei,Tong Chen,Mingfei Yan,et al.Synthesis,characterization,antioxidant activity and neuroprotective effects of selenium polysaccharide from Radix hedysari[J].Carbohydrate Polymers,2015,125:161-168

