表皮生长因子受体抑制剂致相关皮肤瘙痒的机制研究
彭艳梅,刘 青,邓 博,崔慧娟*,段 桦,邱钰芹(.北京中医药大学,北京 0009; .中日友好医院,北京 0009)
表皮生长因子受体(epidermal growth factor receptor,EGFR)的过表达与许多恶性肿瘤的发生和发展有关,使其成为重要的抗肿瘤治疗靶点。目前,表皮生长因子受体抑制剂(epidermal growth factor receptor inhibitors,EGFRIs)已广泛用于肺癌、胰腺癌、乳腺癌、头颈部肿瘤和肠癌的一线至三线治疗。这类药物皮肤不良反应的发生率为36%(粘膜炎)~ 80%(痤疮样皮疹)[1],导致了60%的患者减量,32%的患者停药,因而影响靶向药的疗效[2]。其中,瘙痒总发生率约为50%,不同药物发生情况有一定差别,厄洛替尼总发生率为13%,3/4级发生率< 1%[3],西妥昔单抗总发生率为11%,3/4级发生率< 1%[4],帕尼单抗总发生率为57%,3/4级发生率为2%[5]。皮肤瘙痒常常伴随皮疹发生,也可因皮肤干燥而引起。尽管瘙痒极少导致靶向药减量或停药,但是它严重影响患者的生活质量[1]。一项应用靶向药前6周的生活质量研究显示,干燥和瘙痒是影响患者生活质量主要的因素[6]。EGFRIs相关皮肤瘙痒使患者心烦意乱,夜间的瘙痒会打乱睡眠周期,影响日间正常生活,常见的皮肤表现是抓痕后的水肿、丘疹、苔藓样硬化、渗出或结硬皮。目前对于瘙痒性疾病的发生认为存在中枢和外周的双重机制调控,即瘙痒介质通过刺激C类神经纤维或通过与皮肤感觉神经纤维上的受体结合而介导瘙痒。P物质(substance P,SP)是引起皮肤瘙痒的一个重要神经介质,在靶向药引起的皮肤瘙痒中起着关键作用。目前对于EGFRIs相关皮肤瘙痒的机制研究尚缺乏,本研究以此为基础,旨在通过EGFRIs类药物厄洛替尼与P物质致痒小鼠的对比性研究,对皮肤瘙痒的机制进行探索。
1 材料和方法
1.1 实验动物
SPF级雄性ICR小鼠30只,5~6周龄,26~28 g,购于北京维通利华实验动物公司[SCXK (京) 2012-0001]。饲养环境为中日友好医院SPF级动物房[SYXK (京) 2016-0043]。无菌手术在中日友好医院SPF级动物房内实验操作室[SYXK (京) 2016-0043]进行。并按实验动物使用的3R原则给予人道主义关怀。
1.2 主要试剂与仪器
厄洛替尼为上海罗氏公司产品;SP购于美国MedChemExpress公司(1 mg/支,纯度98.07%,批号HY-P0201);NK-1R抗体购于北京博奥森生物技术有限公司;一氧化氮(NO)比色法试剂盒购于南京建成生物工程研究所;IL-31、IL-33 ELISA检测试剂盒购于武汉优尔生科技股份有限公司;组胺、白三烯B4、SP ELISA检测试剂盒购于上海蓝基生物科技有限公司。采用多道微量加液器、(450±10) nm滤光片的酶标仪进行检测。
1.3 实验方法
1.3.1 厄洛替尼与P物质致痒小鼠
将30只雄性ICR小鼠按体重排序,根据随机数字表随机分成5组,每组6只,分别编号SP、A、B、C、D,每只单笼饲养,分别给药:SP组药物浓度为2.7 mg/mL,注射于小鼠颈背部,每只50 μL,注射前一天剔除颈背部皮肤,为注射做准备;A组予去离子水灌胃,每天一次;B组予厄洛替尼20 mg/kg灌胃,每天一次;C组予厄洛替尼100 mg/kg灌胃,每天一次;D组予厄洛替尼150 mg/kg灌胃,每天一次。
1.3.2 行为学观察
小鼠瘙痒行为学表现为搔抓。小鼠搔抓行为观察按照Kuraishi等的方法[7]。实验前,小鼠分别放入观察盒适应性活动,实验开始后,保持室内安静无人,动物房监控系统对小鼠进行监控录像,实验结束后,回放录像进行搔抓行为观察,由2名不参加实验的工作人员记数。一次搔抓是指小鼠后爪对颈背部注射处及其邻近部位的一次或连续多次搔抓,后爪落地或被舔吃时代表本次搔抓结束;前肢的活动以及后爪对面、耳、腹部等处的搔抓则不做统计。
厄洛替尼致痒小鼠[8]:厄洛替尼连续灌胃10 d,首次给药前1 d剔除背部毛发,面积约1 cm2。若小鼠在给药过程中出现搔抓,说明出现厄洛替尼所致瘙痒,每天对监测录像进行回放,记录小鼠每日的搔抓次数及持续时间。SP致痒小鼠[9]:实验前1 d剔除颈背部毛发,注射药物前将小鼠放人玻璃笼内适应环境1 h。对照组、实验组分别在颈背部皮内注射100 nmol SP和等量的生理盐水,于小鼠颈后部中央皮内注射后立即放回。在无人条件下用数码摄像机拍摄小鼠搔抓行为1 h,回放录像观察小鼠后爪对注射部位的搔抓次数。
1.3.3 皮肤取材及病理切片
干预后于小鼠颈背部进行皮肤活检,标本大小为5 mm × 5 mm。进行皮肤石蜡切片,并进行苏木精-伊红(hematoxylin-eosin,HE)染色,显微镜下观察皮肤组织的表现。包括表皮、毛囊的改变及炎性细胞聚集情况。
1.3.4 免疫组织化学检测
皮肤切片常规脱蜡至水,3%双氧水甲醇液封闭阻断内源性过氧化物酶,微波炉热修复抗原,10%正常山羊血清封闭非特异性背景。倾去血清加入稀释(1∶500)的第一抗体工作液(为兔抗鼠NK-1R抗体),4℃过夜孵化,PBS冲洗后滴加第二抗体(羊抗兔IgG)及SABC,最后滴加新鲜配制的AEC显色液,光镜观察下显色后冲洗,甘油明胶封片,光镜下观察。显色阳性为胞内呈棕黄色颗粒状沉积。
1.3.5 血清标本采集
干预10 d后留取心尖血1 mL,注入试管中,静置5~10 min,离心(2000 r/min,10 min),吸取上层血清注入EP试管中,加盖塞紧,-80℃保存。
1.3.6 比色法检测
取出试剂盒分别加0.1 mL双蒸水、100 μmol/L标准应用液、样本于空白管、标准管和测定管中,加入试剂一、试剂二各0.2 mL,混匀,37℃准确水浴60 min后,分别加入试剂三、试剂四0.2 mL、0.1 mL,充分旋涡混匀30 s,室温静置10 min,3500~4000 r/min,离心10 min,取上清显色。
采用测定波长为550 nm,应用可见光分光光度计(上海菁华科技有限公司)进行检测血清NO含量。计算公式:NO含量=(测定OD值-对照OD值)/(标准OD值-空白OD值)×标准品浓度×稀释倍数。
1.3.7 酶联免疫吸附剂测定(ELISA)
取出试剂盒,于室温放置30 min。取出酶标板,按照标准品的次序分别加入100 μL的标准品溶液于空白微孔中。在各孔中加入50 μL的酶标记溶液。将酶标板用封口胶密封后,37℃孵育反应1 h。酶标板洗涤后用吸水纸彻底拍干。各孔加入显色剂A 50 μL。各孔加入显色剂B 50 μL。室温下避光反应10 min。各孔加入50 μL终止液,终止反应。酶标仪在450 nm波长测量各孔的光密度。
1.4 统计学方法

2 结果
2.1 两组均表现瘙痒的搔抓行为
应用厄洛替尼致痒小鼠与SP致痒的小鼠模型进行对照,研究发现二组均表现为搔抓行为。厄洛替尼所致瘙痒表现在给药2~5 d一过性瘙痒,每次搔抓3~4次,持续1~2 min,第4天达到高峰,第5天搔抓逐渐缓解;P物质所致瘙痒表现在给药后1 h,以10 min为时间段,第一个10 min内搔抓最明显,平均4.7 min开始出现搔抓,8 min达到高峰,后搔抓逐渐减少,至1 h基本完全缓解(如图1所示)。

图1 注射SP后1 h内搔抓情况Fig.1 Scratching behavior at one hour after substance P stimulation
2.2 厄洛替尼和P物质致痒皮肤病理
分别取颈、肩背、腰部皮肤组织,制作石蜡切片。HE染色后于光学显微镜下观察显示,对照组表现出正常的表皮和毛囊状态,厄洛替尼组及SP组均表现为表皮和毛囊周围中性粒细胞、淋巴细胞等炎性细胞的聚集,部分表现为表皮脱落、不全(如图2所示)。
2.3 厄洛替尼和SP上调皮肤NK-1受体的表达
免疫组化显示对照组小鼠皮肤,NK-1R表达为阴性;SP致痒小鼠皮肤,NK-1R表达阳性,主要分布在表皮、毛囊区域,棕黄色免疫复合物主要沉积在胞浆内;厄洛替尼瘙痒模型小鼠,皮肤NK-1R表达阳性,其分布情况与P物质致痒小鼠基本一致,以表皮和毛囊的分布最多(如图3所示)。
2.4 厄洛替尼和SP均能调节血清中SP/NK-1受体下游相关因子的浓度
通过检测SP组、不同剂量厄洛替尼组(其中低剂量组20 mg/kg,中剂量组100 mg/kg,高剂量组150 mg/kg)和空白对照组中的血清瘙痒相关神经传递介质。与对照组相比,厄洛替尼组:白三烯B4、NO无明显差异(P> 0.05);IL-31、IL-33的血清浓度呈剂量依耐性,低剂量组浓度减少,中、高剂量组浓度增加(P< 0.05)。P物质在低剂量组的血清浓度增加(P< 0.05);组胺在低剂量组的血清浓度减少(P< 0.05),中、高剂量组与对照组相比差异有显著性。P物质组:NO无明显差异(P> 0.05);IL-31、IL-33的血清浓度减少(P< 0.05);白三烯B4的血清浓度增加(P< 0.05);组胺的血清浓度减少(P< 0.05)(如表1所示)。

注:A:对照组;B:厄洛替尼组;C:P物质组。图2 各组小鼠皮肤组织病理切片变化(HE染色,× 200)Note.A: Control group; B: Erlotinib group; C: Substance P group.Fig.2 Pathological changes in skin tissue of mice from the control group, erlotinib group, and substance P group. HE staining

注:A:对照组;B:厄洛替尼组;C:P物质组。图3 各组小鼠皮肤NK-1受体免疫组化变化(免疫组化染色,× 200)Note.A: Control group; B: Erlotinib group; C: Substance P group.Fig.3 Immunohistochemical changes in neurokinin 1 receptor in skin tissue of mice from the control group, erlotinib group, and substance P group. Immunohistochemical staining
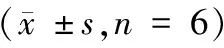
表1 各组白介素-31、白介素-33、组胺、白三烯B4、一氧化氮、P物质浓度Tab.1 Concentration of interleukin-31, interleukin-33, histamine, leukotriene B4, nitric oxide, and substance P in each group
注:与对照组相比,ΔP< 0.05;与P物质组相比,*P< 0.05。
Note.Compared with the control group,ΔP< 0.05. Compared with the substance P group,*P< 0.05.
3 讨论
EGFRIs致皮肤不良反应的机制已进行了大量的研究。Saveria等[10]阐明了应用EGFRIs后发生皮肤毒性的机制,应用EGFRIs皮肤细胞EGFR磷酸化受阻致下游信号通路异常,发生在角质细胞的炎症反应,最终出现了皮肤不良反应,皮肤瘙痒是其中典型的表现之一。本课题组前期的动物实验研究,已建立厄洛替尼引起的皮疹小鼠模型,验证了皮肤病理过程是一种炎症反应[11]。本研究中,致痒小鼠皮肤HE染色显示表皮及毛囊周围炎性细胞聚集,提示瘙痒可能也是在炎症反应的基础上发生的。
SP是引起皮肤瘙痒的一个重要神经介质,SP通过与神经激肽受体结合发挥作用,其中SP与NK-1R的亲和力最大,SP激活后的瘙痒机制主要是NK-1R介导的[12]。Severini等[13]进一步阐释了皮肤瘙痒发生的机理可能是厄洛替尼诱导角质细胞干细胞因子的分泌,随后导致肥大细胞累积,肥大细胞活化后释放介质(如组胺、白三烯B4、NO等)引起瘙痒,SP通过与NK-1R结合后是活化肥大细胞的主要介质。Gangemi等[14]研究EGFRIs相关皮疹瘙痒的血清标志物时发现,EGFRIs相关皮疹患者瘙痒的程度与IL-33、IL-31血浆水平呈正相关,提示EGFRIs可诱导IL-33、IL-31而诱发瘙痒,其致痒机制可能也有SP/NK-1R有关[15]。因此,阿瑞匹坦能通过阻断NK-1R介导的肥大细胞脱粒而发挥止痒作用。Duval等[16]首次报道了应用阿瑞匹坦治疗皮肤瘙痒的3例有效病例。2013年Tonini[17]通过单中心、前瞻性研究,探索性地评估了阿瑞匹坦治疗EGFRIs类靶向药引起难治性皮肤瘙痒的效果,疗效显著。阿瑞匹坦是一种口服的NK-1R抑制剂,通过阻断NK-1R而起到止痒作用,提示EGFRIs相关皮肤瘙痒可能是由于SP/NK-1受体结合而诱导的。本研究正是基于这个假说进行的,以SP致痒小鼠为阳性对照[18],观察厄洛替尼导致皮肤瘙痒后的行为学表现,通过检测SP/NK-1R信号通路可能的下游因子的表达情况,以此来初步验证假说。
本实验通过厄洛替尼和SP激发小鼠瘙痒反应,两者均出现了瘙痒行为,而二者表现有差异。厄洛替尼所致瘙痒表现为间断性发作的瘙痒行为,发作的频次和程度差别不大,此瘙痒模型是首次探索,有待进一步验证。SP所致瘙痒发生在注射后8 min左右达高峰,后搔抓逐渐减少,与文献报道一致[11]。二者的搔抓行为相似,考虑均为瘙痒相关的反应。但二者的表现形式有差别,可能与给药途径有关,SP致痒小鼠为局部皮内注射给药,诱发皮肤瘙痒迅速;EGFRIs致痒小鼠为灌胃给药,皮肤瘙痒与药物应用的累积量有关,这与患者的表现一致。
皮肤NK-1R免疫组化显示,厄洛替尼组和SP组小鼠表皮中NK-1R相比对照组均表达上调,免疫复合物沉积主要沉积在表皮和毛囊内,推测NK-1R的表达部位主要在表皮和毛囊,与皮肤反应病变的位置一致。提示NK-1R参与了二者的瘙抓行为,可能致痒的重要因素。致痒过程一方面可能是诱导一些激动剂的释放,激发感觉神经元的活动引起瘙痒;另一方面可能是SP激活传导痒觉的无髓C纤维上NK-1受体直接引起皮肤瘙痒[19-20]。
实验用ELISA法检测小鼠血清SP/NK-1R可能的下游瘙痒介质,结果显示厄洛替尼组各因子的释放,随着给药剂量的增加而增多,NO差异无显著性。说明瘙痒可能与SP的表达以及下游的信号分子IL-31、IL-33、组胺、白三烯B4有关,但厄洛替尼组仅低浓度组与SP组在IL-31、IL-33、组胺、SP的水平具有一致性,提示可能二者的致痒过程中,下游信号分子相似。说明SP/NK-1R信号通路可能对厄洛替尼诱发的瘙痒行为有调控作用,但与靶向药的剂量有关。此外,其他信号通路可能也对这些因子的表达具有调控作用。基于此,笔者推测EGFRIs相关皮肤瘙痒的机制可能有以下方面:①SP通过激活皮肤细胞上的NK-1R释放激动剂,例如组胺等,激发感觉神经元的活动引起瘙痒;②IL-33、IL-31也可能对此通路有调控作用;③SP直接激活传导痒觉神经纤维上NK-1R引起皮肤瘙痒[21]。
根据前期研究及本实验结果,EGFRIs相关皮肤瘙痒可能的机制有SP激活角质形成细胞、肥大细胞等效应细胞表面的NK-1R,诱导瘙痒介质组胺、IL-31、IL-33等的合成和释放,这些瘙痒介质作用于神经纤维而导致了瘙痒的发生和发展。鉴于角质形成细胞是表皮的主要成分,也是EGFRIs相关皮肤反应的主要效应细胞,推测角质形成细胞可能也是SP作用的主要靶细胞。然而,该实验存在一定的局限性,一方面SP/NK-1R下游信号因子有待于进一步挖掘,另一方面不能排除各因子的表达与时间的相关性。本实验为探索性研究,有待于更深入的研究验证假说。
参考文献:
[1] Lacouture ME, Anadkat MJ, Bensadoun RJ, et al. Clinical practice guidelines for the prevention and treatment of EGFR inhibitor-associated dermatologic toxicities [J]. Support Care Cancer, 2011, 19(8): 1079-1095.
[2] Boone SL, Rademaker A, Liu D, et al. Impact and management of skin toxicity associated with anti-epidermal growth factor receptor therapy: survey results [J]. Oncology, 2007, 72(3-4): 152-159.
[3] Tarceva Package Insert. (2005) OSI Pharmaceuticals, Inc. (Melville, NY). http://www.gene.com/gene/products/information/pdf/tarceva-prescribing.pdf. Accessed 8 December 2017.
[4] Erbitux Package Insert. (2006) ImClone Systems Incorporated and Bristol-Myers Squibb Company (Branchburg and Princeton, NJ). http://erbitux.com/erb/pdf/PI.pdf. Accessed 8 December 2017.
[5] Vectibix Package Insert. Amgen, Inc. Thousand Oaks, CA. U.S. Food and Drug Administration Website. https://www.accessdata.fda.gov/drugsatfda_docs/label/2009/125147s080lbl.pdf. Accessed 8 December 2017.
[6] Clabbers JMK, Boers-Doets CB, Gelderblom H, et al. Xerosis and pruritus as major EGFRI-associated adverse events [J]. Support Care Cancer, 2016, 24(2): 513-521.
[7] Kuraishi Y, Nagasawa T, Hayashi K, et al. Scratching behavior induced by pruritogenic but not algesiogenic agents in mice [J]. Eur J Pharmacol, 1995, 275(3): 229-233.
[8] Surguladze D, Deevi D, Claros N, et al. Tumor necrosis factor-α and interleukin-1 antagonists alleviate inflammatory skin changes associated with epidermal growth factor receptor antibody therapy in mice [J]. Cancer Res, 2009, 69(14): 5643-5647.
[9] Akasaka Y, Yoshida T, Tsukahara M, et al. Glycyrrhetinic acid prevents cutaneous scratching behavior in mice elicited by substance P or PAR-2 agonist [J]. Eur J Pharmacol, 2011, 670(1): 175-179.
[10] Saveria P, Daniela L, Giampiero G. Epidermal growth factor receptor signalling in keratinocyte biology: implications for skin toxicity of tyrosine kinase inhibitors [J]. Arch Toxicol, 2014, 88(6): 1189-1203.
[11] 宋亚中, 徐央波, 邓博, 等. 厄洛替尼引起皮肤不良反应的小鼠模型建立 [J]. 中国比较医学杂志, 2017, 27(1): 17-21.
[12] Munoz M, Covenas R. Involvement of substance P and the NK-1 receptor in human pathology [J]. Amino Acids, 2014, 46(7): 1727-1750.
[13] Severini C, Improta G, Falconieri-Erspamer G, et al. The tachykinin peptide family [J]. Pharmacol Rev, 2002, 54(2): 285-322.
[14] Gangemi S, Franchina T, Minciullo PL, et al. IL-33/IL-31 axis: a new pathological mechanism for EGFR tyrosine kinase inhibitors-associated skin toxicity? [J]. J Cell Biochem, 2013, 114(12): 2673-2676.
[15] Theoharis CT, Anastasia IP, Alexandra T, et al. Targeting IL-33 in autoimmunity and inflammation [J]. J Pharmacol Exp Ther, 2015, 354(1): 24-31.
[16] Duval A, Dubertret L. Aprepitant as an antipruritic agent? [J]. N Engl J Med, 2009, 361(14): 1415-1416.
[17] Tonini G. Aprepitant for management of severe pruritus related to biological cancer treatments: a pilot study [J]. Lancet Oncol, 2012, 13(10): 1020-1024.
[18] 沈非沉, 王晖, 薛漫清. 瘙痒动物模型的研究进展 [J]. 中国比较医学杂志, 2007, 17(3): 182-186.
[19] Andoh T, Nagasawa T, Satoh M, et al. Substance P induction of itch-associated response mediated by cutaneous NKl tachykinin receptors in mice [J]. J Pharmacol Exp Ther, 1998, 286(3): 1140-1145.
[20] Carstens E, Akiyama T. Central mechanisms of itch [J]. Curr Probl Dermatol, 2016, 50: 11-17.
[21] Taracanova A, Alevizos M, Karagkouni A, et al. SP and IL-33 together markedly enhance TNF synthesis and secretion from human mast cells mediated by the interaction of their receptors [J]. Proc Natl Acad Sci U S A, 2017, 114(20): E4002-E4009.

