NaCl盐度对A2/O工艺去除废水污染物和系统微生物的影响
张兰河,田 蕊,陈子成,郭静波,贾艳萍
(1. 东北电力大学化学工程学院, 吉林 132012;2. 东北电力大学建筑工程学院, 吉林 132012)
0 引 言
食品加工、皮革制造和海水淡化等行业的快速发展,导致了大量含盐废水产生[1]。这些含盐废水进入城市污水处理厂与生化处理系统的活性污泥接触后,将影响活性污泥系统中的微生物群落组成、结构和功能,活性污泥系统中的微生物群落特性决定了污泥活性,从而导致有机物去除和脱氮效率的变化。因此,考察不同盐度下微生物群落变化对提高污染物去除能力具有重要意义。
目前,许多学者研究了盐度对生物反应器(如序批式生物反应器SBR、好氧生物处理反应器ABR、浸没式固定床生物反应器SFBBR)活性污泥体系微生物群落特征的影响。王淑莹等[2]采用3个平行的SBR处理实际含盐生活污水,考察了NaCl盐度对生物脱氮性能和微生物菌群的影响,结果表明盐度对硝化菌的抑制作用远大于反硝化菌。李哲等[3]利用处理榨菜废水(NaCl盐度为21 g/L)的SBR研究了活性污泥沉降性能恶化的原因,发现是大量短杆状、弧状微生物群滋生附着于活性污泥表面所致。Abou-Elela等[4]发现在不同NaCl盐度(0.5%、1.0%、1.5%、2.0%、3.0%)下的SBR系统中,添加耐盐木糖葡萄球菌有助于污泥在高盐度下维持较高的COD去除率。Cortés-Lorenzo 等[5]研究了 NaCl盐度(3.7、24.1、44.1 g/L)对氨氧化菌群落结构的影响,发现高盐度导致与亚硝化螺旋菌相关的amoA序列消失,出现具有持久氨化作用的新种类微生物。
厌氧/缺氧/好氧工艺(A2/O)具有流程简单和脱氮效果好的优点而广泛应用于污水处理中,通过厌氧、缺氧和好氧不同运行条件的变换达到同时去除有机物和脱氮的目的。含盐废水分别进入厌氧区、缺氧区和好氧区,并与这些区域的微生物发生作用并影响其特性,微生物特性的变化决定了脱氮效果的好坏。A2/O脱氮工艺中常见的微生物群落,如硝化菌为自养菌,具有好氧、代时长、生长慢、对环境条件敏感等特点[6];反硝化菌为异养菌,具有缺氧、代时短、生长快等特点[7-8]。盐类离子与硝化菌和反硝化菌发生作用,直接影响这些微生物的生长代谢和活性[9]。但是,关于不同盐度下A2/O工艺厌氧区、缺氧区和好氧区的微生物群落结构如何变化,以及盐度影响有机物去除和脱氮作用的主要菌群及其分布规律尚不明确。
高通量测序是一种革命性的微生物生态学研究方法,可以对数百万个DNA分子同时进行测序[10]。其中扩增子测序作为新一代测序方法具有读长更长、周期更短的特点,现已广泛应用于微生物研究领域[11]。本研究分别提取 A2/O工艺不同区域的活性污泥总 DNA,并对其16S rDNA V4区域进行了PCR扩增和扩增产物的高通量测序分析,研究不同盐度下厌氧区、缺氧区和好氧区的微生物群落结构的变化,同时结合有机物去除和脱氮效率的变化,探索含盐废水生物脱氮机理。
1 材料与方法
1.1 试验装置
活性污泥取自吉林市污水处理厂,利用A2/O反应器(图1)进行污泥驯化。A2/O反应器采用有机玻璃制成,有效容积为48 L,其中厌氧区、缺氧区有效容积均为12 L,好氧区有效容积为24 L,采用折流方式运行,竖流式二沉池容积为 5 L。污泥回流比为 50%,硝化液回流比为100%;污泥驯化达到稳定后,MLSS为3 000-3 500 mg/L,HRT为8 h,温度为20~23 ℃。实验用水采用模拟城市污水,主要成分为:无水乙酸钠(1.2 g/L)、氯化钠(0~40 g/L)、氯化铵(0.25 g/L)、磷酸二氢钾(0.05 g/L)、硫酸镁(0.05 g/L)、氯化钙(0.01 g/L)。以14 d作为一个运行周期,进水NaCl盐度分别为0、10和40 g/L。

图1 A2/O工艺流程示意图Fig.1 Schematic diagram of A2/O technology process
1.2 微生物群落结构测定与分析
1.2.1 样品采集
反应器稳定运行后分析A2/O反应器厌氧区、缺氧区和好氧区微生物群落结构的变化。在盐度分别为 0、10和40 g/L的条件下,分别从厌氧区、缺氧区、好氧区取污泥样品。其中,Y.0、Y.10、Y.40分别代表盐度为 0、10和40 g/L时采集的厌氧区污泥样品;Q.0、Q.10、Q.40分别代表盐度为0、10和40 g/L时采集的缺氧区污泥样品;H.0、H.10、H.40分别代表盐度为0、10和40 g/L时采集的好氧区污泥样品。
1.2.2 样品测定
采用CTAB法提取活性污泥样品中的DNA,利用琼脂糖凝胶电泳检测DNA纯度和浓度。以稀释后的样品基因组DNA作为模板,采用515F-806R对16S rDNA的V4区进行PCR扩增,扩增产物采用Illumina Miseq平台进行测序。所用酶和缓冲液使用New England Biolabs 公司的 Phusion® High-Fidelity PCR Master Mix with GC Buffer;反应条件为98 ℃预变性1 min,然后30个循环(98 ℃变性 10 s,50 ℃退火 30 s,72 ℃延伸 30 s),最后72 ℃延伸5 min。利用New England Biolabs 公司的NEB Next® Ultra™ DNA Library Prep Kit for Illumina试剂盒进行文库构建,再经过Qubit 定量和文库检测合格后,使用HiSeq进行上机测序,分析污泥样品的微生物群落结构。
1.2.3 数据分析
利用 Uparse(V7.0.1001)软件进行聚类分析;利用Qiime(V1.9.1)软件计算 Chao1、ACE、Shannon、Simpson等指数[12]、Unifrac距离,构建样本聚类树。
Chao1指数使用公式(1)计算

式中S1为Chao1指数;Sobs为测序分析得到的物种数;F1为样本中数量为1的数目;F2为样本中数量为2的数目。
ACE指数使用公式(2)、(3)计算:
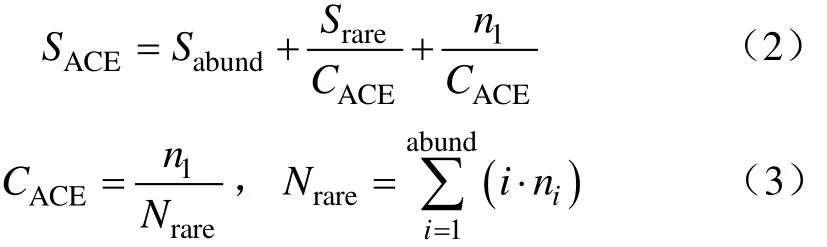
式中SACE为ACE指数;Srare为含有“abund”条序列或少于“abund”条序列的OTU(optical transform unit)数目;ni为含有i条序列的OTU数目;Sabund为多于“abund”条序列的OTU数目;abund默认为10。
Shannon指数使用公式(4)计算

式中H为Shannon指数;Pi为样品中属于第i种的个体的比例,下同。
Simpson指数使用公式(5)计算

式中D为Simposon指数;S为物种数目。
使用R(V2.15.3)软件进行Beta多样性指数组间差异分析。
1.3 水质分析项目和检测方法
采用多参数水质测定仪(连华科技,LH-3BA)测定COD、总氮(TN)和氨氮(NH4+-N)浓度,采用盐酸-紫外分光光度法对硝态氮(NO3--N)进行测定。
2 结果与分析
2.1 盐度对A2/O工艺污染物去除率的影响
不同盐度下A2/O工艺污染物去除率的变化,如图2所示。随着NaCl盐度的增大,厌氧区、缺氧区和好氧区的COD去除率下降。当盐度为0时,厌氧区、缺氧区和好氧区COD去除率分别为52%、80%和56%;当盐度为10 g/L时,各区域COD去除率分别为50%、76%和53%;当盐度为40 g/L时,各区域COD去除率为30%、50%和40%。随着盐度的升高,部分微生物因无法适应盐度环境而消失,导致污泥活性降低,COD去除率下降。
图2b表明盐度对A2/O工艺N去除的影响。随着盐度的增大,出水TN逐渐升高,TN去除率下降。厌氧区和好氧区主要进行NH4+-N的去除,当盐度为0时,厌氧区和好氧区NH4+-N去除率分别为33%和61%;当盐度为10 g/L时,厌氧区和好氧区NH4+-N去除率分别为20%和57%;当盐度为40 g/L时,厌氧区和好氧区NH4+-N去除率分别为11%和39%。缺氧区主要进行NO3--N的去除,随着盐度的增大,出水NO3--N升高。当盐度由0逐渐增大至10和40 g/L时,NO3--N去除率由63%下降至52%和47%。盐度的增大对反硝化和硝化过程产生了抑制,出水NO3--N和NH4+-N均增加。厌氧区NH4+-N的去除主要供微生物细胞合成所需,不能适应盐度变化的微生物死亡使 NH4+-N需求量降低,导致厌氧区NH4+-N去除率下降[13]。同时,不能适应新环境的硝化菌和反硝化菌数量的减少,也导致好氧区和缺氧区N利用率的降低。

图2 盐度对A2/O工艺不同区域COD和N浓度的影响Fig.2 Effect of salinity on COD and N concentration in different regions of A2/O technology process
2.2 盐度对A2/O工艺微生物多样性和差异性的影响
2.2.1 盐度对微生物群落多样性的影响
活性污泥系统中的微生物群落丰富度和多样性越高,污泥系统越稳定,污染物去除率越高[14]。Alpha多样性分析可以反映物种丰富度和群落多样性。其中物种丰富度包括Chao指数与ACE指数,群落多样性指数包括Shannon指数与Simpson指数。A2/O工艺厌氧区、缺氧区和好氧区微生物多样性的变化,如表1所示。与无NaCl的废水相比,加入NaCl后:1)厌氧区Chao指数和ACE指数降低,群落丰富度降低;Shannon指数下降,群落多样性降低;Simpson指数降低,该区域常见物种减少;2)缺氧区Chao指数和ACE指数在10 g/L时略有降低,在40 g/L时升高,群落丰富度增加;Shannon指数下降,群落多样性降低;Simpson指数降低,该区域常见物种减少;3)好氧区Chao指数和ACE指数降低,群落丰富度降低;Shannon指数和Simpson指数在10 g/L时有所升高,在40 g/L时下降,群落多样性降低、该区域常见物种减少。Guo和周贵忠等[15-16]研究发现,随着盐度的不断增加,微生物群落生长受到抑制,导致微生物多样性逐渐降低,这与本研究结果基本一致。

表1 微生物多样性的变化Table 1 Change of microbial diversity
2.2.2 盐度对微生物群落差异性的影响
厌氧区、缺氧区和好氧区微生物群落的差异,如图3所示。Beta多样性是通过比较不同生态系统间的多样性反映单个样品间是否存在显著的群落差异[17-18],应用较多的是主坐标分析(PCoA)和非度量多维尺度分析(NMDS),2点间距离越近,2个样品的微生物群落差异越小。将所有活性污泥样品进行比较发现,中、低盐度(<10 g/L)与高盐度(40 g/L)的微生物群落分别位于左右两侧(图 3),表明低盐度微生物群落与高盐度微生物群落的差异性显著。
根据OTU聚类和微生物丰度对样品进行聚类分析,结果如图3c所示。依据进水NaCl盐度的不同,可分为高盐度微生物群落与低盐度微生物群落,高盐度与低盐度的微生物群落结构差异较大,低盐度的微生物群落产生分支,这与Beta多样性分析结果相一致。图2污染物去除率的变化趋势也与微生物群落的差异性一致,表明盐度对污染物去除和微生物群落结构差异具有显著影响[19]。

图3 A2/O工艺不同区域污泥微生物群落差异Fig.3 Differences of microbial communities in different regions of A2/O process
2.3 盐度对A2/O工艺微生物群落分布的影响
2.3.1 门水平上微生物群落结构
A2/O工艺不同区域活性污泥在门水平上的微生物群落相对丰度,如图 4所示。在所有污泥样品中,变形菌门均为优势菌门,相对丰度最高。Hu等[20]研究也发现,采用A2/O工艺的污水处理厂中变形菌门是最优势菌门。随着进水NaCl盐度的增大(由0升高至40 g/L),微生物多样性降低,厌氧区、缺氧区和好氧区中变形菌门的相对丰度均升高约10%,分别达到58%、49%和54%。绿弯菌门(兼性厌氧菌门)的相对丰度降低,厌氧区相对丰度由 23.4%下降至 9.3%,缺氧区相对丰度由15.7%下降至 14.8%,好氧区相对丰度由 13.3%下降至4.5%;绿弯菌门具有较强的污染物降解能力,其大部分菌属是污泥絮体中的丝状菌,是维持污泥形态的重要菌门之一[21-22]。拟杆菌门相对丰度逐渐降低,厌氧区相对丰度由17.9%下降至10.4%,缺氧区相对丰度由15.1%下降至8.6%,好氧区相对丰度由 19.7%下降至 12.7%,拟杆菌门是一种广泛存在于污水环境中的菌门[23]。
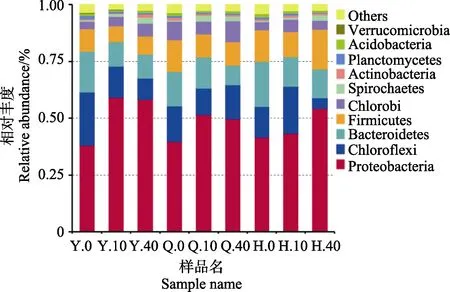
图4 门水平下物种相对丰度Fig.4 Relative abundances at phylum level
2.3.2 属水平上微生物群落结构
图5为优势菌属水平上的微生物群落分析。当NaCl盐度由 0增加至 40 g/L时,厌氧区、缺氧区和好氧区Dechloromonas的相对丰度分别由6%、6%和7%增加至33%、17%和12%。当NaCl盐度为40 g/L时,该属的相对丰度最高,成为优势菌属。Dechloromonas在氮的转化过程中起着一定作用,具有反硝化功能[24-25]。冯杲等[26]研究还发现,多数高氯酸盐降解菌属于Dechloromonas。随着NaCl盐度的逐渐增大,氯离子含量也逐渐增多,适应新环境具有脱氯能力的 Dechloromonas相对丰度显著增大。缺氧区的硝态氮主要通过反硝化过程去除。陶氏菌属(Thauera)与副球菌属(Paracocccus)为该区域中具有反硝化能力的优势菌属[24]。当NaCl盐度为0时,陶氏菌属和副球菌属相对丰度分别为 2.7%和 0.67%;当NaCl盐度为10 g/L时,陶氏菌属和副球菌属相对丰度分别为2.4%和0.56%;当NaCl盐度为40 g/L时,陶氏菌属和副球菌属相对丰度分别为 2.5%和0.44%。结果表明,与无NaCl废水相比,加入NaCl后,缺氧区陶氏菌属和副球菌属相对丰度下降,反硝化过程受到抑制,NO3--N去除率逐渐降低。

图5 属水平下物种相对丰度Fig.5 Relative abundances at genus level
好氧区氮的转化包括氨化作用与硝化作用,梭菌属(Clostridium)具有氨化作用,硝化螺旋菌(Nitrospirae)具有硝化作用。当NaCl盐度为0时,梭菌属和硝化螺旋菌相对丰度分别为0.2%和0.14%;当NaCl盐度为10 g/L时,梭菌属和硝化螺旋菌相对丰度分别为0.16%和0.02%;当NaCl盐度为40 g/L时,梭菌属和硝化螺旋菌相对丰度分别为 0.1%和 0.1%。与无 NaCl废水相比,加入 NaCl后,好氧区梭菌属和硝化螺旋菌相对丰度降低,氨化作用和硝化作用均减弱,NH4+-N去除率下降。
通过对优势菌的分析表明,随着盐度的增大,变形杆菌门中Dechloromonas相对丰度增加;但是,脱氮能力强的陶氏菌属和副球菌属、具有氨化作用的梭菌属和硝化作用的硝化螺旋菌相对丰度降低,这是导致A2/O工艺脱氮效率下降的主要因素。
2.3.3 属水平上微生物群落聚类分析
图 6为属水平上的微生物聚类图。微生物聚类图可直观地表现各菌属相对丰度的高低,便于发现各区域独特的优势菌属。随着NaCl盐度增大,厌氧区的乳酸杆菌属(Lactobacillus)和链球菌属(Streptococcus)相对丰度增大;缺氧区的Tepidibacterium和Veillonella相对丰度增大;好氧区的Lachnoclostridium和Zoogloea相对丰度逐渐增大,这 6种菌属均属于厚壁菌门。很多厚壁菌门产生芽孢,能够抵抗高盐极端环境,在盐碱地、海洋和湖泊污泥中也发现了大量厚壁菌门的耐盐微生物[27-28]。

图6 属水平下微生物聚类图Fig.6 Microbial cluster graph at genus level
综合以上结果可知,不同盐度下A2/O工艺各区域微生物群落结构的变化能够反映污染物去除率的变化,通过监测微生物的多样性、差异性和群落分布,及时调整工艺运行参数,有利于提高脱氮效率。同时,反硝化菌比硝化菌具有更强的耐盐性,加强硝化菌的驯化有利于提高脱氮效率;在厌氧区、缺氧区和好氧区发现了一些具有耐盐性的细菌(如Lactobacillus、Tepidibacterium和Lachnoclostridium等),对这些细菌进行富集和筛选,对提高污染物去除率也有积极意义。
3 结 论
1)盐度的增加降低了微生物的丰富度和多样性,导致A2/O工艺污染物去除率下降。当盐度由0增大至40 g/L时:A2/O反应器厌氧、缺氧和好氧区域 COD去除率分别由52%、80%和56%下降至30%、50%和40%;厌氧区和好氧区NH4+-N去除率分别由33%和61%下降至11%和39%;缺氧区NO3--N去除率由63%下降至47%。
2)低盐度微生物群落与高盐度微生物群落的差异性显著。变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、绿菌门(Chlorobi)始终是 A2/O工艺厌氧区、缺氧区和好氧区的微生物优势菌门,保证了A2/O工艺在含盐环境中具有降解有机物与脱氮的能力。
3)随着NaCl盐度的增大,Dechloromonas成为厌氧区、缺氧区和好氧区的优势菌属;缺氧区活性污泥中陶氏菌属(Thauera)和副球菌属(Paracocccus)、好氧区活性污泥中梭菌属(Clostridium)和硝化螺旋菌(Nitrospirae)相对丰度的降低是导致 A2/O工艺脱氮性能降低的主要原因。
[1] 王子超,高孟春,魏俊峰,等. 盐度变化对厌氧污泥胞外聚合物的影响[J]. 环境科学学报,2016, 36(9):3273-3281.Wang Zichao, Gao Mengchun, Wei Junfeng, et al. Effect of salinity on extracelluar polymeric substances of anaerobic sludge[J]. Acta Scientiae Circumstantiae, 2016, 36(9): 3273-3281. (in Chinese with English abstract)
[2] 王淑莹,唐冰,叶柳,等. NaCl盐度对活性污泥系统脱氮性能的影响[J]. 北京工业大学学报,2008,34(6):631-635.Wang Shuying, Tang Bing, Ye Liu, et al. Influence of NaCl salinity on nitrogen removal of activated sludge system[J].Journal of Beijing University of Technology, 2008, 34(6):631-635. (in Chinese with English abstract)
[3] 李哲,周健,曾朝银. 榨菜废水水质特性及其对活性污泥沉降性能的影响[J]. 给水排水,2005,31(11):57-60.Li Zhe, Zhou Jian, Zeng Chaoyin. Nature of the vegetable processing wastewater and its influence on the secondary sedimentation in acivated sludge procss[J]. Water &Wastewater Engineering, 2005, 31(11): 57-60. (in Chinese with English abstract)
[4] Abou-Elela S I, Kamel M M, Fawzy M E. Biological treatment of saline wastewater using a salt-tolerant microorganism[J]. Desalination, 2010, 250(1): 1-5.
[5] Cortés-Lorenzo C, Rodríguez-Díaz M, Sipkema D, et al.Effect of salinity on nitrification efficiency and structure of ammonia-oxidizing bacterial communities in a submerged fixed bed bioreactor[J]. Chemical Engineering Journal, 2015,266(6): 233-240.
[6] Koops H P, Pommerening-Röser A. Distribution and ecophysiology of the nitrifying bacteria emphasizing cultured species[J]. Fems Microbiology Ecology, 2001, 37(1): 1-9.
[7] Lee D Y, Ramos A, Macomber L, et al. Taxis response of various denitrifying bacteria to nitrate and nitrite[J]. Applied& Environmental Microbiology, 2002, 68(5): 2140-2147.
[8] 王国祥,濮培民,黄宜凯,等. 太湖反硝化、硝化、亚硝化及氨化细菌分布及其作用[J]. 应用与环境生物学报,1999,5(2):79-83.Wang Guoxiang, Pu Peimin, Huang Yikai, et al. Distribution and role of denitrifying, nitrifying, nitrosation and ammonifying bacteria in the taihu lake[J]. Chinese Journal of Applied and Environmental Biology, 1999, 5(2): 79-83. (in Chinese with English abstract)
[9] He Shilong, Niu Qigui, Li Yuyou, et al. Factors associated with the diversification of the microbial communities within different natural and artificial saline environments[J].Ecological Engineering, 2015, 83(213): 476-484.
[10] 王兴春,杨致荣,王敏,等. 高通量测序技术及其应用[J].中国生物工程杂志,2012,32(1):109-114.Wang Xingchun, Yang Zhirong, Wang Min, et al.High-throughput sequencing technology and its application[J]. China Biotechnology, 2012, 32(1): 109-114.(in Chinese with English abstract)
[11] Caporaso J G, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335.
[12] 徐华勤,肖润林,邹冬生,等. 长期施肥对茶园土壤微生物群落功能多样性的影响[J]. 生态学报,2007,27(8):3355-3361.Xu Huaqin, Xiao Runlin, Zou Dongsheng, et al. Effects of long-term fertilization on functional diversity of soil microbial community of the tea plantation[J]. Acta Ecologica Sinica, 2007, 27(8): 3355-3361. (in Chinese with English abstract)
[13] Chang H Y, Ouyang C F. Improvement of nitrogen and phosphorus removal in the anaerobic-oxic-anoxic-OXIC(AOAO) process by stepwise feeding[J]. Water Science&Technology, 2000, 42(3/4): 89-94.
[14] 徐颖. 活性污泥在适应不同污水处理过程中微生物群落及功能的进化研究[D]. 新乡:河南师范大学,2013.Xu Ying. Evolution of the Structures and Functions of the Microbial Community During Adapting to Different Wastewater Treatment Systems[D]. Xinxiang:Henan Normal University, 2013. (in Chinese with English abstract)
[15] Guo Xuechao, Miao Yu, Wu Bing, et al. Correlation between microbial community structure and biofouling as determined by analysis of microbial community dynamics[J].Bioresource Technology, 2015, 197(8): 99-105.
[16] 周贵忠,许硕,姚倩,等. 不同盐度下活性污泥中微生物群落变化规律及其处理模拟染料废水[J]. 环境科学,2017,38(7):2972-2977.Zhou Guizhong, Xu Shuo, Yao Qian, et al. Influence of salinity on microbial community in activated sludge and its application in simulated dye wastewater treatment[J].Environmental Science, 2017, 38(7): 2972-2977. (in Chinese with English abstract)
[17] 李墨青. 纳米银对 SBR系统水处理效能及微生物菌群的影响研究[D]. 哈尔滨:哈尔滨工业大学,2014.Li Moqing. Impacts of Silver Nanoparticles on Water Treatment Efficienciesof SBRsystem and Microbial Communities[D]. Harbin: Harbin Institute of Technology,2014. (in Chinese with English abstract)
[18] Hallenbeck P C, Liu Y. Recent Advances in Hydrogen Production by Photosynthetic Bacteria[J]. International Journal of Hydrogen Energy, 2016, 41(7): 4446-4454.
[19] 张崇淼,马宇超,牛全睿,等. 渐增 NaCl对印染废水处理系统活性污泥微生物的影响[J]. 工业水处理,2017,37(2):33-37.Zhang Chongmiao, Ma Yuchao, Niu Quanrui, et al.Influences of gradual-increase NaCl on the activated sludge microbes in dyeing wastewater treatment systems[J].Industrial Water Treatment, 2017, 37(2): 33-37. (in Chinese with English abstract)
[20] Hu Man, Wang Xiaohui, Wen Xi, et al. Microbial Community Structures in Different Wastewater Treatment Plants as Revealed by 454-pyrosequencing Analysis[J].Bioresource Technology, 2012, 117(6): 72-79.
[21] Miura Y, Watanabe Y, Okabe S. Significance of Chloroflexi in performance of submerged membrane bioreactors (MBR)treating municipal wastewater[J]. Environmental Science &Technology, 2007, 41(22): 7787.
[22] Larsen P, Nielsen J L, Otzen D, et al. Amyloid-like adhesins produced by floc-forming and filamentous bacteria in activated sludge[J]. Applied & Environmental Microbiology,2008, 74(5): 1517.
[23] Lin P Y, Chen H L, Huang C T, et al. Biofilm production, use of intravascular indwelling catheters and inappropriate antimicrobial therapy as predictors of fatality in Chryseobacterium meningosepticum bacteraemia[J].International Journal of Antimicrobial Agents, 2010, 36(5):436-440.
[24] Tian Mei, Zhao Fangqing, Shen Xin, et al. The first metagenome of activated sludge from full-scale anaerobic/anoxic/oxic (A2O) nitrogen and phosphorus removal reactor using Illumina sequencing[J]. Acta Scientiae Circumstantiae, 2015, 35(9): 181-190.
[25] 黄鑫. 基于高通量的珠江水体的反硝化功能基因的研究[D]. 广州:华南理工大学,2016.Huang Xin. High-throughput Sequencing Analysis of Functional Genes of Denitrification in Pearl River[D].Guangzhou: South China University of Technology, 2016.(in Chinese with English abstract)
[26] 冯杲,王倩,张媛媛,等. 微生物法去除高氯酸盐的研究进展[J]. 河北工业科技,2014,31(6):519-524.Feng Gao, Wang Qian, Zhang Yuanyuan, et al. Research progress of microbial method in removing perchlorate[J].Hebei Journal of Industrial Science and Technology, 2014,31(6): 519-524. (in Chinese with English abstract)
[27] 邢平平. 黄河三角洲土壤微生物群落结构对盐生植被演替的响应[D]. 济南:山东师范大学,2013.Xing Pingping. Response of Soil Microbial Community Structure to Halophytic Vegetation Succession[D]. Jinan:Shandong Normal University, 2013. (in Chinese with English abstract)
[28] 侯梅锋,何士龙,李栋,等. 连云港海底底泥及青海湖底泥细菌多样性研究[J]. 环境科学,2011,32(9):2681-2688.Hou Meifeng, He Shilong, Li Dong, et al. Bacterial diversity in Lianyungang marine sediment and Qinghai Lake sediment[J]. Environmental Science, 2011, 32(9): 2681-2688. (in Chinese with English abstract)

