猪圆环病毒2型ZJ/C株增殖条件的优化
陈川林 ,杜爱芳
(1.浙江大学动物科学院,浙江 杭州 310058;2.杭州佑本动物疫苗有限公司,浙江 杭州 310018)
猪圆环病毒2型(PCV2)是引起猪圆环病毒病(PCVD)的主要病原。猪圆环病毒病是世界各国公认的危害养猪业的重要疫病,与“猪瘟”和“蓝耳病”统称为养猪业的“三座大山”,对猪群影响较大。防控猪圆环病毒病最有效的方法是疫苗免疫。目前国内已经生产的猪圆环病毒2型灭活疫苗有猪圆环病毒2型灭活疫苗SH株、猪圆环病毒2型灭活疫苗LG株和猪圆环病毒2型灭活疫苗DBN-SH07株,但是其效价都不是很高。通常PCV2在PK15细胞上的TCID50一般在104~105。
本实验利用猪圆环病毒2型优势株(PCV2-ZJ/C株,其毒价可达到106.0TCID50/0.1mL),在PK15-ZJU细胞上增殖条件的优化,以摸索适合猪圆环病毒2型灭活疫苗(ZJ/C株)生产的工艺条件。
1 材料与方法
1.1 材料
1.1.1 细胞与毒株
PK15-ZJU细胞与PCV2-ZJ/C株,均来自农业部动物病毒学重点开放实验室。
1.1.2 主要试剂
DMEM干粉,Gibco公司产品;胰蛋白酶,Sigma公司产品;新生牛血清,Hyclone公司产品;D-氨基葡萄糖,Sigma公司产品;其它试剂均为分析纯。
1.1.3 主要仪器设备
PH计,梅特勒-托利多仪器(上海)有限公司产品;水浴锅 DK-80,上海精宏实验设备有限公司产品;CO2培养箱,日本SANYO公司产品;荧光显微镜,日本尼康公司产品;电子天秤,梅特勒-托利多仪器(上海)有限公司产品。
1.2 方 法
1.2.1 细胞制备
从液氮罐取出PK15-ZJU细胞置37℃水浴快速融化,加入含8%新生牛血清的DMEM细胞生长液,置37℃、含5%CO2的培养箱培养。待其生长成单层细胞,加入0.02%EDTA-0.05%胰蛋白酶消化液,在37℃下作用5~8min,加入细胞生长液制成细胞悬液,分装于细胞培养瓶中,37℃、12转/h培养,一般48h即可形成细胞单层。
1.2.2 毒种复壮
取毒种(PCV2-ZJ/C株)按细胞培养液1%的量接种到新消化的PK15-ZJU细胞悬液,37℃、5%CO2培养箱培养72h,-20℃冻融3次,收获细胞培养物,测TCID50。
1.2.3 最佳细胞接种密度确定
将消化、分散后的 PK15-ZJU细胞密度分别调整为1.5×105、2.0×105、2.5×105、3.0×105和 3.5×105个 /mL 5个浓度,每个浓度3个转瓶,同步接种1%的PCV2-ZJ/C病毒液(毒种滴度为106.4TCID50/0.1mL),37℃、12转/h培养48h,换含3%血清的维持液,继续培养36h收获病毒液,-20℃冻融3次,测TCID50,以确定适合病毒增殖的最佳细胞接种密度。
1.2.4 不同接毒方法与病毒增殖的关
按表1中4种方法接毒,收获病毒液后于-20℃冻融3次,测TCID50,以确定适合病毒增殖的最佳接毒方法(接毒比例为1%,D-氨基葡萄糖为300mmol/L)。

表1 不同接毒方法
1.2.5 收获时间与接毒量的确定
将长成单层的 PK15-ZJU细胞用消化液消化后,制成2.5×105个/mL的细胞悬液,分别同步接种1%、2%和3%的PCV2-ZJ/C(种毒效价为 106.4TCID50/0.1mL)各 5 瓶,37℃、12转/h培养24h,弃去营养液,加PBS清洗一遍后加300mmol/L的D-氨基葡萄糖作用30min,弃去D-氨基葡萄糖加含3%血清的维持液继续培养。培养72h后每6h取一瓶,-20℃冻融3次,测病毒滴度。
1.2.6 冻融次数确定
按之前试验得出的结果进行病毒的培养,收获病毒液后,分别在-20℃条件下冻融1、2、3、4次,然后分别测定病毒TCID50,以其中TCID50最高者为病毒的最佳冻融次数。
1.2.7 收获毒液的病毒含量(TCID50)测定
取病毒液用无血清的DMEM培养液做10倍系列稀释,从10-4~10-9,共6个稀释度,分别将稀释好的病毒液等体积加入到每孔含有100μL PK15-ZJU细胞悬液的96孔细胞培养板中。每个稀释度接种6孔,同时设PCV2-ZJ/C株阳性细胞对照4孔和空白细胞对照4孔。接种后放置37℃,含5%CO2培养箱培养72h。弃去培养液,将培养的细胞用冷甲醇-丙酮液固定后,与鼠源抗PCV2衣壳蛋白单克隆抗体反应,然后与FITC标记的羊抗鼠IgG反应,最后用倒置荧光显微镜观察每个稀释度的PCV2阳性细胞(荧光显微镜下产生绿色荧光)。根据每个稀释度的阳性细胞孔数,按Reed-Muench方法计算病毒的TCID50。
2 结果
2.1 最佳细胞接种密度确定
从图1可以看出细胞接种密度为2.5×105个/mL时,病毒滴度最高。细胞接种密度为3.5×105时,病毒滴度最低。因此,取最佳细胞接种密度为2.5×105个/mL。

图1 细胞接种密度对病毒增殖的影响
2.2 接毒方法的确定
从图2可以看出采用同步接毒加D-氨基葡萄糖处理的方法接毒,病毒滴度最高,达到106.36TCID50/0.1mL;其次为同步接毒不加D-氨基葡萄糖处理;分步接毒不加D-氨基葡萄糖处理的病毒滴度最低。因此,确定最佳的接毒方法为同步接毒加D-氨基葡萄糖处理。
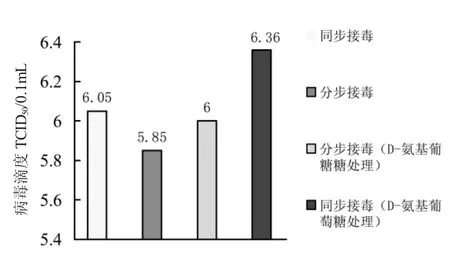
图2 不同接毒方法对病毒增殖的关系
2.3 最佳接毒量与收获时间的确定
从表2可以看出接毒量为2%,病毒感染90h后收毒获得到了病毒的最高滴度106.84TCID50/0.1mL。接毒量为1%和2%时,病毒的滴度都是先随时间的延长而升高,在90h达到了最高值,而后随时间的延长而降低。接毒量为3%时,病毒的滴度也是先随时间的延长而升高,但是最高值出现在84h,而后随时间的延长而降低。所以PCV2-ZJ/C增殖的最佳接毒量为2%,最佳收获时间为90h。

表2 不同接毒量及收获时间时的病毒滴度
2.4 最佳冻融次数的确定
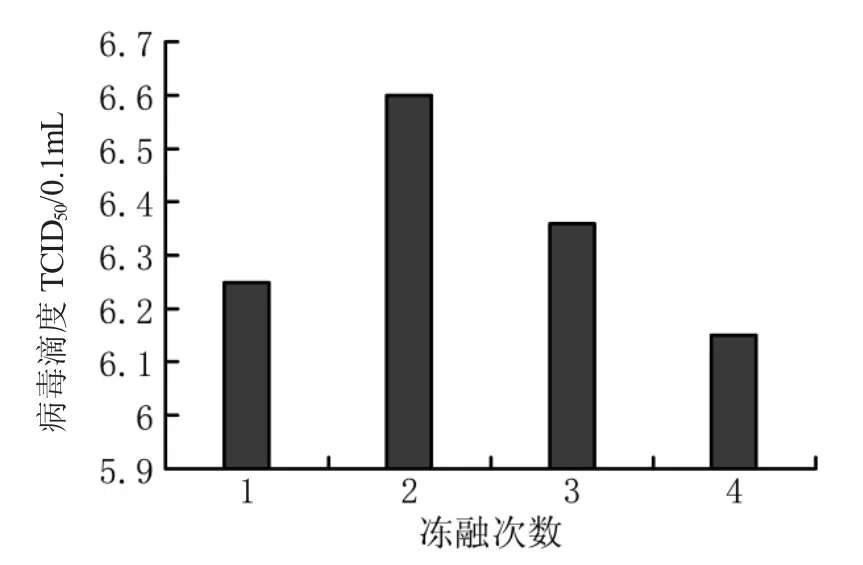
图3 冻融次数与病毒滴度的关系
从图3可以看出冻融2次时,病毒的滴度最高,为106.60TCID50/0.1mL。因此取冻融2次为最佳冻融次数。
3 讨论
在体外培养动物细胞中增殖病毒,细胞接种密度对病毒的增殖有影响。主要是通过细胞的生长状态来影响病毒的增殖。细胞接种密度过低,导致营养液pH升高变碱,抑制细胞的生长,甚至引起细胞死亡。细胞接种密度过高,导致单个细胞营养成分不足,及细胞间相互竞争营养成分,也会抑制细胞的生长。所以合适的细胞接种密度才可以促进细胞的生长,从而促进病毒的增殖。
从本实验看采用同步接毒的方法病毒滴度高于分步接毒,可能是因为PCV2的繁殖要利用PK15细胞复制S期的蛋白。此外研究表明,D-氨基葡萄糖一方面可以增强PK15细胞S期蛋白的表达,另一方面可以促进病毒的DNA进入细胞核,从而增强病毒的增殖,Tischer等最先用D-氨基葡萄糖来提高PCV2的增殖,此后D-氨基葡萄糖普遍用于PCV2的接毒感染实验。Gilpin等用300 mM的D-氨基葡萄糖刺激能够显著增加病毒的增殖能力。本试验通过添加D-氨基葡萄糖处理接毒的PK15细胞,使得PCV2的滴度升高了。
接毒量和收获时间也会影响病毒的滴度,合适的接毒量才可以获得高滴度的病毒。接毒量低,病毒滴度达到高峰的时间延长,细胞状态下降,不利于病毒的增殖;接毒量高,病毒间的自我干扰作用,也不利于病毒的增殖。掌握好收毒的时间也是获得高滴度病毒的关键,因为收毒太早,病毒不能充分增殖,而收毒太晚,部分从细胞中释放出来的病毒在37℃环境中死亡。冻融次数也会影响病毒的滴度,这是因为冻融次数过多,会损伤病毒,降低病毒的活力。冻融次数少,不能使病毒完全从细胞中释放。
PCV2-ZJ/C株从本实验来看其滴度可以达到106.84TCID50/0.1 mL,符合国家规程要求每mL病毒含量应大于等于106.30TCID50的标准。而且,抗原滴度的提高,极大地提高了同剂量疫苗中抗原的含量,对免疫效果的增强具有重要的意义。
在转瓶上通过对PCV2-ZJ/C株在PK15-ZJU细胞上增殖条件的优化,试验结果表明,采用同步接毒加D-氨基葡萄糖处理的方法接毒,细胞接种密度为2.5×105个/mL,接毒量为2%,接毒后90h收获,-20℃冻融2次的条件下,PCV2-ZJ/C株增殖效果最好。这为猪圆环病毒2型灭活疫苗(ZJ/C株)的规模化生产提供了参考依据。
[1] 宋长绪等.猪圆环病毒病(PCVD)研究进展[J].广东农业科学,2010,09:34-37.
[2] 方观向.猪圆环病毒病及其防控措施[J].南方农业,2014,08(24):168-169.
[3] 廖荣斌等.猪圆环病毒病的流行病学调查[J].养猪,2011,01:81-82
[4] Ge M,et al.Development and application of a double-antigen sandwich enzyme-linked immunosorbent assay for detection of antibodies to porcine circovirus 2[J].Clin Vaccine Immunol,2012,19(9):1480-1486.
[5] 蒋大良,等.猪圆环病毒2型致病机制研究进展[J].动物医学进展,2009,30(4):94-98.
[6] Darwich L,et al.Immunology of porcine circovirus type 2(PCV2)[J].Virus Research,2012,164(1/2):61-67.
[7] 徐全圆,等.猪圆环病毒病疫苗的现状与发展[J].猪病防控,2014,11:53-54.
[8] 刘建波,等.猪圆环病毒病的流行趋势与防控对策[J].动物医学进展,2014,35(1):111-115.
[9] 郎洪武,等.猪圆环病毒病及其生物制品学的研究进展[J].中国兽医科学,2012,42(05):545-500.
[10] 王一平,等.猪圆环病毒2型疫苗的研究进展[J].畜牧兽医学报,2012,43(9):1337-1345.
[11] Gilpin,D.F.,et.al.2003.In vitro studies on the infection and replication of porcinecircovirus type 2 in cells of the porcine immune system.VET[J].Immunol.Immunopathol,94(3-4),149-161
[12] 陈念劬.猪圆环病毒2型易感的PK15细胞系的克隆、筛选与鉴定[J].农业科技辑,2011,S1:D050-296-1-57.
[13] Tischer I,et al.Replication of porcine circovirus:Induction by glucosamine and cell cycle dependence[J].Archives of Virology,1987,96(1/2):39-57.
[14] Meerts,P.,et.al.2005.Replication kinetics of different porcine circovirus 2 strains in PK-15 cells,fetal cardiomyocytes and macrophages[J]..Arch..Virol,150(3),427-441.

