乳酸菌细菌素的作用机制及在肉制品中的应用
张晓宁,尚一娜,陈境,霍麒文,李明慧,杨姝玉,邢叶妮,王俊国
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018)
肉制品是人类饮食的重要组成部分,含有丰富的营养价值,极易受到腐败微生物的污染,造成肉制品腐败变质,给消费者的健康带来隐患。目前我国肉类加工行业存在冷链系统不健全、使用化学防腐剂等问题,长期食用会对人体产生毒副作用[1]。食品添加剂通用标准(Codex General Standard for Food Additives,GSFA)批准添加亚硝酸盐、有机酸及其盐类作为肉类和肉类产品的添加剂,此外肉制品企业还可以采取冷冻、冷藏、热加工、腌制、干燥、发酵、烟熏等物理手段对肉制品进行加工,但这不可能完全抑制肉制品中肠杆菌、假单胞菌,乳杆菌等腐败菌的生长,因此天然食品级生物防腐剂的出现为肉制品的防腐保鲜提供一种新的可能。乳酸菌(Lactobacillus)在食品中的应用由来已久,是一种公认的食品级微生物,通过乳酸菌发酵的食物不仅营养及风味有所改变,其抑制腐败菌的作用也大大增强,研究发现这种抑菌作用不仅取决于乳酸菌产酸,而且也与乳酸菌分泌的细菌素有密切联系。细菌素作为乳酸菌的代谢产物被认为是一种天然食品防腐剂,其具有安全性高、防腐作用强以及不会改变食品原有感官品质等优点,因而被广泛应用于肉制品中,以延长肉类的保质期和提高其安全性。本文重点对乳酸菌细菌素分类、生物合成途径、机制及其在肉制品防腐方面的应用进行综述。
1 乳酸菌细菌素及其分类
1.1 乳酸菌细菌素
乳酸菌细菌素是乳酸菌代谢过程产生的一类具有抗菌活性的小分子肽类物质[2],大多是以30~60个氨基酸组成的小分子形式存在。多数产细菌素的乳酸菌是从食品中分离所得,可被人体内蛋白酶降解,对肠道微生物群不会产生太大影响,被大家公认为是安全无毒的(GRAS),因而常被用作食品防腐剂。截止到2015年,产细菌素的乳酸菌多达185株[3]。
1.2 乳酸菌细菌素的分类
目前乳酸菌细菌素的分类主要是基于细菌素的氨基酸结构及其理化性质,Cotter等根据细菌素分子中是否含有羊毛硫氨基酸、分子量大小及是否对热稳定,将乳酸菌细菌素分为三大类,即I类羊毛硫细菌素、II类细菌素及Ⅲ类细菌素,II类细菌素进一步可分为IIa,IIb,IIc 和 IId 4 个亚类[4],见表1。

表1 乳酸菌细菌素的分类Table 1 Classes of bacteriocins from lactic acid bacteria
Ⅰ类细菌素是指含有羊毛硫氨酸、对热稳定、对革兰氏阳性菌有较宽抗菌谱(葡萄球菌,链球菌,李斯特菌属,杆菌和肠球菌)的一组小分子多肽(分子量<5 kDa)。1928年Rogers较早发现乳酸乳杆菌(Lactobacillus lactis)能够产生乳酸链球菌素 A[13];1944年Hirsch发现乳酸链球菌(Streptococcus acidi lactici)代谢产物具有抑菌活性,且这种抑菌活性物质具有类似蛋白质的结构和性质,是Ⅰ类细菌素的主要代表并命名为Nisin[14];随着分子手段的不断进步,2010年Mkrtchyan等从嗜酸乳杆培养基中分离得到了分子量大小只有1.15 kDa的Ⅰ类细菌素,发现其氨基酸序列为Asn-Val-Gly-Val-Leu-X-Pro-Pro-X-Leu-Val[15]。
II类细菌素不含羊毛硫氨酸、对热不稳定,包括IIa,IIb,IIc和IId 4个亚类。IIa类细菌素是II类细菌素中主要的亚种,抗菌谱相比Ⅰ类细菌素较窄,其中植物乳杆菌(Lactobacillus plantarum)产生的乳酸片球菌素(pediocin PA1)为主要代表,2014年Perez等与2015年O'Oconnor等相继研究发现IIa类细菌素仅对乳酸菌、李斯特菌等革兰氏阳性菌表现出抗菌活性,但也存在极少数对大肠杆菌、沙门氏菌等革兰氏阴性细菌表现抗菌活性[16-17]。IIb类细菌素是由两种不同的肽分子组成的多肽,当每种肽的肽比率相等时才会发挥协同作用,产生最佳抗微生物活性[18],乳球菌素G(lactococcin G)和莴苣苦素F(lactacin F)是首次报道的双肽细菌素。此外,1998年Anderssen等从阿根廷发酵香肠分离出了乳杆菌素705(lactobacillin 705),是肉制品中报道中的第一种Ⅱb型细菌素,同时发现乳杆菌素705对其他乳酸菌和嗜热菌具有拮抗作用[19]。2014年Perez等指出该类别还包括乳球菌素Q(lactococcin Q),肠道菌素 X(enterocin X)和肠道菌素 NKR-5-3AZ(enterocin NKR-5-3AZ)等[16]。Ⅱc 类细菌素的分子主链具有头-尾环化的结构特征,到2015年为止,已经从嗜酸乳杆菌(Lactobacillus acidophilus)发现多种环状菌素,包括肠道菌素 AS-48(enterocin AS-48),加萨霉素(gassericin A)等[20]。Ⅱd类细菌素包括非单线性肽,sec依赖性细菌素以及具有N-末端前导序列,并在翻译后立即有活性的无前导序列细菌素[21]。2015年Worapravote等从泰国发酵猪肉香肠(nham)中分离出两种Ⅱd新型细菌素,即Bac7293A和Bac7293B[18],两种细菌素均抑制广谱细菌,包括单增李斯特菌,金黄色葡萄球菌,鼠伤寒沙门氏菌,大肠杆菌以及食物腐败铜绿假单胞菌和嗜水气单胞菌。其抗菌活性均可以被蛋白水解酶(胰蛋白酶、α-胰凝乳蛋白酶、胃蛋白酶和蛋白酶K)水解,但有机溶剂(乙醇,异丙醇,乙腈)和表面活性剂(Tween 20,Tween 80和Triton X-100)均不影响其抗微生物活性。此外从Bac7293A的C-末端螺旋轮看出,细菌素具有较高的平均疏水性(H=0.516)和净电荷(PI=9.99),这在抗微生物活性中起到主要的作用,这与1999年Dathe等就已经发现细菌素疏水性越强其抗菌活性就越强,表面正电荷越多与靶细胞附着就越容易的结论相对应[22],可见细菌素分子结构的疏水特性与表面电荷对于细菌素产生抗性是非常重要的两项指标。
III类细菌素由热不稳定性蛋白质组成,分子量大于30 kDa,以维生素J为主要代表,此外还包括lysostaphin,enterolysin A,helveticin J 等[8,12]。
2 乳酸菌细菌素的生物合成途径
乳酸菌细菌素的生物合成由相关基因调控,包括结构基因、对自身产生免疫的基因、ABC转运蛋白基因及运输细菌素的辅助蛋白基因[23]。其中结构基因是细菌素编码基因,其可能存在于染色体上或质粒上,还有可能同时存在于染色体和质粒上。贡汉生等从传统乳制品分离得到植物乳杆菌KLDS1.0391,对其产生的细菌素进行编码基因定位研究,结果显示:原始菌株和消除质粒的衍生菌株对枯草芽孢杆菌都具有明显的抑菌活性,因此判断植物乳杆菌KLDS1.0391的编码细菌素基因不位于质粒上,而是位于染色体上[24]。
但在一些研究中发现有些乳酸菌在质粒消除或转移后,其不再分泌细菌素,这表明细菌素的编码基因可能位于质粒上。1998年李平兰等发现细菌素的遗传因子不是位于染色体DNA中,而是由独立于染色体的质粒进行编码[25],Van Reenen等采用质粒消除法对细胞某种特征是否由质粒控制进行探讨,用新生霉素处理植物乳杆菌Lb.plantatum 423消除了大小约为6 kb左右的质粒,通过抑菌试验证明其失去产生细菌素Plantaricin 423的能力,因此该菌株编码Plantaricin 423有关的基因初步定位于该菌株6 kb左右的质粒上,与染色体无关[26]。
进一步的研究发现同一菌株可以产生不同的细菌素,其细菌素的编码基因存在的部位也不相同,如植物乳杆菌产生植物激素(Plantaricin ST31)时,其遗传因子是由染色体进行编码,当产生植物激素(Plantaricin 423)时,其遗传因子则是由质粒进行编码。说明当某种细菌产生多种细菌素时,其结构基因可能是由染色体和质粒一起进行编码[27]。
乳酸菌产生的细菌素需要在细胞内经过一系列修饰加工后,才能具有抑菌活性。新合成的细菌素含有N-末端引物,在细胞内由细菌素基因编码的蛋白质或氨基酸进行修饰,包括:丝氨酸和苏氨酸残基脱水形成硫醚交联物以及对不饱和氨基酸的磷酸化处理等[7-8]。其中,以I类细菌素(羊毛硫抗生素)中nisin的生物合成为例进行描述:Nisin的基因簇结构复杂,含有11个基因,分别命名为nisABTCIPRKFEG:nisA基因编码形成nisinA前体多肽;nisB和nisC编码翻译后修饰反应相关的酶;nisT编码ABC转位运输蛋白,这个蛋白与Nisin前体的输出有关;nisP编码和前体加工处理相关的细胞外蛋白酶;nisI编码和自身保护作用相关的脂蛋白质;nisFEG可能编码输出蛋白;nisR和nisK编码的蛋白和Nisin生物合成的调控相关[28],见图1。另外细菌素的产生不仅仅受到内部基因的表达,还会受到外源诱导因子的调控、菌体生长的温度和pH值等。
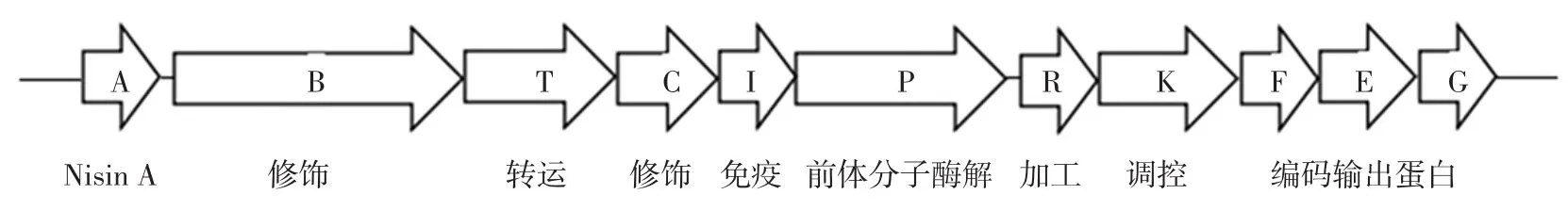
图1 Nisin基因簇结构示意图Fig.1 Nisin gene cluster structure diagram
3 乳酸菌细菌素作用机制
乳酸菌细菌素的产生是与其分泌的一种信息素有关的,也是乳酸菌对外在竞争对手的一种条件反射,当外界细菌的数量达到一定值时,乳酸菌产生的信息素就会自动调控乳酸菌素的合成与分泌,从而使乳酸菌在竞争中取得优势地位,见图2。
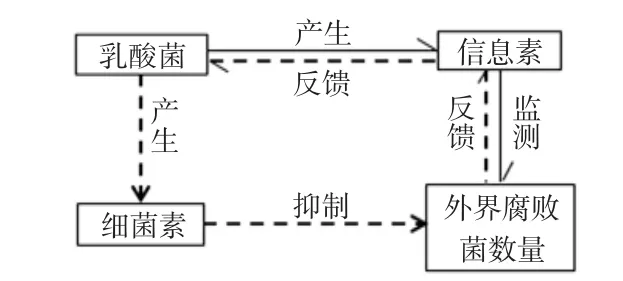
图2 乳酸菌细菌素反馈作用机制Fig.2 Feedback mechanism of bacteriocins from lactic acid bacteria
不同类型的乳酸菌细菌素通过不同的作用机制产生抑菌效果,通常其作用位点是细胞膜,Ⅰ类细菌素作用的最初动力是靶细胞膜和细菌素之间的静电引力。细菌素吸附到敏感的靶细胞上,与靶细胞壁上的肽聚糖、脂质Ⅱ的前体物质相互作用形成细菌素脂质Ⅱ复合物,之后此复合物插入到腐败细菌的细胞膜中,使得其细胞膜形成孔洞导致细胞内物质渗漏,最终造成细胞的死亡[29],见图3。

图3 Ⅰ类细菌素抑菌作用机制Fig.3 Antibacterial mechanism of ClassⅠbacteriocins
Ⅱ类细菌素则是通过N端β折叠区域通过识别位于细胞膜上甘露糖磷酸转移酶系统(MPTs)N端的胞外环,其片段PA-1与其受体细菌相互作用[30],通过静电作用,乳酸片球菌素的N-末端保守结构域与MPTs相结合,疏水性C-末端结构域渗透进入靶细胞的细胞膜,出现致死孔洞造成离子和小分子的泄露,见图4。

图4 Ⅱ类细菌素抑菌机制Fig.4 Antibacterial mechanism of ClassⅡbacteriocinas
另外有研究报道细菌素在对李斯特氏菌抑制过程中,发现细菌素内部结构存在某些特定构像识别位点,其S形铰链状结构的不同决定细菌素是否具有抗李斯特菌特性的作用[31-32]。
乳酸菌细菌素在抑菌过程中,不仅仅对靶细胞膜进行破坏,还可能结合靶细胞细胞壁肽聚糖的前体类脂Ⅱ,干扰其细胞壁的合成。主要是因为细菌素表面存在较多正电荷,是活性阳离子吸附剂,具有很强的吸附性,其N-末端带电残基与靶细胞的初始静电结合,影响靶细胞的特异性终止蛋白质的合成[33],从而阻碍腐败菌细胞壁的合成,早在2006年Gunnar等的研究中得到了证实,即发现细菌素表面所带的正电荷越多,与靶细胞的附着就越容易[34]。
4 乳酸菌细菌素在肉制品中的应用
细菌素因其抗菌作用而得到了广泛的研究与应用。随着研究的不断深入,技术的不断加强,细菌素在肉品中的应用方式也愈来愈多样化,目前主要包括如下4种方式。
4.1 产细菌素乳酸菌直接作为发酵剂
产细菌素乳酸菌作为发酵剂应用于肉制品中,能够水解肉中蛋白质,有助于形成风味和色泽,另外乳酸菌代谢产生的酸性物质及抗菌肽类物质可抑制腐败菌、致病菌的生长,在改善肉制品感官特征的同时起到防腐的作用。2012年Kingcha等利用产细菌素的戊糖片球菌(Pediococcus pentosaceus)作为发酵剂来控制发酵香肠中病原微生物的生长,结果表明接种戊糖片球菌的实验组与对照组相比,发酵18 h~24 h内,人为添加的单增李斯特菌明显减少[35]。2014年Gao等研究发现将分离自传统发酵白菜中的产细菌素乳酸杆菌C2(Lactobacillus)用作香肠的发酵剂,在香肠发酵过程中可有效控制成品中单增李斯特菌、肠杆菌的生长,同时有效降低了丙二醛和亚硝酸盐含量,使产品品质得以改善[36]。此外,国外研究发现肉中本身的内源性蛋白水解酶会影响产细菌素乳酸菌的生长活性及细菌素的产生,2014年Castro等将产细菌素的乳酸杆菌(Lactobacillus lactis)添加到羊肉中,检测单增李斯特菌的生长是否受到抑制,结果发现单增李斯特菌的生长反弹发生在两周后,分析其生长及细菌素活性下降的主要原因是随着时间的延长,肉制品中原有蛋白水解酶逐渐发挥作用,导致细菌素抗性下降[37]。由此可见,产细菌素乳酸菌作为发酵剂应用于肉品中仍存在一定的局限性,因此为了降低肉中原有蛋白酶的影响,使用螯合剂(如EDTA)在延迟蛋白酶活性的同时保证细菌素抗菌活性得到良好的发挥。
4.2 细菌素直接作为防腐剂
将产细菌素的乳酸菌作为发酵剂应用于肉品中,虽然提高了肉制品的保质期与安全性,但也会带来一定的缺陷,如肉制品在多菌发酵系统中,不同乳酸菌产生的细菌素会导致菌株之间拮抗作用的发生,从而影响肉制品的品质,同时在单菌发酵过程中,由于菌株生长环境或营养成分等条件的限制往往会导致菌株不完全发酵,造成细菌素含量较少而作用效率低等的问题。
为了解决上述问题,在肉制品中直接添加细菌素作为防腐剂成为当前细菌素在肉品中应用主要方式之一。2012年Chen等发现屎肠球菌(Enterococcus faecium)产生的肠道菌素A和肠道菌素B应用于如熟火腿、碎猪肉及发酵香肠等不同类型的肉类产品时,可显著降低无害李斯特菌(Listeria innocua)在冷藏期间的数量[38]。之后2014年Grande等将肠道菌素AS-48,用于制作低酸发酵香肠来控制病原微生物的生长,结果显示在成熟结束时(10 d)单增李斯特菌从5.5 lg CFU/g降低到1.19 lg CFU/g,同时对沙门氏菌的抑制作用也比较显著[39]。为了进一步增强细菌素在肉品中的抗菌作用,2012年Turgis等尝试将肠道菌素AS-48与高静水压方法结合使用,发现对沙门氏菌抑制作用显著[40],这表明通过与其他技术的结合,可以增强细菌素的抗微生物能力,同年Turgis研究发现屎肠球菌(Enterococcus faecium)产生的细菌素MT104和MT162可降低香肠中单增李斯特菌的数量,与γ-辐照结合使用也会产生抗李斯特菌的协同效应[40]。另外细菌素还可以与微胶囊化技术结合使用来提高肉产品的安全性。2015年Huq等尝试将乳链菌肽与精油组合使用开发抗李斯特菌制剂,将抗李斯特菌制剂用藻酸盐聚合物微胶囊化,发现在冷藏储存期间,利用微胶囊化技术处理的肉制品与 γ-照射(1.5 kGy)的肉制品,均表现出对单增李斯特菌的协同作用。微胶囊化的乳链菌肽与γ-照射之后单增李斯特菌每天的生长速率为0.03 lg CFU/g,而非微胶囊化的乳链菌肽与γ-照射组合其每天生长速率为0.17 lg CFU/g,微囊化显著(P<0.05)提高了乳链菌肽的抗菌有效性[41]。综上说明细菌素能够用于不同类型肉产品的防腐保鲜,而且与其它技术相结合更是提高了肉制品的安全性。
4.3 将细菌素嵌入肉制品包装膜中
随着人们健康意识的增强,将细菌素以防腐剂的形式添加到肉制品中,会使消费者对肉品的接受性降低,Rose等研究发现在肉制品中直接添加细菌素,会导致其与肉中的谷胱甘肽发生反应,在导致肉制品营养降低的同时也会造成细菌素失活[42]。为了避免这一现象的发生,采用细菌素直接掺入到食品接触材料中的方式,在降低防腐剂使用量的同时也减少了消费者的顾虑。另外,引起肉制品变质的多数腐败微生物是需氧菌,微生物污染主要发生在表面,因此可以通过将细菌素掺入肉制品包装膜中的方式可有效降低其污染程度。
细菌素掺入包装膜发挥其抗菌活性受到诸多因素的影响,近年来研究者们不断改进细菌素掺入到包装膜中的处理方式,发现处理温度是细菌素产生抗性的主要影响因子。2010年Weng等在探讨抑制微生物在表面生长材料的可行性时发现虽然有些细菌素相对耐热,但是将其以溶剂复合的方式掺入到包装膜中还是要避免任何形式的热处理[43]。2011年Sun等发现流延膜(溶剂配混)乳链菌肽的活性是热压膜的3倍,通过实验证实在溶剂混合处理中,应该避免对细菌素或含有细菌素成膜溶液进行热处理[44]。2016年Beristain-Bauza等将鼠李糖乳杆菌(Lacbobacillus pastorianus)的无细胞上清液在92℃下热处理30min,加入成纤溶液与未进行热处理相比,包装膜的抗菌活性降低[45],这表明高温会导致细菌素抗菌活性的损失。研究还发现包装膜材质也会影响细菌素抗菌活性,2007年Marcos等将产细菌素的肠球菌掺入到生物降解膜(海藻酸盐,玉米醇溶蛋白和聚乙烯醇)中,研究其对单增李斯特菌的抗菌作用,其中,含有2000 AU/cm2肠球菌的藻酸盐膜包装有效地控制了单增李斯特菌的生长,在15天期间并未观察到其数量的增加,并在储存29天之后与其它组相比,藻酸盐膜包装组中单增李斯特菌的数量最低,证实了不同类型抗菌包装对于细菌素的抗性具有不同的作用效果[46]。另外在溶剂混配中,细菌素和膜聚合物需要溶解在相同的生物聚合物中,例如蛋白质和碳水化合物[47]。但也有部分研究者提出将细菌素直接掺入到肉制品包装膜中可以提高其抗菌活性,但形成的片晶膜形态特征较差,透明度、厚度和膜机械性质等均有不同程度的下降,因此将细菌素更好的掺入包装膜还有待进一步的研究。
4.4 细菌素涂层于肉制品包装膜上
直接将细菌素掺入肉制品包装中还会带来细菌素与聚合物间的不相容等问题,因此为了避免以上弊端,尝试将细菌素作为扩散涂层吸附到包装表面上,2008年Iseppi等将肠道细菌素作为涂层用于肉制品包装膜上,来评价对李斯特菌的抗微生物效能,结果显示冷藏储存期间与未涂抹肠道细菌素的对照组相比,实验组在24 h内显著降低单增李斯特菌的数量,在4℃和22℃的储存条件下,涂有肠道细菌素膜组的李斯特菌数明显低于对照组。另外涂覆膜与未涂覆膜相比都具有相同的透明度,虽没有对塑料膜表面进行任何处理,细菌素涂层对塑料膜仍具有良好的粘附性[48],可见肉类包装中将细菌素作为涂层用在食品包装膜上具有很好的应用前景。之后2015年Argyri等进一步证实在真空条件下将乳链菌肽与EDTA组合用于包装膜中作为牛排的包装,与未涂抹膜相比涂覆乳链菌肽-EDTA的膜显著降低了腐败细菌、热脂菌和肉杆菌属的数量,很好保持了肉的品质[49]。此外,影响细菌素发挥作用的因素不仅仅是产品包装膜表面特性,还包括细菌素的纯度,吸附温度以及吸附时间等,2016年Woraorayote证实商业乳链菌肽对玻璃纸表面的吸附,确实受到吸附温度的影响,温度的增加会导致乳链菌肽吸附量的减少,并在8℃能够获得乳链菌肽的最大吸附量[11],其次乳酸菌产生细菌素的同时所产生的杂质也会影响乳糖对低密度聚乙烯(LDPE)膜的吸附。
5 展望
乳酸菌细菌素在肉制品防腐领域已经充分显示出其优越性,随着生物技术的发展,有可能更多的新型细菌素被发现,使其具有更为广泛的抑菌活性,从而提高细菌素在肉制品中的应用价值。为了进一步保障人们的身体健康,在实际生产应用细菌素之前,必须要全面了解细菌素的产生,免疫和作用方式的机制,这也是安全和有效利用细菌素的前提。
为了提高细菌素的抑菌作用,可以采用栅栏技术,将细菌素与其他保藏方法联合使用,如采用温和非热物理方法,如脉冲电场、高静水压、真空或改性气调包装等,也能够增强细菌素的抗菌活性。目前还有研究显示可以采用分子生物学方法,通过改变某个特定的氨基酸序列来改变细菌素的抗菌活性。最后,在产品包装膜中掺入细菌素的创新技术是具有挑战性的,人们对于开发抗菌包装也充满了期待。总之随着研究的深入,乳酸菌细菌素这种新型生物防腐剂在肉制品防腐领域必将具有广阔的市场。
[1]张文敏,董庆利,宋筱瑜,等.乳酸钠对肉及肉制品防腐保鲜作用的研究进展[J].食品科学,2016,37(1):235-240
[2]KAUR G,SINGH T P,MALIK R K,et al.Antibacterial efficacy of nisin,pediocin 34 and enterocin FH99 against L.monocytogenes,E.faecium and E.faecalis and bacteriocin cross resistance and antibiotic susceptibility of their bacteriocin resistant variants[J].Journal of Food Science and Technology,2014,51(2):233-244
[3]ZENDO T.Screening and characterization of novel bacteriocins from lactic acid bacteria[J].Bioscience Biotechnology& Biochemistry,2013,77(5):893-899
[4]Cotter P D,Ross R P,Hill C.Bacteriocins a viable alternative to antibiotics[J].Nature Reviews Microbiology,2013,11(2):95
[5]Vijayakumar P P.Bacteriocins of lactic acid bacteria as potential biopreservatives for ready to eat meats[J].Dissertations&Theses G-radworks,2014,161(3):355-356
[6]Mahrous H,Mohamed A,Elmongy M A,et al.Study Bacteriocin Production and Optimization Using New Isolates of spp.Isolated from Some Dairy Products under Different Culture Conditions[J].Food&Nutrition Sciences,2013,4(3):342-356
[7]Todorov S D.Bacteriocins from Lactobacillus plantarum-production,genetic organization and mode of action[J].Brazilian Journal of Microbiology,2009,40(2):209
[8]Zacharof M P,Lovitt R W.Bacteriocins Produced by Lactic Acid Bacteria a Review Article[J].Apcbee Procedia,2012,2(45):50-56
[9]Perez R H,Zendo T,Sonomoto K.Novel bacteriocins from lactic acid bacteria(LAB):various structures and applications[J].Microbial Cell Factories,2014,13(S1):1-13
[10]Mokoena M P.Lactic Acid Bacteria and Their Bacteriocins:Classification,Biosynthesis and Applications against Uropathogens:A Mini-Review[J].Molecules,2017,22(8):1255
[11]WORAPRAYOTE W,MALILA Y,SORAPUKDEE S,et al.Bacteriocins from lactic acid bacteria and theirapplications in meat and meat products[J].Meat Science,2016,120:118-132
[12]Mahrous H,Mohamed A,Elmongy M A,et al.Study Bacteriocin Production and Optimization Using New Isolates of spp.Isolated from Some Dairy Products under Different Culture Conditions[J].Food&Nutrition Sciences,2013,4(3):342-356
[13]ROGERS L A.The inhibiting effect of streptococcus lactis on lactobacillus bulgaricus[J].Journal of Bacteriology,1928,16(16):321-325
[14]HIRSCH A.A Powerful Inhibitory Substance Produced by Group N Streptococci[J].Nature,1944,154(3913):551-551
[15]MKRTCHYAN H,GIBBONS S,HEIDELBERGER S,et al.Purification,characterisation and identification of acidocin LCHV,an antimicrobial peptide produced by Lactobacillus acidophilus n.v.Er 317/402 strain Narine[J].International Journal of Antimi crobial A-gents,2010,35(3):255-260
[16]PEREZ R H,ZENDO T,SONOMOTO K.Novel bacteriocins from lactic acid bacteria(LAB):various structures and applications[J].Microbial Cell Factories,2014,13(S1):1-13
[17]O'CONNOR P M,O'SHEA E F,GUINANE C M,et al.Nisin H Is a New Nisin Variant Produced by the Gut-Derived Strain Streptococcus hyointestinalis DPC6484.[J].Applied&Environmental Microbiology,2015,81(12):3953-3960
[18]Dhewa T.Screening,Production Purification and Potential Use of Bacteriocins From Lactic Acid Bacteria of Meat and Dairy Food Origin[J].International Proceedings of Chemical Biological&Environmenta,2012,39:35
[19]ANDERSSEN E L,DIEP D B,NES I F,et al.Antagonistic activity of Lactobacillus plantarum C11:two new two-peptide bacteriocins,plantaricins EF and JK,and the induction factor plantaricin A.[J].Applied&Environmental Microbiology,1998,64(6):2269-2272
[20]Acedo J Z,van Belkum M J,Lohans C T,et al.Solution structure of acidocin B,a circular bacteriocin produced by llus Lactobaciacidophilus M46.[J].Applied&Environmental Microbiology,2015,81(8):2910-2918
[21]KAŠKONIENE˙V,STANKEVIČIUS M,BIMBIRAITE˙-SURVILIEN E˙K,et al.Current state of purification,isolation and analysis of bacteriocins produced by lactic acid bacteria[J].Applied Microbiology&Biotechnology,2017,101(4):1-13
[22]DATHE M,WIEPRECHT T.Structural features of helical antimicrobial peptides:their potential to modulate activity on model membranes and biological cells[J].Biochimica Et Biophysica Acta,1999,1462(1/2):71-87
[23]王辉,孟祥晨.细菌素编码基因的定位分析[J].微生物学通报,2012,39(6):827-834
[24]贡汉生.四株乳杆菌产细菌素的研究[D].哈尔滨:东北农业大学,2007
[25]李平兰,江汉湖.细菌素研究概述[J].中国畜产与食品,1998(2):82-84
[26]Van Reenen C A,Dicks L M,Chikindas M L.Isolation,purification and partial characterization of plantaricin 423,a bacteriocin produced by Lactobacillus plantarum[J].Journal of Applied Microbiology,1998,84(6):1131-1137
[27]Mechai A,Debabza M,Kirane D.Screening of technological and probiotic properties of lactic acid bacteria isolated from Algerian traditional fermented milk products.[J].International Food Research Journal,2014,21(6):2451-2457
[28]丹彤,张和平.乳酸菌细菌素的分类、生物合成及其应用[J].中国乳品工业,2013,41(3):29-32
[29]DURAN M,ADAY M S,ZORBA N N D,et al.Potential of antimicrobial active packaging‘containing natamycin,nisin,pomegranate and grape seed extract in chitosan coating’to extend shelf life of freshstrawberry[J].Food&Bioproducts Processing,2016,98:354-363
[30]SUN L,SONG H,ZHENG W.Improvement of Antimicrobial Activity of Pediocin PA-1 by Site-directed Mutagenesis in C-terminal Domain[J].Protein&Peptide Letters,2015,22(11):1007-1012
[31]Leistner L.Basic aspects of food preservation by hurdle technology[J].Int.j.food Microbiol,2000,55(1/3):181-186
[32]KUMARIYA R,SOOD S K,RAJPUT Y S.Gradual pediocin PA-1 resistance in Enterococcus faecalis confers cross-protection to diverse pore-forming cationic antimicrobial peptides displaying changes in cell wall and mannose PTS expression[J].Annals of Microbiology,2015(2):1-12
[33]SILVA I M D,BOELTER J F,SILVEIRA N P D,et al.Phosphatidylcholine nanovesicles coated with chitosan or chondroitin sulfate as novel devices for bacteriocin delivery[J].Journal of Nanoparticle Research,2014,16(7):1-10
[34]GUNNAR FIMLAND,JUSSI PIRNESKOSKI,JASADEE KAEWSRICHAN,et al.Mutational analysis and membrane-interactions of the β-sheet-like N-terminal domain of the pediocin-like antimicrobial peptide sakacin P[J].Biochimica Et Biophysica Acta,2006,1764(6):1132-40
[35]KINGCHA Y,TOSUKHOWONG A,ZENDO T,et al.Anti-listeria activity of Pediococcus pentosaceus BCC 3772 and application as starter culture for Nham,a traditional fermented pork sausage[J].Food Control,2012,25(25):190-196
[36]GAO Y,LI D,LIU X.Bacteriocin-producing Lactobacillus sakei,C2 as starter culture infermented sausages[J].Food Control,2014,35(1):1-6
[37]Castro M R,Rivas F P,Campos C.Bacteriocinogenic Lactic Acid Bacteria of Caprine Products from Chaco[J].International Journal of Food Processing Technology,2014,1(1):32-40
[38]CHEN J H,REN Y,SEOW J,et al.Intervention Technologies for Ensuring Microbiological Safety of Meat:Current and Future Trends[J].Comprehensive Reviews in Food Science&Food Safety,2012,11(2):119-132
[39]GRANDE BURGOS M J,PULIDO R P,DEL C L A M,et al.The Cyclic Antibacterial Peptide Enterocin AS-48:Isolation,Mode of Action,and Possible Food Applications[J].International Journal of Molecular Sciences,2014,15(12):22706-22727
[40]TURGIS M,STOTZ V,DUPONT C,et al.Elimination of Listeria monocytogenes,in sausage meat by combination treatment:Radiation and radiation-resistant bacteriocins[J].Radiation Physics&Chemistry,2012,81(8):1185-1188
[41]HUQ T,VU KD,RIEDL B,et al.Synergistic effect of gamma(γ)-irradiation and microencapsulated antimicrobialsagainstListeria monocytogenes on ready-to-eat(RTE)meat.[J].Food Microbiology,2015,46:507-514
[42]ROSE N L,SPORNS P,STILES M E,et al.Inactivation of Nisin by Glutathione in Fresh Meat[J].Journal of Food Science,1999,64(5):759-762
[43]WENG Y M,HOTCHKISS J H.Anhydrides as antimycotic agents added to polyethylene films for food packaging[J].Packaging Technology&Science,2010,6(3):123-128
[44]SUN Q,LI X,WANG P,et al.Characterization and evaluation of the Ag+-loaded soy protein isolate-based bactericidal film-forming dispersion and films.[J].Journal of Food Science,2011,76(6):438-443
[45]BERISTAIN BAUZA S C,MANI LÓPEZ E,PALOU E,et al.Antimicrobial activity and physical properties of protein films added with cell-free supernatant of Lactobacillus rhamnosus[J].Food Control,2016,62:44-51
[46]MARCOS B,AYMERICH T,MONFORT J M,et al.Use of antimicrobial biodegradable packaging to control Listeria monocytogenes during storage of cooked ham[J].International Journal of Food Microbiology,2007,120(1/2):152-158
[47]FERNÁNDEZ PAN I,CARRIÓN GRANDA X,MATÉ J I.Antimicrobial efficiency of edible coatings on the preservation of chicken breast fillets[J].Food Control,2014,36(1):69-75
[48]ISEPPI R,PILATI F,MARINI M,et al.Anti-listerial activity of a polymeric film coated with hybrid coatings doped with Enterocin 416K1 for use as bioactive food packaging.[J].International Journal of Food Microbiology,2008,123(3):281
[49]ARGYRI A A,MALLOUCHOS A,PANAGOU E Z,et al.The dynamics of the HS/SPME-GC/MS as a tool to assess the spoilage ofminced beef stored under different packaging and temperature conditions[J].InternationalJournalofFoodMicrobiology,2015,193:51

