蓝莓果酒发酵过程中花青苷变化规律的研究
◎ 陈小玲 ,李新生 ,2,党 娅 ,2,3,裴金金 ,2,韩 豪 ,2,李 雯 ,刘彩芬
(1.陕西理工大学生物科学与工程学院,陕西 汉中 723000;2.陕西省资源生物重点实验室,陕西 汉中 723000;3.陕西省果业局蓝莓研究所,陕西 汉中 723000)
蓝莓又名越橘,杜鹃花科越橘属植物。蓝莓果风味独特,具有较高的营养价值[1]。蓝莓果酒因富含大量花青苷而具有很高的保健价值,深受人们关注与喜爱。但蓝莓果酒的发酵过程容易造成花青苷流失,影响蓝莓的营养和经济价值[2]。目前,虽然已有研究对果酒的生产工艺进行优化来达到改善果酒品质的目的,但少有人以花青苷为指标来改进蓝莓果酒发酵工艺参数。因此,本研究将以不同发酵条件为背景,探究蓝莓果酒发酵过程中花青苷的变化规律,为蓝莓酒在生产加工中减少花青苷的损失提供一定的思路和参考,为蓝莓果酒的工艺参数优化提供理论依据[3]。将花青苷含量这一指标引入果酒酿造技术参数的筛选中具有一定的创新意义,它为蓝莓果酒工艺参数优化和品质控制提供了技术指导,搭建了理论平台,对保证蓝莓品质、提高农产品附加值、丰富我国果酒市场及确保人们身体健康具有重大意义。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
兔眼蓝莓,采于陕西省果业管理局秦巴山区蓝莓研究所蓝莓试验示范基地;安琪果酒专用酵母,安琪酵母股份有限公司;2b1酵母菌、a2酵母菌,陕西理工大学食品发酵与工程实验室。
1.1.2 试剂
花青苷标准品;果胶酶,上海蓝季科技发展有限公司;碳酸钙、偏重亚硫酸钾,天津永盛精细化工有限公司;蔗糖、琼脂粉、蛋白胨、葡萄糖、酵母浸粉,北京奥博星生物技术有限责任公司;色谱纯乙腈、色谱纯甲醇,霍尼韦尔公司,色谱纯甲酸,天津科密欧化学试剂有限公司。
1.2 仪器与设备
RE-52A旋转蒸发仪,上海亚荣生化仪器厂;SPX-250B-Z型生化培养箱,上海博远实业有限公司医疗设备厂;紫外分光光度计,(T6新世界)北京普析通用仪器有限责任公司;AUY120电子分析天平,岛津公司;超高效液相色谱-三重四级杆串联质谱联用仪,美国Waters公司;pH计。
1.3 蓝莓果酒发酵工艺
实验所采用的果酒发酵工艺流程如图1所示。
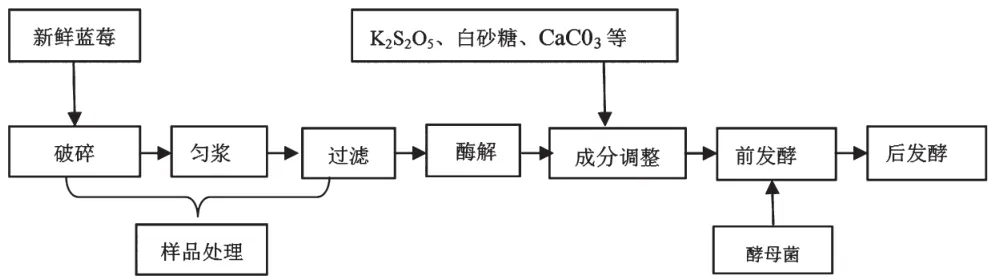
图1 蓝莓果酒发酵工艺流程图
①样品处理:挑选个体完好的新鲜蓝莓用榨汁机进行破碎、匀浆,使果肉破碎率达到90%以上。用纱布过滤,蓝莓果汁制备样品[4]。②酶解:加入果胶酶,将果汁置于60 ℃恒温水浴锅中2 h。③成分调整:以 蔗糖溶解调整果汁总糖,再用CaC03溶液调pH;加入0.01 g/L偏重亚硫酸钾。④前发酵:从安琪葡萄酒干 酵母、酿酒酵母2b1酿酒酵母a2中挑选适合蓝莓果汁发酵的酵母,加入不同实验组进行发酵,持续发酵约10 d左右。⑤后发酵:控制样品在相同条件下继续发酵, 时间20 d左右。
1.4 花青苷含量测定方法
分别取不同时期不同实验组的果酒样品1 mL于离心管中,加入80%的乙醇溶液定容至10 mL,浸提6 h,4 000 r/min,20 ℃下离心10 min,后取上清液加入比色管中,用紫外分光光度计在530 nm处测出每个样品中花青苷的吸光值,每组数据重复测3次,取平均值,绘制时间-花青苷吸光值曲线图,得出蓝莓果酒发酵过程中花青苷含量的变化规律[5]。
1.5 蓝莓果酒发酵过程中花青苷含量变化规律
1.5.1 不同酵母菌对花青苷含量变化规律的影响
分别将a2酵母菌和2b1酵母菌、分离纯化3次以上,并将其活化扩大培养24 h,之后分别接种到相同的蓝莓果汁中,每隔两天测1次发酵液中花青苷的吸光值,记录数据,得出发酵过程中对花青苷含量影响最小的酵母菌种,并将该酵母菌作为最优酵母,在之后的实验中均接种此酵母。
1.5.2 不同温度对花青苷含量变化规律的影响
取200 mL新鲜蓝莓汁于锥形瓶中,调整糖度为25°Bx,用CaC03调pH为3.3,加入0.01 g/L偏重亚硫酸钾,接入5%的最优酵母,分别控制发酵温度在22、24、26、28、30 ℃,持续发酵l5 d,发酵过程中每隔两天测1次发酵液中花青苷的吸光值。
1.5.3 不同初始糖度对花青苷含量变化规律的影响
取200 mL新鲜蓝莓汁于锥形瓶中,分别调整起始糖度含量分别为21、23、25、27、29°Bx,调pH为3.3,加入0.01 g/L偏重亚硫酸钟,接入5%的最优酵母,控制发酵温度26 ℃,持续发酵15 d,发酵过程中每隔两天测1次发酵液中花青苷的吸光值。
1.5.4 不同酵母添加量对花青苷含量变化规律的影响
取200 mL新鲜蓝莓汁于锥形瓶中,调整糖分在25°Bx,用0.3%的果胶酶在60 ℃下酶解30 min,再用CaC03调pH为3.3,加入0.01 g/L偏重亚硫酸钾,分别接入1%、3%、5%、7%、9%的最优酵母持续发酵15 d,发酵过程中每隔两天测1次发酵液中花青苷的吸光值。
1.5.5 不同果胶酶浓度对花青苷含量变化规律的影响
取200 mL新鲜蓝莓汁于锥形瓶中,调整糖分在25°Bx,分别加入0.2%、0.3%、0.4%、0.5%、0.6%的果胶酶,于60 ℃下水浴加热30 min,接入量为5%的最优酵母,用CaC03调pH为3.3,控制发酵温度26 ℃,持续发酵15 d,发酵过程中每隔两天测1次发酵液中花青苷的吸光值[6]。
1.5.6 不同初始pH对花青苷含量变化规律的影响
取200 mL新鲜蓝莓汁于锥形瓶中,调整糖度为25°Bx,用0.3%的果胶酶在60 ℃下酶解60 min,再加入0.01 g/L偏重亚硫酸钟,用CaC03分别调整pH为3.1、3.3、3.5、3.7、4.9。接入5%的最优酵母,在26 ℃下连续发酵15 d。发酵过程中每隔两天测1次发酵液中花青苷的吸光值。
1.6 蓝莓果酒发酵过程中花青苷种类的变化规律
采用超高效液相色谱-三重四级杆串联质谱联用仪测定蓝莓果酒中花青苷的种类[7]。
1.6.1 质谱方法的建立
离子源,电喷雾离子源(ESI);检测模式,多反应监测;扫描方式,正离子扫描;脱溶剂气流量,800 L/h;锥孔气流量,50 L/h;毛细管电压,3 kV;离子源温度,110 ℃;脱溶剂气温度,400 ℃[8]。
1.6.2 色谱条件
色谱柱,ACQUITYUPLC HSS C18柱(2.1 mm×50 mm,1.7 μm);流速 0.3 mL/min;柱温 40 ℃;进样量 10 μL。流动相A为乙腈,B为0.6%甲酸水溶液,进行梯度洗脱,梯度洗脱参数见表1。
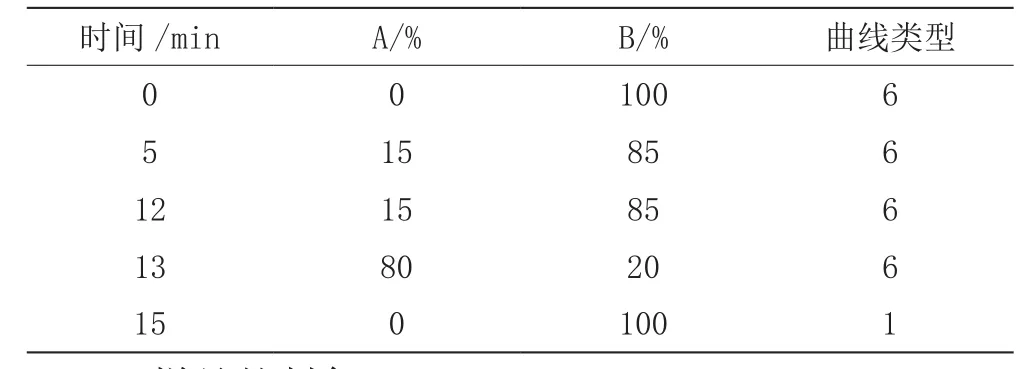
表1 超高效液相色谱条件表
1.6.3 样品的制备
果汁样:取100 mL新鲜蓝莓汁于旋转蒸发仪中,35 ℃下蒸发至水分挥干,4 000 r/min,离心5 min后倒出上清液,再用6%甲酸溶液定容至100 mL容量瓶中,取2 mL样品用微孔过滤膜(黄色)过滤后放在小瓶子里,进样测定。
果酒样:分别取不同时期的果酒100 mL于旋转蒸发仪中,挥干酒精和水分,4 000 r/min,离心5 min后倒出上清液,再6%甲酸溶液定容至100 mL容量瓶中,取2 mL样品用微孔过滤膜(黄色)过滤后放在小瓶子里,进样测定,与对照组进行比对,分析讨论蓝莓果汁在发酵过程中花青苷种类的变化,得出结论。
2 结果与讨论
2.1 蓝莓果酒发酵过程中花青苷含量的变化规律
2.1.1 不同酵母种类下花青苷含量的变化规律
由图2可知,3个菌种发酵的蓝莓果酒中花青苷含量都呈下降趋势,其中a2酵母菌的稳定性比2b1和安琪的好,对果酒发酵过程中花青苷的影响较小,且有利于发酵后期花青苷的保留,所以a2酵母菌确定为蓝莓果酒发酵最适酵母菌,之后进行的实验均接种该酵母。
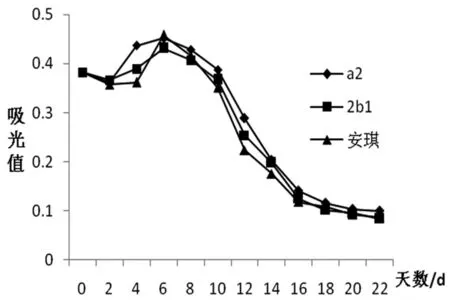
图2 不同酵母种类下花青苷含量的变化规律图
2.1.2 不同温度下花青苷含量变化规律
温度是影响酵母生长、繁殖与发酵的主要环境因素,酵母只能在一定的温度范围内才能生长并起发酵作用[9]。如图3所示,5个温度梯度下,花青苷的含量都呈下降趋势,第8~12 d时,5个温度梯度样品中花青苷含量都大幅下降。24 ℃时花青苷的下降趋势缓慢且最终保留量高于其他几个温度梯度,为最适发酵温度;30 ℃下花青苷含量下降最快,可能是由于温度越高,花青苷越不稳定,越容易分解,导致花青苷损失。
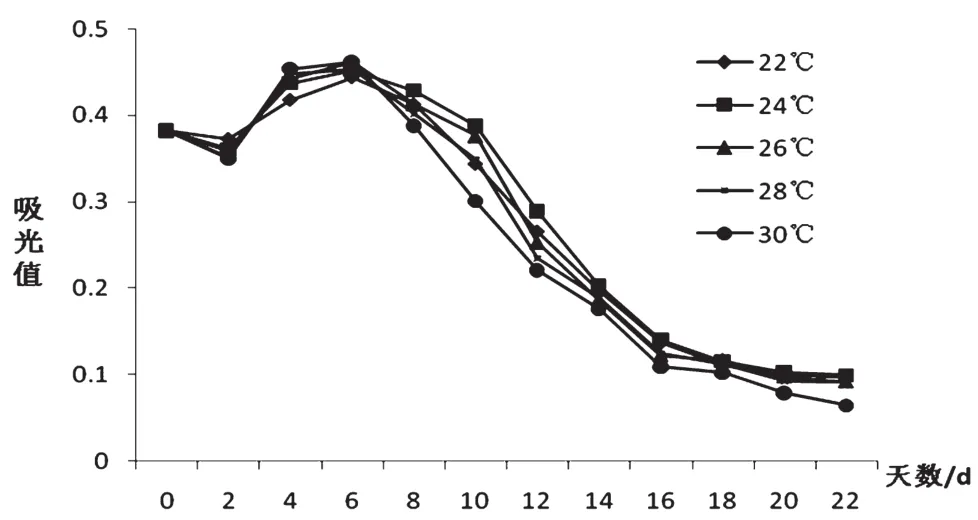
图3 不同温度对花青苷变化规律的影响图
2.1.3 不同初始糖度下花青苷含量变化规律
糖是酵母菌生长繁殖的能量来源,起始糖度对果酒发酵产生重要的影响。从图4可以看出,糖度对花青苷的影响程度较小,5个不同糖度梯度样品花青苷变化曲线的离散程度较小,变化规律几乎一致且都呈下降趋势,第8 d后花青苷的含量下降加快。初始糖度过大反而抑制了酵母的生长和发酵,发酵缓慢导致产生酒精较慢,而适当的糖度反而可以加快酒精的产生,有利于更多花青苷的溶解,25°Bx下花青苷的保留率大于其他,为最适糖度。
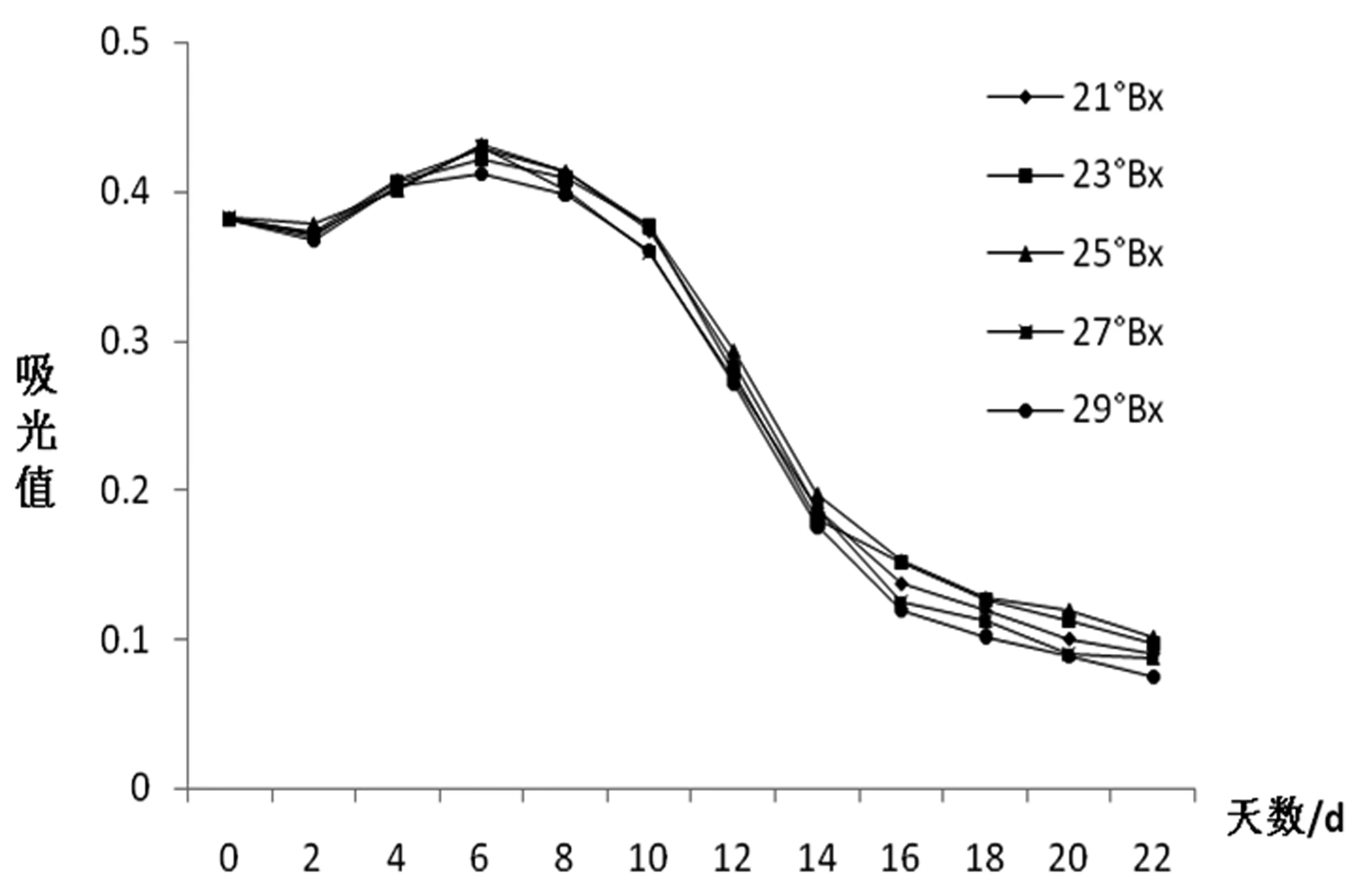
图4 不同糖度对花青苷变化规律的影响图
2.1.4 不同酵母添加量下花青苷含量变化规律
菌种是保证发酵顺利进行的重要保证,如图5所示,添加9%的酵母,在发酵的前4 d,由于发酵产生酒精,所以花青苷的含量较多,但第4 d后,花青苷的含量急剧减少,且最终保留率低,可能是因为接种量过大,导致酵母细胞繁殖过快,消耗大量糖分,不利于酒精的积累;而接种量过小,如添加1%的酵母,则导致发酵时间延长,前期花青苷含量不高,后期含量趋于稳定,且总体呈下降趋势。从图5中看出,5%的酵母是最适添加量。
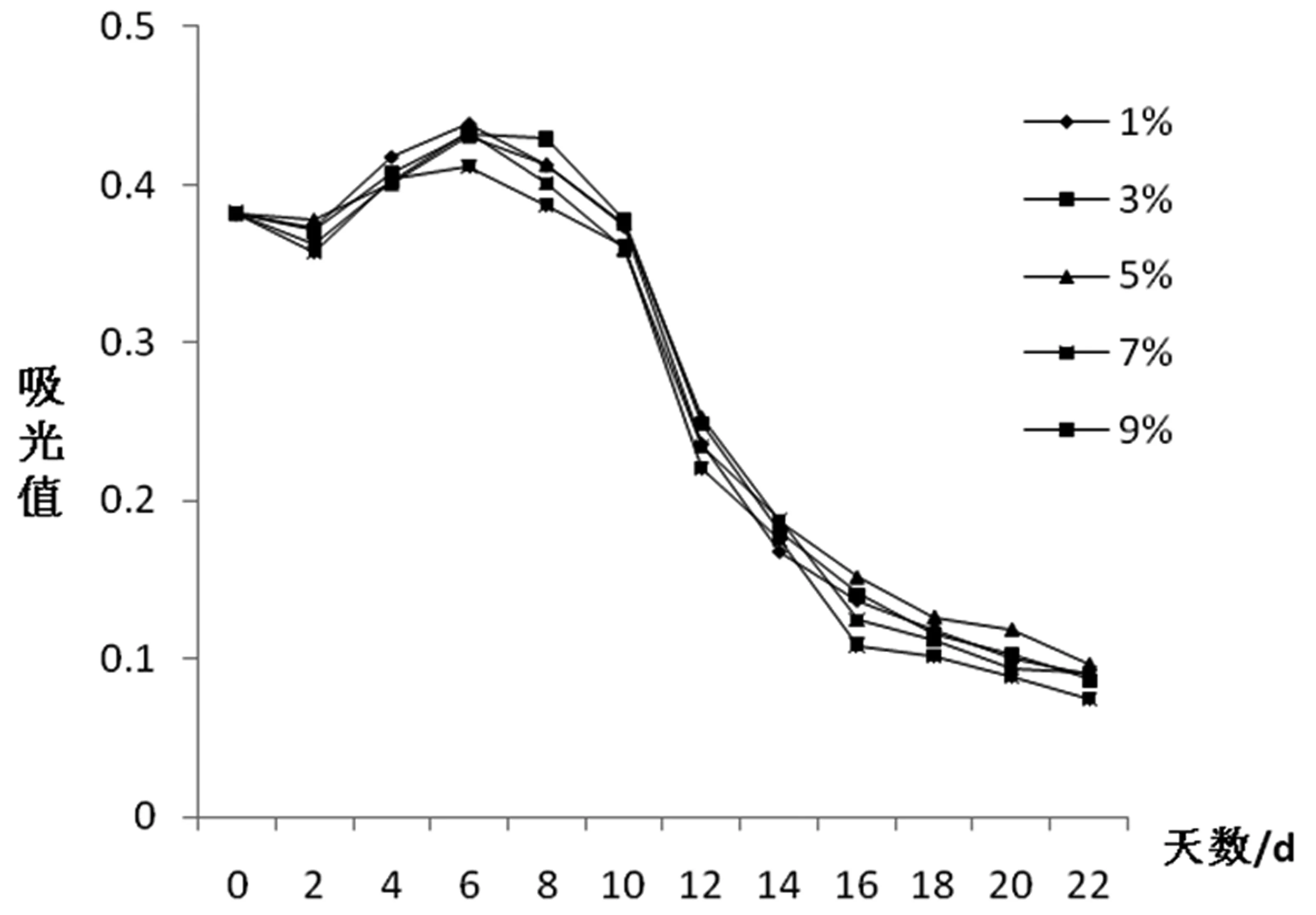
图5 不同酵母量对花青苷变化规律的影响图
2.1.5 不同果胶酶浓度下花青苷含量变化规律
蓝莓中含有丰富的果胶物质,会导致澄清困难、出汁率低等问题。试验表明,果胶酶的添加量对蓝莓果酒发酵过程中花青苷含量的影响几乎成正比,在标准范围内,果胶酶添加量越多则溶出的花青苷越多。但整个过程花青苷含量依然呈现下降趋势。如图6所示,在发酵第2~6 d有小幅度的上升,可能是因为酶解使更多的花青苷溶出,酶添加量越多,花青苷溶出越多,考虑到成本问题,选择0.5%为最适加酶量。
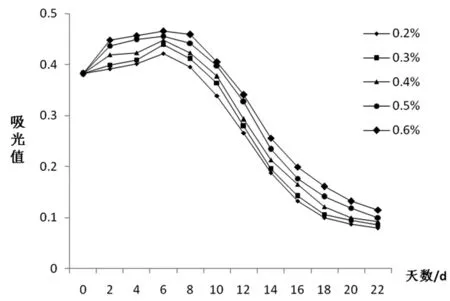
图6 不同果胶酶浓度对花青苷变化规律的影响图
2.1.6 不同初始pH下花青苷含量变化规律
在适宜微酸性环境下,酵母菌生长、繁殖和发酵都很迅速,且花青苷在pH 2~4是最稳定的[10],如图7所示,pH越高,越不利于花青苷的保留,pH 3.3时,花青苷保留率相对较高,但总体仍呈下降趋势,随着微生物对发酵液的降解,发酵液的pH会发生变化,在第8~14 d时,花青苷含量大幅下降。
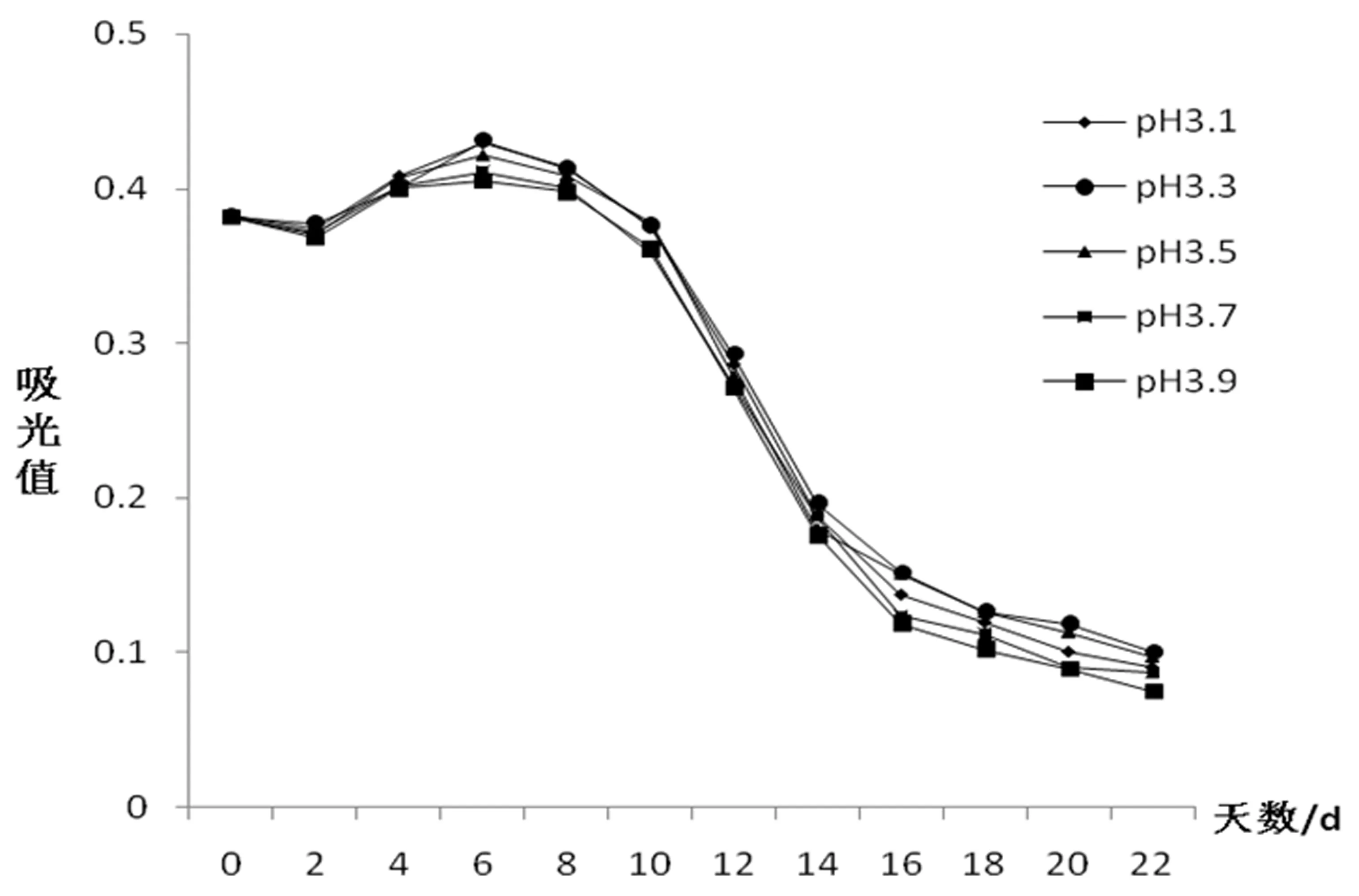
图7 不同pH对花青苷变化规律的影响图
2.2 蓝莓果酒发酵过程中花青苷种类的变化规律
通过超高效液相色谱柱对初始蓝莓汁样品进行分离,并用PDA检测器在530 nm处进行测定,色谱图中主要的峰有11个,可得蓝莓中主要的花青苷类物质为11种,其中保留时间分别为:2.58、2.85、3.10、3.41、3.52、3.65、3.79、4.05、4.38、4.61、4.93 min。如图8 所示。
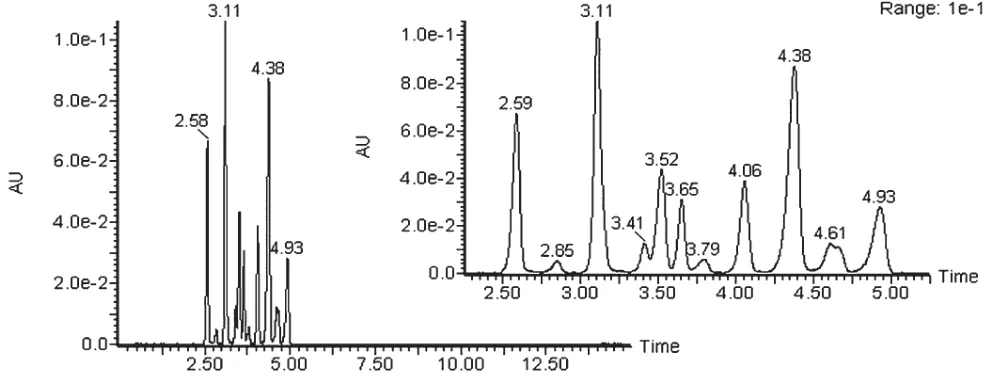
图8 超高效液相色谱图
通过UPLC/MS-MS对蓝莓果酒样品进行全扫描,并用PDA检测器在530 nm处进行测定,可得蓝莓中主要花青苷类物质有11种,其中保留时间分别为:2.63、2.87、3.13、3.44、3.55、3.69、3.81、4.09、4.41、4.69、4.96 min。将色谱图和质谱全扫描图谱对比可初步鉴定蓝莓果酒中也有11种花青苷类化合物,如图9所示。因此,在蓝莓果酒发酵过程中花青苷种类基本不变。
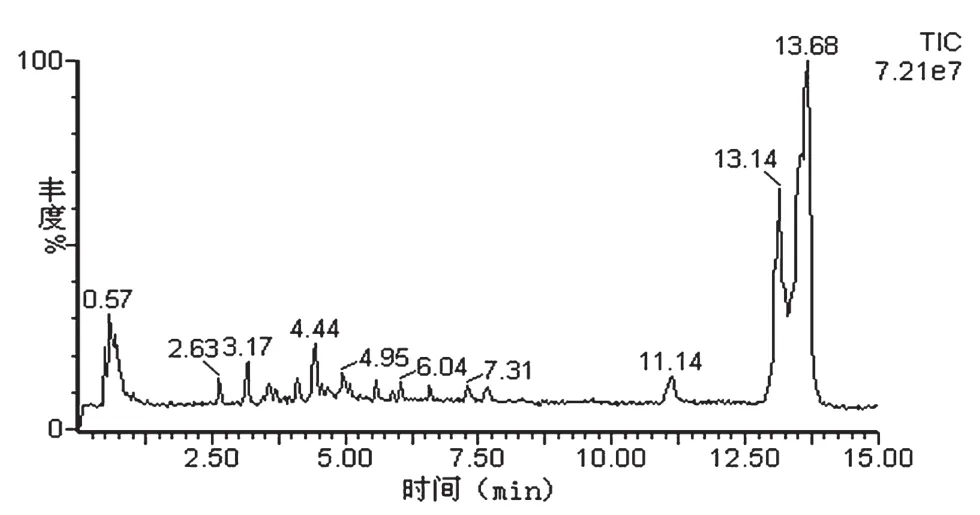
图9 UPLC/MS-MS全扫描图
3 结论
在蓝莓果酒发酵前20 d里,花青苷的变化规律如下:蓝莓果酒发酵过程中花青苷的种类基本不变,含量总体呈下降趋势;在发酵第2~6 d,花青苷含量略有上升,可能是发酵产生的酒精对花青苷进一步的溶解,之后花青苷含量则一直呈下降趋势,其中第8~12 d下降速度最快。在不同的发酵工艺中,对花青苷含量变化规律影响程度大小顺序为:温度>果胶酶浓度>酵母添加量>pH>初始糖度。其中,在温度为26 ℃、pH 3.3、酵母添加量为5%时,花青苷的保留率较高,为最适发酵条件;果胶酶的浓度对花青苷的影响几乎成正比,考虑成本问题,则选取浓度为0.5%,更有利于花青苷的保留;糖度过大或者过小都不利于酒精积累,从而降低花青苷的溶解,其中25°Bx为最适条件。
[1]李 丹.中国蓝莓业的现状及出口前景探析[D].大连:东北财经大学,2011.
[2]丁原春,范文广,韩 双,等.不同发酵工艺对蓝莓酒中花青素含量的影响[J].保鲜与加工,2014,14(6):47-50.
[3]庄惠婷.发酵石榴酒及其抗氧化性研究[D].泰安:山东农业大学,2011.
[4]柳晓晨,张秀玲,李赛男,等.蓝莓类冰酒发酵工艺研究[J].食品工业科技,2015,36(5):144-148,155.
[5]党 娅.蓝莓花青苷提取及组分分析研究[J].中国调味品,2015,40(5):76-81.
[6]叶万军.野生蓝莓混浊型果汁稳定性的研究[D].北京:中国农业科学院,2013.
[7]韩 豪,江 海,张志健,等.超高效液相色谱-三重四级杆串联质谱联用技术定性分析黑豆皮中花青苷类物质[J].食品与发酵工业,2014,40(8):194-200.
[8]韩 豪,李新生,江 海,等.UPLCMS/MS定性分析黑米中花青苷类物质[J].食品工业科技,2014,35(17):289-293,297.
[9]燕 娇.酸浆果酒酿造工艺研究[D].晋中:山西农业大学,2016.
[10]盖禹含,张东升,李亚东,等.蓝莓酒酿造酵母的筛选研究[J].食品科技,2010,35(6):50-53.

