不同表面形貌Cu2O空心球的制备及光催化性能
姚 巡 李明高 谢艳春 刘 飞 刘 钦刘 洋 李 鹏 薛睿庭 范希梅*,
(1西南交通大学材料科学与工程学院,材料先进技术教育部重点实验室,成都 610031)(2中车工业研究院有限公司,北京 100070)
不同形貌纳米材料的合成技术已经成为纳米科学领域的一个重要研究方向,由于纳米粒子的形貌和尺寸对纳米材料的性能有很大影响,具备不同形貌的同种纳米材料往往表现出不同的物理和化学性能[1]。Huynh等[2]研究表明己基噻吩掺杂不同尺寸CdSe纳米棒的太阳能电池可获得不同的光电转化率。Mock等[3]制备出了具有不同形貌的胶体银,发现在等离子体共振体中,球形、五角星形和三角形的胶体银分别显示出了蓝色、绿色和红色。因此,合成形貌和尺寸可控的纳米颗粒已经成为材料科学领域的一个研究重点[4]。
氧化亚铜(Cu2O)是一种典型的p型半导体,禁带宽度为2.17 eV[5],具有较高的光吸收系数和优良的光电性能,使其成为在电子、催化、光学器件和气体传感器等领域具有潜在应用前景的材料[6-9]。在过去的几十年中,大量的研究致力于控制Cu2O的形态,如纳米线[10],纳米立方体[11],空心球[12],八面体[13],花状[14],星形状[15]。Wang等[16]利用十六烷基三甲基溴化铵(CTAB)囊泡合成了具有多层纳米结构的空心Cu2O球体。另外,Qi等[17]通过葡萄糖还原铜盐法合成八面体Cu2O纳米笼。目前,虽然已有很多方法制备不同形貌的Cu2O,但是合成表面形貌可控的Cu2O空心球的研究还较少。而多维结构的空心微球在光催化降解液相污染物时具有低密度、易发生光的折射等特点,从而具有易于光捕获、易于污染物吸附等物理结构优势[18-22]。
本文以简单的一步液相法,在高温条件下,通过改变Cu(NO3)2·3H2O与PVP的质量比值,在EG体系中合成表面形貌不同的Cu2O微球,改变反应时间对Cu2O微球生长过程做了进一步的研究。采用X射线衍射仪(XRD)、扫描电子显微镜(SEM)、N2吸附-脱附测试、紫外-可见漫反射吸收光谱(UVVis DRS)以及光致发光光谱(PL)对其结构、形貌及性能等进行表征,并以甲基橙(MO)为目标污染物,在可见光条件下对其光催化性能进行研究。
1 实验部分
1.1 Cu2O制备
Cu2O的制备流程如图1所示。将一定量的PVP添加到装有90 mL EG的烧杯中,并将烧杯放置到40℃油浴中,磁力搅拌至粉末完全溶解,得到溶液A。再称取一定量的Cu(NO3)2·3H2O溶解在10 mL蒸馏水中,得到蓝色溶液B。然后将溶液A与溶液B混合并搅拌均匀,调节反应温度至180℃反应30 min。最后,将烧杯在空气中自然冷却至室温。把反应完的悬浮液用蒸馏水离心5次、无水乙醇离心5次后于干燥箱中60℃干燥12 h即可得到样品。不同样品的实验条件如表1和表2所示。

表 1 不同wCu(NO3)2·3H2O/wPVP 的条件下制备纳米 Cu2O材料的工艺参数Table 1 Parameters of the preparation of Cu2Onanomaterials under different radios
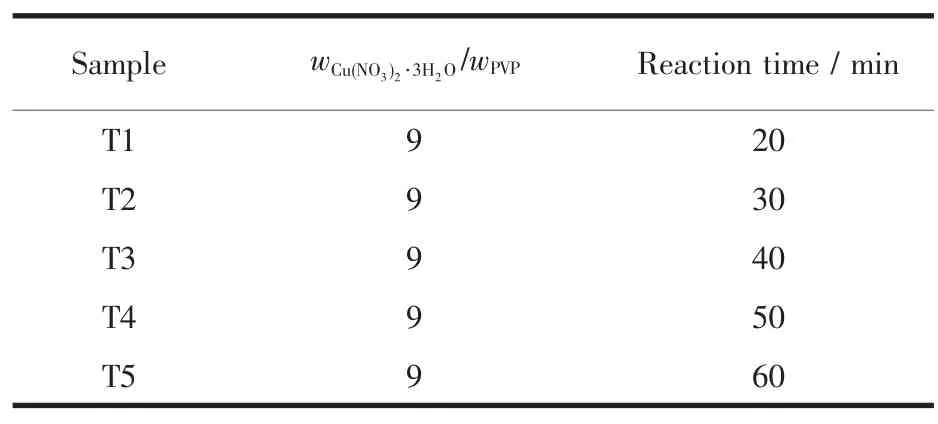
表2 不同反应时间制备纳米Cu2O材料的工艺参数Table 2 Parameters of the preparation of Cu2O nanomaterials under different reaction times
1.2 Cu2O表征
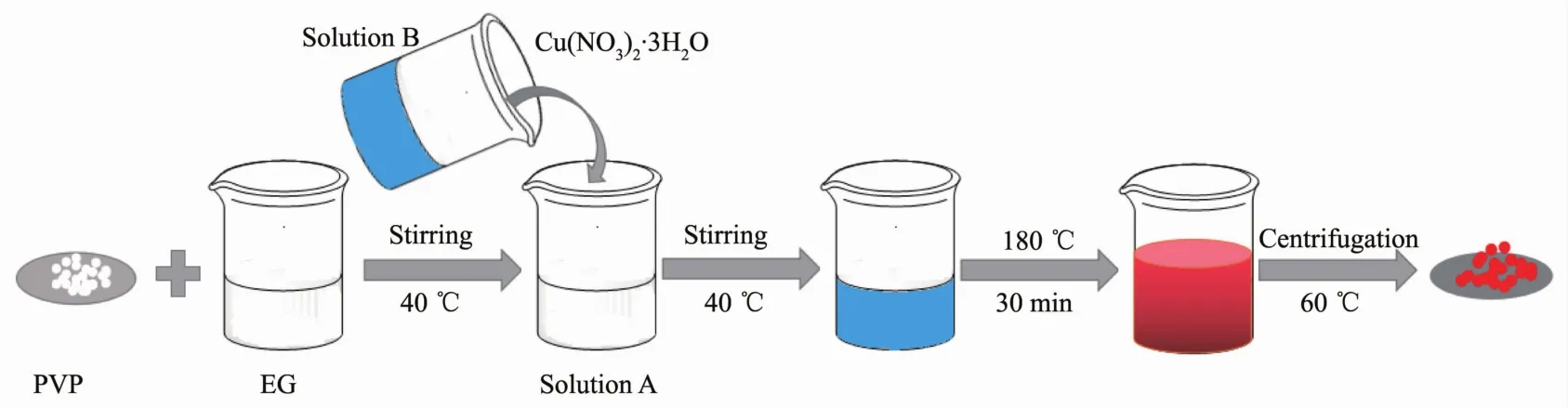
图1 Cu2O制备流程图Fig.1 Preparation process of Cu2O
样品的XRD测试在德国DX-2500型X射线衍射仪上进行,掠入角为0.5°,步宽为0.03°,靶材为Cu Kα,波长 λ=0.154 06 nm,扫描范围为 10°~90°;采用美国Fei公司Quanta 200型的扫描电子显微镜(SEM)观察样品的微观形貌,检测前喷金,工作电压20 kV;采用日本岛津公司Shimadzu 2550型紫外分光光度计(UV-Vis)检测阵列的投射率,扫描步长为0.5 nm,波长范围为300~800 nm;采用英国爱丁堡FLS-980型稳态/瞬态荧光光谱分析仪检测样品的光致发光谱(PL);采用日本岛津UV-2550型紫外可见漫反射仪检测样品的紫外可见漫反射吸收光谱(UV-Vis DRS);采用美国麦克ASAP2020型比表面积与孔径分析仪测定样品的比表面积(SBET)和孔径分布,工作温度为77 K,测试前将待测样品于120℃下脱气3 h;催化装置自制。
1.3 光催化性能测试
将50 mg催化剂加入到50 mL浓度为10 mg·L-1的MO溶液中,然后将混合溶液在黑暗中搅拌5 min,在光催化剂表面实现MO分子的吸附脱附平衡。光催化反应在自制光催化反应器(图2)中进行。将40 W的钨丝灯作为可见光源,固定在距离溶液表面14 cm的位置。每10 min取部分液体放入离心管中,在8 000 r·min-1的离心机中离心5 min后取上层清液,通过UV-Vis分光光度计测定反应液的吸收光谱。根据MO最大吸收波长466 nm处的吸光度,采用朗伯-比耳定律计算溶液浓度。

图2 MO降解装置图Fig.2 Equipment of photocatalysis
2 结果与讨论
2.1 XRD分析
2.1.1 不同质量比值制备样品的XRD分析
图3为不同质量比值制备样品的XRD检测结果。从图中可以看出,合成的样品均在29.647°、36.521°、42.423°、61.552°、73.739°和 77.611°等处出现了衍射峰,分别对应Cu2O的 (110),(111),(200),(220),(311)和(222)晶面,所有的衍射峰与中心立方晶系的特征峰(PDF No.00-005-0667)一致,并且没有其他的衍射峰出现,证明样品为纯的Cu2O。
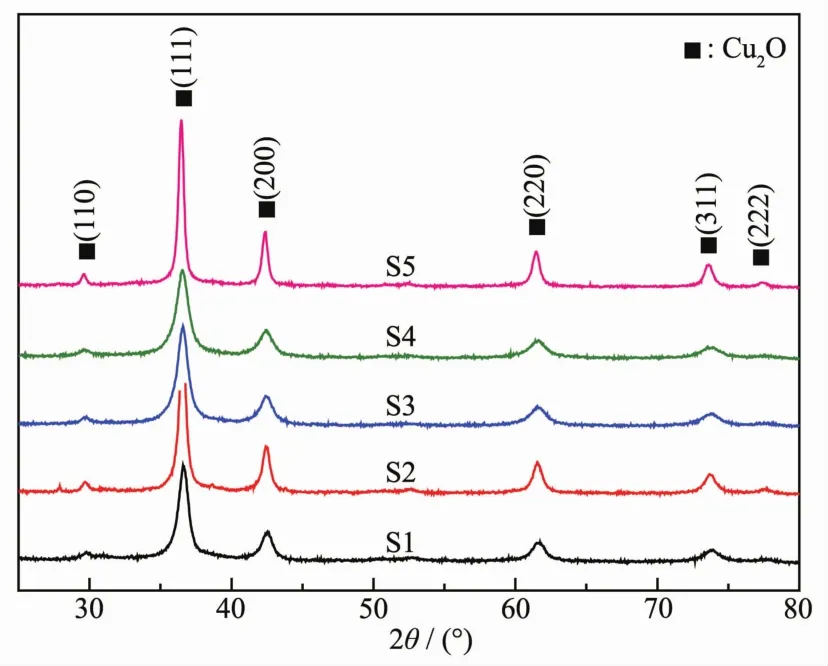
图3 不同质量比值制备Cu2O样品的XRD图Fig.3 XRD patterns of as-prepared products synthesized with different mass ratios
2.1.2 不同反应时间样品的XRD分析
图4为9时,不同反应时间制备的不同样品的XRD图,结果显示反应时间为20、40、50和60 min条件下的样品衍射峰与反应时间为30 min样品衍射峰未发生明显的变化,说明得到的样品为纯的Cu2O。

图4 不同反应时间制得Cu2O的XRD图Fig.4 XRD patterns of as-prepared products synthesized with different reaction times
2.2 SEM分析
2.2.1 不同质量比值制备样品的SEM分析

图5 不同质量比值)制备的Cu2O的SEM图Fig.5 SEM images of Cu2O under differentVP
为了进一步观察Cu2O的微观形貌,我们对样品进行了SEM 测试(图 5)。 图 5(a~e)分别表示=45,22.5,15,11.25 和 9 时制备样品的微观形貌图,可知样品均由直径为1~2 μm的微球组成。当wCu(NO3)2·3H2O/wPVP=45时,微球的表面是粗糙的并且覆盖着纳米刺,这些纳米刺的尺寸为几十纳米(图 5a)。 当 wCu(NO3)2·3H2O/wPVP=22.5 时,Cu2O 微球的表面除了有一些纳米刺外,还出现了纳米立方体结构(图 5b)。当 wCu(NO3)2·3H2O/wPVP=15 和 11.25 时,微球的表面覆盖着纳米立方体,纳米立方体的尺寸大概为20~80 nm,同时,质量比值为11.25时,微球还出现了一些纳米球形颗粒(图 5(c,d))。 当 wCu(NO3)2·3H2O/wPVP=9时,微球表面全部由球型的小颗粒团聚而成,球型颗粒的直径为50 nm左右,如图5e所示。此外,从图5(a~d)可以看出,得到的Cu2O微球表面都出现了一些小孔洞。
2.2.2 不同反应时间样品的SEM分析
在对钢轨波磨区进行波磨统计分析和系统的测量研究后认为,钢轨的波磨直接与钢轨的材质有关。通过对各种类型的钢轨波磨进行研究发现,发现波磨主要跟钢材的化学成分、钢轨的处理和钢轨的表面状态三大因素有关。
由于Cu2O微球表面出现了一些小孔洞(图5(a~d)),我们推测得到的Cu2O微球有可能为空心球结构。 而从图 5e看出,wCu(NO3)2·3H2O/wPVP=9 时,反应时间为30 min,得到完整的Cu2O微球,因此我们在此工艺基础上,进一步改变反应时间来研究Cu2O微球的生长过程。

图6 不同反应时间条件下Cu2O的SEM图Fig.6 SEM images of Cu2O under different reaction times
图 6(a~e)为 wCu(NO3)2·3H2O/wPVP=9 时,反应时间分别为 20,30,40,50 和 60 min 条件下所制得的样品SEM图。从6a可以看出,得到微球是开口的,由此可知,这些球为空心结构。当反应时间为30和40 min时,得到的Cu2O微球状结构比较完整(图6(b,c))。从图6(d,e)可以看出,当反应时间为50和60 min时,所制得的Cu2O球发生破裂解体,解体后的纳米颗粒团聚在一起。
2.3 生长机理
合成Cu2O是在EG溶液中进行,溶液中只有Cu(NO3)2·3H2O 和 PVP,在这个反应过程中,PVP作为保护剂,EG作为分散媒介和还原剂。EG在高温下脱水生成乙醛(CH3CHO),CH3CHO能够贡献一个氢原子(H)[23],如方程式(1)所示。新生成的氢原子(H)作为还原剂将Cu(NO3)2·3H2O还原成Cu2O,如方程式(2)所示。化学反应方程式如下:

在合成Cu2O反应中,PVP不仅作为保护剂,也作为表面活性剂,能够选择性地与Cu2O晶体的不同晶面吸附(物理吸附或化学吸附)。在Cu2O晶体生长过程中,一些吸附PVP的晶面其生长速率降低,没有吸附PVP的晶面生长速率保持不变[4],这就可以通过改变Cu(NO3)2·3H2O与PVP的质量比值来控制Cu2O形貌。在反应时间为30 min,wCu(NO3)2·3H2O/wPVP=45时,PVP的浓度较低,Cu2O晶体只有一部分晶面与PVP吸附,这就导致了晶体各向异性的生长,Cu2O球表面为刺状。当wCu(NO3)2·3H2O/wPVP=15时,PVP浓度增大,Cu2O晶体更多的晶面吸附PVP,Cu2O球表面由刺状变成立方体状。wCu(NO3)2·3H2O/wPVP=9时,Cu2O所有的晶面几乎都吸附PVP,出现了等轴生长,Cu2O球表面由球形小颗粒团聚而成。
基于对20和30 min条件下Cu2O形貌和结构的研究结果,我们提出了一个可能的机理来解释Cu2O空心结构的生长过程:如图7所示,长链状的聚合物PVP,在溶液中会变成柔软的线圈,这些线圈会趋向于缠结在一起形成伪球状,作为空心球结构的模板,溶液中的Cu2+会聚集在PVP形成的伪球状周围。随着温度升高,Cu2+和PVP自主装成核壳胶束。EG作为还原剂通过均相成核作用将Cu2+还原成Cu1+[23],即生成Cu2O。然后通过洗涤、离心将里面PVP分离出来,得到空心结构的Cu2O。

图7 Cu2O空心球生长机理示意图Fig.7 Cu2O hollow spheres growth mechanism
2.4 BET及孔径分析
众所周知,光催化剂的比表面积影响其光催化活性,比表面积值越大,吸附污染分子和活性物质的活性位点越多,光催化反应更有效。图8(a~c)分别为77 K下样品 S1,S3,S5的N2吸附-脱附等温曲线和孔径分布图。从图中可以看出,3个样品的吸附-脱附等温曲线均呈Ⅳ型,H3型滞后环,说明制备的样品含有介孔结构。从孔径分布(图8内插图)可以看出样品的孔径主要分布在3~25 nm,所以孔径分布主要为介孔分布。样品的比表面积和平均孔径大小的定量分析如表3所示,从表3中可以看出,表面形貌为刺状的Cu2O比表面积最大,表面形貌为球形颗粒的Cu2O其次,而表面形貌为纳米立方体的Cu2O比表面积(SBET)最小。

表3 不同样品的比表面积和孔径Table 3 BET surface areas and average pore diameters of the different samples
2.5 UV-Vis DRS分析
图9a为样品S1,S3,S5的紫外-可见漫反射吸收光谱图。从图中可以看出,样品在可见光范围内均有明显的吸收,并且样品S1的吸收强度最强,S5次之,而S3的吸收强度最弱。根据公式计算样品的禁带宽度:

图8 不同样品的N2吸附-脱附等温曲线和孔径分布曲线Fig.8 Nitrogen adsorption-desorption isotherms of different samples

图9 不同质量比值制备样品的UV-Vis DRS光谱(a)和禁带宽度(b)Fig.9 UV-Vis diffuse reflectance absorption spectra(a)and energy gap(b)of as-synthesized Cu2O at different mass ratios

2.6 PL分析
半导体材料的PL光谱通常被用于研究其电子-空穴对的再复合率,低的峰强意味着低的电子-空穴对的再复合[26-27]。图10为样品S1,S3,S5在激发波长为308 nm时得到的PL图谱。从图中可以看出,3个样品在618 nm处都存在一个可见光发射峰,并且S3的特征峰强度最强,S5次之,而样品S1的最弱。因此S1在受到光激发时材料内部电子-空穴对的再复合率相对较低,而S3的再复合率相对较高。
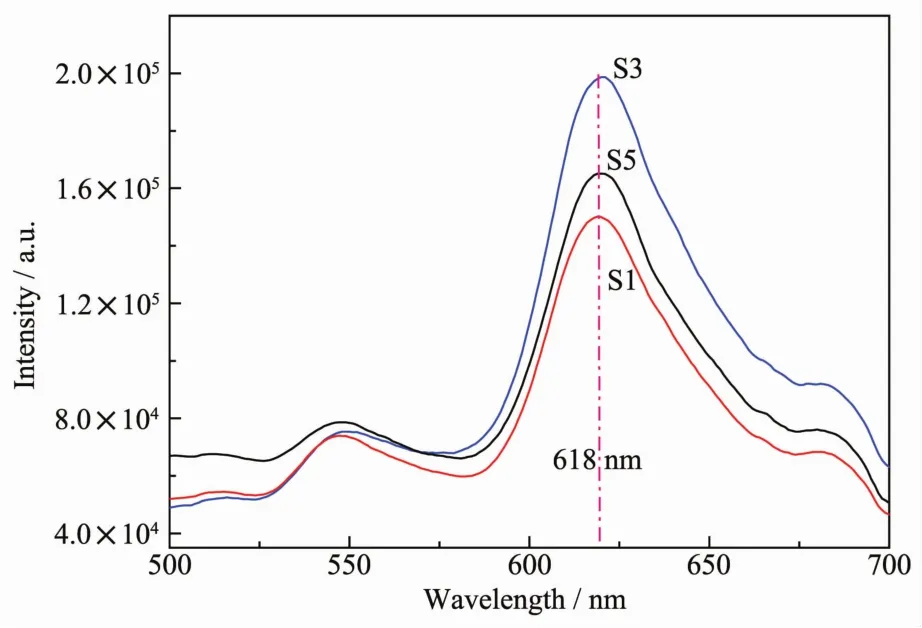
图10 不同质量比值制备样品的PL光谱Fig.10 PL spectra of as-synthesized Cu2O at different mass ratios
2.7 不同样品的光催化性能分析
图11(a~e)分别为样品S1-S5在可见光辐照下对MO溶液的光催化降解全谱图。从图中可以看出,随着可见光辐照时间的延长,MO在465 nm处的最大吸收峰的强度逐渐降低。图11f为样品S5降解MO溶液的宏观图,从图中可以看出,随着辐照时间的延长,MO溶液的颜色变得越来越浅。
图12所示为不同质量比值条件下制备的Cu2O纳米材料在1 h内在可见光照射下对MO溶液的光催化降解效率。MO的降解效率可以通过以下方程计算:

图11 不同样品在可见光辐照下对MO溶液的光催化降解全谱图(a~e)以及S5降解MO的宏观图(f)Fig.11 Absorption spectra(a~e)of MO solution with different samples after different irradiation times under visible light irradiation;(f)Macroscopic picture of MO degradated by S5 after different irradiation times

A0代表MO的达到吸附平衡时的浓度,At代表经过光照时间t后的MO浓度[28]。从图12可以看出,样品S1、S2、S3、S4、S5 对 MO 溶液的降解效率都随着光照时间的延长而增加。此外,通过对比可知,在相同的条件下,S1对MO的光催化效率最好,10 min降解效率可达94.3%,S5、S2和S4次之,而S3最差,60 min降解效率仍然只有37.1%。从图5(a)可以看出S1球形表面为纳米刺状,由BET、UV-Vis DRS和PL分析可知其比表面积大,吸光能力强,在受到光激发时材料内部电子-空穴复合率相对较低,因而光催化性能好。此外,S5的降解效率大于S3,结果与前面BET、UV-Vis DRS和PL表征分析相符合。
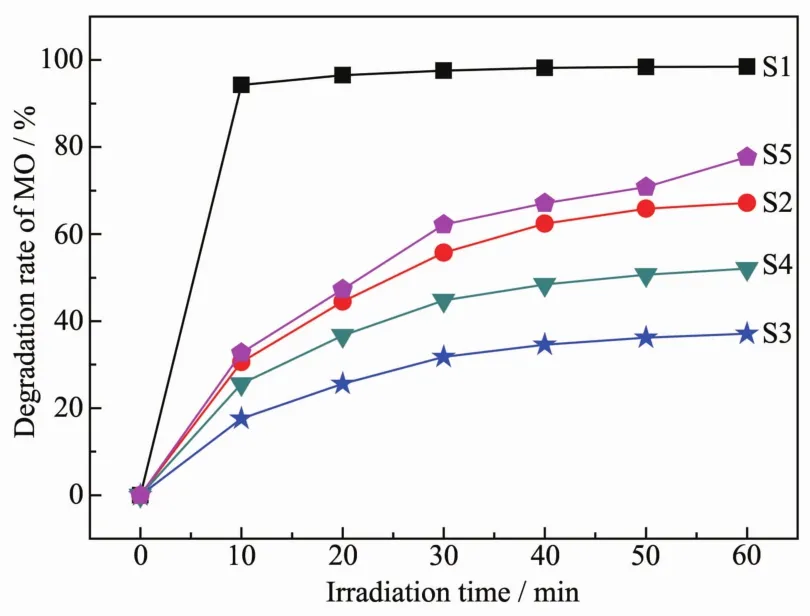
图12 不同质量比值的样品在可见光辐照下对MO溶液的降解效率图Fig.12 Photocatalytic degradation rate of MO with samples obtained with different mass radios

图13 不同反应时间制备的样品在可见光辐照下对MO溶液的降解效率图Fig.13 Photocatalytic degradation rate of MO with samples obtained with different times
图13所示为不同反应时间条件下制备的Cu2O纳米材料在1 h内在可见光照射下对MO溶液的光催化降解效率。通过对比可知,在相同条件下,T1的的光催化效率最好,60 min能达到90.2%,而T4、T5的降解效率比较差,60 min降解效率分别只能达到23.2%和19%。由图6可知,反应时间为20 min时得到的Cu2O是开口的空心球,其暴露面积大于完整的Cu2O,所以T1的降解效率大于T2。反应时间为50和60 min时,所制得的Cu2O球发生破裂解体,解体后的纳米颗粒团聚在一起,相对于空心结构的Cu2O,暴露面积大大减小,从而降解效率很低。因此说明空心结构有助于提高半导体材料的光催化性能。
为了检测Cu2O纳米光催化剂在催化过程中的化学稳定性以及重复利用率,对样品S1进行了5个周期降解MO溶液的循环实验,如图14所示。从图中可以看出,第5次的降解效率仍然很高,60 min后依然可达89.2%。因此说明该Cu2O纳米材料有很好的稳定性。
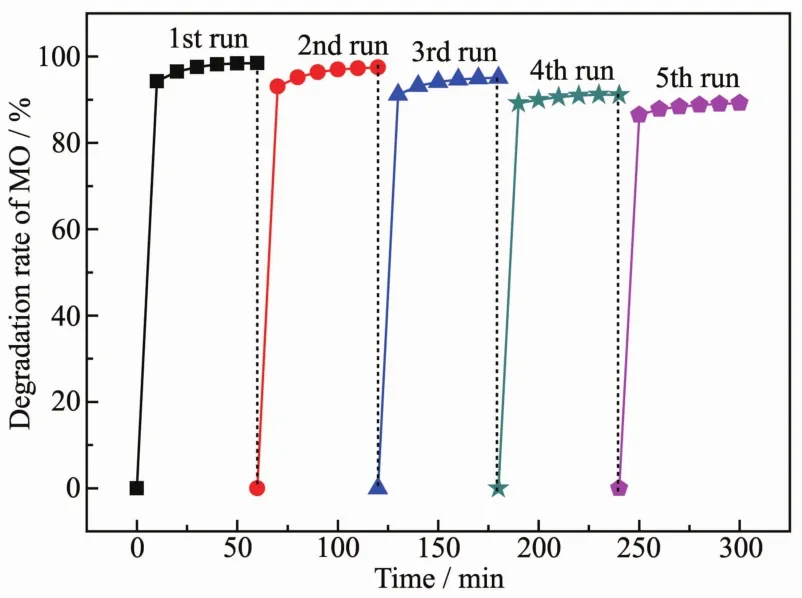
图14 S1降解MO的循环试验图Fig.14 Photocatalytic degradation rate of MO solution for recycles of S1
2.8 光催化机理
如图15所示,在可见光的照射下,Cu2O价带中的电子被激发到导带,形成电子(e-)和空穴(h+)对。一方面,e-与溶液中 O2结合产生超氧自由基(·O2-);另一方面,h+可以将H2O氧化形成羟基自由基(·OH)。具有强氧化性的·O2-和·OH可以把吸附在半导体表面的MO氧化成CO2和H2O。

图15 光催化机理Fig.15 Photocatalytic mechanism
3 结 论
在180℃条件下,以Cu(NO3)2·3H2O为原料,PVP为表面活性剂,EG为还原剂,采用简单的一步液相溶剂热法成功的合成了Cu2O微球。结果表明,通过改变Cu(NO3)2·3H2O与PVP的质量比值,可以制备出表面形貌为纳米刺、立方体和球形的Cu2O微球,在wCu(NO3)2·3H2O/wPVP=9时,改变反应时间对样品微观形貌做进一步的研究,可以发现制备出的Cu2O微球为空心结构。并且表面形貌为纳米刺的Cu2O空心球光催化性能最好,在可见光辐照10 min条件下,对MO溶液的降解率可达到94.3%。
[1]Zhu J W,Wang Y P,Wang X,et al.Powder Technol.,2008,181(3):249-254
[2]Huynh,W U,Dittmer J J,Alivisatos A P.Science,2002,295(5564):2425-2427
[3]Mock J J,Barbic M,Smith D R,et al.J.Chem.Phys.,2002,116(15):6755-6759
[4]Zhang H,Ren X,Cui Z L.J.Cryst.Growth,2007,304(1):206-210
[5]Zhang X X,Song J M,Jiao J,et al.Solid State Sci.,2010,12(7):1215-1219
[6]Tan Y W,Xue X Y,Peng Q,et al.Nano Lett.,2007,7(12):3723-3728
[7]Mao B G,Chu D Q,Wang L M,et al.Mater.Lett.,2013,109:62-65
[8]Zhang J T,Liu J F,Peng Q,et al.Chem.Mater.,2006,18(4):867-871
[9]ChangY,TeoJJ,ZengHC.Langmuir,2005,21(3):1074-1079
[10]Hafez M,Al-Marzouki F,Mahmoud W E.Mater.Lett.,2011,65(12):1868-1870
[11]Gou L F,Murphy C J.Nano Lett.,2003,3(2):231-234
[12]Yu H G,Yu J G,Liu S W,et al.Chem.Mater.,2007,19(17):4327-4334
[13]Zhang X J,Wang G F,Wu H B,et al.Mater.Lett.,2008,62(28):4363-4365
[14]Liang Z H,Zhu Y J.Mater.Lett.,2005,59(19):2423-2425
[15]Chu X Z,Cheng Z P,Xu J M,et al.Mater.Lett.,2015,159:297-300
[16]Xu H L,Wang W Z.Angew.Chem.Int.Ed.,2007,46(9):1489-1492
[17]Lu C H,Qi L M,Yang J H,et al.Adv.Mater.,2005,17(21):2562-2567
[18]Yu C L,Zhou W Q,Liu H,et al.Chem.Eng.J.,2016,287:117-129
[19]Yu C L,Zhou W Q,Yang K,et al.J.Mater.Sci.,2010,45(21):5756-5761
[20]Yu C L,Jimmy C Y,Chan M.J.Solid State Chem.,2009,182(5):1061-1069
[21]Yu C L,Chao F F,Li X,et al.Chem.Eng.J.,2013,219:86-95
[22]Yu C L,Yang K,Xie Y,et al.Nanoscale,2013,5(5):2142-2151
[23]Wan S M,Guo F,Shi L,et al.J.Mater.Chem.,2004,14(16):2489-1491
[24]Jin Y X,Cui Q L,Wang K,et al.J.Appl.Phys.,2011,109(5):053521
[25]Ng C H B,Fan W Y.J.Phys.Chem.B,2006,110(42):20801-20807
[26]Yang Z M,Zhang P,Ding Y H,et al.Mater.Res.Bull.,2011,46(10):1625-1631
[27]Fan X M,Lian J S,Guo Z X,et al.Appl.Surf.Sci.,2005,239(2):176-181
[28]Zhang H,Zhou D,Zhang L N,et al.J.Nanosci.Nanotechnol.,2009,9(2):1321-1325

