例析高考中滴定分析法常见考查方式
王 春
(浙江省柯桥中学 310020)
滴定分析法是一种重要的定量分析方法.近年来,滴定分析法频频在高考试题中出现.首先赏析两道高考题.

例1 (2014年重庆理综,9)中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定.
(1)仪器A的名称是____,水通入A的进口为____.
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为____.

(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的____;若滴定终点时溶液的pH=8.8,则选择的指示剂为____;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)____(①=10 mL,②=40 mL,③<10 mL,④>40 mL).
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:____g·L-1.
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施____.
答案:(1)冷凝管或冷凝器,b

(5)原因:盐酸的挥发;改进措施:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响.
此题对滴定的考查比较全面,分别有滴定操作、指示剂的选择、数据处理和误差分析.
例2 (2017年天津卷删减)用沉淀滴定法快速测定NaI等碘化物溶液中c(I-).滴定的主要步骤: ①取待测NaI溶液25.00 mL于锥形瓶中.②加入25.00 mL 0.1000 mol·L-1AgNO3溶液(过量),使I-完全转化为AgI沉淀.③加入NH4Fe(SO4)2溶液作指示剂.④用0.1000 mol·L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定.⑤重复上述操作两次.三次测定数据如下表:
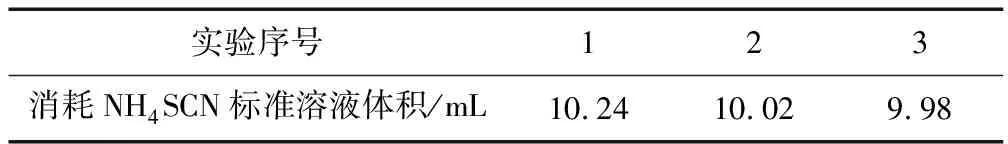
实验序号123消耗NH4SCN标准溶液体积/mL10.2410.029.98
⑥数据处理.
回答下列问题:
(1)所消耗的NH4SCN标准溶液平均体积为____mL,测得c(I-)=____mol·L-1.
(2)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为____.
(3)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果____.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果____.
答案:(1)10.00 0.0600
(2)用NH4SCN标准溶液进行润洗
(3)偏高 偏高
由上两题可看出滴定分析法常见的考查点有:1.滴定前的准备工作;2.滴定步骤及操作;3.数据分析及处理;4.误差分析,因此在平常的学习中对滴定的知识点必须要全面细致的掌握.
下面对滴定的知识点进行归纳总结(以0.1000mol/L的盐酸滴定未知浓度的氢氧化钠溶液为例).
1.滴定前的准备工作
(1)滴定管的选择:酸性、氧化性的试剂(如溴水、KMnO4溶液等)用酸式滴定管,因为酸和氧化性物质易腐蚀橡胶管;碱性物质(如NaOH、Na2CO3溶液等)用碱式滴定管,因为碱性物质易腐蚀玻璃,致使活塞无法打开.
(2)滴定管使用:查漏—洗涤—润洗—装液—排气泡—调液面—计数
查漏的办法是:酸式滴定管将旋塞关闭,将滴定管装满水后垂直架在滴定管夹上,放置 2min,观察管口及旋塞两端是否有水渗出,随后再将旋塞转动180°,再放置2min,看是否有水渗出.碱式滴定管应选择大小合适的玻璃珠和橡皮管,并检查滴定管是否漏水.
润洗是用待装液分别润洗酸式滴定管和碱式滴定管.润洗的基本操作是:从滴定管上口加入少量待装液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2~3次.
排气泡的操作是:酸式滴定管可转动旋塞,使溶液急速冲下排除气泡;碱式滴定管则可将橡皮管向上弯曲,并用力捏挤玻璃珠所在处,使溶液从尖嘴喷出,即可排除气泡.
排除气泡后调节溶液液面,使之在“0”刻度或“0”刻度以下,等1~2min后读数,读数精确至 0.01mL,备用.
(3)锥形瓶:只用蒸馏水洗涤干净,不能用待装液润洗.
(4)指示剂的选择:①由于石蕊的变色现象不够清晰所以不用石蕊作指示剂.②强碱弱酸滴定时,由于滴定终点为碱性所以选用碱性范围变色的试剂酚酞.③强酸弱碱滴定时,由于滴定终点为酸性所以选用酸性范围变色的试剂甲基橙.④强酸强碱滴定时甲基橙和酚酞均可用.⑤不是所有的滴定都需要指示剂,如用标准的Na2SO3溶液滴定KMnO4溶液时,KMnO4溶液颜色褪去即为终点.
2.滴定步骤及操作

(1)用碱式滴定管量25 mL待测氢氧化钠溶液放入锥形瓶里,滴入几滴甲基橙指示剂,振荡锥形瓶使溶液充分混合,这时溶液呈黄色.(2)如图所示,把锥形瓶放在酸式滴定管的下面,瓶下垫一白瓷板或一张白纸.右手拿住锥形瓶,左手小心地旋转酸式滴定管的旋塞使酸滴下,边滴边摇动锥形瓶(向一个方向作圆周转动),眼睛注视锥形瓶内溶液颜色的变化,直到加入一滴酸后溶液颜色从黄色变为橙色,静置半分钟颜色不再变化,这就表示已到达滴定终点.(3)读取滴定管液面所在刻度的数值,记录.
3.滴定终点判断和描述
该例中滴定终点判断是:滴入最后一滴盐酸时溶液褪色,且半分钟内不恢复红色.
高考中常考滴定终点的描述,其规范描述是:当滴入最后一滴×××标准溶液后,溶液变成×××色,且半分钟内不恢复原来的颜色.
4.数据分析处理
记录用去盐酸的体积,根据有关公式计算出氢氧化钠的浓度.
5.误差分析

在高考中常见的误差有:(1)滴定前仰视读数,滴定后俯视读数.(偏低)原因:仰视读数导致V(始)增大,俯视读数导致V(终)偏小,所以V(标准)减少.(2)酸式滴定管滴定前有气泡,滴定终点时气泡消失.(偏高)原因:气泡体积当做酸的体积,所以V(标准)增大.(3)放出碱液的滴定管开始有气泡,放出液体后气泡消失.(偏低)原因:实际放出碱液少故V(标准)减小.(4)滴定管洗涤后,未用标准液洗涤.(偏高)原因:c(标准)偏低,导致V(标准)增大.(5)滴定结束,滴定管尖嘴外有一滴未滴下.(偏高)原因:V(标准)增大.(6)配制标准液时,定容俯视.(偏低)原因:标准液浓度偏高使反应的标准液V减少.(7)滴定管洗涤后,未用标准液洗涤.(偏高)原因:标准液c偏低,导致标准液V增大.(8)锥形瓶水洗后,用待测液又洗过再装待测液.(偏高)原因:待测液V增大,物质的量增大,导致标准液V增大.
以上为滴定中需要学生掌握的知识点也是高考中的易考点.最后以一道题作为总结.
例3 某学生用0.1mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.用酸式滴定管准确移取20 mL待测盐酸注入洁净的锥形瓶,并加入2~3滴指示剂
B.用标准溶液、待测盐酸溶液分别润洗碱式滴定管、酸式滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2cm
E.调节液面至“0”或“0”以下刻度,记下读数
F.在锥形瓶下垫一张白纸,把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度
就此实验完成如下填空:
(1)正确操作步骤的顺序是____(填字母).
(2)下列可以作为本次滴定实验最佳指示剂的是____.
A.淀粉 B.石蕊 C.酚酞 D.KMnO4

(3)判断到达滴定终点的实验现象是____.
(4)右图表示某次滴定时50mL滴定管中前后液面的位置.请将用去的标准KOH溶液的体积填入下表空格中.有关数据记录如下:

滴定序号待测液体积/mL所消耗KOH标准液的体积/mL滴定前滴定后消耗的体积120.000.5025.1224.62220.00320.006.0030.5824.58
(5)根据上表数据,则盐酸样品的物质的量浓度c(HCl)=____(不必化简).
(6)下列几种情况会使测定结果偏高的是____.
a.上述A步骤操作之前,先用待测液润洗锥形瓶
b.读数时,若滴定前仰视,滴定后俯视
c.若在滴定过程中不慎将数滴碱液滴在锥形瓶外
d.若未充分振荡,刚看到溶液变色,立刻停止滴定
e.若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸
答案(1)BDCEAF (2)C
(3)当滴入最后一滴标准液,溶液由无色变为粉红色,且保持半分钟不褪色
(4)0.30 24.90 24.60
参考文献:
[1]李丽敏,顾慰中.滴定分析法重点难点剖析[J].昌潍师专学报,2000(10).
——以“NaOH标准溶液的标定”微课教学为例

