胰岛素自身免疫综合征的临床特点分析并文献复习
韦俊芳,赵艳艳,赵琳琳,马笑堃,郝晓,吴文讯,秦贵军
胰岛素自身免疫综合征(insulin autoimmune syndrome,IAS)属于自身免疫性低血糖症(autoimmune hypoglycemia,AIH),是一种少见的可引起严重低血糖的内分泌疾病。20世纪80年代日本学者HIRATA[1]首次报道,50余年来国内外文献中报道的病例数已达400余例,且以日本报道最多。TAKAYAMA-HASUMI等[2]于1979—1981年在日本2 094家医院以问卷形式进行的一项流行病学调查显示,除外使用口服降糖药物或外源性胰岛素引起低血糖等原因,IAS发病率仅次于胰岛素瘤和胰外肿瘤,高居第3位。而我国至2016年仅报道90余例IAS患者[3-7],夏维波等[8]总结其收集的IAS患者资料,其中有2例因误诊为胰岛素瘤而行外科手术治疗。因此,正确识别IAS对于指导临床工作具有显著的现实意义。本研究总结10例IAS患者的临床特点,并结合相关文献对其进行复习,以期在临床工作中减少对IAS漏诊、误诊及不必要的手术治疗。
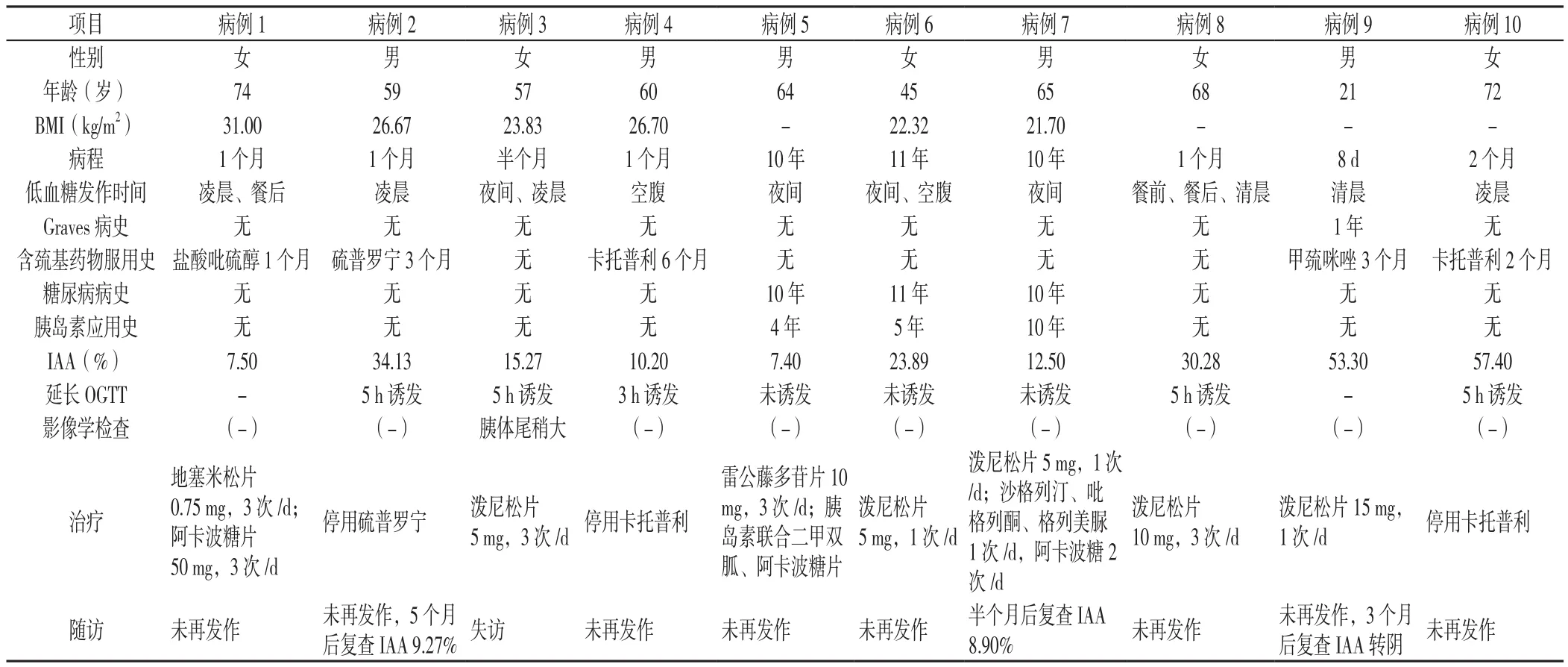
表1 10例IAS患者入院时及随访资料Table 1 The clinical characteristics of ten patients with IAS during initial and subsequent follow-up visits
1 对象与方法
1.1 研究对象 经郑州大学第一附属医院病案室计算机检索2007年1月—2017年5月内分泌与代谢病科确诊为IAS的患者共10例。
1.2 方法 回顾性总结10例IAS患者的临床特点及随访情况,包括一般资料〔性别、年龄、体质指数(BMI)、病程等〕、低血糖发作时间、既往史(Graves病史、含硫基药物服用史、糖尿病病史、胰岛素应用史或其他既往史等)、实验室检查及影像学检查、治疗及随访情况。其中实验室检查包括:血生化、甲状腺功能、胰高血糖素、生长激素、皮质醇、胰岛细胞抗体(ICA)、谷氨酸脱羧酶抗体(GADA)水平、胰岛素自身抗体(IAA),测定5 h口服葡萄糖耐量试验(OGTT)的血糖、C肽、胰岛素水平及低血糖发作时血糖、C肽、胰岛素水平;影像学检查包括腹部超声、腹部增强CT、胰腺灌注成像、垂体MRI等。随访方式为定期电话或门诊复查,随访内容为症状转归、用药、血糖和胰岛素抗体等情况,以及治疗和预后情况。
2 结果
2.1 患者临床资料 本组10例IAS患者,其中男5例,女5例,男女比例为1∶1;年龄21~74岁,60岁及以上6例;病程8 d~11年。低血糖多于夜间和凌晨发作;5例患者有含巯基药物服用史,其中1例患者有Graves病史,发病前曾服用甲巯咪唑;余4例患者分别为服用卡托普利2例,硫普罗宁1例,盐酸吡硫醇1例;3例患者伴有2型糖尿病且有胰岛素应用史;2例患者无明显诱因发生IAS;1例患者伴未分化关节炎;10例患者均呈典型低血糖表现,其中4例患者出现意识不清、昏迷。10例患者均行胰岛素相关抗体测定,其中血生化、甲状腺功能、胰高血糖素、生长激素、皮质醇、ICA、GADA均阴性,IAA均阳性。影像学检查:4例患者行胰腺CT,其中1例示胰体尾稍大,不排除胰体尾增生可能;8例患者行腹部超声,均未见异常;1例患者行胰腺灌注成像,未见异常;2例患者行垂体MRI,未见异常(见表1)。
2.2 OGTT结果 10例患者中5例患者进行5 h OGTT,其中1例因出现低血糖症状提前结束,3例患者仅进行了3 h OGTT,2例患者(病例1、9)由于低血糖而频繁进食未能行OGTT;OGTT结果提示4例患者符合糖尿病,3例患者符合糖耐量受损,1例患者糖耐量正常(见表2)。
2.3 低血糖发作时血糖、C肽、胰岛素水平结果 10例患者低血糖发作时胰岛素与血糖比值、C肽与血糖比值、胰岛素与C肽比值最高分别为1 340.35、6.84、240.19,最低分别为111.11、0.88、31.32;低血糖发作时血清胰岛素水平均明显升高,并与C肽水平升高程度不匹配(见表3)。
2.4 治疗及随访 10例患者均予少食多餐、高纤维素低碳水化合物饮食,其中3例患者加用阿卡波糖;6例患者应用糖皮质激素治疗,其中5例患者加用泼尼松口服,起始剂量为5~30 mg/d,1例患者加用地塞米松(0.75 mg,3次/d);1例患者加用雷公藤多苷(10 mg,3次/d),余3例未予药物治疗。5例有含巯基药物服用史患者,均停用相应药物,1例伴Graves病患者,停用甲巯咪唑,行131I治疗,并给予泼尼松15 mg,1次/d,未再发作低血糖;2例停用卡托普利改为钙离子拮抗剂口服,均未再发作低血糖。10例IAS患者,完成随访9例,失访1例,随访时间为1~12个月;其中8例患者未再出现低血糖症状;2例患者复查IAA较前明显下降,1例患者于3个月后复查IAA转阴(见表1)。
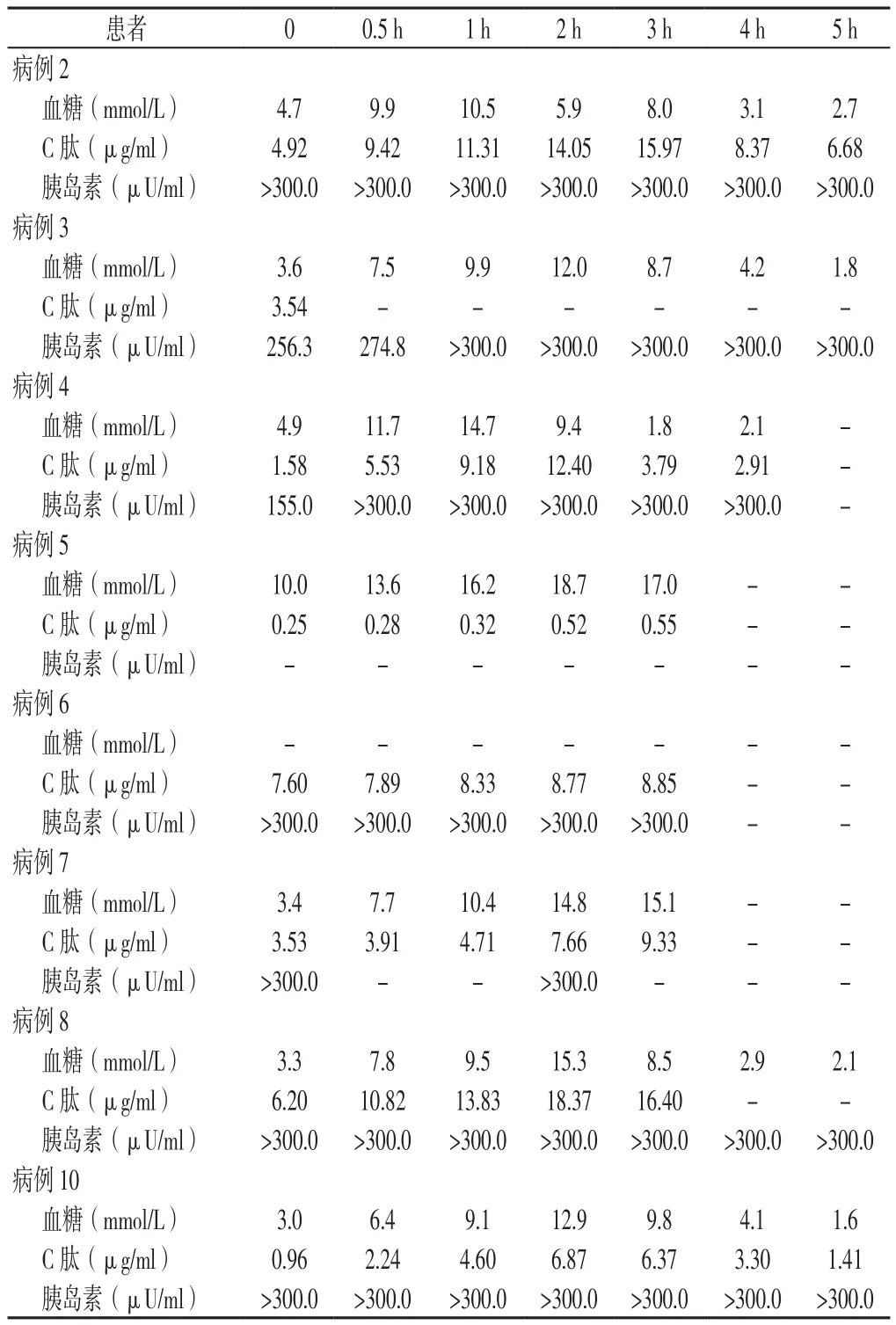
表2 8例IAS患者OGTT血糖、C肽、胰岛素水平结果Table 2 OGTT blood glucose,insulin and C-peptide release test results of eight patients
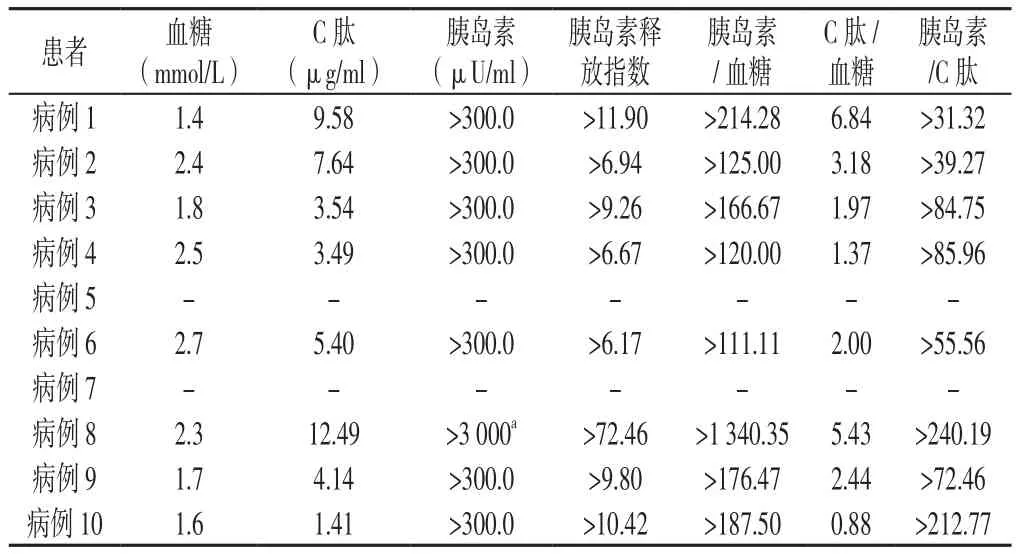
表3 10例IAS患者低血糖发作时血糖、C肽、胰岛素水平及胰岛素释放指数结果Table 3 Blood glucose,C-peptide,insulin and insulin release index of ten patients while hypoglycemia occuring
3 讨论
IAS首次由HIRATA[1]报道,也称为Hirata's disease,其本质上是由结合胰岛素、胰岛素原或胰岛素受体(胰岛素模拟物)内源性抗体滴度和亲和力可变性及其显著增加引起的罕见的自身免疫性疾病[9]。值得一提的是,胰岛素及其类似物可以通过类似于IAS的机制导致糖代谢紊乱和低血糖的发生,因此,在临床工作中易于将IAS与由于外源性胰岛素引起的胰岛素抗体导致的脆性糖尿病相互混淆[10-13]。经典IAS的诊断标准为:无外源性胰岛素应用的情况下自发性低血糖发作,高水平的血清免疫活性胰岛素及高水平的IAA[14],其中血清中存在高水平的IAA,以及与C肽水平升高不呈比例的高胰岛素水平是IAS的显著特点。
在大多数情况下,IAA是指具有κ轻链以及λ变量的多克隆IgG,Scatchard分析将IAA根据其与胰岛素的亲和力和结合容量的特点分为2种类型:低亲和力和高结合容量、高亲和力和低结合容量,当胰岛素抗体不饱和时胰岛素可以与其结合而呈现胰岛素抵抗和高血糖,当抗体结合能力达到饱和时或由于某些原因促进抗原抗体突然解离时,则出现严重低血糖,从而表现出高低血糖交替的特点[15]。
诱导胰岛素抗体产生的原因存在异质性,尽管已经推测IAS的病因涉及特异性人白细胞抗原(HLA)分型,潜在的自身免疫性疾病和/或病毒感染,含巯基的药物,但IAS的确切病因机制至今尚未明确[16]。
目前文献报道的引起IAS的含巯基药物包括甲巯咪唑、谷胱甘肽、卡托普利、α-巯基丙酰甘氨酸(硫普罗宁)、α-硫辛酸、青霉胺、硫代葡萄糖金等;其机制可能是含巯基药物通过与胰岛素分子的二硫键相互作用诱导IAA形成,并增加其免疫原性[17]。
本研究10例IAS患者在低血糖发作时,同步检测胰高血糖素、生长激素、皮质醇等升糖激素未见明显异常,血清胰岛素水平明显升高,而且与C肽水平升高程度不匹配,IAA均明显升高,其中5例有明确含巯基药物服用史,3例有胰岛素应用史,停用此类药物并加用类固醇激素后,2例低血糖未再发作,与文献报道的IAS特点一致[18]。
此外,IAS多合并其他类型的自身免疫性疾病,以Graves病最常见[19],少数合并系统性红斑狼疮、类风湿关节炎、甲状腺炎、系统性硬化病、黑棘皮病等,本研究中,1例伴有Graves病史,1例伴未分化关节炎也与上述研究结果相似。
同时,在临床工作中,接受胰岛素治疗的患者中经常出现胰岛素抗体,故需鉴别IAA阳性是由于外源性胰岛素抗体还是内源性胰岛素抗体所致。EGUCHI[20]应用Scatchard分析方法发现,应用外源性胰岛素治疗者胰岛素抗体通常具有高亲和力和低结合容量,很少引起低血糖症,这与IAS中提出的IAA的低亲和力和高结合容量特征不同。目前临床上常用的放射免疫分析方法尚无法区分抗体性质,但通常外源性胰岛素所致胰岛素抗体的滴度相对较低,且随时间延长逐渐下降,有自愈倾向,不会造成反复低血糖[21]。本研究中,3例患者同时合并2型糖尿病且应用外源性胰岛素,日胰岛素用量均在30 U以上,停用胰岛素超过5个t1/2后仍有反复低血糖发作,合并持续的高胰岛素血症,且胰岛素水平升高超过C肽水平升高的倍数,因此支持IAS的诊断。
由于IAS和胰岛细胞瘤临床表现相似,均有反复发作低血糖且血清总免疫活性胰岛素水平升高,因此临床工作中需注意鉴别。结合文献及本院10例IAS患者特点,笔者总结主要鉴别点如下:(1)胰岛素瘤的低血糖多发生在空腹,而IAS的低血糖多发生在夜间和凌晨;胰岛β细胞瘤患者出现低血糖时易出现昏迷,随意进食后一般不易缓解;胰岛β细胞瘤患者体质量大部分超重,而IAS患者体型正常或消瘦。(2)多数胰岛素瘤患者低血糖发作时,胰岛素释放指数>0.4,文献报道胰岛素瘤的胰岛素释放指数为0.7~4.5,很少超过数百,同理推测胰岛素/C肽也较小,表现为胰岛素水平升高与C肽水平升高基本平行[22];IAS患者低血糖发作时胰岛素/血糖、胰岛素/C肽相对于胰岛素瘤等内源性高胰岛素血症明显升高,本研究中IAS胰岛素释放指数>6.17~72.46,胰岛素/C肽>31.32~240.19,呈胰岛素、C肽水平升高分离现象;(3)OGTT及动态血糖监测结果示IAS患者血糖波动较大,呈低血糖、高血糖交替的特点,而胰岛素瘤患者血糖整体处于较低水平;(4)IAA在胰岛素瘤患者中呈阴性,而IAS患者中绝大多数为阳性,且随着病情缓解后IAA可转阴;(5)影像学检查如腹部彩色多普勒超声、增强CT及胰腺动态增强MRI等在胰岛素瘤患者中常可以发现占位病变,而IAS患者多为阴性,也有极少数影像学表现为胰尾部信号异常而误诊为胰岛素瘤进而行手术切除者,但术后病理为胰腺增生或未见异常。临床上对于高度怀疑胰岛β细胞瘤或胰岛β细胞增生而影像学检查结果为阴性者,可考虑行胰腺动脉钙刺激静脉采血术予以鉴别。
多数IAS患者不需特殊治疗,经少量多餐、低碳水化合物饮食,必要时加用糖苷酶抑制剂延缓食物的吸收和停用诱发药物、胰岛素或改换剂型后低血糖症状可逐渐缓解。本研究中有3例患者停用原诱发药物后低血糖症状未再发作,且其中1例患者5个月后复查IAA,较前明显降低。低血糖严重者或伴发其他自身免疫疾病者可适当加用糖皮质激素,必要时联合血浆置换(TPE)或免疫抑制剂(包括雷公藤多苷、霉酚酸酯、高剂量免疫球蛋白、利妥昔单抗等)。CASTERA等[23]报道了1例IAS伴发1型糖尿病(T1DM)患者,通过使用常规TPE来实现其血糖稳定性,以及免疫抑制治疗来减弱并最终解决免疫失调。
综上所述,IAS预后良好,文献中未见严重合并症的报道。但由于发病率较低、临床少见,容易漏诊,当患者反复低血糖发作、血清免疫活性胰岛素水平明显升高,与C肽水平升高程度不匹配,而又无胰腺占位病变时要考虑IAS的可能,常规检测IAA水平,有助于该病的诊断,及避免不必要的治疗。
本文无利益冲突。
[1]HIRATA Y.Methimazole and insulin autoimmune syndrome with hypoglycemia[J].Lancet,1983,29(2):1037-1038.
[2]TAKAYAMA-HASUMI S,EGUCHI Y,SATO A,et al.Insulin autoimmune syndrome is the third leading cause of spontaneous hypoglycemic attacks in Japan[J].Diabetes Res Clin Pract,1990,10(3):211-214.
[3]CHU J P,ZHENG X W,LU J,et al.Insulin-induced autoimmune syndrome:a case report[J].Exp Ther Med,2016,12(5):3359-3362.DOI:10.3892/etm.2016.3767.
[4]徐太军.近15年文献报告的胰岛素自身免疫综合征71例荟萃分析[J].中国免疫学杂志,2016,32(7):1053-1055.DOI:10.3969/j.issn.1000-484X.2016.07.027.XU T J.Analysis of 71 cases of insulin autoimmune syndrome[J].Chinese Journal of Immunology,2016,32(7):1053-1055.DOI:10.3969/j.issn.1000-484X.2016.07.027.
[5]SAHNI P,TRIVEDI N,OMER A.Insulin autoimmune syndrome:a rare cause of postprandial hypoglycemia[J].Endocrinol Diabetes Metab Case Rep,2016.pii:16-0064.DOI:10.1530/EDM-16-0064.
[6]UCHIGATA Y.Insulin autoimmune syndrome[J].Nihon Rinsho,2016,74(Suppl 2):602-605.
[7]LIMINET C,VOUILLARMET J,CHIKH K,et al.Antibodymediated insulin resistance:when insulin and insulin receptor act as autoantigens in humans[J].Can J Diabetes,2016,40(5):462-465.DOI:10.1016/j.jcjd.2016.02.007.
[8]夏维波,顾锋,吴韬,等.胰岛素自身免疫综合征三例并文献复习[J].中华内科杂志,2006,45(1):61-62.DOI:10.3760/j.issn:0578-1426.2006.01.023.XIA W B,GU F,WU T,et al.Insulin autoimmune syndrome:a report of three cases and review of the literature[J].Chinese Journal of Internal Medicine,2006,45(1):61-62.DOI:10.3760/j.issn:0578-1426.2006.01.023.
[9]ISMAIL A A.The insulin autoimmune syndrome(IAS) as acause of hypoglycaemia:an update on the pathophysiology,biochemical investigations and diagnosis[J].Clin Chem Lab Med,2016,54(11):1715-1724.DOI:10.1515/cclm-2015-1255.
[10]JASSAM N,AMIN A,HOLLAND P,et al.Analytical and clinical challenges in a patient with concurrent type 1 diabetes,subcutaneous insulin resistance and insulin autoimmune syndrome[J].Endocrinol Diabetes Metab Case Rep,2014,2014:130086.DOI:10:1530/EDM-13-0086.
[11]MATSUYOSHI A,SHIMODA S,TSURUZOE K,et al.A case of slowly progressive type 1 diabetes with unstable glycemic control caused by unusual insulin antibody and successfully treated with steroid therapy[J].Diabetes Res Clin Pract,2006,72(3):238-243.DOI:10.1016/j.diabres.2005.10.018.
[12]TRABUCCHI A,LACONO R F,GUERRA L L,et al.Characterization of insulin antibodies by Surface Plasmon Resonance in two clinical cases:brittle diabetes and insulin autoimmune syndrome[J].PLoS One,2013,8(12):e84099.DOI:10.1371/journal.pone.0084099.
[13]ISMAIL A A.Insulin analogues as a new example of interference in insulin assays[J].Ann Clin Biochem,2016,53(Pt 1):181-182.DOI:10.1177/0004563215590165.
[14]UCHIGATA Y,EGUCHI Y,TAKAYAMA-HASUMI S,et al.Insulin autoimmune syndrome(Hirata disease):clinical features and epidemiology in Japan[J].Diabetes Res Clin Pract,1994,22(2/3):89-94.
[15]ZHAO T Y,LI F,XIONG Z Y.Frequent reoccurrence of hypoglycemia in a type 2 diabetic patient with insulin antibodies[J].Mol Diagn Ther,2010,14(4):237-241.DOI:10.2165/11538490-000000000-00000.
[16]SUC T,LIN Y C.Hyperinsulinemic hypoglycemia associated with insulin antibodies caused by exogenous insulin analog[J].Endocrinol Diabetes Metab Case Rep,2016.pii:16-0079.DOI:10.1530/EDM-16-0079.
[17]ICHIHARA K,SHIMA K,SAITO Y,et al.Mechanism of hypoglycemia observed in a patient with insulin autoimmune syndrome[J].Diabetes,1977,26(5):500-506.
[18]杨晓平,李芳萍.胰岛素自身免疫综合征的诊治[J].中华 内 分 泌 代 谢 杂 志,2011,27(10):857-858.DOI:10.3760/cma.j.issn.1000-6699.2011.10.019.YANG X P,LI F P.Approach to the patient of insulin autoimmune syndrome:diagnosis and treatment[J].Chinese Journal of Endocrinology and Metabolism,2011,27(10):857-858.DOI:10.3760/cma.j.issn.1000-6699.2011.10.019.
[19]卜石,杨文英.自身免疫性低血糖症[J].中国糖尿病杂志,2007,15(1):60-61.DOI:10.3321/j.issn:1006-6187.2007.01.024.BU S,YANG W Y.Autoimmune hypoglycemia[J].Chinese Journal of Diabetes,2007,15(1):60-61.DOI:10.3321/j.issn:1006-6187.2007.01.024.
[20]EGUCHI Y.Scatchard analysis of insulin autoantibodies in the insuiln autoimmune syndrome[J].J Tokyo Women Med University,1998,59:1296-1305.
[21]陈敏,窦京涛,王先令,等.胰岛素自身免疫综合征临床特征及随访资料分析并文献复习[J].中华内分泌代谢 杂 志,2012,28(10):813-816.DOI:10.3760/cma.j.issn.1000-6699.2012.10.007.CHEN M,DOU J T,WANG X L,et al.Insulin autoimmune syndrome:an analysis of clinical features,following up data,and review of literature[J].Chinese Journal of Endocrinology and Metabolism,2012,28(10):813-816.DOI:10.3760/cma.j.issn.1000-6699.2012.10.007.
[22]张俊清,郭晓蕙.胰岛素瘤10例临床特点分析[J].中国实用内科杂志,2006,26(22):1805-1807.DOI:10.3969/j.issn.1005-2194.2006.22.015.ZHANG J Q,GUO X H.Clinical characteristic analysis of insulinoma(report of 10 cases)[J].Chinese Journal of Practical Internal Medicine,2006,26(22):1805-1807.DOI:10.3969/j.issn.1005-2194.2006.22.015.
作者贡献:韦俊芳、赵艳艳进行课题设计与实施、资料收集整理、成文并对文章负责;韦俊芳、赵艳艳、赵琳琳、马笑堃、郝晓进行课题设计与实施、评估、资料收集整理;赵艳艳、吴文讯、秦贵军进行质量控制及审校。

