骨髓间充质干细胞移植对急性脊髓损伤脱髓鞘病变的保护作用
苟杨,刘丹彦,刘金凤,孙鸿然
重庆医科大学附属第一医院 麻醉科,重庆 400042
脊髓损伤发病率日益增高,且为致残的主要原因。患者主要临床表现为截瘫、运动障碍和尿失禁[1-2]。目前治疗方法有激素治疗[3]、粒细胞集落刺激因子注射[4]、促红细胞生成素注射[5]、针灸[6]和放置生物材料支架[7],但缺乏有效且易行的治疗方法。现大都是基于对神经元的保护[8-9],罕有研究关于脱髓鞘病变的保护作用。间充质干细胞具有高度的可塑性、较低的免疫抗原性,且在特定条件下可经诱导后向神经细胞分化,以上优势使它可以在不同个体间移植。近年来骨髓间充质干细胞研究成为热点,研究发现其具有如下优点:可自体骨髓取材,避免伦理道德问题;低免疫抗原性,在诱导移植耐受中具有优势[10];易与中枢系统组织整合[11];Liu等研究发现,骨髓间充质干细胞具有高度分化潜能和强大的增殖能力[12];能增加损伤脊髓中神经生长因子含量[13],促进神经轴突再生[14]。这些优点使骨髓间充质干细胞成为探索治疗脊髓损伤的新方向。
BMSCs促进脊髓损伤后运动功能的恢复机制可能与其在损伤部位的抗炎[15]、抗瘢痕增殖[16]、免疫抑制作用[17]和抗凋亡[18]有关。脱髓鞘是脊髓损伤的重要病理变化,且少突胶质细胞凋亡在脊髓损伤后脱髓鞘病变中起至关重要的作用[19-22]。在本研究中,我们通过行为学和形态学,以确定BMSCs是否能够抑制脊髓损伤后脱髓鞘病变;通过行为学和蛋白质组学确定最佳移植时机;并通过CNPase与TUNEL及CNPase与caspase 3共表达,探讨 BMSCs移植能否抑制少突胶质细胞凋亡并阐明其潜在保护机制。
1 材料与方法
1.1 材料
DMEM/F12干细胞培养基、胰蛋白酶购自美国Hyclone公司;油红O干粉、茜素红染料购自广州赛业公司;1%锇酸、甲醇、焦油紫、中性树胶、NaCl、NaH2PO4·2H2O购自重庆东方试剂厂;Luxol fast blue粉剂购自美国Sigma公司;冰醋酸、多聚甲醛、丙酮、Na2HPO4·12H2O购自重庆川东化工有限公司;β-actin、caspase 3、驴抗兔荧光二抗、驴抗小鼠荧光二抗购自美国Proteintech公司;BDNF、CNPase、MBP、MAP2 购自美国 Abcam公司;羊抗鼠二抗、驴抗兔二抗购自武汉Abclonal公司;BCA蛋白分析试剂盒、ECL试剂盒、一步法TUNEL细胞凋亡试剂盒购自上海碧云天公司;双苯酰亚胺 (Hochst33258) 购自美国ThermoFisher公司;NeuN购自美国Millipore公司。
1.2 实验方案
健康雄性 SD幼鼠 56只,4周龄,体重为100–120 g,SPF级,由重庆医科大学实验动物中心提供。将幼鼠脱颈处死后,在无菌条件下取双侧股骨和胫骨并暴露骨髓腔,将收集的骨髓接种到培养基瓶内。24 h后首次换液,3 d后传代,传到第3代,用含10%胎牛血清的DMEM/F12溶液配制成第3代BMSCs总个数约为2.5×106个的待移植细胞悬液[23-25]。
1.2.1 脊髓损伤后骨髓间充质干细胞移植效果评估实验
健康雄性SD大鼠48只,体重为180–220 g,SPF级,由重庆医科大学实验动物中心提供,随机将动物分为3个组:假手术组 (Sham group,16只)、模型组 (Vehicle group,16只) 和治疗组(Treated group,16只)。模型组应用 Rivlin &Tator’s硬脊膜外钳夹方法制作急性脊髓损伤(Spinal cord injury,SCI) 模型,用3.5%的水合氯醛 (按每100 g体重1 mL) 经腹腔注射麻醉后,逐层切开皮肤肌肉,切除T10锥板,暴露脊髓,运用0.88 kg·m/s2力的Yasargil动脉瘤夹夹闭脊髓45 s,若在夹闭脊髓的过程中有明显摆尾动作,伤后立即出现瘫痪,视为模型成功;且于术后7 d暴露受伤脊髓并在脊髓损伤处上下1 cm区注射10 μL PBS。治疗组建模成功7 d后注射10 μL第3代骨髓间充质干细胞悬液。假手术组仅做脊髓显露,不予损伤,术后7 d暴露手术部位并在同一脊髓节段 (T10–T11)上下1 cm区注射等体积PBS。所有外科手术过程均在无菌恒温条件下进行,术后每天对大鼠膀胱3次压迫排尿。在细胞移植后1、3、7 d进行BBB运动评分;并在细胞移植7 d后进行锇酸染色、透射电镜观察神经纤维、LFB染色、TUNEL染色、细胞分化情况、BDNF蛋白表达水平及CNPase与caspase 3免疫荧光共表达检测。
1.2.2 不同时间点骨髓间充质干细胞移植实验
将建模成功大鼠 (18只) 随机分为3组:1 d组、7 d组和14 d组。其分别在脊髓损伤后1、7、14 d移植BMSCs。SD大鼠脊髓钳夹损伤1、7和14 d后,如上所述将动物再次麻醉,暴露椎板切除部位后于各组受损脊髓处移植BMSCs。并进行BBB运动评分和MBP、CNPase、caspase 3蛋白表达水平的检测。
1.3 方法
1.3.1 第三代骨髓间充质干细胞培养
脱颈处死4周龄雄性SD幼鼠,在无菌环境下,取股骨和胫骨,剪掉骨骺端,暴露骨髓腔后用10%胎牛血清反复冲洗骨髓腔至其发白,将细胞悬液收集至15 mL离心管内,常温1 500 r/min离心5 min。弃上清,将细胞密度调整为1.0×106/mL,接种于25 cm2细胞培养瓶内,37 ℃、5% CO2恒温孵箱内培养,48 h后首次换液。本实验采用全骨髓贴壁法,通过更换培养基除去未贴壁细胞,每3天更换一次培养基直至细胞达到70%–80%融合后进行传代,传至第3代,观察细胞生长状态。
1.3.2 大鼠BMSCs的成脂分化观察
取第 3代生长融合至 70%–80%的 BMSCs,以细胞密度为2.0×104个/mL接种于6孔板。使其均匀分布,在37 ℃、5% CO2恒温箱内培养,待细胞融合至100%时继续培养2–3 d。加入成脂诱导A液,诱导3 d后,更换成脂诱导B液,诱导1 d;如此反复诱导4次后,用成脂诱导B液诱导7 d。进行油红O染色,各孔加入4%多聚甲醛37 ℃固定30 min后再加入油红O工作液1 mL,染色15 min;观察并记录染色情况。
1.3.3 大鼠BMSCs的成骨分化观察
BMSCs生长至100%后,加入成骨诱导液,14 d后进行茜素红染色。各孔加入 4%多聚甲醛37 ℃固定30 min后再加入茜素红染液1 mL,染色10 min,观察并记录染色情况。
1.3.4 BBB评分
BBB评分是一种神经功能评定法,是目前评估脊髓损伤大鼠功能恢复程度的常用方法之一。将动物放入一开口盆,轻敲盆壁,使其爬行,观察动物的臀、膝、踝、躯干运动及其协调情况。BBB评分是将大鼠后肢运动分为22个等级。后肢全瘫为0分,完全正常为21分。在骨髓间充质干细胞移植效果评估实验中和不同时间点骨髓间充质干细胞移植实验中,均在移植后第1、3、7天由两个技术人员采用双盲法对大鼠进行BBB评分。
1.3.5 锇酸染色
将细胞移植7 d后SD大鼠 (9只) 用水合氯醛深麻醉,敞开腹腔和胸腔,分别暴露肝脏、肠系膜和心脏。将针头通过由心尖偏下插入心脏至主动脉内并固定,剪开右心耳,将生理盐水经微量泵由主动脉泵入大鼠体循环,直至肝脏和肠系膜变白,右心耳流出清亮的液体后继续泵入 4%多聚甲醛溶液固定脊髓。固定完全后,取脊髓损伤部位为中心上下各 1 cm的脊髓组织浸泡在配好的浸泡液 (1%锇酸1 mL、1%氯酸钾3 mL、浓甲醛溶液0.6 mL、冰醋酸0.05 mL 溶液混合) 中避光浸泡3 d后取出,流水冲洗1 d,30%的蔗糖溶液脱水,用冰冻切片机切片。在光学显微镜下观察有髓神经纤维的结构变化。
1.3.6 透射电镜观察神经纤维
细胞移植7 d后SD大鼠 (9只) 用上述方法灌注。先用生理盐水灌注体循环待右心耳流出的液体变清亮后,再灌注1%戊二醛固定液 (总量1 000 mL:25%戊二醛40 mL、0.2 mol/L PBS 460 mL、ddH2O 500 mL) 和4%多聚甲醛的混合液。灌注后取材,将取出的脊髓切为1 mm×1 mm×1 mm大小的组织块,浸泡于装有4%戊二醛的西林瓶内并送到重庆医科大学电镜室,再将脊髓移进1%四氧化锇中固定 1–2 h (4 ℃),用丙醇梯度 (50%、70%、80%、90%、100%) 脱水10 min,将脊髓标本放到烤箱内,37 ℃ 24 h,60 ℃ 48 h;在超薄切片机下制作超薄切片,再进行醋酸铀-枸橼酸铅双重染色后于透射电镜下观察脊髓中神经纤维髓鞘的超微结构。
1.3.7 LFB染色
将细胞移植7 d后SD大鼠 (9只) 经上述方法灌注,取脊髓损伤中心上下各1 cm的脊髓组织放进4%的多聚甲醛浸泡1 d,30%蔗糖溶液脱水,–80 ℃冰箱速冻5 min。将标本取出后用冰冻切片机切片,将切好的组织切片进行快蓝染色检测:1) 60 ℃ LFB浸泡2 h;2) 95%乙醇浸泡1 min,0.05%碳酸锂浸泡 10 s;3) ddH2O浸泡1 min;4) 0.1%焦油紫浸泡10 min,37 ℃;5) 95%乙醇浸泡15 min;6) 50%甘油封片,光学显微镜下观察。再将每张切片随机选取 5个视野,所得图像用Image J图像软件分析并计数神经纤维髓鞘数。
1.3.8 TUNEL染色
1) 用上述方法对大鼠进行灌注取材后制作冰冻切片于–20 ℃保存;2) 冰冻切片室温复温15 min;3) PBS冲洗 3次,10 min/次;4) 0.3% Triton破膜30 min;5) PBS冲洗3次,10 min/次;6) 山羊血清 37 ℃封闭 1 h;7) 滴加小鼠来源的一抗CNPase (1∶100,Abcam公司),置于4 ℃冰箱孵育过夜;8) 37 ℃复温2 h;9) PBS冲洗3次,10 min/次;10) 避光滴加驴抗小鼠 (Proteintech公司)的荧光二抗 (1∶200),37 ℃恒温孵育2 h,PBS冲洗3次,10 min/次;11) DAPI 37 ℃孵育15 min后PBS冲洗2次,10 min/次;12) 在样品上加50 μL TUNEL检测液,37 ℃避光孵育1 h;13) PBS洗涤3次,10 min/次;14) 抗免疫荧光淬灭剂封片后荧光显微镜下观察。
1.3.9 免疫印迹
细胞移植7 d后从脊髓损伤处上下1 cm内收集组织样品。每组取3只大鼠,生理盐水快速灌注后在冰上快速取下脊髓组织,放入装有细胞裂解液的匀浆器中提取蛋白。BCA (Bicinchoninic acid) 法测定蛋白浓度并调节蛋白浓度一致。取10 μL蛋白样品并进行SDS-PAGE (蛋白质聚丙烯酰胺凝胶电泳),电泳结束后将凝胶中的蛋白采用250 mA电流转到PVDF膜上。将PVDF膜放入10%脱脂奶粉溶液封闭2 h,小鼠来源BDNF (1∶1 000,Abcam公司)、小鼠来源β-actin (1∶2 000,Proteintech公司)、小鼠来源CNPase (1∶1 000,Abcam公司)、小鼠来源MBP (1∶1 000,Abcam公司) 和兔来源caspase 3(1∶1 500,Proteintech公司) 4 ℃孵育过夜,山羊抗鼠lgG二抗 (1∶3 000,Abclonal公司) 和驴抗兔lgG二抗 (1∶3 000,Abclonal公司) 37 ℃孵育90 min,ECL显色。
1.3.10 免疫荧光
免疫荧光检测BMSCs在受损脊髓的分化情况。步骤如下:1) 第三代BMSCs用1 mL双苯酰亚胺(Hochst33258,ThermoFisher公司) 孵育 24 h,使荧光素标记到细胞核;2) 将标记的细胞移植到受损脊髓7 d后,用上述方法对大鼠进行灌注取材后制作冰冻切片于–20 ℃保存;3) 冰冻切片室温复温15 min;4) PBS 冲洗 3次,10 min/次;5) 0.3% Triton破膜30 min;6) PBS冲洗3次,10 min/次;7) 山羊血清37 ℃封闭1 h;8) 分别滴加小鼠来源的一抗 NeuN (1∶20,Millipore公司)、MAP2 (1∶20,Abcam 公司)、MBP (1∶50,Abcam 公司)和CNPase (1∶100,Abcam公司),置于4 ℃冰箱孵育过夜;9) 37 ℃复温2 h;10) PBS冲洗3次,10 min/次;11) 避光,驴抗小鼠 (Proteintech公司)的荧光二抗 (1∶200),37 ℃恒温孵育2 h,PBS冲洗3次,10 min/次;12) 50%甘油封片后,采用激光共聚焦显微镜观察 BMSCs在受损脊髓的分化情况。
免疫荧光检测少突胶质细胞凋亡步骤如下:1) 用上述方法对大鼠进行灌注取材后制作冰冻切片于–20 ℃保存;2) 冰冻切片室温复温15 min;3) PBS冲洗3次,10 min/次;4) 0.3% Triton破膜30 min;5) PBS冲洗3次,10 min/次;6) 山羊血清 37 ℃封闭 1 h;7) 分别滴加兔来源的一抗caspase 3 (1∶20,Proteintech公司)和小鼠来源CNPase (1∶100,Abcam公司),置于4 ℃冰箱孵育过夜;8) 37 ℃复温2 h;9) PBS冲洗3次,10 min/次;10) 避光,滴加驴抗兔 (proteintech公司)、驴抗小鼠 (Proteintech公司)的荧光二抗 (1∶200),37 ℃恒温孵育2 h,PBS冲洗3次,10 min/次;11) DAPI 37 ℃孵育15 min后PBS冲洗2次,10 min/次;12) 50%甘油封片后,采用激光共聚焦显微镜观察caspase 3和CNPase二者共表达的情况。
1.4 统计学方法
所有数据用(±s) 表示,采用 Graphpad Prism7.0进行单因素方差分析,P<0.05认为有显著性差异。
2 结果
2.1 第三代骨髓间充质干细胞
原代提取的BMSCs在24 h后开始贴壁,呈现梭形或椭圆形;48 h后有细胞集落形成;1周后细胞集落不断扩大,70%–80%细胞融合时进行传代;传代后的BMSCs不断纯化,第3代BMSCs梭形细胞数量占据绝对优势。
2.2 大鼠BMSCs的成脂与成骨分化
大鼠BMSCs成脂诱导21 d后,细胞形态由长梭形变成圆形,胞质内出现脂滴,脂滴饱满,串珠状排列,油红 O染色呈鲜红色 (图2A)。大鼠BMSCs成骨诱导14 d后,细胞间质内形成大量可被茜素红染成红色的钙化样结节 (图2B)。
2.3 骨髓间充质干细胞移植治疗对运动功能的恢复
为了评估 BMSCs移植后实验对象的运动功能,我们使用了BBB评定量表评估行为学变化。本实验选取的实验动物健康,行动敏捷,造模前BBB评分均为21分,模型组和治疗组各有1只造模失败被排除,脊髓损伤后所有动物呈双下肢瘫痪。本实验BBB评分结果如图3所示:在细胞移植后1、3、7 d均显示模型组与假手术组相比,BBB评分明显降低 (#P<0.05);细胞移植1 d后治疗组与模型组相比,大鼠的运动功能评分无明显差异 ($P>0.05),在细胞移植后3、7 d显示治疗组比模型组大鼠后肢运动有明显改善,BBB评分明显升高 (*P<0.05)。

图1 光学显微镜下观察第三代骨髓间充质干细胞(Scale bar=100 μm)Fig. 1 Observed the third generation BMSCs under optical microscope. Scale bar=100 μm.

图2 大鼠BMSCs成脂与成骨分化 (Scale bar=100 μm)Fig. 2 Adipogenic induction and osteogenic induction of BMSCs. Scale bar=100 μm.
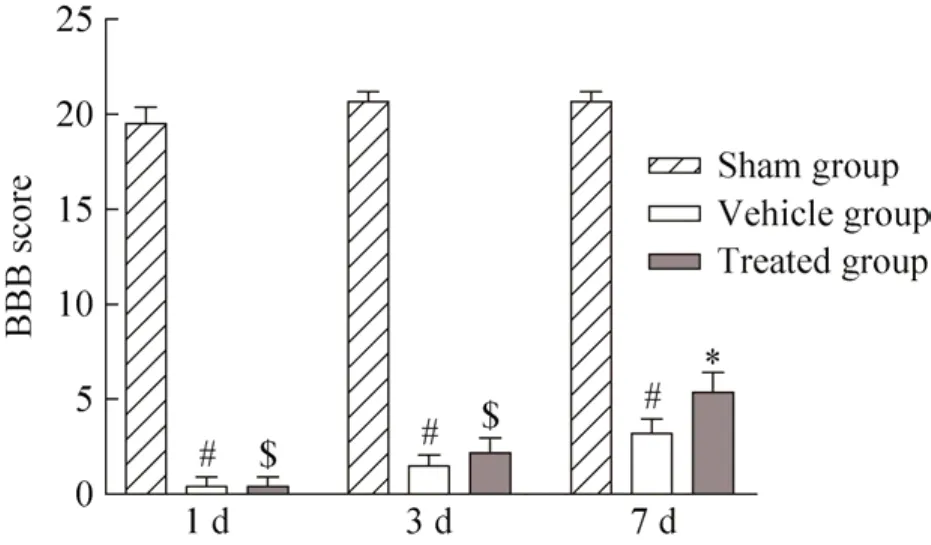
图3 各组BBB评分比较Fig. 3 BBB assessment in each group. #P<0.05 vs sham group *P<0.05, $P>0.05 vs vehicle group.
2.4 移植后的BMSCs分化
双苯甲亚胺标记的BMSCs移植7 d后在受损脊髓免疫荧光表达情况如图4所示。部分双苯甲亚胺标记的阳性细胞表达少突胶质细胞标记物 CNPase和MBP、神经元标记物NeuN和MAP2。BMSCs移植后检测了BDNF、caspase 3蛋白表达水平的变化,结果如图 5所示。与假手术组比较,模型组 BDNF、caspase 3表达均增加 (#P<0.05)。骨髓间充质干细胞移植后,治疗组 BDNF表达水平与模型组相比进一步增加 (*P<0.05),caspase 3表达则降低 (*P<0.05)。
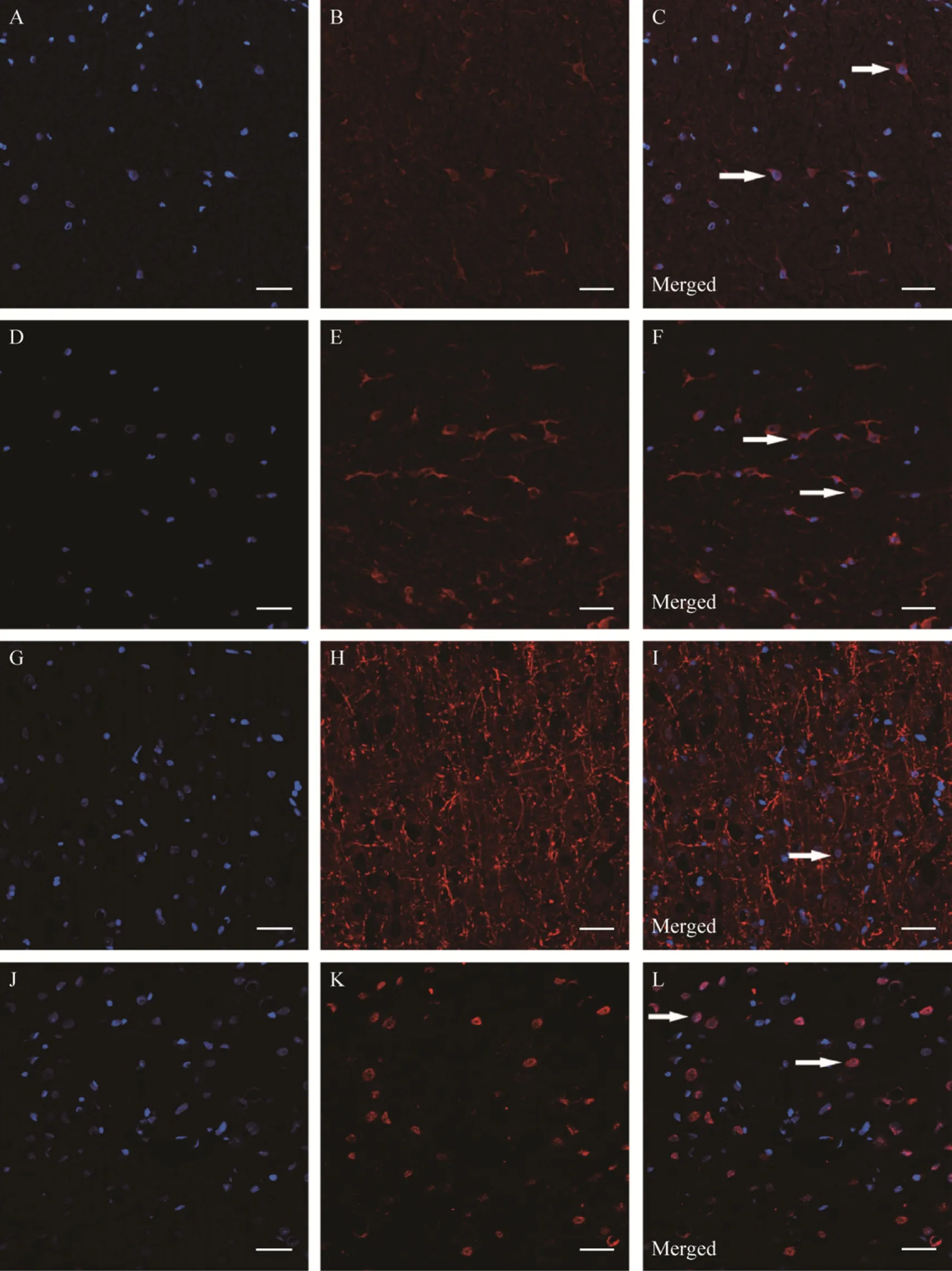
图4 双苯酰亚胺标记的骨髓间充质干细胞移植到受损脊髓7 d后的分化情况 (Scale bar=50 μm)Fig. 4 Differentiation of the bis-benzimide-labeled BMSCs 7 days after transplantation into damaged spinal cord. The transplanted cells have bis-benzimide fluorescence (blue) in their nuclei (A, D, G, J). Immunostaining with antibodies(red) against CNPase (B), MBP (E), MAP2 (H) and NeuN (K). The bis-benzimide-labeled BMSCs express the specific markers of the oligodendrocyte (C, F) and neuron (I, L).
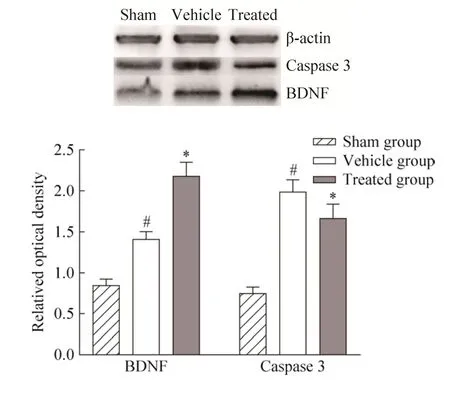
图5 骨髓间充质干细胞移植后对脊髓损伤大鼠BDNF、caspase 3蛋白表达的影响Fig. 5 Effect of transplantation of BMSCs on the expressions of BDNF and caspase 3 in rats with spinal cord injury. *P<0.05 vs vehicle group, #P<0.05 vs sham group.
2.5 BMSCs移植通过对脱髓鞘病变有保护作用
本实验通过锇酸染色、LFB、TUNEL和透射电镜研究轴索髓鞘纤维的病理变化,以确定BMSCs移植是否对脱髓鞘病变有保护作用。
2.5.1 锇酸染色结果
假手术组白质形态正常,有髓神经纤维分布均匀,髓鞘规则致密 (图 6A)。模型组显示白质呈疏松状,髓鞘变性、溃变、崩解、有髓神经纤维缺失 (图6B)。经BMSCs移植后治疗组较模型组白质形态有所改善,有髓神经纤维增多,髓鞘溃变、崩解情况趋于好转 (图6C),通过对神经残存数量进行计数:经骨髓间充质干细胞移植后,神经残损数量较模型组明显升高 (*P<0.05),见图7。
2.5.2 LFB染色
另外,进行 LFB髓磷脂染色以评估 BMSCs的神经保护作用。LFB染色显示模型组白质排列较紊乱,呈疏网状,髓鞘水肿,应用骨髓间充质干细胞移植后,上述情况得到明显改善 (图 8)。髓鞘纤维计数显示:模型组神经纤维计数较假手术组减少,有显著性差异 (#P<0.05);治疗组较模型组增多,有显著性差异 (*P<0.05) (图9)。

图6 各组大鼠脊髓神经纤维的形态观察 (锇酸染色,Scale bar=50 μm)Fig. 6 Observed the morphology of spinal cord nerve fibers in rats of different groups. (A) Shan group. (B) Vehicle group.(C) Treated group. Osmium staining, scale bar=50 μm.
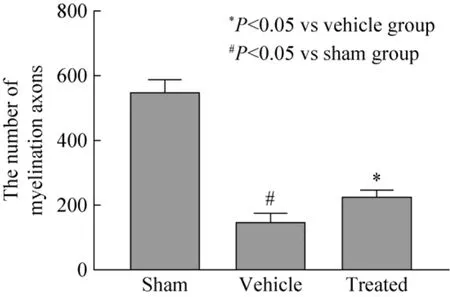
图7 各组神经纤维残存数量的比较Fig. 7 The number of nerve fibers remaining in each group.
2.5.3 透射电镜观察
我们通过透射电镜观察了白质有髓轴突的超微结构特征。假手术组髓鞘结构致密、厚薄均匀,板层结构清晰 (图 10A);模型组髓鞘结构松散,板层疏松脱失,形态不规则,髓鞘与轴突分离,明暗板层不清 (图 10B);治疗组上述情况得到明显改善 (图 10C)。

图8 LFB染色观察各组别有髓神经纤维的变化 (Scale bar=100 μm)Fig. 8 Observed the variation of myelinated nerve fiber in LFB staining. Scale bar=100 μm. (A–C) Anterior funiculus.(D–F) Posterior funiculus. (G–I) Posterior funiculus. (A, D, G) Sham group. (B, E, H) Vehicle group. (C, F, I) Treated group.

图9 各组别有髓神经纤维数量比较Fig. 9 The number of myelinated nerve fibers in each group. *P<0.05 vs vehicle group, #P<0.05 vs sham group.
2.5.4 TUNEL染色观察
细胞移植7 d后,通过脊髓损伤处上下1 cm区的脊髓切片 TUNEL染色观察到出现较多的TUNEL+细胞 (阳性细胞呈红色圆形),还观察到大量TUNEL+的少突胶质细胞 (图11);与假手术组相比,模型组的CNPase-TUNEL+细胞明显增多 (*P<0.05);与模型组相比,治疗组的CNPase-TUNEL+细胞减少(#P<0.05),见图12。
2.6 免疫荧光双标检测CNPase-caspase 3细胞
本实验通过免疫荧光双标检测不同组别病变部位的少突胶质细胞凋亡情况。假手术组CNPasecaspase 3+细胞数目较少;模型组CNPase-caspase 3+细胞广泛分布在白质中;而治疗组的 CNPasecaspase 3+细胞散在分布,较模型组明显减少 (图13)。
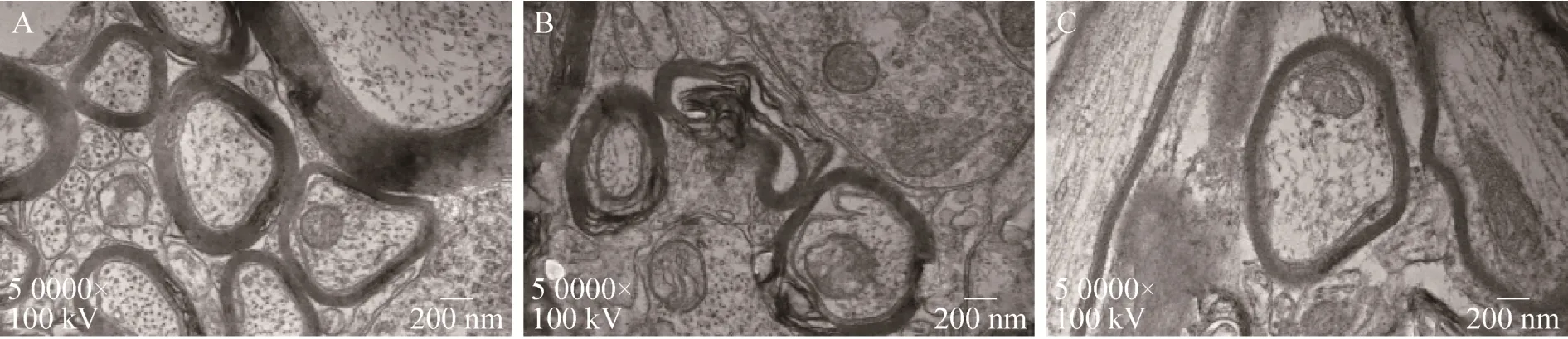
图10 TEM对不同组别髓鞘超微结构观察Fig. 10 TEM observation in each group (×50 000). (A) Sham group. (B) Vehicle group. (C) Treated group.
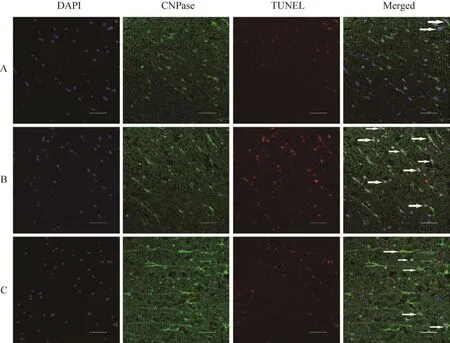
图11 不同组别白质有髓神经纤维TUNEL染色情况Fig. 11 TUNEL staining of myelinated nerve fiber in each group. (A) Sham group, few CNPase-TUNEL+ cells. (B) Vehicle group, CNPase-TUNEL+ cells wildly distributes in the white matter. (C) Treated group, fewer CNPase-TUNEL+ cells than treated group. Arrows represent CNPase-TUNEL+ positive cells.
2.7 各时间点移植效果的检测
2.7.1 各时间点BBB评分
在时间点实验中,7 d组的BBB评分与1 d组相比显著增加 (@P<0.05),与14 d组相比略有增加 ($P<0.05) (图14)。以上结果提示损伤7 d后BMSCs移植能显著提升大鼠运动功能。
2.7.2 各时间点蛋白水平的表达
CNPase和MBP在髓鞘形成起关键作用,并且其表达减少表明脱髓鞘的发生。为了检测不同时间点移植细胞后脱髓鞘病变,本研究应用 Western blotting检测1 d组、7 d组和14 d组的MBP和CNPase表达。7 d组MBP和CNPase表达水平明显升高,与1 d组、14 d组差异显著 (%P<0.05,&P<0.05vs 7 d group)。同时也检测了凋亡指标caspase 3在各个时间点组间的表达。与1 d组、14 d组相比,7 d组caspase 3表达水平最低 (图15)。

图12 CNPase-TUNEL+细胞数量计数Fig. 12 The numbers of CNPase-TUNEL+ cells.#P<0.05 vs vehicle group, *P<0.05 vs sham group.
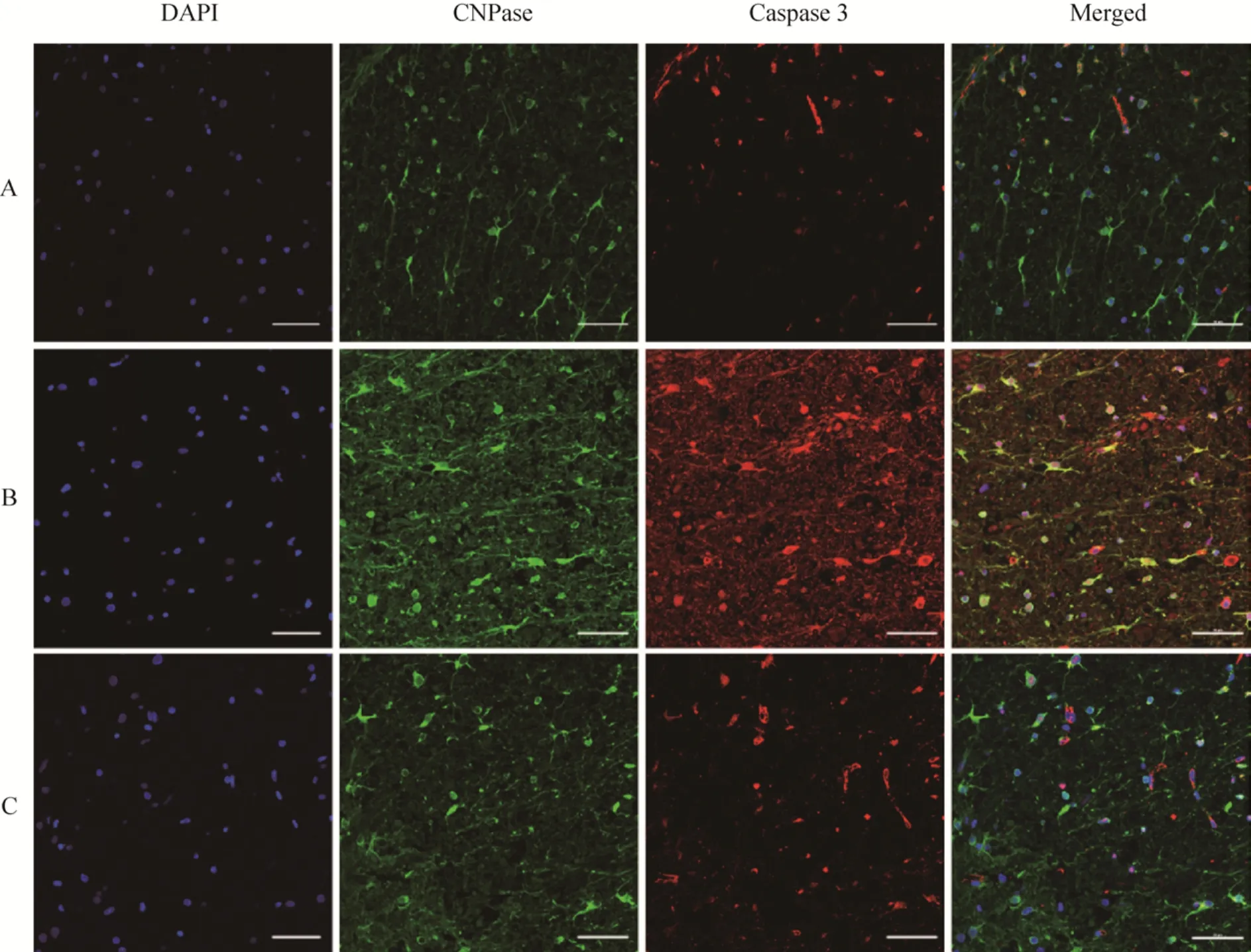
图13 免疫荧光双标结果 (Scale bar=50 μm)Fig. 13 Immunofluorescence of CNPase-caspase 3+. (A) Sham group, few CNPase-caspase 3+ cells. (B) Vehicle group,CNPase-caspase 3+ cells wildly distributes in the white matter. (C) Treated group, fewer caspase 3+-CNPase cells than treated group.

图14 各时间点组间BBB评分比较Fig. 14 BBB scores were compared between different time point groups. @P<0.05, $P<0.05 vs 7 d group.
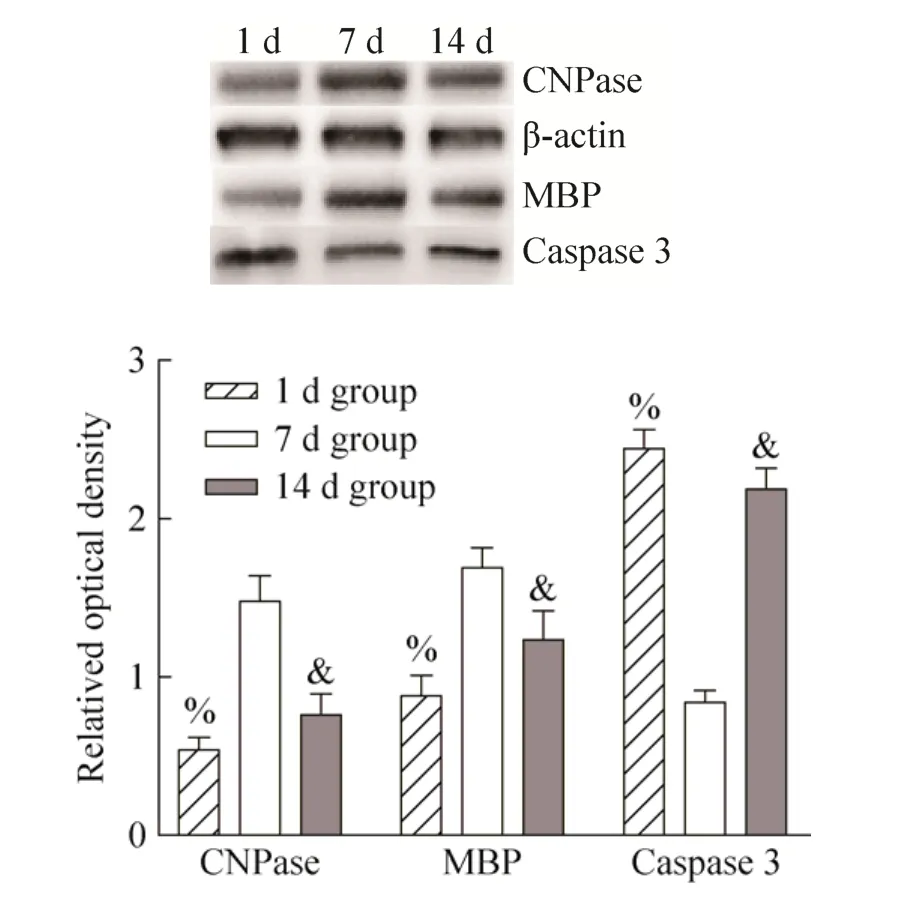
图15 不同时间点移植对脊髓损伤大鼠 CNPase、MBP、caspase 3蛋白表达的影响Fig. 15 Effects of transplantation at different time points on the expressions of CNPase, MBP and caspase 3 in rats with spinal cord injury. %P<0.05, &P<0.05 vs 7 d group.
3 讨论
人体神经系统中髓鞘由少突胶质细胞和施旺细胞组成,中枢神经系统以少突胶质细胞为主要组成部分。髓鞘的功能是形成郎飞结,使神经冲动以跳跃方式传导,从而提高其传导速度。在脊髓损伤早期出现少突胶质细胞凋亡引起轴突脱髓鞘改变[26];而髓鞘的缺失将会抑制神经冲动的传导,最终影响神经功能正常发挥[27-28]。因此,对髓鞘的保护在脊髓损伤早期显得尤为重要。目前,治疗脱髓鞘病变的方法有很多,如免疫调节 (激素治疗)[29]、降低炎症反应[30],但是效果不尽人意。骨髓间充质干细胞是由中胚层发育的早期细胞,具有多向分化潜能[31],不但能分化成软骨[32]、脂肪[33]等中胚层起源细胞,而且能分化成神经元和神经胶质细胞[34]等外胚层细胞。本实验采用全骨髓差异贴壁法获得细胞,操作简单,对细胞活性影响小,获得的 BMSCs纯度较高;并在移植前对其进行多向分化功能鉴定发现:“油红O染色”和“茜素红染色”胞质出现鲜红的脂滴和细胞间质内形成大量红色的钙化样结节,提示 BMSCs 具有成脂和成骨分化潜能。同时亦证实移植细胞为骨髓间充质干细胞。
本研究采用Rivlin & Tator’s急性硬膜外脊髓钳夹损伤模型,在脊髓损伤7 d后给予骨髓间充质干细胞移植,对其进行神经功能评分,结果显示,与模型组相比,治疗组BBB评分明显升高,其后肢运动功能有显著改善;锇酸染色和LFB染色观察亦发现,模型组白质疏松,大量有髓神经纤维丢失,而经骨髓间充质干细胞移植后白质疏松形态好转,髓鞘崩解、水肿情况亦有所改善;同时,透射电镜结果显示,假手术组髓鞘厚薄均匀、结构完整,而模型组髓鞘水肿明显,板层分离严重;经骨髓间充质干细胞移植后,虽有个别髓鞘板层存在崩解现象,但大多数髓鞘水肿明显减轻。以上结果提示,骨髓间充质干细胞移植可明显减轻急性脊髓损伤脱髓鞘病变,改善急性脊髓损伤后运动功能且对髓鞘具有保护作用。
本实验中我们检测了3个时间点 (伤后1 d、7 d和14 d) 研究移植最佳时间。与1 d组相比,7 d组MBP、CNPase蛋白表达增加,caspase 3表达则降低。尽管目前对脊髓损伤的急性和亚急性期没有明确区分[35],但有研究者认为脊髓损伤后24 h为急性期,损伤后7 d为亚急性期[36]。骨髓间充质干细胞在急性期主要作用为抗炎。然而主流观点认为骨髓间充质干细胞移植主要发挥替代和桥接作用[37]。同时,亚急性期损伤脊髓的微环境更适合细胞生长和分化[38-40]。但过长时间的延迟移植并不会产生更佳的治疗效果。与14 d组相比,7 d组MBP、CNPase蛋白表达增加,caspase 3表达则降低。通过上述结果可大胆推测,SCI后7 d可能是 BMSCs移植治疗的最佳窗口期。瘢痕形成是脊髓损伤的重要病理变化,伤后2周可能导致瘢痕明显形成,抑制细胞整合和轴突再生[41]。有研究表明,脊髓损伤14 d后,病变部位的蛋白多糖沉积不利于细胞存活[42-43]。同时,亦有研究者认为伤后7 d是移植的最佳时间[44]。因此,我们认为伤后7 d是SCI治疗的最佳时间。进一步关于BMSCs在伤后7 d移植的生理和解剖相关研究将提供其对中枢神经系统修复更有价值的证据。
BMSCs具有多向分化潜能,大多数体内外实验证实移植 BMSCs治疗脊髓损伤是因其可分化为神经元样细胞包括神经元、少突胶质细胞、星形胶质细胞和施万细胞[45]。然而微环境对BMSCs的分化起重要作用[46]。有研究者证明 BMSCs移植至脑主要分化为神经元[47],移植至脊髓主要分化为胶质细胞[48]。那么我们推测在急性脊髓损伤微环境的影响下,BMSCs移植可分化为脊髓神经细胞。本实验通过免疫荧光显示:标记的BMSCs移植至受损脊髓后可部分分化为带神经元标记物NeuN、MAP2的神经元和带少突胶质细胞标记物CNPase、MBP的少突胶质细胞,这3种细胞均分布在受损脊髓处,表明其对急性脊髓损伤的保护作用可能与 BMSCs的分化有关。但分化是一动态过程[49],分化程度与数量需要进一步研究。此外 BMSCs对受损脊髓的保护亦可能与其分泌的神经营养因子有关。Li等证明BMSCs可分泌BDNF且在受损脊髓处长时间表达[50]。Al-Gharaibeh等通过神经干细胞移植治疗亨廷顿病发现神经干细胞移植后可分化为神经元,且分化的神经元可分泌BDNF[51]。而少突胶质细胞移植治疗短暂性脑缺血研究亦发现少突胶质细胞可促进内源性 BDNF的分泌[52]。那么我们大胆推测,BMSCs移植至受损脊髓后,在脊髓受损处 BMSCs和分化形成的神经元、少突胶质细胞均可通过分泌BDNF而发挥保护作用。本实验通过Western blotting结果可印证BDNF的表达在治疗组较模型组升高。但有趣的是模型组 BNDF的表达亦比假手术组高,这可能与机体的自身修复有关,即当脊髓损伤后会出现一定程度和时间的内源性 BDNF分泌增多[53]。有研究者提出 BDNF在脊髓损伤微环境中可能是通过抗凋亡对脱髓鞘病变发挥保护作用[54-55]。本研究通过 TUNEL染色发现骨髓间充质干细胞移植可抑制少突胶质细胞凋亡。由此可推测骨髓间充质干细胞移植可能是通过分化为神经元和少突胶质细胞并分泌BDNF发挥抗凋亡而对受损脊髓产生保护作用。亦有研究者证实在慢性脊髓损伤模型中BDNF可通过caspase 3信号通路抗少突胶质细胞凋亡[56],由此可推测在急性脊髓损伤模型中BDNF也可发挥同样作用。本实验通过免疫荧光CNPase和caspase 3共表达提示:与模型组相比,治疗组中CNPase和caspase 3共表达细胞减少;且免疫印迹显示治疗组caspase 3蛋白表达水平比模型组低,这说明骨髓间充质干细胞移植抗少突胶质细胞凋亡可能通过抑制caspase 3发挥作用。
综上所述,骨髓间充质干细胞移植对急性脊髓损伤脱髓鞘病变有保护作用。且保护作用是多机制共同参与,本实验推测其中之一的机制是通过分泌BDNF发挥抗少突胶质细胞凋亡从而对损伤脊髓有保护作用。然而目前对骨髓间充质干细胞治疗急性脊髓损伤为初步研究,诸如微环境、宿主和移植物相互作用的变化等需要进一步探索。此外,移植后效应也需更长时间的观察,长期的运动功能和生化检测将进一步了解骨髓间充质干细胞对脊髓损伤的治疗效果。
[1]Ackery A, Tator C, Krassioukov A. A global perspective on spinal cord injury epidemiology. J Neurotrauma, 2004, 21(10): 1355–1370.
[2]Thuret S, Moon LDF, Gage FH. Therapeutic interventions after spinal cord injury. Nat Rev Neurosci, 2006, 7(8): 628–643.
[3]Ludwig PE, Patil AA, Chamczuk AJ, et al.Hormonal therapy in traumatic spinal cord injury.Am J Transl Res, 2017, 9(9): 3881–3895.
[4]Khorasanizadeh M, Eskian M, Vaccaro AR, et al.Granulocyte colony-stimulating factor (G-CSF) for the treatment of spinal cord injury. CNS Drugs,2017, 31(11): 911–937.
[5]Priestley JV, Michael-Titus AT, Tetzlaff W. Limiting spinal cord injury by pharmacological intervention.Handb Clin Neurol, 2012, 109: 463–484.
[6]Meng QX, Liu X, Shan QQ, et al. Acupuncture for treatment of secondary osteoporosis in patients with spinal cord injury: a controlled study. Acupunct Med, 2014, 32(5): 381–386.
[7]Zhou Y, Wang Z, Li J, et al. Fibroblast growth factors in the management of spinal cord injury. J Cell Mol Med, 2017, 22(1): 25–37.
[8]Taylor L, Jones L, Tuszynski MH, et al.Neurotrophin-3 gradients established by lentiviral gene delivery promote short-distance axonal bridging beyond cellular grafts in the injured spinal cord. J Neurosci, 2006, 26(38): 9713–9721.
[9]Yasuda A, Tsuji O, Shibata S, et al. Significance of remyelination by neural stem/progenitor cells transplanted into the injured spinal cord. Stem Cells,2011, 29(12): 1983–1994.
[10]Yin F, Guo L, Meng CY, et al. Transplantation of mesenchymal stem cells exerts anti-apoptotic effects in adult rats after spinal cord ischemia-reperfusion injury. Brain Res, 2014, 1561: 1–10.
[11]Stewart AN, Matyas JJ, Welchko RM, et al. SDF-1 overexpression by mesenchymal stem cells enhances GAP-43-positive axonal growth following spinal cord injury. Restor Neurol Neurosci, 2017,35(4): 395–411.
[12]Liu W, Ding YM, Zhang XM, et al. Bone marrow stromal cells inhibit caspase-12 expression in rats with spinal cord injury. Exp Ther Med, 2013, 6(3):671–674.
[13]Ritfeld GJ, Tewarie RDSN, Vajn K, et al. Bone marrow stromal cell-mediated tissue sparing enhances functional repair after spinal cord contusion in adult rats. Cell Transplant, 2012, 21(7): 1561–1575.
[14]Lu P, Wang YZ, Graham L, et al. Long-distance growth and connectivity of neural stem cells after severe spinal cord injury. Cell, 2012, 150(6):1264–1273.
[15]Chen SX, Shi JB, Zhang M, et al. Mesenchymal stem cell-laden anti-inflammatory hydrogel enhances diabetic wound healing. Sci Rep, 2015, 5: 18104.
[16]Ibrahim M, Jang M, Park M, et al. Capsaicin inhibits the adipogenic differentiation of bone marrow mesenchymal stem cells by regulating cell proliferation, apoptosis, oxidative and nitrosative stress. Food Funct, 2015, 6(7): 2165–2178.
[17]Yin Y, Wu RX, He XT, et al. Influences of age-related changes in mesenchymal stem cells on macrophages duringin-vitroculture. Stem Cell Res Ther, 2017, 8(1): 153.
[18]Dasari VR, Spomar DG, Cady C, et al. Mesenchymal stem cells from rat bone marrow downregulate caspase-3-mediated apoptotic pathway after spinal cord injury in rats. Neurochem Res, 2007, 32(12):2080–2093.
[19]Liu XZ, Xu XM, Hu R, et al. Neuronal and glial apoptosis after traumatic spinal cord injury. J Neurosci, 1997, 17(14): 5395–5406.
[20]Li GL, Farooque M, Holtz A, et al. Apoptosis of oligodendrocytes occurs for long distances away from the primary injury after compression trauma to rat spinal cord. Acta Neuropathol, 1999, 98(5):473–480.
[21]Emery E, Aldana P, Bunge MB, et al. Apoptosis after traumatic human spinal cord injury. J Neurosurg, 1998, 89(6): 911–920.
[22]Crowe MJ, Bresnahan JC, Shuman SL, et al.Apoptosis and delayed degeneration after spinal cord injury in rats and monkeys. Nat Med, 1997,3(1): 73–76.
[23]Furuya T, Hashimoto M, Koda M, et al. Treatment of rat spinal cord injury with a Rho-kinase inhibitor and bone marrow stromal cell transplantation. Brain Res, 2009, 1295: 192–202.
[24]Mothe AJ, Bozkurt G, Catapano J, et al. Intrathecal transplantation of stem cells by lumbar puncture for thoracic spinal cord injury in the rat. Spinal Cord,2011, 49(9): 967–973.
[25]Ankeny DP, McTigue DM, Jakeman LB. Bone marrow transplants provide tissue protection and directional guidance for axons after contusive spinal cord injury in rats. Exp Neurol, 2004, 190(1):17–31.
[26]Tian DS. Activation by oscillating field stimulation on damaged spinal cord oligodendrocyte precursor cells and the related research [D]. Ji’nan: Shandong University, 2014 (in Chinese).田大胜. 振荡电场刺激对受损脊髓少突胶质前体细胞的活化作用及相关研究[D]. 济南: 山东大学,2014.
[27]Huang SQ, Qi W, Sun SQ, et al. Axonal demyelination and alteration of MBP and Id2 expression after compressed spinal cord injury. J Third Mil Med Univ, 2013, 35(5): 381–384 (in Chinese).黄思琴, 漆伟, 孙善全, 等. 大鼠脊髓压迫性损伤后脱髓鞘病变及MBP、Id2的表达变化. 第三军医大学学报, 2013, 35(5): 381–384.
[28]Jiang J, Sun SQ. Effect of curcumin on demyelination after compressed spinal cord injury. Chin J Clin Anat, 2014, 32(4): 437–441 (in Chinese).蒋锦, 孙善全. 姜黄素对脊髓压迫性损伤脱髓鞘病变的保护作用. 中国临床解剖学杂志, 2014,32(4): 437–441.
[29]Tian YT. The influence of estrogen on myelin regeneration and its related mechanism[D]. Shijiazhuang:Hebei Medical University, 2015 (in Chinese).田亚汀. 雌激素对髓鞘再生的影响及机制研究[D].石家庄: 河北医科大学, 2015.
[30]Huang JL. The experimental study about mesenchymal stem cells promoting remyelination in cuprizoneinduced demyelination mice [D]. Chongqing: Third Military Medical University, 2013 (in Chinese).黄嘉璐. 骨髓间充质干细胞促进Cuprizone诱导的脱髓鞘模型髓鞘修复的实验研究[D]. 重庆: 第三军医大学, 2013.
[31]Martinez AMB, de Oliveira Goulart C, Dos Santos Ramalho B, et al. Neurotrauma and mesenchymal stem cells treatment: from experimental studies to clinical trials. World J Stem Cells, 2014, 6(2):179–194.
[32]Chen K, Man C, Zhang B, et al. Effect ofin vitrochondrogenic differentiation of autologous mesenchymal stem cells on cartilage and subchondral cancellous bone repair in osteoarthritis of temporomandibular joint. Int J Oral Maxillofac Surg, 2013, 42(2):240–248.
[33]Khayat G, Rosenzweig DH, Quinn TM. Low frequency mechanical stimulation inhibits adipogenic differentiation of C3H10T1/2 mesenchymal stem cells. Differentiation, 2012, 83(4): 179–184.
[34]Chen J, Zhang ZM, Liu J, et al. Acellular spinal cord scaffold seeded with bone marrow stromal cells protects tissue and promotes functional recovery in spinal cord-injured rats. J Neurosci Res, 2014,92(3): 307–317.
[35]Burns AS, Marino RJ, Kalsi-Ryan S, et al. Type and timing of rehabilitation following acute and subacute spinal cord injury: a systematic review.Global Spine J, 2017, 7(S3): 175S–194S.
[36]Chen KN, Deng SY, Lu HZ, et al. RNA-seq characterization of spinal cord injury transcriptome in acute/subacute phases: a resource for understanding the pathology at the systems level.PLoS ONE, 2013, 8(8): e72567.
[37]Nakajima H, Uchida K, Guerrero AR, et al.Transplantation of mesenchymal stem cells promotes an alternative pathway of macrophage activation and functional recovery after spinal cord injury. J Neurotrauma, 2012, 29(8): 1614–1625.
[38]Zhang LX, Yin YM, Zhang ZQ, et al. Grafted bone marrow stromal cells: a contributor to glial repair after spinal cord injury. Neuroscientist, 2015, 21(3):277–289.
[39]Wright KT, El Masri W, Osman A, et al. Concise review: bone marrow for the treatment of spinal cord injury: mechanisms and clinical applications.Stem Cells, 2011, 29(2): 169–178.
[40]Syková E, Jendelová P, Urdzíková L, et al. Bone marrow stem cells and polymer hydrogels--two strategies for spinal cord injury repair. Cell Mol Neurobiol, 2006, 26(7/8): 1111–1127.
[41]Schwartz M, Yoles E. Immune-based therapy for spinal cord repair: autologous macrophages and beyond. J Neurotrauma, 2006, 23(3/4): 360–370.
[42]McKeon RJ, Schreiber RC, Rudge JS, et al.Reduction of neurite outgrowth in a model of glial scarring following CNS injury is correlated with the expression of inhibitory molecules on reactive astrocytes. J Neurosci, 1991, 11(11): 3398–3411.
[43]Fitch MT, Doller C, Combs CK, et al. Cellular and molecular mechanisms of glial scarring and progressive cavitation:in vivoandin vitroanalysis of inflammation-induced secondary injury after CNS trauma. J Neurosci, 1999, 19(19): 8182–8198.
[44]Park DY, Mayle RE, Smith RL, et al. Combined transplantation of human neuronal and mesenchymal stem cells following spinal cord injury. Global Spine J, 2013, 3(1): 1–5.
[45]Shahrezaie M, Mansour RN, Nazari B, et al.Improved stem cell therapy of spinal cord injury using GDNF-overexpressed bone marrow stem cells in a rat model. Biologicals, 2017, 50: 73–80.
[46]Mayer U, Benditz A, Grässel S. miR-29b regulates expression of collagens I and III in chondrogenically differentiating BMSC in an osteoarthritic environment. Sci Rep, 2017, 7: 13297.
[47]Sun JM, Wei ZZ, Gu XH, et al. Intranasal delivery of hypoxia-preconditioned bone marrow-derived mesenchymal stem cells enhanced regenerative effects after intracerebral hemorrhagic stroke in mice. Exp Neurol, 2015, 272: 78–87.
[48]Parr AM, Tator CH, Keating A. Bone marrow-derived mesenchymal stromal cells for the repair of central nervous system injury. Bone Marrow Transplant, 2007, 40(7): 609–619.
[49]Syková E, Jendelová P. Magnetic resonance tracking of implanted adult and embryonic stem cells in injured brain and spinal cord. Ann N Y Acad Sci,2005, 1049(1): 146–160.
[50]Li J, Guo WC, Xiong M, et al. Erythropoietin facilitates the recruitment of bone marrow mesenchymal stem cells to sites of spinal cord injury. Exp Ther Med, 2017, 13(5): 1806–1812.
[51]Al-Gharaibeh A, Culver R, Stewart AN, et al.Induced pluripotent stem cell-derived neural stem cell transplantations reduced behavioral deficits and ameliorated neuropathological changes in YAC128 mouse model of Huntington’s disease. Front Neurosci, 2017, 11: 628.
[52]Ahn JH, Chen BH, Shin BN, et al. Intravenously infused F3.Olig2 improves memory deficits via restoring myelination in the aged hippocampus following experimental ischemic stroke. Cell Transplant, 2016, 25(12): 2129–2144.
[53]Pettersson LME, Geremia NM, Ying ZX, et al.Injury-associated PACAP expression in rat sensory and motor neurons is induced by endogenous BDNF.PLoS ONE, 2014, 9(6): e100730.
[54]Chen SD, Wu CL, Hwang WC, et al. More insight into BDNF against neurodegeneration: anti-apoptosis,anti-oxidation, and suppression of autophagy. Int J Mol Sci, 2017, 18(3): 545.
[55]Yu HJ, Sun SQ. The role of BDNF on demyelination after compressed spinal cord injury in rat. Chin J Clin Anat, 2016, 34(2): 186–190 (in Chinese).余海军, 孙善全. BDNF在大鼠脊髓压迫性损伤脱髓鞘病变中的作用. 中国临床解剖学杂志, 2016,34(2): 186–190.
[56]Uchida K, Nakajima H, Hirai T, et al. The retrograde delivery of adenovirus vector carrying the gene for brain-derived neurotrophic factor protects neurons and oligodendrocytes from apoptosis in the chronically compressed spinal cord of twy/twy mice. Spine, 2012, 37(26): 2125–2135.

