甲基莲心碱在氧化应激中的作用机制研究
刘向东,李慧,王成志,赵焕东,肖平
(1.中南大学湘雅医院 肾内科,湖南 长沙 410008;2.湖南省长沙市第一医院 呼吸科,湖南 长沙 410005;3.中南大学湘雅医院 卫生部纳米生物技术重点实验室,湖南 长沙 410007)
甲基莲心碱(Neferine, Nef)是从莲子心中提取的一种双苄基异喹啉类生物碱[1-2]。研究表明,其具有抗癌﹑抗血栓形成﹑减轻急性肾损伤﹑抑制炎症和氧化应激等生物学作用[1-7]。但对于Nef在糖尿病肾病中的作用及机制尚不清楚。本研究以高糖培养大鼠近端肾小管上皮细胞(normal rat kidney proximal tubular epithelial cell, NRK-52E)复制糖尿病体外细胞实验模型[8-9]。采用Nef进行干预,观察细胞活力﹑血红素加氧酶1(heme oxygenase-1, HO-1)和氧化应激指标的变化,探究Nef在糖尿病肾病中的作用及其机制。见图 1﹑2。

图1 Nef化学结构式
图2 NRK-52E细胞 (×100)
1 材料与方法
1.1 仪器与试剂
NRK-52E细胞株(中国科学院上海细胞库),DMEM细胞培养基(美国Hyclone公司),胎牛血清(中国杭州四季青生物工程材料有限公司),Nef(中国大连美仑生物技术有限公司),D-无水葡萄糖(中国北京索莱宝科技有限公司),锌原卟啉Ⅸ(zinc protoporphyrin Ⅸ, ZnP)和甘露醇购自美国Sigma公司,HO-1抗体和P67抗体购自美国Abcam公司,β-actin抗体(美国Cell Signaling Technology公司),CCK-8(日本同仁化学研究所),总胆红素(total bilirubin,TB)﹑活性氧(reactive oxygen species, ROS)及丙二醛(malondialdehyde, MDA)测定试剂盒购自中国南京建成生物工程研究所。细胞培养箱(日本SANYO公司),酶标仪(美国Bio-Tek公司),电泳仪(美国BIORAD公司),Fluor Chem R多功能成像分析系统(美国ProteinSimple公司),流式细胞仪(美国BD Biosciences公司)。
1.2 方法
1.2.1 细胞培养 将NRK-52E细胞培养于含5%胎牛血清的DMEM低糖培养基,于37℃﹑5%二氧化碳CO2细胞培养箱中培养,每1﹑2天更换培养基。细胞长满瓶底约80%时,按1∶3~1∶5进行传代,取对数期细胞用于实验。
1.2.2 细胞分组 实验分为6组:①对照组,用正常葡萄糖浓度(5.5 mmol/L)的DMEM培养基培养细胞,不予特殊处理;②高渗组,在对照组中加入38.9 mmol/L甘露醇,作为渗透压对照[8];③高糖组,加入无水葡萄糖使DMEM培养基中葡萄糖浓度达44.4 mmol/L,作为糖尿病肾病体外细胞实验模型[8-9];④Nef组,在高糖组中加入2μmol/L Nef;⑤HO-1抑制剂组,在Nef组中加入10μmol/L HO-1特异性酶活性抑制剂ZnP;⑥ZnP组:对照组中加入10μmol/L ZnP。上述各组干预时间均为24 h。
1.2.3 CCK-8法 采用CCK-8法检测细胞活力。取对数期NRK-52E细胞种植于96孔板,细胞密度2 000个/孔,培养12 h后进行换液,加入含不同处理组药物的培基继续培养24 h,再加入10μl CCK-8试剂于37℃细胞培养箱中孵育2 h,最后使用酶标仪检测各孔450 nm处吸光度。上述实验独立重复≥3次。
1.2.4 Western blot检测 采用 Western blot检测HO-1和P67的表达。使用RIPA细胞裂解液裂解各组细胞,收集蛋白样品。使用10% SDS-PAGE凝胶电泳进行蛋白分离,再将蛋白质电转移(250 mA,2 h)至0.45μm孔径的PVDF膜;用含5%胎牛血清白蛋白的TBST封闭2 h;随后于4℃孵育一抗过夜(HO-1比例1∶20 000,P67和β-actin比例1∶2 000)。用TBST洗膜3次,10min/次,加入二抗于室温孵育1 h;TBST洗膜洗膜3次,10min/次,最后使用超敏ECL化学发光剂显影,用Alpha-View软件进行灰度值分析。
1.2.5 DCFH-DA探针 采用DCFH-DA探针检测ROS。取对数期细胞接种于6孔板,培养稳定12 h后换液,加入含不同处理组药物的培基继续培养21 h,再加入8μmol/L DCFH于37℃孵育3 h,弃培养液,预冷PBS漂洗2遍,加入无EDTA的胰酶消化后收集细胞,预冷PBS再次漂洗2遍,加入PBS重悬(细胞密度10×106个/ml),最后使用流式细胞仪检测细胞内荧光信号(激发波长500 nm,发射波长525 nm),采用Flowjo 7.6软件进行结果分析[10-12]。实验独立重复3次。
1.2.6 TB和MDA的检测 细胞接种于培养皿,培养稳定12 h后换液,加入含不同处理组药物的培基继续培养24 h,收集细胞,按照检测试剂盒说明书分别定量检测TB和MDA,并使用细胞总蛋白进行标准化(nmol/mg)。
1.3 统计学方法
数据分析采用SPSS 18.0统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Nef对高糖培养的NRK-52E细胞活力的影响
对照组﹑ZnP组﹑高渗组﹑高糖组﹑Nef组﹑HO-1抑制剂组的细胞活力分别为(100.00±8.33)%﹑(84.18±6.64)%﹑(91.30±10.62)%﹑(73.88±7.82)%﹑(108.16±12.12)%和(84.26±11.57)%,经方差分析,差异有统计学意义(F=10.837,P=0.000)。进一步两两比较经LSD-t检验,ZnP组﹑高渗组的细胞活力与对照组比较,差异无统计学意义(P>0.05);高糖组细胞活力低于对照组和Nef组(P<0.05);HO-1抑制剂组细胞活力低于Nef组(P<0.05)。
对照组NRK-52E细胞活力为(100.00±10.71)%,0.0﹑0.5﹑1.0﹑2.0﹑4.0﹑6.0﹑8.0 和 16.0μmol/L Nef组 的 细 胞 活 力 分 别 为(76.67±9.99)%﹑(81.11±7.68)%﹑(90.11±7.41)%﹑(103.81±15.81)%﹑(114.08±10.19)%﹑(116.21±5.59)%﹑(94.30±7.11)%和(53.16±7.29)%,经方差分析,差异有统计学意义(F=17.333,P=0.000)。进一步两两比较经LSD-t检验,0.0μmol/L Nef组细胞活力低于对照组(P<0.05);16.0μmol/L组细胞活力低于 0.0μmol/L Nef组(P<0.05);2.0﹑4.0﹑6.0和 8.0μmol/L Nef组细胞活力均高于0.0μmol/L Nef组。见图3。
2.2 Nef对HO-1和P67蛋白表达的影响
2.2.1 HO-1蛋白 对照组HO-1蛋白相对表达量为(1.00±0.00),0.0﹑0.5﹑1.0﹑2.0 和 4.0μmol/L Nef组HO-1蛋白相对表达量分别为(1.34±0.10)﹑(1.58±0.30)﹑(2.22±0.47)﹑(2.96±0.39)和(3.62±0.19),经方差分析,差异有统计学意义(F=36.778,P=0.000)。进一步两两比较经LSD-t检验,0.0μmol/L Nef组HO-1蛋白相对表达量与对照组比较,差异无统计学意义(P>0.05);1.0﹑2.0和 4.0μmol/L Nef组HO-1蛋白表达水平高于 0.0μmol/L Nef组(P<0.05)。见图4。
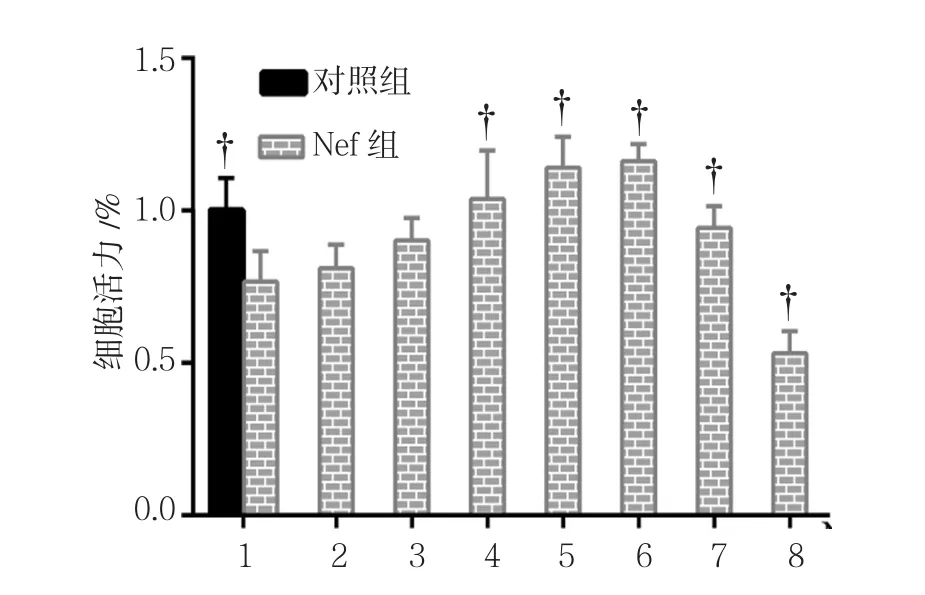
图3 不同浓度Nef对NRK-52E细胞活力的影响 (±s)
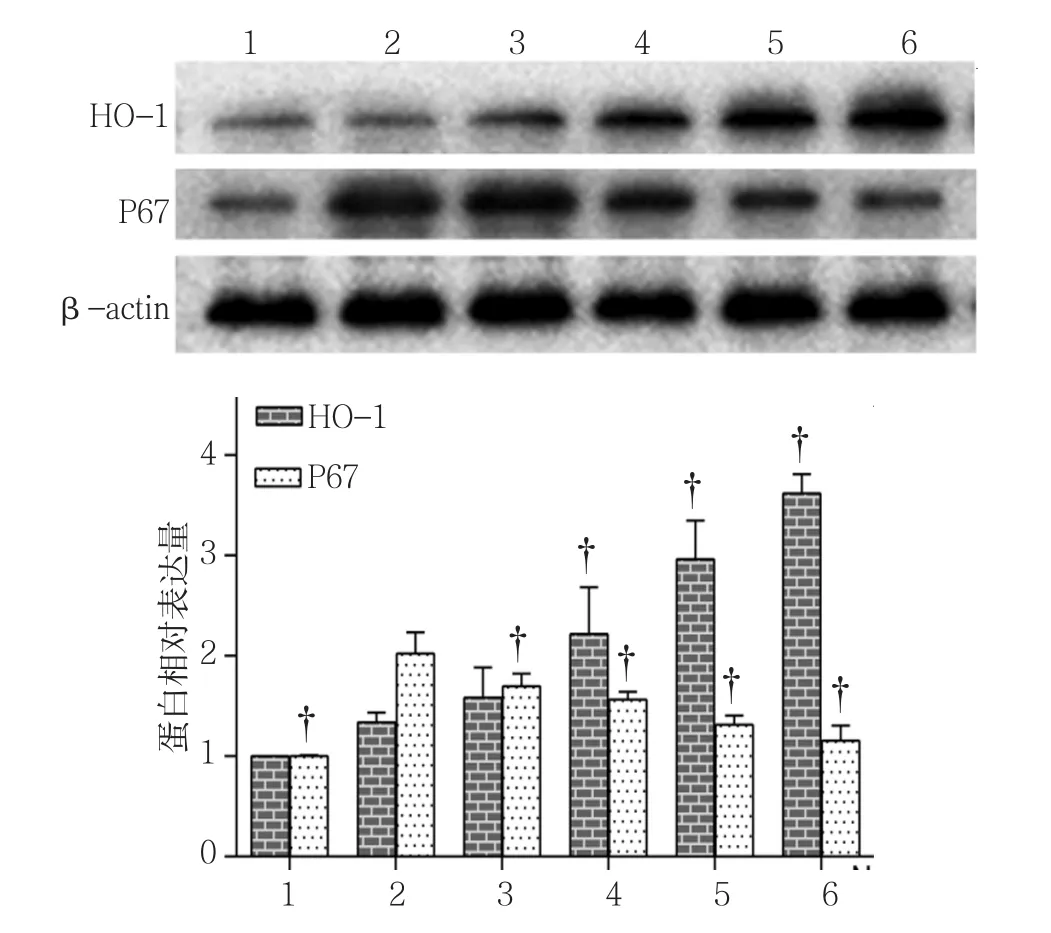
图4 不同浓度Nef对HO-1和P67蛋白表达的影响
2.2.2 P67蛋白 对照组P67蛋白相对表达量为(1.00±0.00),0.0﹑0.5﹑1.0﹑2.0 和 4.0μmol/L Nef组P67蛋白相对表达量分别为(2.02±0.21)﹑(1.70±0.13)﹑(1.56±0.08)﹑(1.31±0.09) 和(1.16±0.15),经方差分析,差异有统计学意义(F=25.728,P=0.000)(见图4)。进一步两两比较经LSD-t检验,0.0μmol/L Nef组P67蛋白表达水平高于对照组(P<0.05);0.5﹑1.0﹑2.0和4.0μmol/L Nef组P67蛋白表达水平低于0.0μmol/L Nef组(P<0.05)。对照组﹑高渗组﹑高糖组﹑Nef组﹑HO-1抑制剂组﹑ZnP组的P67蛋白相对表达量分别为(1.00±0.00)﹑(1.08±0.17)﹑(1.75±0.15)﹑(1.32±0.22)﹑(1.98±0.13)和(1.19±0.03),经方差分析,差异有统计学意义(F=23.629,P=0.000)(见图 5)。进一步两两比较经LSD-t检验,高糖组P67蛋白表达水平高于对照组(P<0.05);Nef组P67蛋白表达水平低于高糖组(P<0.05);HO-1抑制剂组P67蛋白表达水平高于 Nef组(P<0.05)。
2.3 Nef对HO-1酶活性的影响
对照组﹑ZnP组﹑高渗组﹑高糖组﹑Nef组﹑HO-1抑制剂组的HO-1酶活性分别为(0.75±0.13)﹑(0.57±0.10)﹑(0.87±0.17)﹑(1.07±0.11)﹑(2.90±0.29)和(0.66±0.12)nmol/mg,经方差分析,差异有统计学意义(F=86.536,P=0.000)。进一步两两比较经LSD-t检验,高糖组HO-1酶活性高于对照组(P<0.05);Nef组HO-1酶活性高于高糖组(P<0.05);HO-1抑制剂组HO-1酶活性低于Nef组(P<0.05)。
对照组HO-1酶活性(0.75±0.13)nmol/mg,0.0﹑0.5﹑1.0﹑2.0和 4.0μmol/L Nef组 的 HO-1酶 活 性分 别 为(1.07±0.11)﹑(1.46±0.20)﹑(2.03±0.24)﹑(2.90±0.29)和(3.52±0.35)nmol/mg,经方差分析,差异有统计学意义(F=63.828,P=0.000)。进一步两两比较经LSD-t检验,0.0μmol/L Nef组HO-1酶活性与对照组比较,差异无统计学意义(P>0.05);1.0﹑2.0和4.0μmol/L Nef组的HO-1酶活性高于0.0μmol/L Nef组(P<0.05)。见图 6。
2.4 Nef对高糖培养的NRK-52E细胞ROS水平的影响
对照组﹑高渗组﹑高糖组﹑Nef组﹑HO-1抑制剂组﹑ZnP组的ROS分别为(1539.16±882.07)﹑(2564.16±1550.08)﹑(13342.50±1952.24)﹑(5077.83±611.45)﹑(16175.83±678.36)和(2248.16±1592.09),经方差分析,差异有统计学意义(F=69.496,P=0.000)。进一步两两比较经LSD-t检验,高糖组ROS水平高于对照组(P<0.05);Nef组ROS水平低于高糖组(P<0.05);HO-1抑制剂组ROS水平高于Nef组(P<0.05)。见图 7。
2.5 Nef对MDA的影响
对照组﹑ZnP组﹑高渗组﹑高糖组﹑Nef组﹑HO-1抑 制 剂 组 的 MDA分 别 为(0.381±0.036)﹑(0.536±0.031)﹑(0.492±0.039)﹑(0.914±0.093)﹑(0.472±0.070) 和(1.038±0.088)nmol/mg, 经 方差分析,差异有统计学意义(F=52.016,P=0.000)。进一步两两比较经LSD-t检验,高糖组MDA水平高于对照组(P<0.05);Nef组MDA水平低于高糖组(P<0.05);HO-1抑制剂组MDA水平高于Nef组(P<0.05)。
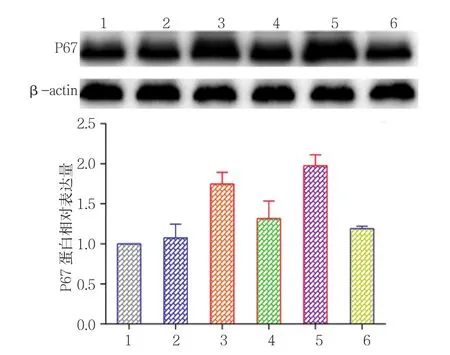
图5 不同处理组P67蛋白表达水平比较
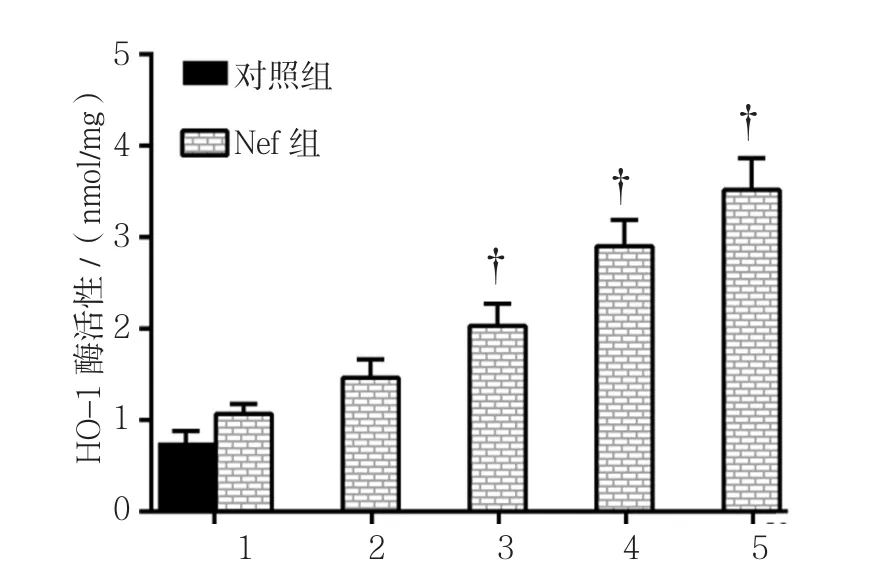
图6 不同浓度Nef对 HO-1酶活性的影响 (±s)

图7 不同处理组ROS的变化
3 讨论
氧化应激在组织器官损伤和功能障碍中扮演重要角色[13]。过高的ROS可使细胞内蛋白质﹑脂质和核酸出现过氧化损伤,并引起细胞代谢障碍,最终导致细胞功能障碍,甚至出现坏死或凋亡[13-16]。在糖尿病中,NADPH氧化酶活性增加﹑线粒体功能障碍等导致ROS产生增多,而超氧化物歧化酶﹑过氧化氢酶﹑谷胱甘肽过氧化物酶功能下降又引起ROS清除障碍,最终导致ROS产生并积聚,使机体持续处于氧化应激状态[14-15,17]。在糖尿病肾脏,ROS可直接损伤滤过屏障﹑足细胞﹑内皮细胞和肾小管上皮细胞,还可通过激活多元醇途径和蛋白激酶C,促进糖基化产物形成及肾间质纤维化,最终导致糖尿病肾病[8,14,18]。目前临床上常使用硫辛酸﹑维生素E等抗氧化剂进行抗氧化应激治疗,但疗效有限,因此寻找更安全有效的抗氧化应激药物是当务之急[19]。
已知中药莲子心具有解热﹑镇痛﹑止血剂等功效。Nef是莲子心的重要活性成分。以往研究表明,其具有抗癌﹑抗心律失常﹑抗血栓形成﹑抗纤维化﹑抗炎﹑抗氧化应激及抗凋亡等作用[1,6,20-21]。本研究利用高糖培养NRK-52E细胞,复制糖尿病肾病体外实验模型[8],通过检测NADPH氧化酶﹑ROS﹑MDA及细胞活力,证实高糖可以诱导NRK-52E细胞出现氧化应激,导致细胞活力下降,并发现Nef可减轻上述氧化应激损伤。
NADPH氧化酶是产生ROS的主要酶,与肾脏氧化应激密切相关,由5个亚基组成:2个膜亚基gp91﹑p22组成膜复合体,3个胞质亚基p40﹑p47﹑p67[8]。本研究通过Western blot检测P67亚基,反映NADPH氧化酶的表达和氧化应激。HO-1是血红素代谢的关键酶,广泛表达于全身各个组织器官,可将血红素分解为一氧化碳CO﹑胆绿素和Fe2+,具有舒张血管﹑抗炎﹑抗氧化应激及抗凋亡等作用[22-23]。在肾脏,HO-1主要表达于近端肾小管上皮细胞,依次是远端小管﹑集合管和髓袢,肾小球﹑足细胞和系膜细胞几乎不表达,因此本实验选择NRK-52E细胞作为研究对象[24-25]。HO-1是一种蛋白酶,其抗氧化应激功能主要由其代谢产物胆红素和CO产生,因此在实验中常采用胆红素的浓度来反映HO-1的酶活性[22,26]。HO-1抗氧化应激作用的强弱除与量有关,更与酶活性相关。本实验使用的ZnP就是与HO-1酶活性中心特异性结合,从而抑制HO-1的功能,但其对HO-1的表达无抑制作用,甚至因为酶活性下降,导致底物堆积,反而促进HO-1的表达[27-28]。本研究通过检测HO-1的表达和酶活性,并比较其在高糖组﹑Nef组和HO-1抑制剂组的变化,且同时检测和比较该组P67的表达水平﹑细胞活力﹑ROS和MDA,结果发现Nef可以诱导HO-1的表达并增加酶活性,相应地使P67表达下调,ROS和MDA下降,细胞活力增加;当抑制HO-1活性后,Nef上述作用消失,由此说明Nef具有抗氧化应激作用,而且该作用是通过HO-1实现的。
综上所述,本研究发现Nef通过诱导HO-1表达并增加酶活性,从而抑制NADPH氧化酶的表达,导致ROS减少,脂质过氧化减弱,氧化应激损伤减轻,从而保护细胞。不仅证实高糖可诱导氧化应激损伤,Nef具有抗氧化应激作用,并探究Nef抗氧化应激的部分机制,为临床治疗糖尿病肾病和氧化应激损伤提供新思路和实验依据,也为Nef的后续实验和临床应用打下实验基础。但本研究尚局限于细胞水平,且氧化应激检测指标有限,也只探究了Nef抗氧化应激作用与HO-1的关系,尚需从整体水平进一步验证,并探究更多的Nef抗氧化应激机制。
参 考 文 献:
[1]LI H, TANG Y, WEN L, et al. Neferine reduces cisplatin-induced nephrotoxicity by enhancing autophagy via the AMPK/mTOR signaling pathway[J]. Biochemical Biophysical Research Communications, 2017, 484(3): 694-701.
[2]BASKARAN R, POORNIMA P, HUANG C Y, et al. Neferine prevents NF-κB translocation and protects muscle cells from oxidative stress and apoptosis induced by hypoxia[J]. Biofactors,2016, 42(4): 407-417.
[3]GUAN G, HAN H, YANG Y, et al. Neferine prevented hyperglycemiainduced endothelial cell apoptosis through suppressing ROS/Akt/NF-κB signal[J]. Endocrine,2014,47(3):764-771.
[4]PRIYA L B, BASKARAN R, HUANG C Y, et al. Neferine ameliorates cardiomyoblast apoptosis induced by doxorubicin:possible role in modulating NADPH oxidase/ROS-mediated NF-κB redox signaling cascade[J]. Sci Rep, 2017, 7(1): 12283.
[5]EID W, ABDEL R W. Neferine enhances the antitumor effect of mitomycin-C in hela cells through the activation of p38-MAPK pathway[J]. Journal of Cellular Biochemistry, 2017, 118(10): 3472-3479.
[6]ZHENG L, CAO Y, LIU S, et al. Neferine inhibits angiotensin II-induced rat aortic smooth muscle cell proliferation predominantly by downregulating fractalkine gene expression[J]. Experimental Therapeutic Medicine, 2014, 8(5): 1545-1550.
[7]LI X, TONG G, ZHANG Y, et al. Neferine inhibits angiotensin II-stimulated proliferation in vascular smooth muscle cells through heme oxygenase-1[J]. Acta Pharmacologica Sinica, 2010, 31(6):679-686.
[8]PIWKOWSKA A, ROGACKA D, AUDZEYENKA I, et al. High glucose concentration affects the oxidant-antioxidant balance in cultured mouse podocytes[J]. Journal of Cellular Biochemistry,2011, 112(6): 1661-1672.
[9]ZHANG X, LIU X, LI Y, et al. Downregulation of microRNA-155 ameliorates high glucose-induced endothelial injury by inhibiting NF-κB activation and promoting HO-1 and NO production[J].Biomedicine Pharmacotherapy, 2017, 88: 1227-1234.
[10]SUN Z, HU W, YIN S, et al. NGF protects against oxygen and glucose deprivation-induced oxidative stress and apoptosis by upregulation of HO-1 through MEK/ERK pathway[J]. Neuroscience Letters, 2017, 641: 8-14.
[11]JIA Z, DONG A, CHE H, et al. 17-DMAG protects against hypoxia-/reoxygenation-induced cell injury in HT22 cells through Akt/Nrf2/HO-1 pathway[J]. Dna Cell Biology, 2016, 36(2): 95-102.
[12]WANG Z, KA S O, LEE Y, et al. Butein induction of HO-1 by p38 MAPK/Nrf2 pathway in adipocytes attenuates high-fat diet induced adipose hypertrophy in mice[J]. European Journal of Pharmacology, 2017, 799: 201-210.
[13]PRUCHNIAK M P, ARAZNA M, DEMKOW U. Biochemistry of oxidative stress[J]. Oxygen Transport to Tissue XXXIII, 2015,23(11): 9-19.
[14]SAGOO M K, GNUDI L. Diabetic nephropathy: is there a role for oxidative stress[J]. Free Radical Biology Medicine, 2018, 116:50-63.
[15]RABILLOUD T, CHEVALLET M, LUCHE S, et al. Oxidative stress response: a proteomic view[J]. Expert Review of Proteomics, 2005, 2(6): 8-14.
[16]RABILLOUD T, CHEVALLET M, LUCHE S, et al. Oxidative stress response: a proteomic view[J]. Expert Review of Proteomics, 2008, 2(6): 949-956.
[17]FORBES J M, COUGHLAN M T, Cooper M E. Oxidative stress as a major culprit in kidney disease in diabetes[J]. Diabetes, 2008,57(6): 1446-1454.
[18]KANWAR Y S, SUN L, XIE P, et al. A glimpse of various pathogenetic mechanisms of diabetic nephropathy[J]. Annual Review of Pathology, 2011, 6(1): 395-423.
[19]中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版)[J]. 中国医学前沿杂志: 电子版, 2015, (3): 26-89.
[20]SHIBU M A, RAVICHANDRAN M, SHANMUGAVADIVU M,et al. Pharmacological benefits of neferine - a comprehensive review[J]. Life Sci, 2018, 199: 60-70.
[21] GUAN G, HAN H, YANG Y, et al. Neferine prevented hyperglycemia-induced endothelial cell apoptosis through suppressing ROS/Akt/NF-κB signal[J]. Endocrine, 2014, 47(3):764-771.
[22]查锡良, 药立波. 生物化学与分子生物学[M]. 第8版. 北京:人民卫生出版社, 2013: 246-249.
[23]KIM J, LIM J, KANG B Y, et al. Capillarisin augments antioxidative and anti-inflammatory responses by activating Nrf2/HO-1 signaling[J]. Neurochemistry International, 2017, 105: 11-20.
[24]ABRAHAM N G, CAO J, SACERDOTI D, et al. Heme oxygenase: the key to renal function regulation[J]. American Journal of Physiology Renal Physiology, 2009, 297(5): 1137-1152.
[25]DA S J, ZAND B A, YANG L M, et al. Heme oxygenase isoformspecific expression and distribution in the rat kidney[J]. Kidney International, 2001, 59(4): 1448-1457.
[26]MAAMOUN H, ZACHARIAH M, MCVEY J H, et al. Heme oxygenase (HO)-1 induction prevents endoplasmic reticulum stress-mediated endothelial cell death and impaired angiogenic capacity[J]. Biochemical Pharmacology, 2017, 127(Suppl 4): 46-59.
[27]ZHANG C, LI C, CHEN S, et al. Berberine protects against 6-OHDA-induced neurotoxicity in PC12 cells and zebrafish through hormetic mechanisms involving PI3K/AKT/Bcl-2 and Nrf2/HO-1 pathways[J]. Redox Biology, 2017, 11(C):1-11.
[28]LI W, ZHI W, LIU F, et al. Atractylenolide I restores HO-1 expression and inhibits Ox-LDL-induced VSMCs proliferation,migration and inf l ammatory responses in vitro[J]. Experimental Cell Research, 2017, 353(1): 26-34.

