戊唑醇对秀丽线虫的生殖毒性作用
吕荣荣,屈满,岳营,邱月秀,尹立红,李云晖*
(东南大学公共卫生学院环境医学工程教育部重点实验室,江苏南京210009)
戊唑醇(tebuconazole,TEB)是一种羟乙基三唑衍生物,属于三唑类内吸收性杀菌剂,全球生产量大,在农业上应用广泛,并在农作物、水体、土壤中有大量的残留,在小溪中的最大残余量为9.1μg/L[1],对人类以及动物的健康造成了威胁。动物实验表明三唑类杀菌剂具有哺乳动物生殖毒性[2],可降低附睾和前列腺的质量,导致前列腺组织形态学的改变,精子数量的降低[3]。目前的研究表明,戊唑醇有生物富集性,有明显的肝毒性,并可以导致甾类激素合成障碍,损害内分泌相关器官,可以导致雄性生物雌性化[4]。
秀丽线虫(简称线虫),是研究生殖毒性的优秀模式动物[5]。线虫虫体比较小,易于饲养,可以在短时间内获得大量的实验样本,全身透明,易于进行荧光观察,基因与人具有40%的同源性,实验结果具有很好的外推性。包括哺乳动物与线虫在内的有性生殖生物,生殖细胞从生殖干细胞到有活性的生殖细胞的过程具有高度的保守性。在雄性中,生殖细胞通过有丝分裂进行生殖干细胞的自我更新,经过两次减数分裂形成单倍体配体,精细胞活化后成为可以受精的精子。与生殖相关的基因,线虫与哺乳动物也具有高度同源性[6]。所以用秀丽线虫作为模式生物研究环境毒物对精子发生过程的毒性作用具有较高的可靠性。本研究主要是利用秀丽线虫的优势探讨戊唑醇对于精子发生和精子形成过程的影响以及潜在的毒作用机制。
1 材料与方法
1.1 秀丽线虫虫株与培养方法
野生型N2、him-5(e1490)和fog-2(q71)虫株均购于美国明尼苏达大学线虫遗传中心(Caenorhabditis Genetic Center,CGC)。him-5(e1490),雄虫突变体,有33%的雄虫可以用于雄性生殖毒性方面的研究;fog-2(q71) 是雌虫突变体,本身不产生精子,可与雄虫进行杂交产生后代。本研究所用的所有基因型的秀丽线虫均培养于加有大肠杆菌(OP50)的线虫生长培养基(nematode growth media,NGM),恒温20℃培养。
1.2 主要试剂以及配制方法
戊唑醇,纯度99.999%,购于百灵威科技公司;琼脂糖、琼脂 、 多聚蛋白胨、 胆固醇和二甲基亚砜均购于美国Sigma-Aldrich公司;二脒基苯基吲哚(DAPI),购于中国Sigma-Aldrich公司;Pronase购于瑞士Roche公司;Trizol购于美国Invitrogen公司;SYBR Green I购于日本Toyobo公司。
M9缓冲液:氯化钠2.5g、磷酸氢二钠3g、磷酸二氢钾1.5g,加蒸馏水定容到500mL,高压灭菌结束后加入0.5mL浓度为1mol/L的硫酸镁,摇匀备用。
SM缓冲液:25mmol/L氯化钾 、 45mmol/L氯化钠 、 5mmol/L氯化钙 、1 m mol/L 硫 酸镁 、 50mmol/L HEPES,调整pH至7.6左右,过滤除菌,现用现配加入BSA或PVP,终浓度分别为1和10mg/mL。
1.3 实验方法
1.3.1 染毒方法将戊唑醇溶解于DMSO中,配制成1 mg/mL的储备液,然后用无菌M9溶液稀释成所需染毒浓度,设3个浓度组分别为0.1、1.0和10.0μg/L,并设定M9溶液为对照组。提前1d制作用于染毒的带有NGM培养基的24孔板中,并加入OP50。将400μL配制好的染毒液滴至24孔板内,然后将L2期的秀丽线虫[N2或者him-5(e1490)]加入染毒皿中,在20℃恒温培养箱中染毒直到L4期。
1.3.2 生育力和发育水平的测定染毒后的野生型N2线虫用挑针随机分别挑到10个新的并预置OP50的NGM培养基上,每24h转一次板,直到线虫不再产卵。对每个平板中的秀丽线虫进行计数,并计算出每个线虫的总后代数目。染毒后的秀丽线虫挑到新的NGM培养基上,观察产第1只卵的时间记为 t0,第1只卵孵化后挑入新的NGM培养基上,子一代产第1只卵的时间记为t1,世代时间为 t1-t0。
同时培养him-5(e1490)雄虫突变株与fog-2(q71)雌虫突变株。突变体fog-2(q71)发育到雌雄虫株可以分辨时,将雌虫挑入新的培养皿中单独培养。him-5(e1490)雄虫按照1.3.1的方法染毒结束后与fog-2(q71)雌虫(young adult期)按1∶1的比例挑入提前加有 1滴OP50的新的NGM培养基上,12h杂交结束后将fog-2(q71)雌虫挑入新的、加有OP50的NGM培养基上,每隔24h转一次板,直至线虫不再产卵,计算每个线虫的总产卵数。每组至少计数10条。
1.3.3 生殖细胞计数[7]染毒后的him-5雄性秀丽线虫用M9溶液洗涤3次,用挑针将线虫挑至玻片上,用90%的酒精洗涤3次,加2μg/mL的DAPI染液,盖上盖玻片,用荧光显微镜进行拍照观察,经染色后生殖细胞核呈蓝色,并整齐的排列在生殖腺内。整个实验过程在恒温环境下进行,并避光。将一列细胞中至少有2个或以上的具有新月形细胞核的细胞区域定义为过渡区(transition zone,TZ)[8],顶体末梢细胞(distal tip cell,DTC)与TZ之间的细胞为有丝分裂细胞,TZ之后的细胞为减数分裂细胞,根据细胞核的形态确定区域后,计算有丝分裂区和减数分裂区生殖细胞的数目。
1.3.4 精细胞形态和大小的测定染毒结束后的him-5(e1490)雄虫转移到不含OP50的NGM培养基上,除去线虫表面黏附的OP50。然后将线虫挑入提前加有1滴精子缓冲液(sperm medium buffer,SMB)的玻片上,在显微镜下用1mL注射器轻划线虫尾部1/3处,释放出精子。利用微分干涉相差显微镜进行精子形态 观 察,并随机选取视野进行拍照。每条线虫不少于200个精细胞,每组不少于10条。利用Image-pro Plus,测量精细胞的直径以及横截面积。
1.3.5 精细胞体外活化能力的测定在载玻片上滴10 μL含Pronase E(200μg/mL)的SM缓冲液,挑入5~10条染毒结束后除去OP50的him-5(e1490)雄虫至缓冲液中,用1mL注射器从线虫尾部1/3处划开,释放精细胞,10 min后用微分干涉差显微镜随机选取视野,观察精细胞能否形成正常伪足(应保证液体不会干),出现正常伪足即可视为活化;随机选取若干视野计数,每条线虫计数不少于100个精细胞,并计算其活化率。每个浓度组10条,实验重复3次。
1.3.6 RNA的提取以及实时荧光定量PCR用Trizol法提取him-5(e1490)线虫的总RNA,然后逆转录成cDNA进行实时荧光定量PCR(quantitativereal-time PCR,qPCR)。引物根据线虫数据库的序列(http://www.wormbase.org)以及美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)进行设计,具体的引物序列见表1。反应体系为:SYBR GreenIMasterMix8μL,SYBR GreenIMaster Plus2μL,上、下游引物(10μmol/L)各1.2μL,去离子水6.6μL,cDNA 1μL,组成20μL反应体系。根据引物序列确定退火温度,扩增步骤为94℃预变性5min,94℃、 5s,52℃退火30s(a ge-1, d af-2, d af-16基因);或54℃退火30 s(s w m-1, spe-6, a kt-1, spe-4, tr y-5, fer-1基因),采集荧光信号,40个循环;72℃、10min延伸,act-1作为内参照,采用相对定量法测定精子发生相关nsulin/IGF信号通路基因daf-2, a kt-1, a kt-2, d af-16以及SWM-1信号通路基因try-5, s pe-4, s pe-6,fer-1的mRNA相对表达水平。每个基因设定3个平行样,实验重复3次。

表1 精子发生与精子形成相关基因的引物序列(5´- 3 ´)
1.4 统计学方法
利- 用 SPSS17.0统计软件进行数据分析处理,结果采用x±s 表示,后代数目、生殖细胞数、精细胞直径、精细胞横截面积以及相关基因mRNA的表达水平组间的比较采用单因素方差分析,不同染毒剂量组分别与对照组之间差异的分析采用Dunnet’s t检验,其中检验水准 α=0.05。精细胞活化率的差异分析采用 χ2检验,不同染毒剂量组分别与对照组之间差异的分析采用四格表 χ2检验,并校准α 值。
2 结果
2.1 戊唑醇对秀丽线虫生育力与发育水平的影响
为了探讨戊唑醇是否对秀丽线虫具有生殖毒性,我们观察了野生型N2染毒后的后代数目,结果见图1A,可以看出戊唑醇剂量为10.0μg/L时可以引起野生型秀丽线虫后代数目的降低,差异具有统计学意义(P<0.05)。染毒后N2的世代时间无明显差异(图1B),表明这种后代数目的差异是由染毒后线虫生育力降低引起的,而非线虫发育不良所导致。为了进一步探讨这种后代数目的差异是否是由于精子受损引起的,我们观察了him-5(e1490)染毒后杂交后代数目,结果如图1C所示,戊唑醇染毒后 , 1.0和10.0μg/L剂量组均表现为后代数目的降低,差异具有统计学意义(P<0 .05),表明戊唑醇染毒后可以导致精子的产生过程受损。
2.2 戊唑醇对精子发生过程的毒作用
2.2.1 戊唑醇对线虫生殖腺生殖细胞数目的影响见图2。him-5(e1490)秀丽线虫戊唑醇染毒后,与对照组相比,戊唑醇在1.0和10.0μg/L剂量组有丝分裂细胞数(图2A),减数分裂细胞数(图2B),总生殖细胞数(图2C)均明显减少,差异均具有统计学意义(P均<0.05)。说明戊唑醇可以影响精子的发生过程,导致生殖毒性。

图2 戊唑醇染毒后对秀丽线虫生殖腺生殖细胞的影响
2.2.2 戊唑醇对精细胞数目的影响见 图 3。1.0和10.0μg/L戊唑醇染毒后,精细胞的数目与对照组相比明显降低(P均<0.05)。进一步表明戊唑醇对精子发生过程产生了影响,导致精细胞数目的降低,从而产生生殖毒性。
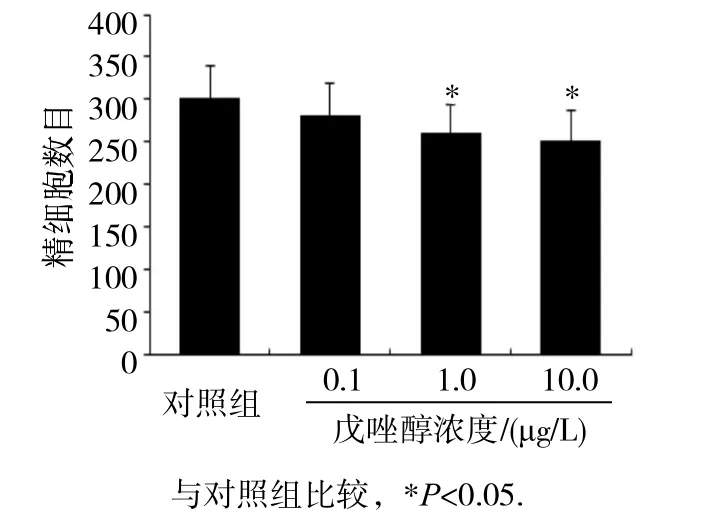
图3 戊唑醇染毒后对精细胞数目的影响
2.3 戊唑醇对精子形成过程的毒作用
戊唑醇染毒后,秀丽线虫精细胞的形态并未发现明显异常,非圆细胞的数量并未见明显增多,但戊唑醇染毒后精细胞的大小明显受到影响,精细胞的直径与面积都较对照组有明显的降低 (P 均<0.01);利用pronase对染毒后him-5(e1490)秀丽线虫的精细胞进行体外活化,不能正常伸出伪足的精细胞视为未能正常活化的精细胞。发现1 .0 和 1 0 μg/L戊唑醇染毒后未活化的精细胞数目明显增多,精细胞的活化率明显降低(P<0.05或P<0.01),见表2。
2.4 戊唑醇对秀丽线虫精子发生以及精子形成相关基因表达的影响
2.4.1 戊唑醇对精子发生相关基因表达的影响戊唑醇暴露后对秀丽线虫精子发生相关的4种mRNA表达水平的影响见表3。与对照组相比,daf-2、akt-1、daf-16mRNA在1.0和10.0μg/L染毒剂量组的表达量均上升(P均<0.01);age-1mRNA在 0.1~10.0μg/L染毒剂量组的表达量均明显下降,差异具有统计学意义(P<0.05或P<0.01)。

表2 不同浓度戊唑醇暴露后秀丽线虫精细胞大小及活化能力的影响
2.4.2 戊唑醇对精子形成相关基因表达的影响戊唑醇染毒后对秀丽线虫精子形成相关 5种基因mRNA表达水平的影响见表4。戊唑醇暴露后与对照组相比精子形成相关基因 tr y-5、 spe-4、 spe-6、 fer-1的mRNA表达量均明显上升(P <0.05或P<0.01);swm-1mRNA在1.0 μg/L剂量组表达量上升,差异具有统计学意义(P<0.01)。

表3 戊唑醇暴露后秀丽线虫精子发生相关基因 m RNA的相对表达水平

表4 不同浓度戊唑醇暴露后秀丽线虫精子形成相关基因 m RNA的相对表达水平
3 讨论
三唑类杀菌剂是全球十大农药之一,通过抑制麦角固醇的合成而达到杀菌的目的[9],与其他农药相比,三唑类杀菌剂在全球有更大的消费量[10]。戊唑醇是一种常见的三唑类杀菌剂,被广泛应用于农作物、蔬菜、水果的菌害控制。残留在蔬菜水果中的戊唑醇的半衰期大约是6d[11],人可以通过进食摄入残留的戊唑醇以及在从事相关职业时通过呼吸和皮肤摄入戊唑醇。在从事农业生产人的尿中检测出戊唑醇的两个代谢产物TEB-OH以及TEB-COOH的量分别是8.0~387.8 g/L(0.025~1.198mol/L)以及5.7~102.9g/L(0.017~0.305 mol/L)[12-13]。因为戊唑醇的环境残留量以及职业暴露可能会对人类的健康造成威胁,目前对戊唑醇的毒性研究越来越多。
目前的研究表明,三唑类杀菌剂的重要作用靶点是肝脏,可以引起肝脏毒性[14]。也有研究表明三唑类杀菌剂会抑制甾醇类化合物的合成或者释放从而损伤内分泌相关器官[15]。哺乳动物研究表明三唑类杀菌剂具有生殖毒性[3],表现为前列腺和附睾组织质量的减轻,前列腺组织形态学的改变以及后代精子数量的降低。本文以秀丽线虫作为模式生物,研究戊唑醇的生殖毒性及其潜在的影响基因。
秀丽线虫身体小,易于饲养,全身透明易于荧光观察,短时间内可以获得大量的实验样本以及突变体易于获得等优点使线虫成为研究化学物质毒性的优秀模式动物。秀丽线虫野生型N2有两个U型性腺臂,每个性腺含有143个体性腺细胞以及大于1000个生殖细胞,秀丽线虫雄虫突变体只有1个性腺,包含56个体性腺细胞以及大于1 0 00个生殖细胞[16],大量的生殖细胞易于进行生殖毒性的研究。秀丽线虫和哺乳动物的生殖细胞均是从生殖干细胞开始经过有丝分裂与减数分裂,由二倍体生殖干细胞形成单倍体配子,再完成受精等一系列的生殖过程并形成新的生命体。秀丽线虫生殖细胞从顶体末梢细胞开始随时间在性腺上向纳精囊方向迁移,所以位于不同发育状态的生殖细胞定位在性腺的不同部位,易于区分与观察。因此,我们选择秀丽线虫作为模式生物研究戊唑醇的雄性生殖毒性。
首先我们用野生型秀丽线虫N2的后代数目作为指标探讨戊唑醇是否具有生殖毒性,世代时间作为发育指标探讨发育毒性。实验结果表明戊唑醇可以导致秀丽线虫后代数目的减少,世代时间并没有统计学差异,表明此剂量下,戊唑醇导致的秀丽线虫生育力的降低很有可能是生殖细胞受损导致的并不是由于发育低下引起的。目前的研究表明戊唑醇具有雄性生殖毒性,可以导致睾丸和附睾质量的降低,所以我们又观察了him-5(e1490)雄虫染毒后与fog-2(q71)杂交之后的后代数目,实验结果表明,杂交之后的后代数目也较对照组降低,表明戊唑醇暴露后可以导致雄性生殖毒性。
生殖细胞携带遗传信息完成生物信息的世代传递,是联系有性生殖生物过去、现在和未来的纽带。在这个过程中,含有两份遗传信息的生殖干细胞经过一系列复杂的过程生成单倍体的配子,然后完成受精过程形成新的生物体。对于雄性来说,双倍体的精母干细胞历经精子的发生过程产生单倍体的配子,然后通过精子的形成过程产生有功能的、活化的、可以受精的精子[17]。在精子的发生过程中,生殖干细胞通过有丝分裂维持生殖细胞的数量,经过减数分裂进行分化产生单倍体的配体。在这个过程中受多种信号通路的调控,Insulin/IGF信号通路是其中关键的调控通路之一[18]。并且有研究表明戊唑醇会导致激素合成障碍,所以我们怀疑Insulin/IGF信号通路可能是戊唑醇染毒后导致生殖毒性的作用机制之一。实验结果表明,戊唑醇染毒后有丝分裂区的细胞以及减数分裂区的细胞数目与对照组相比均降低,提示戊唑醇损害精子发生过程,精子发生过程产生的精细胞数目染毒剂量组与对照组相比也降低,进一步验证了精子发生过程的异常。IGF-1通路包括DAF-2/IGF-1受体(IGF-1R)、磷脂酰肌醇3-激酶(AGE-1/PI3K)、磷酸肌醇依赖性蛋白激酶(PDK1)、AKT-1/2和血清与糖皮质激素诱导的蛋白激酶(SGK-1)5部分。细胞外信号通过DAF-2/IGF-1R转导,刺激AGE-1/PI3K活化后产生次级信号激活PDK1、AKT-1/2及SGK,调节转录因子Forkhead box class O(DAF-16/FOXO)的活性,最终调节生殖细胞分裂周期[19]。与对照组相比,daf-2、akt-1、daf-16 mRNA在1.0和10.0μg/L戊唑醇染毒剂量组表达量均上升;age-1mRNA在各染毒组表达量均明显下降。表明戊唑醇可能是通过影响IGF-1通路相关基因的表达,导致精子发生过程的异常,从而产生生殖毒性。daf-16基因编码线虫box O(FOXO)同系物蛋白;daf-16作为一种转录因子参与调节秀丽线虫生命的很多过程,包括寿命、脂肪代谢 、 应激反应和先天免疫调节等并受多种基因调控[20-21];daf-16可以响应并且协同其他基因参与DNA损伤过程,减轻DNA损伤导致的发育停滞[22];在我们的实验结果中,戊唑醇染毒后,位于不同时期的生殖细胞的数目都有不同程度的降低,但是细胞的发育过程并没有受损,生殖干细胞依然可以经过有丝分裂、减数分裂等一系列的过程发育成精细胞,生殖腺的组织形态也没有发生明显的改变,所以 d af-16基因的高表达可能与其减轻DNA损伤有关。
生殖干细胞经过精子的发生过程生成精细胞,精细胞必须经过活化并具有一定的迁移能力才能到达子宫与卵子结合完成受精。精细胞成为有活力的可以受精的精子的这个过程称为精子的形成。雄性家兔实验表明三唑类杀菌剂可以减少精子的数量,使精子的形态以及运动能力异常[23]。我们的实验结果表明,与对照组相比戊唑醇并没有导致秀丽线虫精子形态的改变,但是与对照组相比精子相对比较小,表现为精子直径以及横截面积的降低。精细胞体外活化的能力较对照组也降低,表明戊唑醇染毒后可以影响精子形成过程。SWM-1信号通路是调节精子形成过程的关键通路之一[24]。SWM-1蛋白酶抑制剂抑制TRY-5蛋白酶的活化后激活相应的可传入精子细胞内信号,进而抑制SPE-6激酶的活性,激活SPE-4并与FER-1分离,之后MO和细胞膜融合,从而活化精子细胞,形成具有运动活力的精子[25]。我们的研究结果表明,与对照组相比,戊唑醇暴露后精子形成相关基因try-5, spe-4,spe-6, fer- 1 的mRNA表达量均明显上升, swm-1基因1μg/L 剂量组基因表达量上升,提示戊唑醇可能是通过SWM-1信号通路相关基因的表达影响精子形成过程,导致精子变小,并且活化能力降低。精子的形成过程是一个非常复杂的过程,各种信号通路参与其中,相互调节,SWM-1蛋白可以抑制精子在交配前活化,从而确保雄性的生殖能力,因为无法成功的转运已经活化的精子,swm-1突变体的雄虫不具有生殖能力[26];精液蛋白酶TRY-5是秀丽线虫中精子的活化启动器可以启动精子的活化[27],雌雄同体交配后,TRY-5蛋白从性腺释放并伴随着精子的迁移转移到雌性秀丽线虫体内,使精子在合适的时间活化[27]。SPE-6是类酪蛋白激酶1蛋白,在精子发生过程中精细胞的分裂[28]以及精子的活化方面均发挥作用[29], spe-6基因突变体雄虫的精子也会提早活化,从而导致生殖能力的降低[29]。SPE-6蛋白同时参与SPE-8信号通路的精子活化途径,并且起负调控作用,而且精子形成的发动需要下降的SPE-6蛋白的表达[30],在我们的实验结果中,try-5、 spe-4、 fer-1基因表达量的上升,表明戊唑醇可以使精子在雄虫体内过早的成熟,可能也是导致雄虫体内储存的精细胞数目降低的原因之一,而 spe-6基因表达量的上升,表明在交配后,戊唑醇影响了雄虫的精子在雌虫体内激活SPE-8信号通路,从而使有幸生存下来的可以进入雄虫体内的精子的活化率降低,最终导致生殖能力的下降;此外,因为 spe-6基因同时参与精子发生的过程的调控, spe-6基因表达量的上升,可能还受其他基因的影响。
总的来说,戊唑醇可以通过影响IGF-1通路相关基因的表达从而使生殖腺生殖细胞数目降低,减少精细胞的数量从而影响精子的发生过程;使SWM-1信号通路相关基因的表达量上升,降低其作用从而使MO与细胞膜无法融合,不但使精细胞变小,并且使精细胞的活化异常,从而产生生殖毒性。
[1]BERENZEN N,LENTZEN-GODDING A,PROBSTM,et al.A comparison of predicted and measured levels of runoff-related pesticide concentrations in small lowlanDStreams on a landscape level[J].Chemosphere,2005,58(5):683-691.
[2]VIEIRAM L,COSTA N O,PEREIRAM R F,et al.Chronic exposure to the fungicide propiconazole:Behavioral and reproductive evaluation of F1and F2generations of malerats[J].Toxicology,2017,389(1):85-93.
[3]JACOBSEN P R, AXELSTADM, BOBERGJ, et al.Persistent developmental toxicity in rat offspring after low dose exposure to a mixture of endocrine disrupting pesticides[J].Reprod Toxicol,2012,34(2):237-250.
[4]TAXVIG C,HASS U,AXELSTADM,et al.Endocrinedisrupting activities in vivo of the fungicides tebuconazole and epoxiconazole[J].Toxicol Sci,2007,100(2):464-473.
[5]ZANNI E,DE BELLIS G,BRACCIALEM P,et al.Graphite nanoplatelets and Caenorhabditis elegans:insights from an in vivo model[J].Nano Lett,2012,12(6):2740-2744.
[6]CHU DS,LIU H,NIX P,et al.Sperm chromatin proteomics identifies evolutionarily conserved fertility factors[J].Nature,2006,443(7107):101-105.
[7]SHAHAM S.Methods in cell biology[J/OL].WormBook,2006.doi:10.1895/wormbook.1.49.1.
[8]CINQUIN O,CRITTENDEN S L,MORGAN D E,et al.Progression from a stem cell-like state to early differentiation in the C.elegans germ line[J].Proc Natl AcaDSci U S A,2010,107(5):2048-2053.
[9]SONG Z,NES W D.Sterol biosynthesis inhibitors:potential for transition state analogs and mechanism-based inactivators targeted at s terol m ethyltransferase[J]. L ipids,2007,42(1):15-33.
[10]FENNER K, CANONICA S, WACKETTL P, et al.Evaluating pesticide degradation in the environment:blinDSpots and emerging opportunities[J].Science, 2013, 341(6147):752-758.
[11]ZHANG Q, HUA X,YANGY, et al.Stereoselective degradation of flutriafol and tebuconazole in grape[J].Environ Sci Pollut Res Int,2015,22(6):4350-4358.
[12]FUSTINONI S,MERCADANTE R,POLLEDRI E,et al.Biological monitoring of exposure to tebuconazole in winegrowers[J].J Expo Sci Environ Epidemiol,2014,24(6):643-649.
[13]MERCADANTE R, POLLEDRI E, SCURATI S, et al.Identification and quantification of metabolites of the fungicide tebuconazole in human urine[J].Chem Res Toxicol,2014,27(11):1943-1949.
[14]NESNOW S,WARD W,MOORE T,et al.Discrimination of tumorigenic triazole conazoles from phenobarbital by transcriptional analyses of mouse liver gene expression[J].Toxicol Sci,2009,110(1):68-83.
[15]TAXVIG C,VINGGAARD AM,HASS U,et al.Do parabens have the ability to interfere with steroidogenesis?[J].Toxicol Sci,2008,106(1):206-213.
[16]KIMBLEJ,HIRSH D.The postembryonic cell lineages of the hermaphrodite and male gonads in Caenorhabditis elegans[J].Dev Biol,1979,70(2):396-417.
[17]MA X,ZHAOY,SUN W,et al.Transformation:How do nematode sperm become activated and crawl?[J].Protein Cell,2012,3(10):755-761.
[18]ESCOTTGM,DA ROSA L A,LOSS EDA S.Mechanisms of hormonal regulation of sertoli cell development and proliferation:a key process for spermatogenesis[J].CurrMol Pharmacol,2014,7(2):96-108.
[19]HUBBARD EJ,KORTA D Z,DALFO D.Physiological control of germline development[J].Adv ExpMed Biol,2013,757:101-131.
[20]KWON ES,NARASIMHAN S D,YEN K,et al.A new DAF-16isoform regulates longevity[J].Nature,2010,466(7305):498-502.
[21]HENDERSONST,JOHNSON TE.daf-16integrates developmental and environmental inputs to mediate aging in the nematode Caenorhabditis elegans[J].Curr Biol, 2001,11(24):1975-1980.
[22]DAITOKU H,KANEKOY,YOSHIMOCHI K,et al.Nontranscriptional function of FOXO1/DAF-16contributes to translesion DNA synthesis[J].Mol Cell Biol,2016, 3 6(21):2755-2766.
[23]COSTA N O,VIEIRAM L,SGARIONI V,et al.Evaluation of thereproductive toxicity of fungicide propiconazole in malerats[J].Toxicology,2015,335:55-61.
[24]TECHNAU GM.Advances in ExperimentalMedicine and Biology.Brain development in Drosophila melanogaster.Preface[J].Adv ExpMed Biol,2008,628:5 -6.
[25]CHU DS,SHAKESDC.Spermatogenesis[J].Adv ExpMed Biol,2013,757:171-203.
[26]STANFIELD GM,VILLENEUVE AM.Regulation of sperm activation by SWM-1is required for reproductive success of C.elegans males[J].Curr Biol,2006,16(3):252-263.
[27]SMITHJR,STANFIELDGM.TRY-5is a sperm-activating protease in Caenorhabditis elegans seminal fluid[J].PLoS Genet,2011,7(11):e1002375.
[28]VARKEYJP,JANSMA PL,MINNITIAN,et al.The Caenorhabditis elegans spe-6gene is required for major sperm protein assembly anDShows seconDSite non-complementation with an unlinked deficiency[J].Genetics,1993,133(1):79-86.
[29]MUHLRAD PJ,WARDS.Spermiogenesis initiation in Caenorhabditis elegans involves a casein kinase1encoded by the spe-6gene[J].Genetics,2002,161(1):143-155.
[30]NISHIMURA H,L'HERNAULTS W.Spermatogenesisdefective(spe)mutants of the nematode Caenorhabditis elegans provide clues to solve the puzzle of male germline functions during reproduction[J].Dev Dyn,2010,239(5):1502-1514.

