白细胞介素4受体α亚单位基因多态性与重症肌无力的相关性
姜 平,岳耀先,谢琰臣,高 翔,谷传凯,郝洪军,秦 月,丁晓君,宋 敏,张 栩,李海峰
重症肌无力(myasthenia gravis,MG)是T细胞依赖、自身抗体介导的自身免疫疾病[1]。白介素-4(interleukin-4,IL-4)是B细胞的生长分化因子,促进抗体产生和亚类转化,还参与调节性T细胞功能。IL-4与三类IL-4受体(IL-4R)复合物结合以行使其功能:Ⅰ类IL-4R复合物表达于T淋巴细胞、NK细胞、嗜碱性粒细胞和肥大细胞,Ⅱ类复合物表达于非淋巴细胞来源的肿瘤细胞,Ⅲ类复合物表达于B细胞和单核细胞[2]。α链是三类IL-4R复合物共有的关键亚单位,IL-4与IL-4R结合可以在上述不同细胞募集IL-4R另外两条链中的一条形成异源二聚体启动信号传导。IL-4在MG的发病中起重要作用。MG患者的血清IL-4水平显著低于健康人[3]。用乙酰胆碱受体(acetylcholine receptor,AChR)致敏敲除IL-4基因的小鼠一次即可导致长期的肌肉无力[4]。在实验性变态反应性MG模型,用AChR抗体与肌细胞共孵育后肌细胞的IL-4R水平上调并且对IL-4的反应性增强,提示IL-4R在MG发病中的作用[5]。
迄今尚无IL-4基因多态性与MG相关的证据[6]。IL-4Rα的基因多态性与多种自身免疫疾病的易感性有关[7~11]。Pal等报道MG患者IL-4Rα的GG基因型频率显著高于健康对照[12]。IL-4R基因多态性与MG的关系尚需独立验证。本研究在中国人MG队列探索IL-4R基因多态性与MG易感性和严重程度的关系。
1 材料和方法
1.1 研究对象 纳入青岛大学附属医院和北京友谊医院诊治随访的480例MG患者,均符合MG的诊断标准:典型波动性肌肉无力症状且新斯的明试验阳性,并且AChR抗体阳性和/或重复神经刺激低频递减>10%。AChR抗体用ELISA试剂盒(RSR Limited,Cardiff,UK)检测。随机选取同一地区健康查体人员487例为对照组,已排除慢性感染和自身免疫疾病。患者和对照均为汉族人,患者间及患者和对照间均无亲缘关系。本研究获得各自医院伦理委员会批准,患者本人或家长(<15岁的患者)及对照均签署了知情同意书。纳入的患者每年至少随访2次,且在病情加重及治疗方案调整后的2~3 m内随访。MG组按性别、发病年龄[13]、有无胸腺瘤、AChR抗体(阳性/阴性)、首发受累范围(眼肌型/全身型)及发病后2 y间最严重时Oosterhuis 评分[14]分为相应亚组。自然史研究[15]报道称MG患者中有82%在发病2 y内发展到疾病最严重程度,因此我们仅对病程在2 y以上且有充分资料的患者进行最严重时 Oosterhuis评分的分析。由于临床特征间存在交互作用[16,17],因此我们在亚组分析时还使用一个新的亚组分类方案(见图1)[18]。
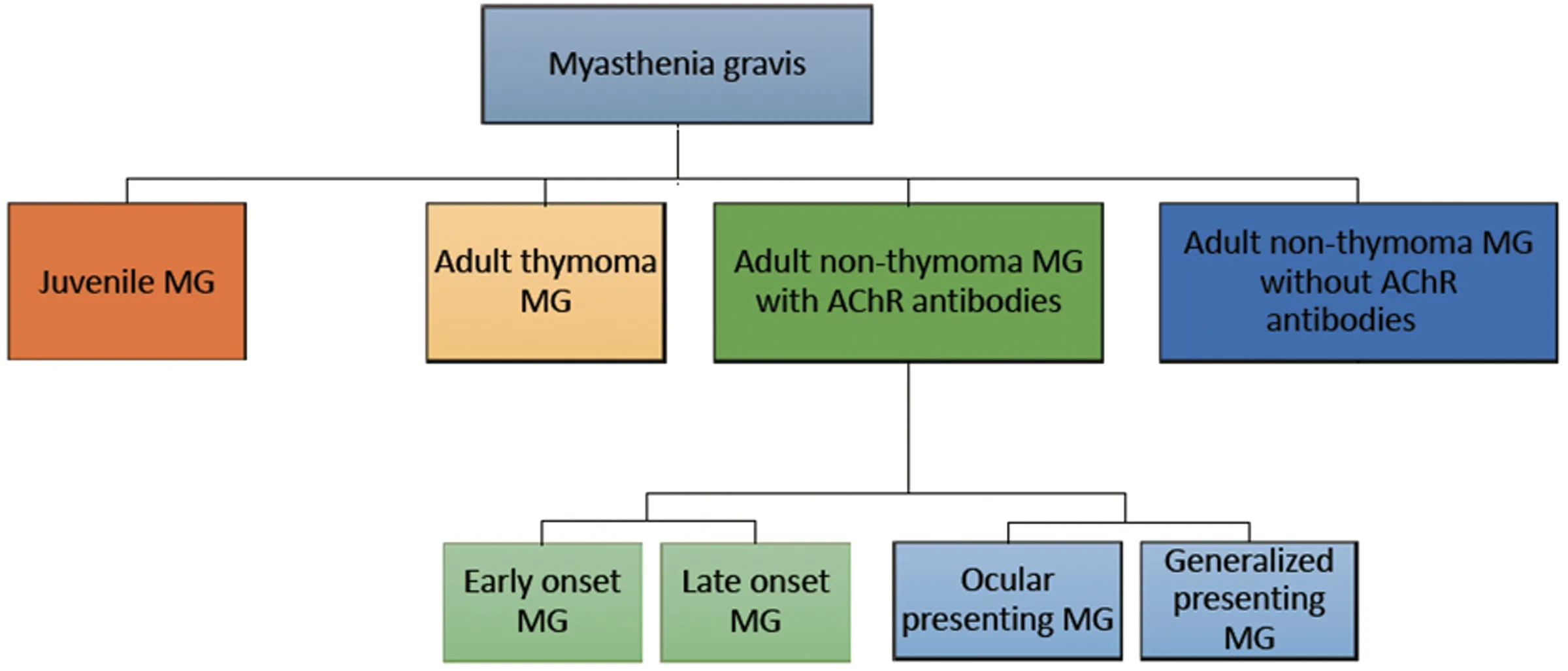
图1 新分类的流程图
1.2 SNP选择和实验方法 选择IL-4R基因的6个位点,其中rs1805010、rs1805011、rs1805015和rs1801275是位于外显子区的错义突变,rs2107356位于基因 5’端上游区域,rs8832位于3’末端,最小等位基因频率(minor allele frequency,MAF)均>5%(1000 Genomes项目(http://www.internationalgenome.org/),东亚人群的MAF值)。取乙二胺四乙酸(EDTA)抗凝静脉血0.5 ml,使用Biochain试剂盒(Biochain,Newark,CA,USA)提取DNA。采用上海天昊生物科技有限公司专利SNPscanTM技术进行基因分型。随机选取40例样本进行双盲质控,质控结果与原分型结果一致。
1.3 统计方法 采用χ2检验或Fisher精确检验(SPSS软件19.0版)比较MG组与对照组、各MG亚组与对照组以及MG亚组间等位基因的频率。多重校正采用Bonferonni方法。使用在线软件SNPstats(http://bioinfo.iconcologia.net/snpstats/start.htm)进行对照组Hardy-Weinberg 遗传平衡检验,并在共显性、加性遗传模型下比较组间基因型频率的差异。当MG亚组分析发现等位基因频率有显著性差异时,进行Logistic回归分析其是否为独立的相关因素。
2 结 果
2.1 MG组与对照组的一般情况 MG患者中男性189例,女性291例,发病年龄为1~86岁(中位数40岁,四分位间距32岁)。MG组患者的病程8~220 m(中位数43 m,四分位距61 m),每年平均随访6.5次。健康对照共487例,其中男249例,女238例,年龄14~78岁(中位数45岁,四分位间距24岁)。6个SNP的分型成功率为97.93%~99.48%,对照组各SNP基因型的分布均符合Hardy-Weinberg遗传平衡。
2.2 MG组与对照组比较 MG组rs1801275 G等位基因的频率显著高于对照组(P=0.036,OR=1.293,95%CI1.017~1.643),但未通过Bonferonni校正。MG组与对照组相比,rs1801275的基因型频率在共显性模型和加性模型下有显著差异(见表1)。
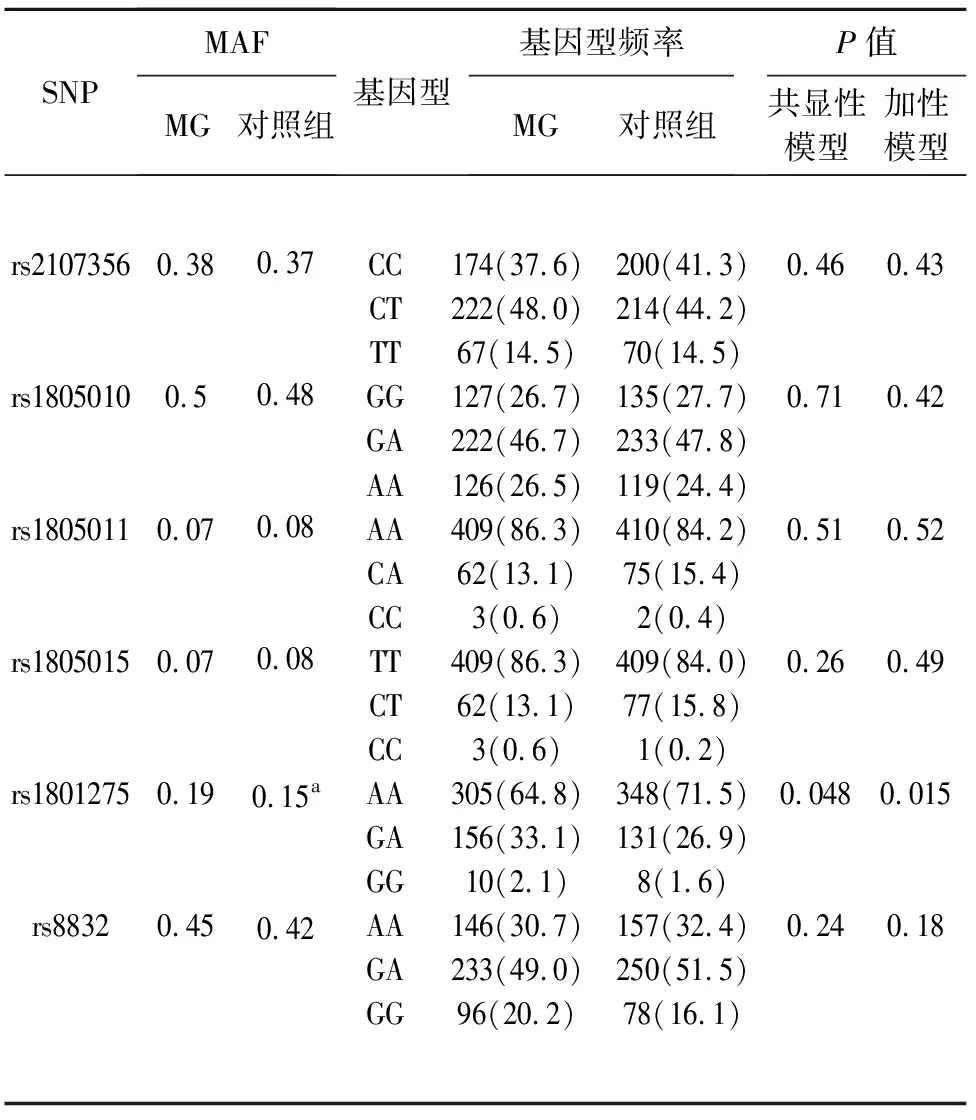
表1 MG患者和健康对照中SNP的分布
a:MG与对照组相比,P=0.036,OR=1.293 (1.017-1.643),PBon=0.216;共显性模型,P=0.048;加性模型,P=0.015
2.3 MG亚组与对照组及亚组间的比较 伴胸腺瘤亚组rs2107356 T等位基因和rs1805010 A等位基因的频率显著高于对照组和不伴胸腺瘤亚组,通过Bonferonni校正;但这两个SNP的等位基因频率在不伴胸腺瘤亚组与对照组间无显著性差异。伴胸腺瘤亚组与对照组或不伴胸腺瘤亚组相比,这两个SNP的基因型频率在共显性和加性模型下有显著性差异(见表2)。
AChR抗体阳性亚组rs1801275 G等位基因的频率显著高于对照组,通过Bonferonni校正。该等位基因的频率在男性MG患者显著高于男性对照(P=0.017,OR=1.531,95%CI1.086~2.160),在AChR抗体阳性亚组显著高于AChR抗体阴性亚组(P=0.039,OR=1.522,95%CI1.020~2.271),但未通过Bonferonni校正。该等位基因的频率在AChR抗体阴性亚组与对照组间无显著性差异。AChR抗体阳性亚组与对照组相比,rs1801275的基因型频率在共显性和加性模型下有显著性差异(见表2)。
2.4 对基于临床特征的亚组分析中潜在混杂因素的校正 以胸腺瘤(伴/不伴)为因变量,以发病年龄(<15/15~50/>50岁,以为<15岁参考)、性别(男/女)、AChR抗体(+/-)、发病时的受累肌群(眼肌型/全身型)和基因型(共显性和加性模型下)为自变量进行Logistic回归,发现发病年龄、AChR抗体和rs2107356(P=0.011)及 rs1805010(P=0.001)的基因型是伴胸腺瘤的独立相关因素。以AChR抗体(+/-)为因变量,以发病年龄、性别、胸腺瘤、发病时的受累肌群和基因型(共显性和加性模型下)为自变量,Logistic回归发现胸腺瘤、发病时受累肌群和rs1801275的基因型(P=0.022)是AChR抗体阳性的独立相关因素。
2.5 新分类的亚组与对照组及亚组间的比较 新分类采用MG的主要临床特征组合形成有生物学和临床意义的亚组,该分类使每个信息完整的患者均被分到一个亚组且只被分到一个亚组。按照新分类,儿童型71例;409例成人患者中伴胸腺瘤的成人亚组104例;300例不伴胸腺瘤的成人患者中,AChR抗体阴性亚组84例;204例AChR抗体阳性不伴胸腺瘤的成人患者中,早发型亚组(EOMG,发病年龄15~50岁)126例,晚发型亚组(LOMG,>50岁)78例;眼肌型起病亚组135例,全身型起病亚组67例;部分患者因信息不全无法分类。
伴胸腺瘤的成人亚组rs2107356 T等位基因和rs1805010 A等位基因的频率显著高于对照组和不伴胸腺瘤的成人亚组,通过Bonferonni校正。这两个SNP的等位基因频率在不伴胸腺瘤的成人亚组与对照组间无显著性差异。伴胸腺瘤的成人亚组与对照组和不伴胸腺瘤的成人亚组相比,这两个SNP的基因型频率在共显性和加性模型下有显著性差异(见表3)。
AChR抗体阳性不伴胸腺瘤的成人亚组rs1801275的G等位基因频率显著高于对照组,通过Bonferonni校正。AChR抗体阳性不伴胸腺瘤的成人亚组该等位基因的频率高于AChR抗体阴性不伴胸腺瘤的成人亚组(P=0.023,OR=1.750,95%CI1.086~2.160),但未通过Bonferonni校正。该等位基因的频率在AChR抗体阴性不伴胸腺瘤的成人亚组与对照组间无显著性差异。在AChR抗体阳性不伴胸腺瘤的成人患者中,EOMG、LOMG、眼肌型发病和全身型发病亚组该等位基因的频率显著高于对照组,但在EOMG与LOMG亚组间以及在眼肌型发病和全身型发病亚组间无显著性差异。AChR抗体阳性不伴胸腺瘤的成人亚组与对照组相比,rs1801275基因型的频率在共显性和加性模型下有显著性差异(见表3)。
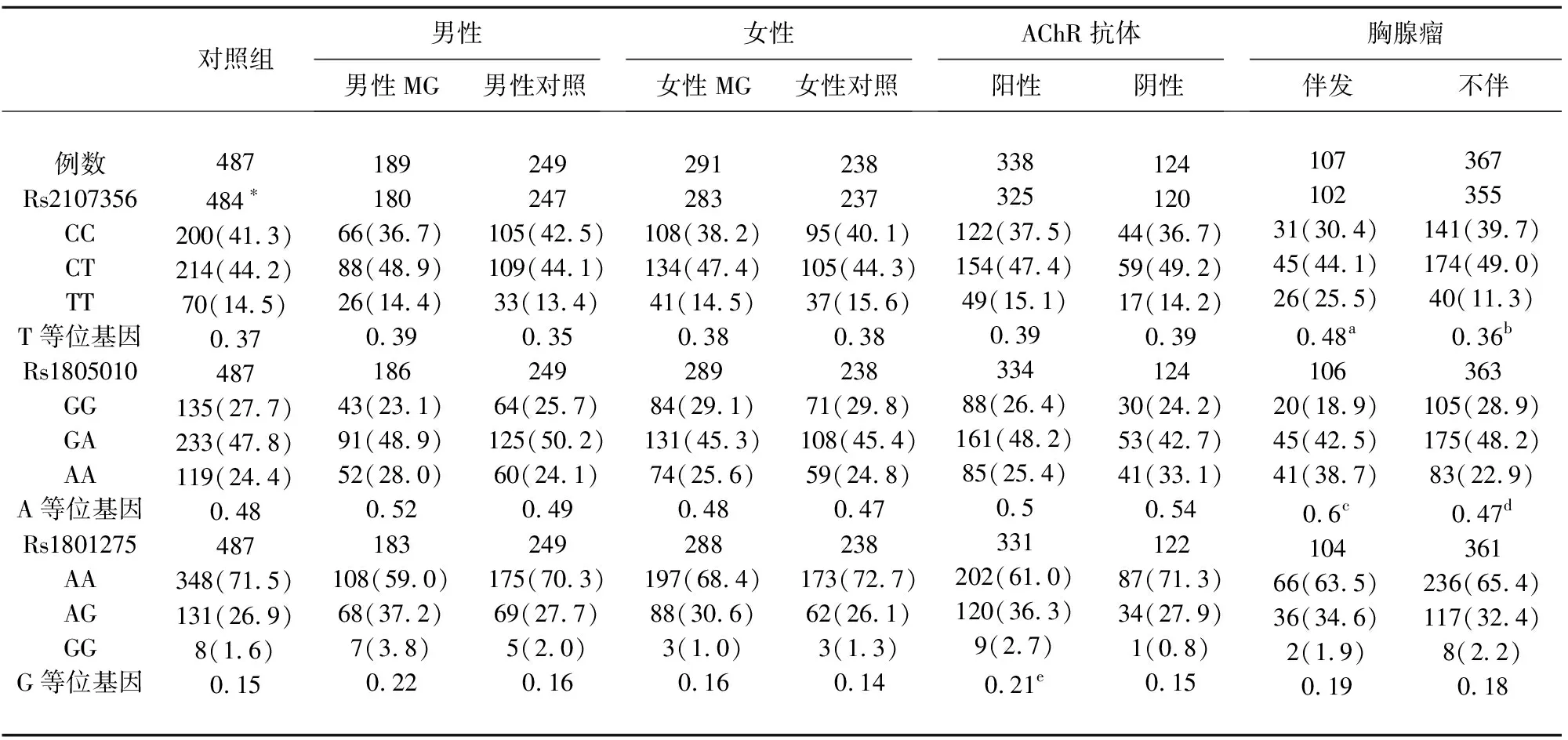
表2 MG亚组和对照组rs1805010、rs1801275和rs2107356的等位基因和基因型频率[例数(%)]
注:*表示每组中成功分型且有足够临床资料的患者数。a:伴胸腺瘤亚组与对照组比较,P=0.003,OR=1.572(1.160~2.132),PBon=0.018;共显性模型,P=0.017;加性模型,P=0.0055。b:伴胸腺瘤亚组与不伴胸腺瘤亚组比较,P=0.002,OR=1.627(1.188~2.229),PBon=0.012;共显性模型,P=0.0025;加性模型,P=0.0023。c:伴胸腺瘤亚组与对照组比较,P=0.002,OR=1.596(1.180~2.158),PBon=0.012;共显性模型,P=0.008;加性模型,P=0.003。d:伴胸腺瘤亚组与不伴胸腺瘤亚组比较,P=0.001,OR=1.687(1.236~2.302),PBon=0.006;共显性模型,P=0.004;加性模型,P=0.0012。e:AChR抗体阳性亚组与对照组比较,P=0.003,OR=1.482(1.146~1.915),PBon=0.018;共显性模型,P=0.0032;加性模型,P=0.0007
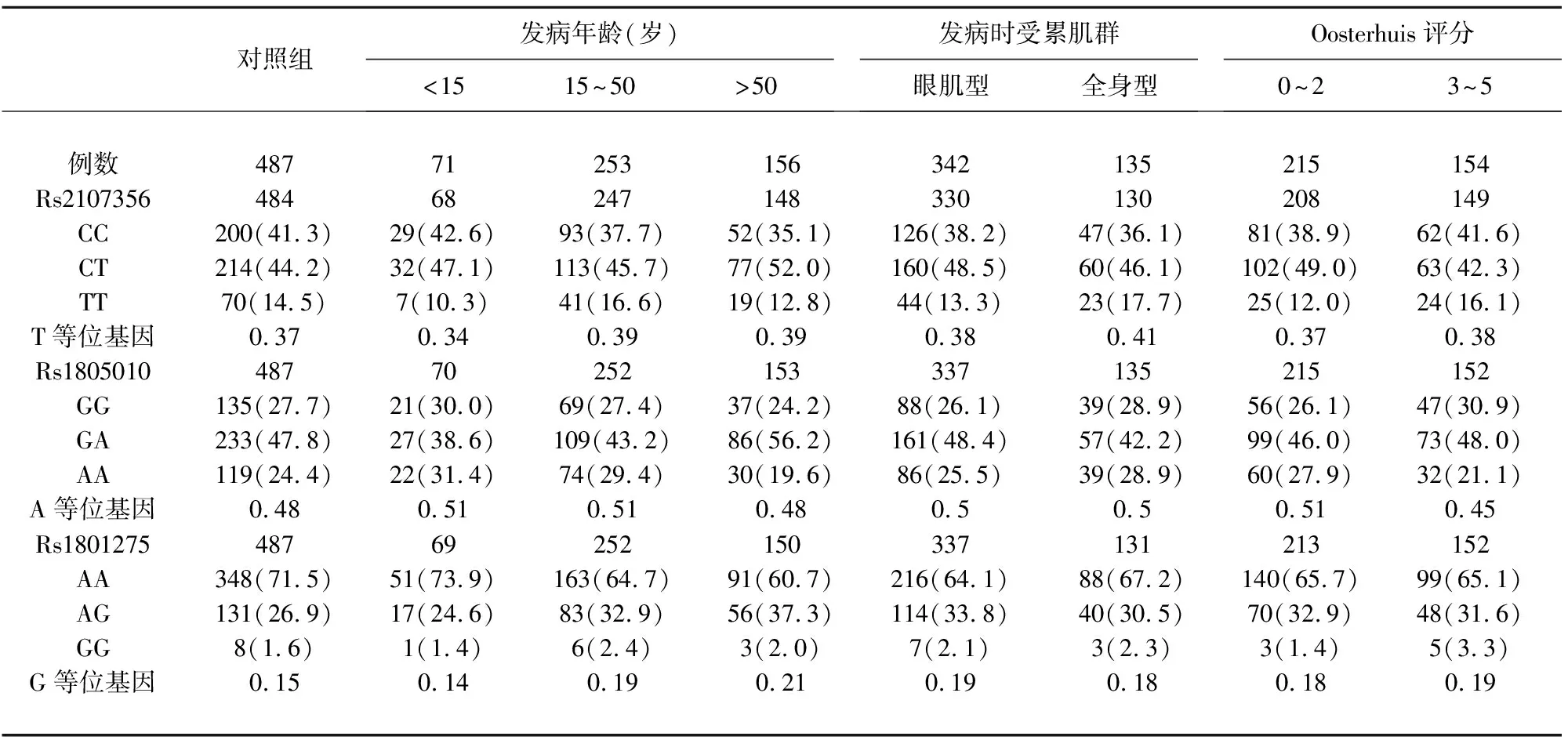
表2 MG亚组和对照组rs1805010、rs1801275和rs2107356的等位基因和基因型频率 [例数(%)](续)
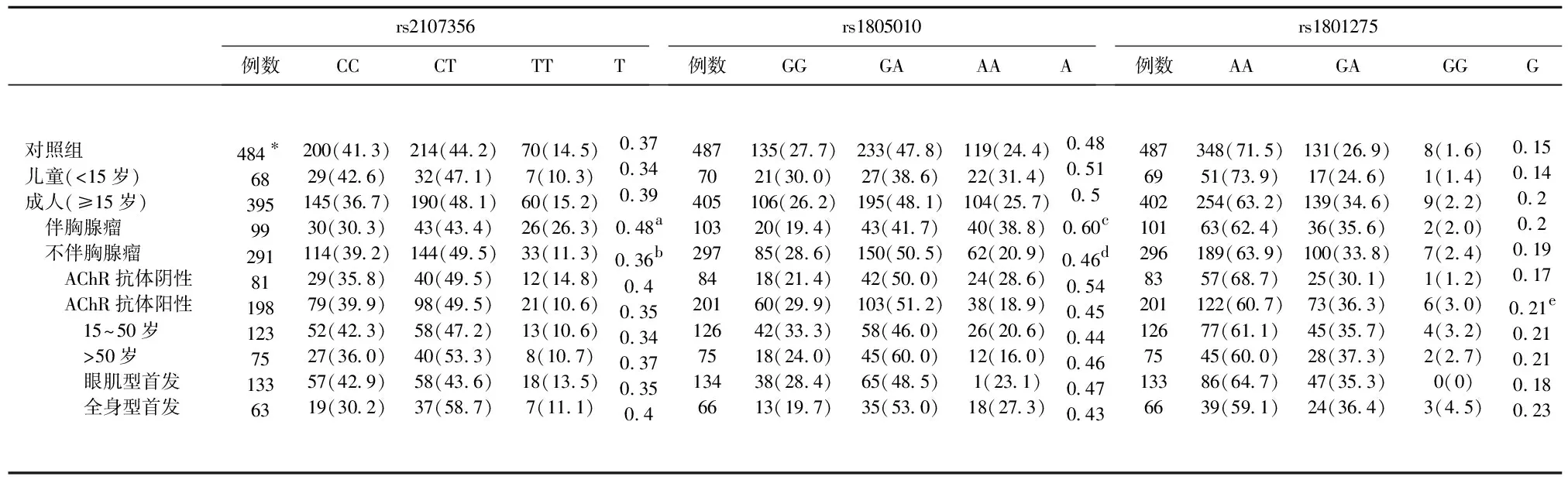
表3 新分类中MG亚组和对照组rs1805010、rs1801275和rs2107356的等位基因和基因型频率 [例数(%)]
注:*表示每组中成功分型且有足够临床资料的患者数。a:伴胸腺瘤的成人亚组与对照组比较,P=0.003,OR=1.600(1.176-2.177),PBon=0.018;共显性模型,P=0.0056;加性模型,P=0.0017。b:伴胸腺瘤的成人亚组与不伴胸腺瘤的成人亚组比较,P=0.003,OR=1.634(1.179-2.264),PBon=0.018;共显性模型,P=0.0025;加性模型,P=0.0032。c:伴胸腺瘤的成人亚组与对照组比较,P=0.003,OR=1.583(1.166-2.148),PBon=0.018;共显性模型,P=0.0034;加性模型,P=0.0013。d:伴胸腺瘤的成人亚组与不伴胸腺瘤的成人亚组比较,P=0.001,OR=1.731(1.255-2.388),PBon=0.006;共显性模型,P=0.0025;加性模型,P=0.0012。e:AChR抗体阳性不伴胸腺瘤的成人亚组与对照组比较,P=0.006,OR=1.509(1.121-2.030),PBon=0.036;共显性模型,P=0.011;加性模型,P=0.0026
3 讨 论
本研究旨在采用候选SNP策略在一个代表性的MG队列探索IL-4R基因多态性与MG的易感性和严重程度的关系,发现rs2107356和rs1805010的等位基因频率在胸腺瘤亚组高于对照组和不伴胸腺瘤亚组,rs1801275的等位基因频率在AChR抗体阳性亚组高于对照组,但未发现不同严重程度亚组间有显著性差异。以前研究的亚组分析[16,17]发现单一的MG临床特征会受到其他临床特征的交互作用影响,所以我们在亚组的等位基因频率有显著性差异时进行Logistic回归以寻找与某一临床特征相关的独立相关因素,发现rs2107356和rs1805010的基因型与胸腺瘤相关以及rs1801275的基因型与AChR抗体阳性相关。我们进而在新分类中进行亚组分析,该分类方案反映了目前对MG发病机制的认识,并尽可能减少临床特征间交互作用的影响,发现在成人MG患者中rs2107356和rs1805010与伴发胸腺瘤相关,rs1801275与AChR抗体阳性不伴胸腺瘤的成人MG相关。两种分类方法得到相近的结果。
rs2107356和rs1805010的等位基因和基因型频率在伴胸腺瘤的成人亚组高于对照组和不伴胸腺瘤的成人亚组,但不伴胸腺瘤的成人亚组和对照组之间无差异。胸腺瘤是源于胸腺上皮的肿瘤,MG患者可伴有胸腺瘤[19]。本研究首次发现这两个SNP与胸腺瘤相关。IL-4是有促进肿瘤生长作用的细胞因子,以浓度依赖性方式促进人类肿瘤细胞的增殖。在体内阻断IL-4R可显著减少一些肿瘤的淋巴结和血源性转移。IL-4亦可通过增加抗凋亡分子的表达而促进肿瘤生存。IL-4对肿瘤的作用主要由II类IL-4R复合物途径信号介导[2]。rs2107356也与胃癌[20]和多发性骨髓瘤[21]的易感性有相关性,rs1805010与肾细胞癌[22]及宫颈癌[23]的易感性有相关性,大多数肿瘤为上皮来源。IL-4R在胸腺瘤发病机制中的作用可能与在这些肿瘤中的机制相似。
MG患者rs1801275 G等位基因的频率高于对照组,尤其是在AChR抗体阳性不伴胸腺瘤的成人亚组。rs1801275的基因型是MG患者AChR抗体阳性的独立相关因素。已经发现该突变是一种“获得功能”的突变,可促进IL-4R的信号传导,在免疫调节中的信号传导能力高于野生型[24,25]。该变异型可以促进调节性T细胞在IL-4主导下向Th17转化,影响哮喘严重程度[11]。但Pal等并未发现该变异型与MG相关[12]。
我们的研究有一定局限性:未纳入仅有胸腺瘤而未发生MG的患者,未来需纳入这些患者验证IL-4R基因多态性与胸腺瘤的相关性。而且,既往研究发现伴胸腺瘤MG患者的T细胞受体与不伴胸腺瘤MG患者不同[26]。IL-4R多态性对在胸腺瘤生长和诱导T细胞表达特定T细胞受体的作用有待进一步研究。
总之,在中国汉族人群,rs2107356、rs1805010和rs1801275与MG的易感性相关。
[参考文献]
[1]Meriggioli MN,Sanders DB. Autoimmune myasthenia gravis:emerging clinical and biological heterogeneity[J]. Lancet Neurol,2009,8(5):475-490.
[2]Suzuki A,Leland P,Joshi BH,et al. Targeting of IL-4 and IL-13 receptors for cancer therapy[J]. Cytokine,2015,75(1):79-88.
[3]Uzawa A,Kawaguchi N,Himuro K,et al. Serum cytokine and chemokine profiles in patients with myasthenia gravis[J]. Clin Exp Immunol,2014,176(2):232-237.
[4]Ostlie N,Milani M,Wang W,et al. Absence of IL-4 facilitates the development of chronic autoimmune myasthenia gravis in C57BL/6 mice[J]. J Immunol,2003,170(1):604-612.
[5]Shandley S,Martinez S,Krolick K. IL-4 receptor as a bridge between the immune system and muscle in experimental myasthenia gravis I:up-regulation of muscle IL-15 by IL-4[J]. Clin Immunol,2009,132(2):246-256.
[6]Huang D,Xia S,Zhou Y,et al. No evidence for interleukin-4 gene conferring susceptibility to myasthenia gravis[J]. J Neuroimmunol,1998,92(1/2):208-211.
[7]Krabben A,Wilson AG,de Rooy DP,et al. Association of genetic variants in the IL4 and IL4R genes with the severity of joint damage in rheumatoid arthritis:a study in seven cohorts[J]. Arthritis Rheum,2013,65(12):3051-3057.
[8]Xu Y,Chen ZQ,Li YM,et al. Correlation between some Th1 and Th2 cytokine receptor gene polymorphisms and systemic lupus erythematosus in Chinese patients[J]. Int J Dermatol,2007,46(11):1129-1135.
[9]Yabiku K,Hayashi M,Komiya I,et al. Polymorphisms of interleukin(IL)-4 receptor alpha and signal transducer and activator of transcription-6(Stat6) are associated with increased IL-4Ralpha-Stat6 signalling in lymphocytes and elevated serum IgE in patients with Graves’ disease[J]. Clin Exp Immunol,2007,148(3):425-431.
[10]Slager RE,Otulana BA,Hawkins GA,et al. IL-4 receptor polymorphisms predict reduction in asthma exacerbations during response to an anti-IL-4 receptor α antagonist[J]. J Allergy Clin Immunol,2012,130(2):516-522.
[11]Massoud AH,Charbonnier LM,Lopez D,et al. An asthma-associated IL4R variant exacerbates airway inflammation by promoting conversion of regulatory T cells to TH17-like cells[J]. Nat Med,2016,22(9):1013-1022.
[12]Pál Z,Varga Z,Semsei á,et al. Interleukin-4 receptor alpha polymorphisms in autoimmune myasthenia gravis in a Caucasian population[J]. Hum Immunol,2012,73(2):193-195.
[13]Aarli JA. Myasthenia gravis in the elderly:Is it different[J]. Ann N Y Acad Sci,2008,1132:238-243.
[14]Skeie GO,Pandey JP,Aarli JA,et al. TNFA and TNFB polymorphisms in myasthenia gravis[J]. Arch Neurol,1999,56(4):457-461.
[15]Grob D,Brunner N,Namba T,et al. Lifetime course of myasthenia gravis[J]. Muscle Nerve,2008,37(2):141-149.
[16]Yue YX,Hong Y,Xie Y,et al. Association study between IL-17A and IL-17F gene polymorphism and myasthenia gravis in Chinese patients[J]. Neurol Sci,2016,37(1):123-130.
[17]Zhang X,Ding XJ,Wang Q,et al. Rs3761389 polymorphism in autoimmune regulator(AIRE) gene is associated with susceptibility of myasthenia gravis in Chinese patients[J]. J Clin Neurosci,2017,40(6):180-184.
[18]Li HF,Xie Y,Yue YX. Myasthenia gravis:subgroup classifications[J]. Lancet Neurol,2016,15(4):355-356.
[19]Romi F. Thymoma in myasthenia gravis:from diagnosis to treatment[J]. Autoimmune Dis,2011,2011:474512.
[20]Xia HZ,Du WD,Wu Q,et al. E-selectin rs5361 and FCGR2A rs1801274 variants were associated with increased risk of gastric cancer in a Chinese population[J]. Mol Carcinog,2012,51(8):597-607.
[21]Brown EE,Lan Q,Zheng T,et al. Common variants in genes that mediate immunity and risk of multiple myeloma[J]. Int J Cancer,2007,120(12):2715-2722.
[22]Luo Y,Ye Z,Li K,et al. Associations between polymorphisms in the IL-4 and IL-4 receptor genes and urinary carcinomas:a meta-analysis[J]. Int J Clin Exp Med,2015,8(1):1227-1233.
[23]Ivansson EL,Gustavsson IM,Magnusson JJ,et al. Variants of chemokine receptor 2 and interleukin 4 receptor,but not interleukin 10 or Fas ligand,increase risk of cervical cancer[J]. Int J Cancer,2007,121(11):2451-2457.
[24]Hershey GK,Friedrich MF,Esswein LA,et al. The association of atopy with a gain-of-function mutation in the alpha subunit of the interleukin-4 receptor[J]. N Engl J Med,1997,337(24):1720-1725.
[25]Risma KA,Wang N,Andrews RP,et al. V75R576 IL-4 receptor alpha is associated with allergic asthma and enhanced IL-4 receptor function[J]. J Immunol,2002,169(3):1604-1610.
[26]Inada K,Okumura M,Shiono H,et al. Role of positive selection of thymoma-associated T cells in the pathogenesis of myasthenia gravis[J]. J Surg Res,2005,126(1):34-40.

