虾青素对急性脑出血小鼠的神经功能的保护及机制研究
何 洋,高 扬,曹 芳,张 强,陈 伟,冉启山,刘喜平,杨 露,姚声涛
脑出血(intracerebral hemorrhage,ICH)是神经科常见的疾病,其发病率约占全部脑血管疾病的35%,是脑血管最重要疾病之一,全球每年约有300万新发的ICH患者,其发病率、致死致残率极高,远超其他种疾病对人群造成的危害,ICH后存活的患者均会出现不同程度的神经功能障碍[1]。尽管目前ICH的致病机制的研究已取得了显著进展,临床有许多关于ICH药物治疗和手术治疗的研究,但到目前为止仍缺乏公认有效的治疗措施。ICH诱发的继发性炎症损伤造成神经元凋亡,在神经功能缺损中发挥着重要的作用,因此干预ICH神经元的凋亡是治疗ICH的重要措施之一。虾青素(3,3’-二羟基-β,β-胡萝卜素-4,4’-二酮;AST)在自然界广泛分布,是主体甲壳类动物的色素,如鲑鱼等生物[2]。虾青素于1987年被美国食品和药物管理局批准为饲料添加剂,1999年被批准为膳食补充剂[3]。近年来,许多关于虾青素的体外和体内研究试验中证明其抗氧化作用,例如对单线态氧的猝灭作用,对超氧化物、过氧化氢和羟基自由基的强烈清除作用以及对脂质的抑制作用过氧化[4,5];除此之外,虾青素的其他几种生物活性,包括抗癌、抗炎、抗氧化、抗凋亡、抗糖尿病,免疫调节活性和神经保护作用也已有报道[2]。虾青素具有广泛的药理活性,其中神经保护作用颇受研究人员关注,虾青素药动学研究表明,虾青素可以定位于脂质膜表面或者穿过脂质膜AD[6],同时在啮齿动物中可以通过血脑屏障,从而对神经系统疾病也有较好的功效。研究发现虾青素可改善由脂多糖诱发的小鼠脑内神经炎症反应,显著抑制大脑中的IL-1α、IL-6和TNF-α的表达[7,8]。虾青素治疗与降低的皮质损伤体积、神经元损失和皮质中的神经变性相关,这可能通过模拟神经营养因子和促进突触存活而发生。虾青素对小鼠ICH的神经保护的影响尚未见报道,因此本研究以炎症和凋亡为切入点,采用小鼠自体尾血定位注射建立尾状壳核脑出血模型,进一步研究虾青素对ICH的保护作用的靶点,观察虾青素改善ICH小鼠神经炎症损伤的作用是否与抑制炎症细胞释放炎症因子IL-1β和TNF-α以及凋亡基因Caspase-3的有关,为进一步研究虾青素在ICH的继发性的炎性损伤提供药理依据。
1 材料与方法
1.1 实验动物 实验动物为清洁级C57BL/6小鼠,雄性,6~8周龄,16~20 g,由第三军医大学实验动物中心提供,合格证号:SCXK(渝)20120913。饲养于遵义医学院SPF级实验动物中心,饲养条件是光照时间7:00-19:00,黑暗时间19:00~7:00,相对空气湿度45%~55%,温度22~26 ℃,可自由进食进水。
1.2 主要药品与试剂 虾青素(美国Santa Cruz公司);DW-2000脑立体定位仪(成都泰盟公司);IL-1β、TNF-α和Caspase-3 ELISA试剂盒(美国eBioscience公司);NeuN兔抗小鼠和Caspase-3兔抗小鼠单克隆抗体(美国Abcam公司);羊抗兔IgG二抗、TUNEL试剂盒、ELISA试剂盒和Hoeschst染料(美国Invitrogen公司);Neuronal Medium-basal培养基,高糖DMEM和FBS(美国Gibco公司)。
1.3 小鼠脑皮质神经元原代培养 取18 d胎龄的C57小鼠,显微镜下剥取胎鼠大脑前皮质,去除脑膜和血管。眼科剪剪碎至约1 mm×1 mm×1 mm,0.125%胰蛋白酶37 ℃孵育10 min,吹打15~20次,2500 r/min离心10 min。弃上清液,用完全培养基含10%胎牛血清、2 μmol/L谷氨酰胺的DMEM高糖培养基重悬细胞沉淀,计数细胞至5×105个/ml,接种于多聚-L-赖氨酸(Poly-L-Lysine)包被的细胞培养板中。置于37 ℃、含5% CO2及饱和湿度的培养箱中培养,24 h后换液至含2% B27、0.4×10-4mol/L阿糖胞苷(Ara-C)和0.5 mM谷氨酰胺Neuronal Medium-basal培养基,以后每隔72 h半量换液,培养至8 d。实验分组:(1)空白对照组为生理盐水组;(2)实验组为2个AST浓度组(10-4和10-5mol/L),加入20 μmol/L Hb至培养液中;(3)实验对照组为Hb 20 μmol/L Hb处理。
1.4 小鼠ICH模型的制备 C57小鼠用10%水合氯醛(40 mg/kg)腹腔麻醉注射,俯卧固定于小鼠大脑立体定位仪上,头皮酒精消毒,暴露顶骨,取尾动脉血50 μl,用注射泵(5 μl/min)注射至左脑纹状体(小鼠前囟右侧2.5 mm,向前0.2 mm,向腹侧3.5 mm);注射后针头停留8~10 min,拔出针头用医用骨蜡封闭注射孔,缝合头皮切口。假手术组以同样的方法注射等量生理盐水。
1.5 分组与给药 实验分组为假手术组、ICH模型组、10 mg/kg和30 mg/kg AST治疗组,各6只小鼠。各组做脑出血手术,于2 h、12 h、24 h、48 h连续灌胃给予相应药物(AST用1 ml/kg橄榄油溶解配制,假手术组和ICH模型组小鼠仅给予连续橄榄油灌胃处理),每天1次。
1.6 脑出血小鼠神经功能缺损评分(NDS) 将24只小鼠随机分为4组。各组术后连续给药后,并于给药后的1 d、3 d、5 d、7 d参照文献[9]对各处理组小鼠作神经功能缺损程度评分,神经功能评分在2级以上的小鼠视为ICH模型成功,纳入实验研究对象,剔除评分在0级或4级以上的模型小鼠。主要包括行走测试、提尾反射、平衡测试、感觉测试、反射缺失和反常运动。最大得分为18分,轻型伤:1~6分;中型伤:7~12分;重型伤:13~18分。
1.7 ELISA法测定ICH血肿周围组织中TNF-α、IL-1β和Caspase-3的含量 取假手术组、ICH模型组、AST不同剂量治疗组小鼠在ICH在不同时间点脑血肿灶周组织0.5 g,加入预冷的PBS,使制成质量浓度为10%的脑组织匀浆,4 ℃,4000 r/min,离心15 min,置-70 ℃低温冰箱保存备用。ELISA检测组织匀浆液中的TNF-α、IL-1β和Caspase-3的表达变化情况。
1.8 脑组织病理学检查 各组分别于1 d、3 d各取3只小鼠,4%多聚甲醛灌流固定后取出脑组织后4 ℃继续相同的方法固定24 h以上,20%和30%的庶糖梯度脱水,采用冷冻切片的方法,给予脑片冰冻切片漂片法作神经元染色。在光学显微镜(10×20)下,随机选取5个高倍视野,阳性为红色神经元胞核,计数阳性染色神经元数量。

2 结 果
2.1 AST提高了Hb诱导的神经元损伤的存活率 通过神经原代培养实验考察10-4mol/L和10-5mol/L AST对Hb诱导神经元细胞损伤的保护作用。前期预实验发现AST对神经元生长无影响,在36 h观察期内神经元存活率一直稳定在80%;相较于对照组,在光镜下观察TUNEL和Caspase-3凋亡实验发现,模型组(Hb组)神经元在36 h后存活率显著下降,差异有统计学意义(P<0.01)。同时给予神经元10-4mol/L和10-5mol/L AST后,与模型组(Hb组)比较36 h后AST组神经元存活率得到显著提高,TUNEL阳性和Caspase-3阳性细胞数量显著降低,差异有统计学意义(P<0.05),表明AST对Hb诱导原代神经元细胞损伤能显著提高原代神经元细胞活力,具有明显神经保护作用(见图1)。
2.2 AST对脑出血小鼠神经功能缺损评分的影响 神经功能缺损程度评分(NDS)是评估小鼠ICH后损伤程度的重要参考指标模型组的NDS显著均显著高于假手术组(P<0.01),ICH模型制备成功;30 mg/kg组在给药后的1 d、3 d均能明显改善小鼠的神经功能缺损(P<0.05),而10 mg/kg组只在给药后3 d能显著降低脑出血小鼠NDS(P<0.05)(见图2)。


A:TUNEL染色;B:Caspase-3染色;C:不同剂量Ica组TUNEL和Caspase-3阳性细胞数的比较。a-对照组;b-Hb组;c-AST(10-4mol/L)组;d - AST(10-5mol/L)组(n=4)。与对照组比较a:P<0.01;与Hb组比较b:P<0.05,c:P<0.01
图1 AST对Hb诱导损伤神经元保护作用(×200)
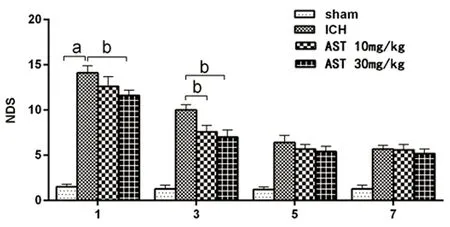
与假手术组组比较a:P<0.01;与ICH模型组比较b:P<0.05图2 各组不同时间脑出血小鼠神经功能评分比较
2.3 AST对ICH小鼠血肿灶周围组织中TNF-α、IL-1β和Caspase-3表达的影响 ELISA法检测小鼠ICH后血肿周围组织的TNF-α、IL-1β和Caspase-3的蛋白表达变化。假手术组和ICH模型组结果见图3,由图3可以看出,TNF-α、IL-1β和Caspase-3在小鼠ICH血肿周围组织的蛋白表达水平显著增高(P<0.01),并且在3 d达到最大值。与ICH组比较,30 mg/kg的AST在出血后的1 d、3 d能显著抑制TNF-α、IL-1β和Caspase-3的表达水平(P<0.05或P<0.01),在出血后的5 d能显著抑制Caspase-3的表达水平(P<0.01);10 mg/kg在出血后的1 d能显著抑制TNF-α、IL-1β和Caspase-3的表达水平(P<0.05),在出血后的3 d能显著抑制TNF-α和Caspase-3的表达水平(P<0.05或P<0.01),在出血后的5 d能显著抑制IL-1β的表达水平(P<0.05)(见图3)。
2.4 脑组织病理学改变 假手术组小鼠脑组织各脑区结构完整,神经细胞形态正常,手术后各时间段均未见神经细胞凋亡和炎性细胞浸润;造模后3 d,与AST组比较,ICH模型组出血灶周围神经元胞体大小不一、形态各异。与ICH模型组,AST治疗组神经元数量在脑出血后各时间点的计数皆显著增加,差异有统计学意义(P<0.01);造模后3 d时,AST治疗组神经元数量明显多于模型组,差异有统计学意义(P<0.01)(见图4)。
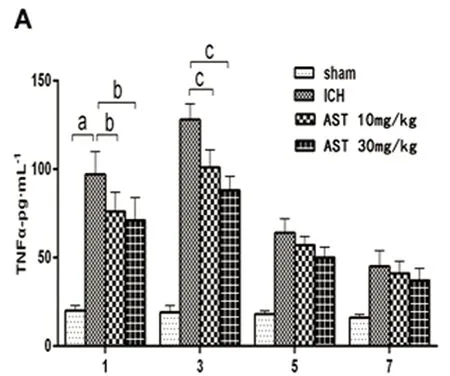


A:TNF-α;B:IL-1β;C:Caspase-3。与假手术组比较a:P<0.01;与ICH模型组比较b:P<0.05,c:P<0.01
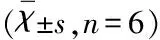


3 讨 论
血肿灶周围过度的炎症反应是ICH后继发性损伤最重要致病机制之一,其主要表现是血肿灶周小胶质细胞的大量活化和释放多种炎性因子(如TNF-α、IL-1β、IL-6和TGF-β等)进而加加剧了神经元炎性损伤[10]。Caspase-3是细胞凋亡过程中的最主要效应蛋白,其在ICH的神经变性凋亡的致病过程中起着非常重要的作用。研究发现,虾青素对多种中枢系统疾病(脑梗死、脊髓损伤、脑创伤、蛛网膜下腔出血和帕金森病)的疾病动物模型中均有显著的改善作用[11~15]。其作用机制有抗炎抗氧化应激,促进海马神经发生和可塑性,调节小胶质细胞活性等[16]。虾青素能抑制LPS诱导的ICR小鼠海马脑区的TNF-α、IL-1β及环氧化酶等炎症因子的蛋白表达,改善其学习记忆和空间认知能力[17]。虾青素是否能抑制ICH后继发性脑炎症损伤,目前尚未见文献报道。TNF-α和IL-1β在ICH血肿灶周围的神经元的变性凋亡中起着重要的作用。TNF-α是ICH后升高得最快的炎性因子,可引起IL-1β,IL-6的级联反应[18]。TNF-α可诱导IL-1β大量表达,后者可通过NF-κB细胞信号传导途径激活血肿灶区的小胶质细胞活化并分泌大量的炎症因子,加剧了局部脑组织炎性损害[18]。TNF-α还能够激活基质金属蛋白酶-9细胞信号传导通路,增加脑出血后血脑屏障的通透性,加剧了组织水肿,导致灶周神经元大量变性凋亡[19]。IL-1β诱导脑血管内皮细胞间粘附分子等活化,引起血肿周围组织的炎性细胞浸润。另外,IL-1β还可以下调Bcl-2和p-Ak等通路蛋白的表达,并上调bax蛋白,进而活化Caspase-3凋亡因子,诱导神经元细胞变性和凋亡。同时,IL-6还可以激活钙通道造成细胞内钙超载,造成神经细胞的变性凋亡[20]。
课题组前期的预实验中对AST的给药浓度做了综合的研究,结果提示10-4mol/L的AST浓度过高,原代大脑皮质神经元出现变性凋亡。10-8~10-5mol/L均未造成皮质原代神经元的变性凋亡,起到了较好的神经元保护的作用。体外研究表明,AST能显著提高Hb诱导损伤的原代大脑皮质神经元细胞存活率。体内实验结果提示,给予AST连续灌胃治疗小鼠ICH后,AST能明显改善ICH小鼠的神经功能缺损程度的评分,小鼠脑出血血肿周围组织炎症因子TNF-α和IL-1β的表达也明显低于模型组,提示AST通过抑制炎症因子的表达改善ICH小鼠的血肿周围炎症反应。另外,ICH小鼠血肿周围组织Caspase-3凋亡蛋白表达显著高于假手术对照组,证实了Caspase-3在参与了ICH的神经元变性凋亡的过程,而ICH小鼠在给予不同剂量的AST治疗后,Caspase-3凋亡蛋白的表达显著降低,提示AST对ICH的保护作用也可通过抗神经元细胞的凋亡作用有关。
综上所述,本课题实验结果与上述文献报道相符,AST的作用机制可能与其保护受损神经元,减轻小鼠脑出血的炎症因子、凋亡因子和氧化应激反应有关,为AST临床用于ICH的防治提供了基础药理学依据。
[参考文献]
[1]Ariesen MJ,Claus SP,Rinkel GJ,et al. Risk factors for intracerebral hemorrhage in the general population:a systematic review[J]. Stroke,2003,34:2060-2065.
[2]Hussein G,Sankawa U,Goto H,et al. Astaxanthin,a carotenoid with potential in human health and nutrition[J]. J Nat Prod,2006,69:443-449.
[3]Guerin M,Huntley ME,Olaizola M. Haematococcus astaxanthin:applications for human health and nutrition[J]. Trends in Biotechnology,2000,21:210-216.
[4]Matsuno T,Miki W. Biological functions and activities of carotenoids[J]. Pure & Applied Chemistry,1991,63:141-146.
[5]Palozza P,Krinsky NI. Astaxanthin and canthaxanthin are potent antioxidants in a membrane model[J]. Archives of Biochemistry & Biophysics,1992,297:291-295.
[6]Goto S,Kogure K,Abe K,et al. Efficient radical trapping at the surface and inside the phospholipid membrane is responsible for highly potent antiperoxidative activity of the carotenoid astaxanthin[J]. Biochimica et Biophysica Acta(BBA)-Biomembranes,2001,1512:251-258.
[7]Nguyen KT,Deak T,Owens SM,et al. Exposure to acute stress induces brain interleukin-1beta protein in the rat[J]. Journal of Neuroscience the Official Journal of the Society for Neuroscience,1998,18:2239.
[8]Rothwell NJ,Luheshi GN. Interleukin 1 in the brain:biology,pathology and therapeutic target[J]. Trends in Neurosciences,2000,23:618-625.
[9]Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20:84.
[10]Zhang Z,Ze Z,Lu H,et al. Microglial Polarization and Inflammatory Mediators After Intracerebral Hemorrhage[J]. Molecular Neurobiology,2017,54:1874-1886.
[11]Shen H,Kuo CC,Chou J,et al. Astaxanthin reduces ischemic brain injury in adult rats[J]. Faseb J,2009,23:1958-1968.
[12]Masoudi A,Dargahi L,Abbaszadeh F,et al. Neuroprotective effects of astaxanthin in a rat model of spinal cord injury[J]. Behav Brain Res,2017,329:104-110.
[13]Ji X,Peng D,Zhang Y,et al. Astaxanthin improves cognitive performance in mice following mild traumatic brain injury[J]. Brain Res,2017,1659:88-95.
[14]Wu W,Wang X,Xiang Q,et al. Astaxanthin alleviates brain aging in rats by attenuating oxidative stress and increasing BDNF levels[J]. Food Funct,2014,5:158-166.
[15]Grimmig B,Morganti J,Nash K,et al. Immunomodulators as Therapeutic Agents in Mitigating the Progression of Parkinsons Disease[J]. Brain Sci,2016,6(4):41.
[16]Grimmig B,Kim SH,Nash K,et al. Neuroprotective mechanisms of astaxanthin:a potential therapeutic role in preserving cognitive function in age and neurodegeneration[J]. Geroscience,2017,39:19-32.
[17]Jiang X,Chen L,Shen L,et al. Trans-astaxanthin attenuates lipopolysaccharide-induced neuroinflammation and depressive-like behavior in mice[J]. Brain Res,2016,1649:30-37.
[18]Clark IA,Alleva LM,Vissel B. The roles of TNF in brain dysfunction and disease[J]. Pharmacology & therapeutics,2010,128 (3):519-548
[19]Hein AM,Stasko MR,Matousek SB,et al. Sustained hippocampal IL-1β overexpression impairs contextual and spatial memory in transgenic mice[J]. Brain Behavior & Immunity,2010,24(2):243-253.
[20]Ji C,Chen G. Signaling Pathway in Early Brain Injury after Subarachnoid Hemorrhage:News Update[J]. Acta Neurochir Suppl,2016,121:123-126.

