免疫胶体金技术检测猪繁殖与呼吸综合征
徐丽华,李军星,苏 菲,田瑞雨,王 赛,袁秀芳(浙江省农业科学院 畜牧兽医研究所,浙江 杭州 310021)
猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)最早于1987年在美国发现,随后在短短几年内迅速遍及全球各个养猪业发达的国家和地区[1-2]。1996年,我国首次在北京分离到PRRSV,随后在我国猪群中感染率逐年上升,某些地区猪群血清阳性率已达50%~80%。PRRSV主要引起母猪的繁殖障碍与新生仔猪的呼吸道疾病,以及免疫抑制和持续性感染,造成仔猪的高死亡率,给养猪业造成了巨大的经济损失[3-5],猪繁殖与呼吸综合征是目前危害我国养猪业的最主要传染病之一。
猪场中猪繁殖与呼吸综合征(PRRS)的诊断检测,一般根据其流行病学、临床症状以及剖检情况进行初步诊断,再应用实验室方法进行确诊。目前PRRSV的检测方法主要有反转录聚合酶链式反应法(RT-PCR)、酶联免疫吸附试验(ELISA)和电镜观察等[6]。这些检测方法都存在检测成本高、需要一定的仪器设备、需要具备相关实验技能的技术员进行操作等缺点,不适于基层临床使用[6]。
胶体金免疫技术是80年代继荧光素、放射性同位素和酶3大标记技术后发展起来的固相标记免疫测定技术[7]。该方法最初仅用于免疫电镜技术,现在已发展到免疫印迹、免疫斑点渗滤法及免疫层析法等方法,并广泛应用于临床诊断中。胶体金免疫技术具有简单快速、单份测定、特异敏感,且不需要任何仪器设备,在几分钟内就可观察到颜色对比鲜明的实验结果等特点,具有很大的发展潜力和应用前景[8-9]。
本实验综合应用分子生物学技术、生物化学技术和免疫学技术,探索建立斑点胶体金免疫检测技术,试图为临床提供一种简便、快速、灵敏、特异的检测PRRSV手段。
1 材料与方法
1.1 试剂和仪器
标准阴、阳性血清采自临床健康断奶仔猪,经美国IDEXX公司生产的ELISA检测试剂盒鉴定;冻干酶联葡萄球菌A蛋白购自上海科欣生物科技研究所;牛血清白蛋白购自上海华美生物工程公司;弗氏佐剂为Sigma公司产品;氯化金、柠檬酸三钠、碳酸钾、辛酸、硫酸铵等化学试剂均为国产分析纯;0.45 μm硝酸纤维素薄膜为浙江省台州市路桥四甲生化塑料厂出品。
1.2 工具酶和菌种
限制性内切酶BamH I、XhoI、T4 DNA连接酶、TaqDNA聚合酶、Pfu高保真DNA聚合酶购自上海生工生物工程公司;100 bp DNA Marker、低分子量标准蛋白Marker、凝胶回收试剂盒(Lot0307)购于上海申能博彩生物科技有限公司。原核表达载体pET-28 a(+)由浙江大学动物科学学院余旭平副教授惠赠。受体菌E.coliDH5α和E.coliBL21-plysS由本实验室保存。
1.3 兔抗猪IgG多克隆抗体的制备及纯化
采集临床健康猪血清,辛酸-硫酸铵法提取猪IgG[10-11],以SDS-PAGE电泳检测猪IgG的纯度,Lowry法测定蛋白浓度。与弗氏完全佐剂或不完全佐剂等量混合制成乳液,4 ℃保存备用。
从浙江省农科院畜牧兽医研究所种兔场选取1.5~2 kg体重的新西兰兔2只,首次用含弗氏完全佐剂的猪IgG乳液进行足垫免疫,每只兔注射0.4 mL。隔14 d后,用含弗氏不完全佐剂的猪IgG乳液进行第2次免疫;14 d后进行第3次免疫;再隔10 d,对实验兔进行耳静脉采血。琼脂扩散试验测定效价,达到预期效价后,进行心脏采血,分离血清,再应用辛酸-硫酸铵法初步纯化兔抗猪IgG,测定多抗的蛋白浓度。
1.4 原核表达载体的构建和表达
采集临床疑似PRRS的组织病料,提取病毒基因组RNA,用RT-PCR技术扩增出特异性条带,经测序分析后确定为PRRSV核衣壳蛋白的全基因序列,命名为PRRSV/N。将PRRSV/N片段和原核表达载体pET-28 a(+)进行连接,并转入受体菌E.coliBL21-pLysS中,取得单菌落,提取质粒DNA,经双酶切鉴定后,将阳性克隆转化子接种于LB液体培养基(含50 U·mL-1卡那霉素),IPTG诱导表达4 h,收集菌体,经15% SDS-PAGE电泳检测表达蛋白。Western blot验证表达产物的免疫反应性。
1.5 表达蛋白的纯化
表达蛋白的纯化按照《分子克隆实验指南》(第二版)操作[12]。纯化蛋白经15% SDS-PAGE电泳后,将凝胶用3 mol·L-1KCl溶液显色,切下目的条带,重蒸水冲洗,放入电浓缩装置中进行电浓缩4~5 h。吸取浓缩液装入透析袋中,用0.02 mol·L-1Tris-HCl,0.9% NaCl溶液透析过夜,即得纯化蛋白。
1.6 胶体金的制备及标记
采用柠檬酸三钠还原法制备胶体金[13-14]。先取100 mL双蒸水,加入1%氯金酸水溶液1 mL制成终浓度为0.1%溶液,用恒温磁力搅拌器加热搅拌,沸腾后立即加入2 mL新鲜配制的1%柠檬酸三钠水溶液,继续加热并剧烈搅拌,等溶液颜色稳定为酒红色,停止加热搅拌,用双蒸水补足到原体积,冷却至室温。用0.2 mol·L-1K2CO3调至pH值8.2,在磁力搅拌下加入0.8 mg提纯的兔抗猪IgG多克隆抗体,搅拌15 min后加入BSA至终浓度为0.5 g·L-1,继续搅拌10 min后取出。混合物先在4 ℃,4 000 r·min-1,离心10 min;取上清再用高速冷冻离心机,13 000 r·min-1,4 ℃离心30 min;弃上清,沉淀用0.02 mol·L-1Tris-HCl(pH值7.4)、0.2% BSA溶液洗涤1次,按原始体积的1/10将沉淀重悬于胶体金保存液(0.02 mol·L-1Tris-HCl,0.5% BSA),4 ℃保存备用。制备的胶体金委托浙江大学科学楼电镜室作电镜检查。
1.7 斑点胶体金免疫检测技术的建立
剪取大小为0.5 cm×0.5 cm、孔径为0.45 μm的硝酸纤维素薄膜(NCM膜),直接点样加上PRRSV/N纯化蛋白,室温干燥后,用1%脱脂奶粉封闭30 min,0.01 mol·L-1PBS(pH值7.2)洗涤3次,将NCM膜粘于0.5 cm×5 cm的塑料棒上成检测试剂条。用PRRSV标准阴性和阳性血清,1∶50稀释后与NCM膜作用30 min,0.01 mol·L-1PBS(pH值 7.2)洗涤3次,直接加入已标记好的胶体金悬液中,室温5 min,肉眼观察结果。同时进行Dot-ELISA法检测,验证结果的正确性。
2 结果与分析
2.1 兔抗猪IgG多克隆抗体的制备
实验兔经猪IgG三次免疫后,耳静脉采血,琼脂扩散试验测定,抗体效价已达1∶16(图1)。所有免疫兔心脏采血,分离血清,辛酸-硫酸铵法纯化兔抗猪IgG,经SDS-PAGE检测,主要呈现IgG分子的2个条带(图2)。Lowry法测定兔抗猪IgG蛋白浓度为14.6 mg·mL-1。
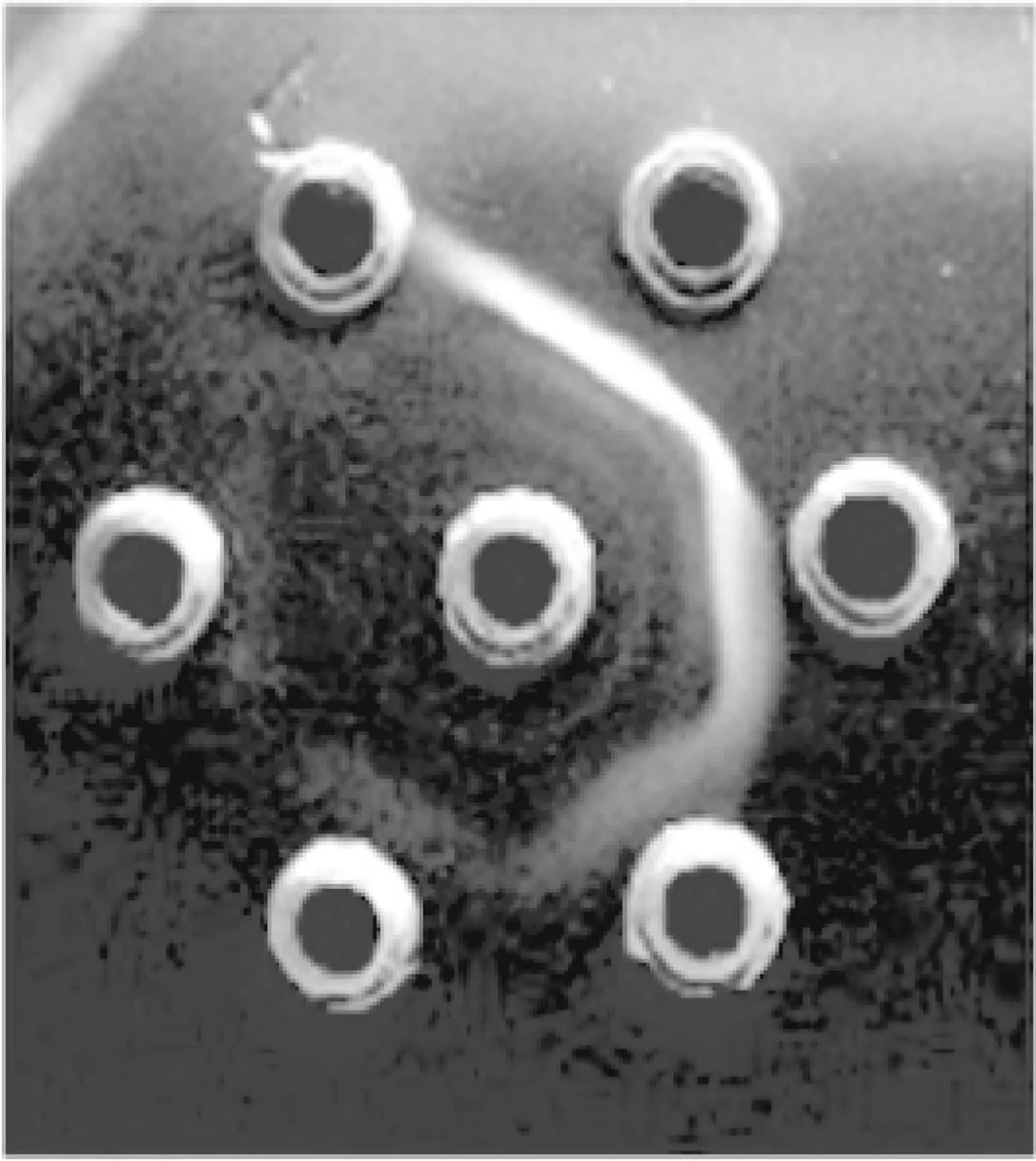
图1 琼脂扩散实验测定兔抗猪IgG抗体效价
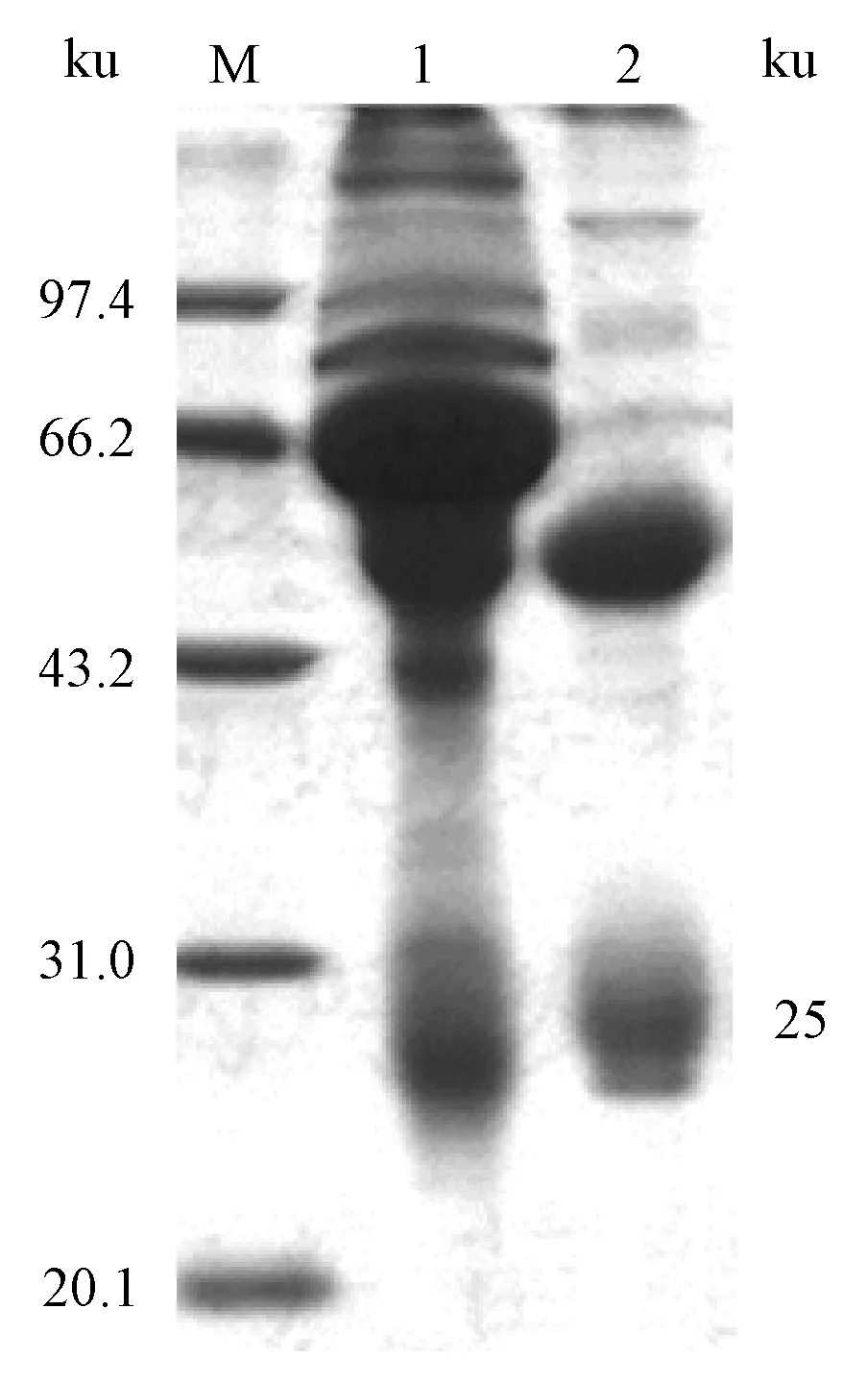
M为低分子量标准蛋白Marker;1为兔抗猪血清;2为兔抗猪IgG抗体图2 SDS-PAGE电泳检测兔抗猪IgG抗体
2.2 PRRSV/N基因原核表达载体的构建
RT-PCR技术,从临床组织病料中扩增出PRRSV的核衣壳蛋白全基因序列,电泳检测扩增片段大小与预期相符(图3)。

M为100 bp DNA Ladder plus;1为PRRRSV A/N基因图3 PRRSV/N基因PCR扩增结果
将扩增的PRRSV/N片段和原核表达载体pET-28a(+)连接并转入BL21感受菌后,获得单菌落,经双酶切鉴定后(图4),测序验证克隆正确。
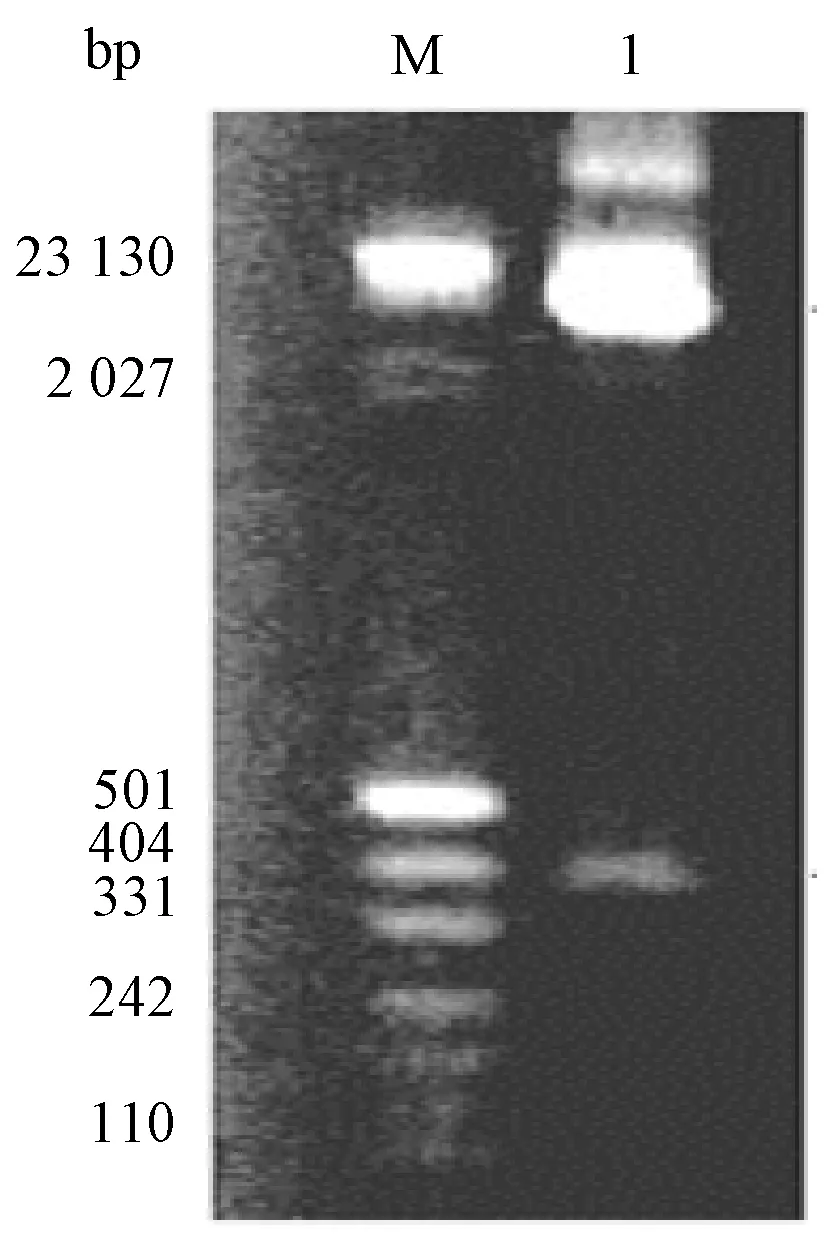
M为pUC19 DNA/Mspl(Hpa11)+Lambda DNA/Hind111 Marker;1为PRRSV A/N双酶切结果图4 PRRSV/N双酶切产物
2.3 融合蛋白的表达及免疫印迹检测
正确克隆的转化子用IPTG诱导,表达产物经15% SDS-PAGE电泳和染色分析发现,重组PRRSV/N蛋白获得了高效表达,目标蛋白的分子量约为17 ku(图5),与预期相符。

1为pET-PRRSV/N诱导前菌体蛋白;2为pET-PRRSV/N诱导后菌体蛋白;M为低分子量标准蛋白Marker图5 SDS-PAGE检测
表达产物转膜后,分别以PRRSV阴性和阳性血清进行Western blot分析。显色结果表明,表达蛋白可被PRRSV阳性血清所识别,马上出现清晰的条带;而与阴性血清作用,呈阴性反应(图6)。

1为阳性血清检测重组蛋白;2为阴性血清对照;M为低分子量标准蛋白Marker图6 重组蛋白的Western-Blot检测
2.4 融合蛋白的纯化
pET在大肠杆菌中表达出PRRSV/N后,表达蛋白以包涵体形式存在。将细菌裂解后收集包涵体,用8 mol·L-1尿素裂解,再经15% SDS-PAGE电泳检测,表达蛋白纯度在90%以上,蛋白浓度为20.6 mg·mL-1(图7)。将PRRSV/N初步纯化的蛋白再经过SDS-PAGE电泳,割取凝胶进行电浓缩,透析取得纯化蛋白。

1为PRRSV/N融合蛋白;2、3、4分别为PRRSV/N纯化蛋白倍比稀释;M为低分子量标准蛋白Marker图7 为PRRSV/N纯化蛋白倍比稀释SDS-PAGE检测
2.5 斑点胶体金免疫检测技术的建立
在100 mL氯金酸溶液中加入2 mL 1%柠檬酸三钠水溶液,烧制出的胶体金经电镜观察,直径在18~20 nm,跟文献报导相符合(图8)。

图8 电镜观察胶体金颗粒(10万倍)
选取PRRSV标准阴性和阳性血清,用标记好的胶体金作用,在5~10 min内就可以看到清晰的显色,且阴阳性对比明显(图9)。
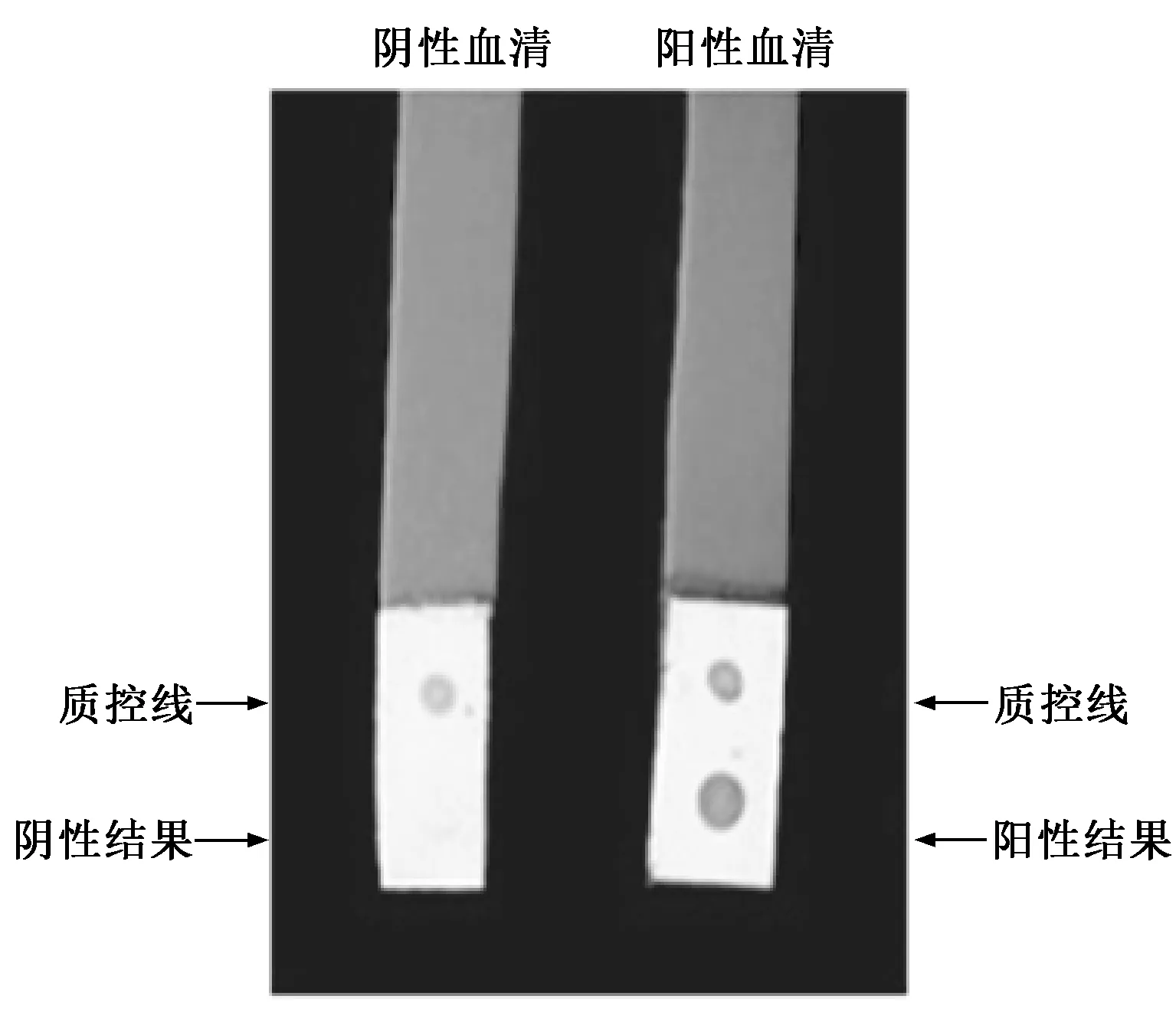
图9 斑点胶体金检测PRRSV阴阳性血清结果
3 讨论
近年来,PRRSV在我国的不同省、市、自治区都存在不同程度的流行,其感染率高,造成的损失很大,给养猪户带来了极大的困扰。目前检测PRRSV主要应用美国IDEXX生产的ELISA检测试剂盒,但该方法检测不但价格较高(每头检测成本高达30~50元),而且需要一定的设备和实验操作要求,另外整个检测过程需要2~3 h,临床上难以推广应用。因此,建立一种方便、快捷且准确的诊断方法,对及时预防该病具有重要意义。
胶体金免疫技术是以胶体金作为显色剂,应用于抗原抗体反应的一种新型免疫标记技术。具有简单、快速、准确和不需要任何实验仪器等优点,已广泛应用于临床医学,而在动物医学上应用还不多,具有很大的开发前景。
制备胶体金的方法很多,主要有柠檬酸三钠还原法、柠檬酸三钠-鞣酸还原法、白磷还原法等,其中柠檬酸三钠还原法制备的胶体金颗粒比较均匀一致。本实验采用柠檬酸三钠还原法,通过对不同用量的柠檬酸三钠与氯金酸反应,以及制备胶体金颗粒的最佳反应时间等的摸索,最后证明100 mL氯金酸溶液,用2 mL柠檬酸三钠还原最好,制备出的胶体金颗粒大小较均匀,直径在18~20 nm。另外,pH值对胶体金标记的影响也很大,根据文献报道,我们将二抗标记时pH值调至8.2,实验证明,最后反应效果较好。
斑点胶体金法检测抗原或抗体出现特异性反应,最重要是需要高纯度的纯化抗原。在PRRSV的结构蛋白中,核衣壳蛋白(N蛋白)是保守性蛋白,其免疫原性最强。本实验选取了N蛋白为研究对象,应用原核表达系统以融合蛋白的形式高效表达了该蛋白,并以包涵体的形式存在。用细菌裂解液裂解菌体,所得包涵体再用8 mol·L-1尿素裂解,经SDS-PAGE电泳检测得到初步纯化的蛋白浓度比较高,再经过电浓缩,蛋白复性液透析后得到高浓度的纯化蛋白。经过Western blot分析,表明该蛋白能与PRRSV阳性血清发生特异性反应,非特异性背景很低;而和PRRSV阴性血清作用后则无反应,说明纯化蛋白具有很高的反应特异性。另外,PRRSV/N蛋白的等电点为10.7,其中有1个二硫键,因此选用pH值为11的蛋白复性液进行透析,效果较好。将纯化蛋白点在NCM膜上,经PRRSV标准阴阳性血清作用后,直接浸于标记好的胶体金中,5~10 min就可以用肉眼直接观察结果,其中阳性血清作用后,NCM膜上出现清晰的鲜红色斑点,而阴性血清作用的NCM膜上无斑点出现。
本实验采用斑点胶体金法,除了用胶体金标记代替酶标记和酶底物外,其原理及操作与Dot-ELISA法基本相同,检测的灵敏度和特异性也相仿。因前者比后者减少底物显色步骤,同时色彩鲜明反差强,检测时间更短,30~40 min即可检测结果。此外,具有可肉眼直接观察结果、单份测定、操作简便、能在基层使用等优点。目前我们正进一步提高胶体金检测的灵敏度和稳定性,同时进行临床检测试验。
参考文献:
[1] 杨汉春. 2014年猪病流行情况与2015年流行趋势及防控对策[J]. 猪业科学, 2015(2):38-40.
[2] 朱佳毅, 任晓峰. 猪繁殖与呼吸综合征病毒检测方法的研究进展[J]. 中国预防兽医学报, 2014, 36(1):77-80.
[3] SUR J H, DOSTER A R, OSORIO F A. Apoptosis induced in vivo during acute infection by porcine reproductive and respiratory syndrome virus[J]. Veterinary Pathology, 1998, 35(6):506-514.
[4] 李丽琴, 蔡雪辉, 刘永刚,等. PRRSV变异株活疫苗和灭活疫苗免疫特性的研究[J]. 中国预防兽医学报, 2010, 32(6):468-472.
[5] 高云, 杨汉春, 刘平黄,等. PRRS病毒核衣壳蛋白在大肠杆菌中的高效表达[J]. 中国兽医学报, 2001, 21(5):438-440.
[6] 李雪松, 符芳, 李海忠,等. 快速检测猪繁殖与呼吸综合征病毒胶体金免疫层析方法的建立[J]. 中国预防兽医学报, 2011, 33(9):718-722.
[7] 孔繁德, 黄印尧, 赖清金. 免疫胶体金技术及其发展前景[J]. 福建畜牧兽医, 2002, 24(7):42-43.
[8] 许丽. 免疫胶体金技术及其在兽医临床上的应用探讨[J]. 中国畜牧兽医文摘, 2016, 32(4):53.
[9] 王荣, 孔繁德, 陈琼,等. 斑点免疫金渗滤法同时检测猪瘟和猪繁殖与呼吸综合征抗体的研究[J]. 福建畜牧兽医, 2008(增刊1):107-111.
[10] 白丽, 王晶. 应用辛酸硫酸胺法提取小鼠腹小如血清中的IgG抗体[J]. 大理学院学报(医学版), 2000, 9(4):3-4.
[11] 刘晓波, 蔡美英. 一种简单实用纯化腹水McAb方法:辛酸/硫酸铵法[J]. 四川大学学报(医学版), 1999, 30(4):455-456.
[12] 萨姆布鲁克,拉塞尔,曼尼阿蒂斯,等. 分子克隆实验指南[M]. 3版.北京:科学出版社, 2002.
[13] 徐葛林, 胡巧玲, 吴杰,等. 检测狂犬病毒的胶体金免疫层析法的建立及应用[J]. 中国人兽共患病学报, 2004, 20(3):236-237.
[14] 陈素娟, 陈冰, 孙化露,等. 鸭疫里默杆菌单克隆抗体的研制及免疫胶体金检测方法的建立[J]. 中国兽医学报, 2012, 32(11):1651-1655.

