超声波与菠萝蛋白酶协同作用对鸭肉嫩化的影响
赵 立,周 振,贺倩倩,汤 超,黄鸣璐,李苗云,陈 军,白青云
(1.淮阴工学院生命科学与食品工程学院,江苏 淮安 223003;2.河南农业大学食品科学技术学院,河南 郑州 450002)
嫩度是肉品最重要的品质之一,是决定消费者购买度的重要指标。外源酶如木瓜蛋白酶、菠萝蛋白酶、猕猴桃蛋白酶和无花果蛋白酶,在肉品嫩化方面得到了广泛的应用,菠萝蛋白酶在国外已有品牌,如McCormick和Knorr。菠萝蛋白酶是从菠萝的茎和果实中提取出的一种半胱氨酸蛋白水解酶,是一种内切蛋白酶,由于其较强的蛋白水解能力,商业上广泛用于食品、化妆品、医药、编织工业等[1]。
商品化的外源酶能够有效水解肌肉纤维蛋白,如肌动蛋白、肌球蛋白、肌联蛋白和伴肌动蛋白等[2-3]。Sullivan等[4]认为菠萝蛋白酶除可以提高肉的嫩度,还可以改善肉的感观接受度。Lizuka等[5]将牛肉用菠萝汁腌制,应用衰减全反射傅里叶变换红外光谱法持续监测发现肉类蛋白结构性的变化。Ketnawa等[6]添加20%的菠萝蛋白酶可以强烈水解牛肉、鸡肉和鱿鱼的肌肉蛋白。菠萝蛋白酶还是一种很好的盐酸水解剂的替代品,有效水解牡蛎肉,生产的蚝油具有较高的感官评分[7]。
超声波是指频率在20~100 kHz之间的机械振动在固、液、气介质中传播的弹性波。本实验利用超声波清洗器进行鸭肉的处理,而超声波清洗器的原理是由超声波发生器所发出的超声冲击波产生的空化效应,产生机械破坏作用,从而达到破坏肉的内部结构以促使肉类嫩化效果。Ahmad等[8]利用超声功率20 kHz的超声波处理10 min可显著减少肌动蛋白和肌球蛋白之间的相互作用以增加鸡肉的嫩度。Stadnik等[9]研究表明低频低密度的超声波可以显著改变宰后24、48、72 h和96 h牛肉的pH值、剪切力和色差,不仅能改善肉的嫩度,还能显著抑制高氧肌红蛋白的形成。超声波可以削弱肌纤维内部结构的相互作用,通过直接或间接的“空化作用”破坏细胞的结构,降低肉的“背景硬度”——肌原纤维和胶原蛋白,从而改善肉的嫩度[10-11]。
有研究表明,在液体介质中产生大量机械的、热力学和化学效应能够断裂多肽链之间的氢链和范德华力,进而改变酶蛋白的二级和三级结构以钝化多种酶,如漆酶、过氧化物酶、多酚氧化酶、脱氢酶、果胶酶、脂氧化酶、过氧化氢酶、淀粉酶、脂肪酶、胰蛋白酶、溶解酵素[12]。但是短时间和低强度的超声波处理可以提高一些酶的活性[13]。张永军等[14]研究发现相同的处理功率条件下,超声波对菠萝蛋白酶的活性影响随着时间的变化均呈现出抛物线式的变化,总体上呈下降趋势。在处理功率为240 W,处理时间为10 min时,菠萝蛋白酶活性增大到未处理菠萝蛋白酶的119.05%,160 W和200 W对菠萝蛋白酶的热稳定性的作用非常明显,处理5~25 min菠萝蛋白酶的热稳定性均比未处理的菠萝蛋白酶强。
综上所述,单一菠萝蛋白酶和超声波处理对肉的嫩化均有效果,同时,超声波对菠萝蛋白酶的性质有一定的影响,然而目前为止,两者协同作用对肉的嫩化作用方面的研究还很少,目前仅限于王晶等[15]所研究的菠萝蛋白酶和超声波对羊肉嫩度的影响。因此,本实验利用超声波协同菠萝蛋白酶对鸭肉的嫩化工艺进行研究,并对嫩化机理进行探讨,为肉品的嫩化提供更多更有效的方法。
1 材料与方法
1.1 材料与试剂
鸭胸肉由安徽强英集团有限公司提供,将鸭胸肉在4 ℃解冻24 h,剔除可见脂肪和结缔组织,切成3 cm×2.5 cm×2.5 cm的均匀块形。
菠萝蛋白酶(酶活300 000 U/g) 南宁东恒华道生物科技有限责任公司;牛血清蛋白、蛋白质Marker日本Takara生物公司;其他试剂为分析纯。
1.2 仪器与设备
ETS-2大容量高速匀浆机 江苏金坛市亿通电子有限公司;HH-4数显恒温水浴锅 国华电器有限公司;722-N可见分光光度计 上海菁华科技仪器有限公司;pHS-3C型pH计 上海雷磁科学仪器股份有限公司;TAXT PLUS物性分析仪 英国Lload公司;Avanti J-26 XP高速冷冻离心机 美国贝克曼公司;DSA50–GL1超声波清洗机 福州德森精工有限公司;CR-10色差计 日本柯尼卡公司。
1.3 方法
将一定量的菠萝蛋白酶用不同的pH值缓冲液溶解制备含酶溶液,将含酶溶液喷洒在鸭肉表面(液料比1∶10(mL/g)),冰浴上人工滚揉5 min至含酶溶液完全被鸭肉吸收,置于蒸煮袋中真空包装,再置于超声波清洗机中进行嫩化实验。
1.3.1 超声波与酶协同作用嫩化鸭肉的工艺优化
1.3.1.1 单因素试验
固定超声波功率80 W、酶添加量500 U/g、pH 7、嫩化时间15 min、温度40 ℃条件,改变其中一个条件,设定温度为20、30、40、50、60 ℃,时间为5、10、15、20、25 min,缓冲液pH值为5、6、7、8、9,酶添加量为300、400、500、600、700 U/g,超声波功率为60、70、80、90、100 W,测定各样品的剪切力值,考察各因素对嫩化鸭肉的影响。
1.3.1.2 响应面优化试验
通过SPSS 11.5软件对上述5 个单因素试验进行方差分析,选取影响剪切力显著的因素进行响应面优化试验,根据Box-Behnken试验设计原理,以温度(A)、pH值(B)、酶添加量(C)和超声波功率(D)为自变量,以剪切力值为响应值进行4因素3水平的试验,试验因素与水平设置如表1所示,嫩化时间为15 min。
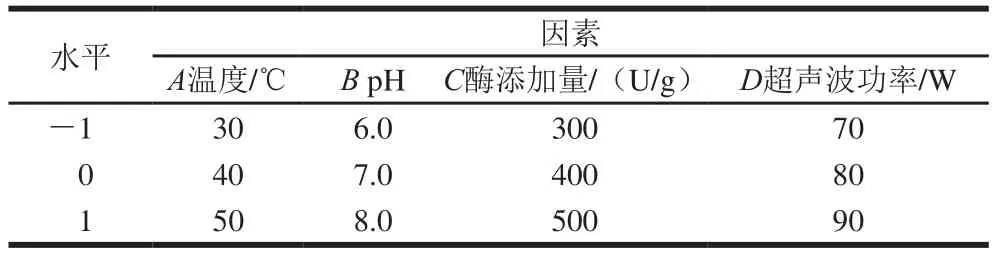
表1 响应面试验因素与水平Table1 Coded and real levels of independent variables used in Box-Behnken design
1.3.2 剪切力的测定
将嫩化后的肉样于沸水浴中蒸煮30 min,取出,沥干水分,冷却,沿肌纤维方向切割成长×宽×高为20 mm×10 mm×10 mm的条型,取样后立即置于TA.PLUS物性分析仪上进行测定。采用复合剪切探头(FG/SBS)测试,探头移动速率30 mm/min,在样品中下行距离为20 mm,取最大应力值为剪切力。
1.3.3 超声波与酶协同作用嫩化鸭肉的指标测定
利用最优工艺参数进行鸭肉嫩化处理后,取肉样进行各项指标的测定(pH值、持水力、肌原纤维蛋白溶解度、色差、剪切力、肌原纤维小片化指数、不溶性胶原蛋白含量),同时进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)和透射电镜分析。
1.3.3.1 pH值测定
称取5 g肉糜,加入25 mL的蒸馏水,均质30 s,然后采用pH电极计测量其pH值[16]。
1.3.3.2 持水力测定
10 g肉糜加15 mL 0.6 mol/L的NaCl溶液,置于离心管中,涡旋振荡1 min,于4 ℃静置15 min,再次振荡1 min,置于高速冷冻离心机中4 ℃、5 000 r/min离心15 min。测量上清液体积,结果以上清液体积占最初体积百分比表示[16]。
1.3.3.3 色差测定
运用色差仪测定L*、a*、b*、c*、h*值和色差值。L*值为亮度值,表示样品从白到黑的水平;a*值表示样品颜色从绿到红的范围,b*值表示样品颜色从蓝到黄的范围;c*值表示彩度,即色彩饱和的程度;h*值表示色调角;色差值表示色空间的综合值,即总色差。
1.3.3.4 肌原纤维小片化指数(myofibril fragmentation index,MFI)测定
肌原纤维悬液的制备采用Rawdkuen等[17]的方法:将4 g肉糜加入40 mL的分离介质中(2 ℃),用高速组织捣碎机匀浆,于5 000 r/min离心15 min。将上清液慢慢倒出,沉淀中再倒入40 mL的分离介质,用玻璃棒搅匀,于5 000 r/min离心15 min,缓慢倒出上清液。在沉淀中加入10 mL的分离介质制成悬液,通过20 目的筛网过滤除去结缔组织和碎片,再加10 mL的分离介质冲洗筛网,制成肌原纤维悬液,蛋白质浓度的测定采用双缩脲法。MFI的测定:取肌原纤维悬液1 mL,用分离介质稀释至蛋白质质量浓度为(0.5±0.05)mg/mL。稀释的肌原纤维悬液搅拌后倒入比色皿中,立即在540 nm波长处测定吸光度。MFI以其测得的吸光度乘以200计。
1.3.3.5 肌原纤维的溶解度测定
肌浆蛋白含量:称取2 g肉糜,用20 mL冰冷的0.025 mol/L磷酸钾缓冲液(pH 7.2)提取,均质,4 ℃过夜,不断振荡,1 500 r/min离心20 min,上清液蛋白含量用双缩脲法进行测定。总蛋白含量:称取2 g肉糜,用40 mL冰冷的磷酸缓冲液(pH 7.2,内含1.1 mol/L KI溶液),均质,4 ℃过夜,不断振荡,1 500 r/min离心20 min,上清液蛋白含量用双缩脲法进行测定。肌原纤维蛋白含量为两者之差[16]。
1.3.3.6 不溶性胶原蛋白含量测定
胶原蛋白总量:称取1 g肉样于25 mL的6 mol/L盐酸溶液或3 mol/L硫酸溶液中,于108 ℃水解18 h,趁热过滤至25 mL容量瓶中,用盐酸或硫酸溶液多次洗涤烧杯和滤纸并入容量瓶,用水定容,摇匀待测。不溶性胶原蛋白量:称取1 g肉样加入15 mL 1/4 Ringer’s试剂(1.8 g NaCl,0.25 g KCl,0.06 g CaCl2·6H2O,0.05 NaHCO3,0.186 g CH3COOH,溶于1 L蒸馏水),在离心管中均质,77 ℃水浴60 min,冷却至室温,4 500 r/min离心15 min,弃去上清液,沉淀加20 mL的6 mol/L盐酸溶液或3 mol/L硫酸溶液,在108 ℃条件下水解18 h,趁热过滤至25 mL容量瓶中,用盐酸或硫酸溶液多次洗涤烧杯和滤纸并入容量瓶,用水定容摇匀待测[16]。待测液参照GB/T 9695.23—2008《肉与肉制品 羟脯氨酸含量测定》方法,计算公式如式(1)、(2):

1.3.3.7 SDS-PAGE分析[17-18]
称取4 g肉样于10 mL样品提取液中(85 ℃预热),用高速匀浆机以中速匀浆15 s,于4 ℃高速冷冻离心机10 000 r/min离心5 min,取上清液备用。上清液和2×样品缓冲液以1∶1混合,沸水浴5 min,冷却至室温上样,上样量为20 μg蛋白。初始电压为80 V,进入分离胶后电压加大至100 V。染色、脱色至背景清晰。
1.3.3.8 透射电镜分析[19]
将鸭肉样品于2.5%戊二醛(25%戊二醛溶液与0.1 mol/L、pH 7.4 PBS按1∶9体积比混合)中4 ℃固定,送至南京农业大学生命科学院电镜室进行透射电镜分析。
1.4 数据分析
实验数据用 ±s表示,采用SPSS 11.5进行数据处理与分析。单因素试验各组间数值的比较分析采用单因素方差分析(ANOVA),Duncan极差检验。
2 结果与分析
2.1 超声波与菠萝蛋白酶协同作用对鸭肉的嫩化工艺结果2.1.1 单因素试验结果
2.1.1.1 温度对鸭肉嫩化效果的影响
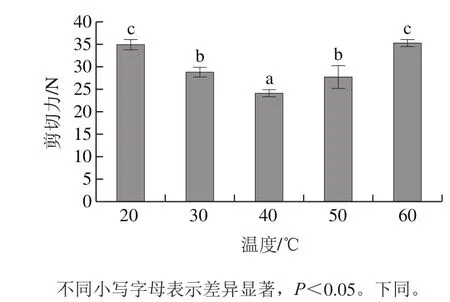
图1 温度对鸭肉嫩化效果的影响Fig.1 Effect of temperatures on tenderization of duck muscle
由图1可见,随着嫩化处理温度的升高,在达到40 ℃时剪切力达到最低(23.997 N),显著低于其他各组(P<0.05)。尽管菠萝蛋白酶的最适作用温度范围为55~60 ℃[20],由于超声波在工作期间产生的热效应会使处理温度上升,同时超声15 min可以大大增加酶的活性[14],因此,随着处理温度上升到60 ℃时,实际温度已大于60 ℃,鸭肉蛋白质在此温度条件下可能已发生变性,菠萝蛋白酶发生失活,剪切力显著增加(P<0.05)。因此,最佳温度在40 ℃左右。
2.1.1.2 嫩化时间对鸭肉嫩化效果的影响
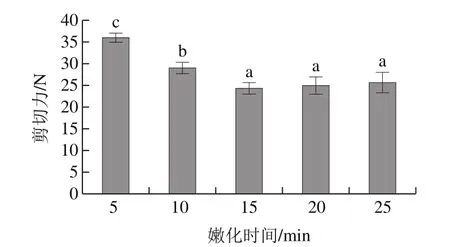
图2 嫩化时间对鸭肉嫩化效果的影响Fig.2 Effect of treatment time on tenderization of duck muscle
由图2可见,随着鸭肉嫩化时间的延长,15 min时鸭肉的剪切力降到了24.451 N,显著低于5 min和10 min(P<0.05),随着嫩化时间的延长,超声波对酶活力的影响增加,酶的活力显著下降[9],酶对鸭肉中蛋白的水解达到了饱和。而王晶等[15]认为超声波和菠萝蛋白酶处理30 min羊肉的剪切力达到最低,这可能是由于原料肉块较大,酶添加量较低,以及羊肉本身较鸭肉肌纤维粗糙所致。因此,最佳作用时间为15 min。此嫩化时间远远小于普通外源酶法所需要的1 h[3],大大缩短了嫩化时间。
2.1.1.3 pH值对鸭肉嫩化效果的影响
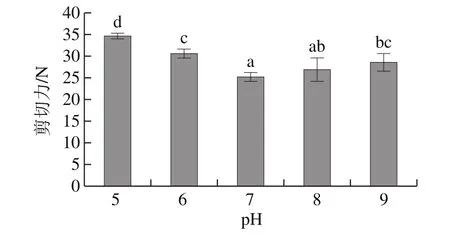
图3 pH值对鸭肉嫩化效果的影响Fig.3 Effect of pH value on tenderization of duck muscle
由图3可见,pH值对鸭肉的嫩化效果影响显著(P<0.05)。菠萝蛋白酶的最适作用pH值在5~8之间[20],pH值为7时嫩化效果最好,这与吴茂玉等[21]报道的pH值在7.1附近菠萝蛋白酶活力达到最高点一致。因此,最佳作用pH值为7.0。
2.1.1.4 酶添加量对鸭肉嫩化效果的影响
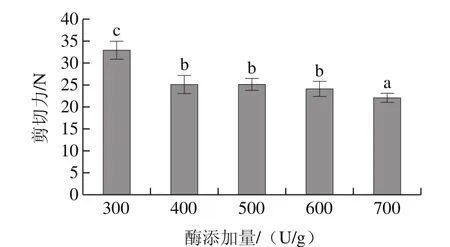
图4 酶添加量对鸭肉嫩化效果的影响Fig.4 Effect of bromelain concentration on tenderization of duck muscle
由图4可见,当酶添加量为400 U/g时,鸭肉的剪切力明显下降(P<0.05),达到了25.211 N,尽管随着酶添加量的增加,剪切力还有轻微下降,但不显著(P>0.05),当酶添加量达到700 U/g时剪切力虽然显著下降(P<0.05),但出现了过度嫩化现象,颜色发黄,肉质过软,感观品质下降。因此,最佳酶添加量为400 U/g。
2.1.1.5 超声波功率对鸭肉剪切力的影响
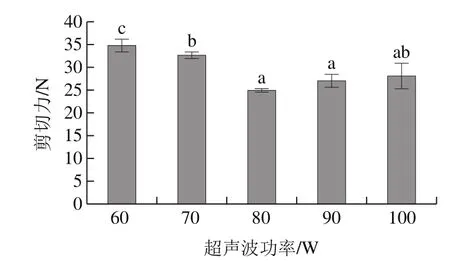
图5 超声波功率对鸭肉嫩化效果的影响Fig.5 Effect of ultrasonic power on tenderization of duck muscle
由图5可见,低功率对肉的嫩度有显著的改善作用,在由60 W增加到80 W时,鸭肉的剪切力显著下降(P<0.05),这也是由于超声波对肌纤维蛋白产生机械物理破坏作用,同时其空化作用使线粒体、肌质网和溶酶体膜破坏,加快蛋白酶溶液的扩散和渗透,提高嫩化效果[22]。而随着超声波功率的增加,肉的嫩化效果并未有显著的改善。因此,最佳超声波功率为80 W。
2.1.2 响应面优化试验结果
2.1.2.1 响应面回归方程及方差分析
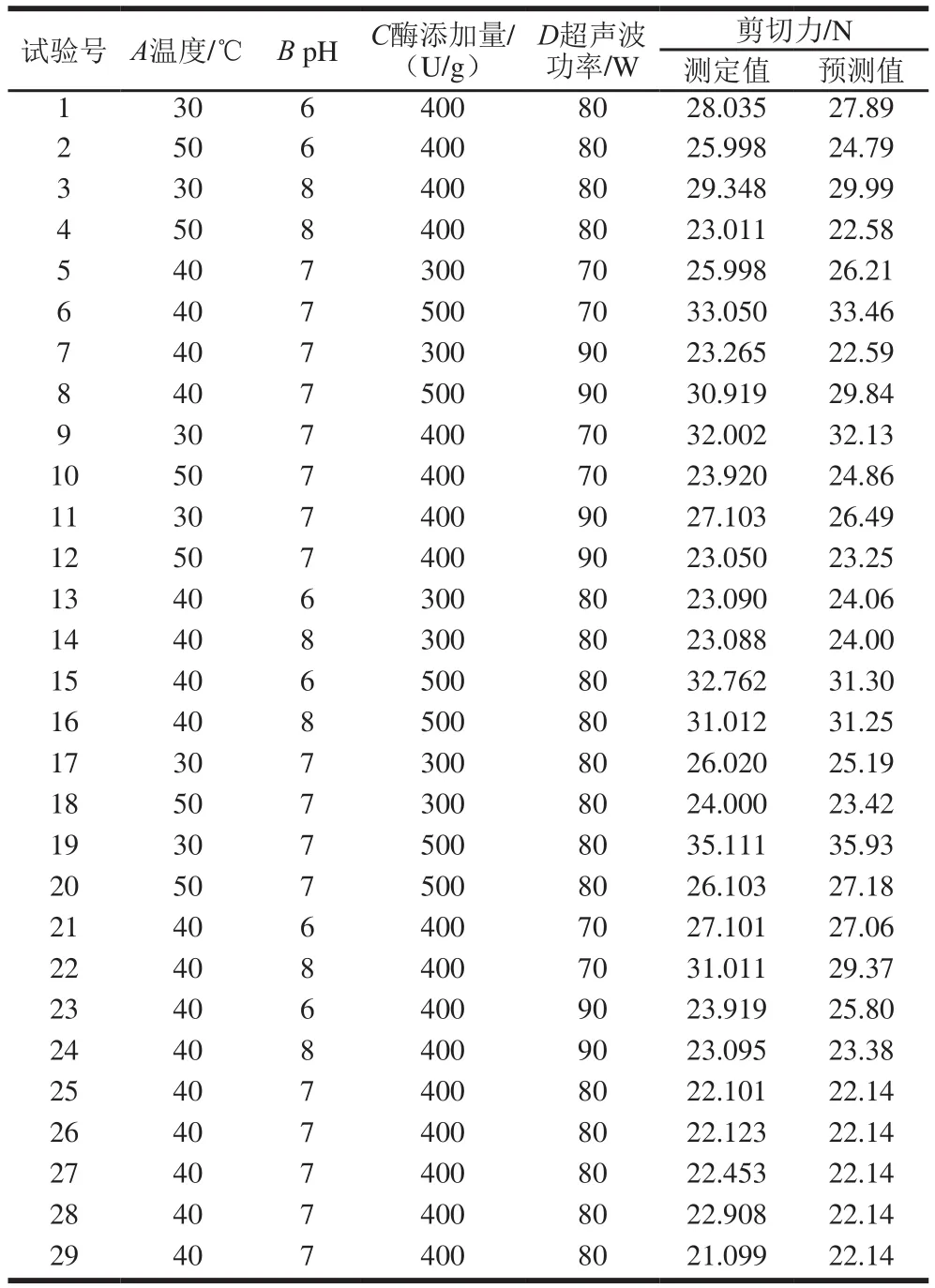
表2 响应面试验设计及结果Table2 Box-Behnken design with predicted and measured values of shear force
根据实际测定值对表2中的数据采用逐步回归拟合,得到剪切力对温度(A)、pH值(B)、酶添加量(C)和超声波功率(D)的模型回归方程:剪切力/N=277.294 8-1.399 0A-13.535 5B-0.179 2C-3.465 3D+0.022 3A2+1.948 2B2+3.566 7×10-4C2+0.023 2D2-0.107 5AB-1.747×10-3AC+0.010 1AD-0.118 4BD。对所建的模型进行方差分析见表3。
由表3可知,模型的F值为28.04,P值小于0.000 1,说明该预测模型极显著(P<0.01),失拟项不显著(P=0.120 9),说明在试验设计的范围内,模型能够很好地表明各因素值和剪切力之间的关系。对于各嫩化因素,一次项A(温度)、C(酶添加量)和D(超声波功率)对模型影响极显著(P<0.01);B(pH值)对模型影响不显著(P=0.931 4);因素间只有AC(温度和酶添加量)的交互作用对模型的影响极显著(P<0.01);各影响因素二次项均有极显著的影响(P<0.000 1)。从F值可以看出各单因素的影响主次顺序为酶添加量(C)>温度(A)>超声波功率(D)>pH值(B);交互项影响大小为AC>BD>AB>AD>BC>CD。
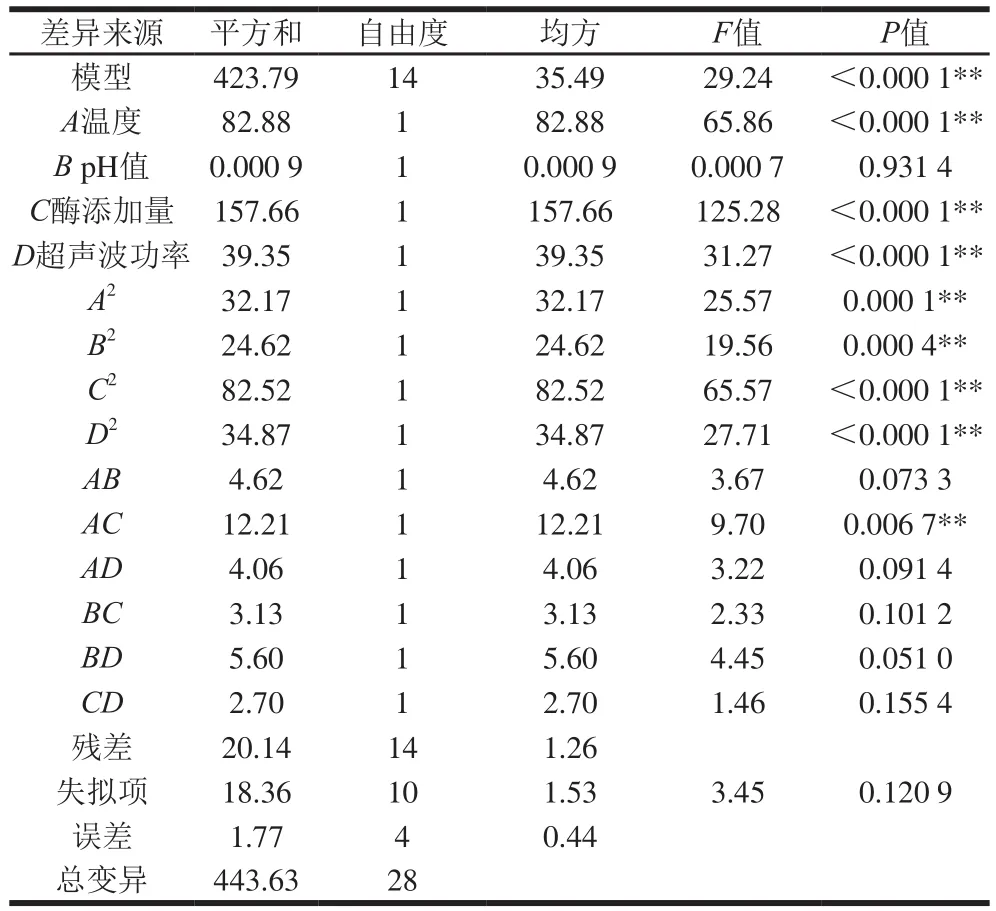
表3 响应面试验回归方程与方差分析Table3 Analysis of variance for response surface regression equation
2.1.2.2 交互作用影响分析
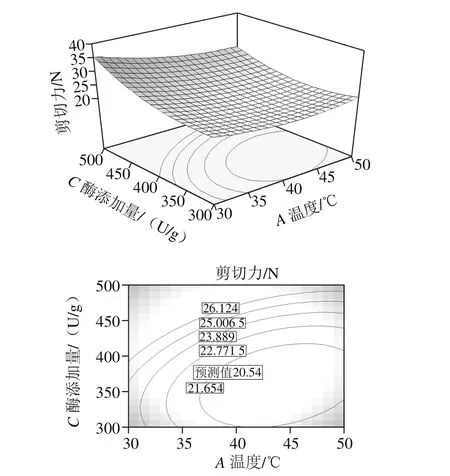
图6 温度和酶添加量交互作用对鸭肉剪切力的响应面和等高线图Fig.6 Response surface and contour plots showing the interactive effects of temperature and bromelain concentration on shear force of duck muscle
利用Design-Expert 6.0软件对表2数据进行二元多次回归拟合,得到各因素之间相互作用的响应面及等高线图,从表3可见,温度和酶添加量之间交互作用对鸭肉剪切力影响极显著(P<0.01),因此只对此交互作用进行分析。由图6可见,温度和酶添加量等高线图为椭圆形,交互作用最为显著(P<0.01),随着温度的升高,鸭肉剪切力先增加后下降,而随着酶添加量的增加,鸭肉剪切力逐渐增加,随后趋于不变。当酶添加量349.27 U/g、温度44.63 ℃时,鸭肉的剪切力达到极值,预测值为20.54 N。
2.1.3 最佳工艺参数确定及验证实验结果
通过软件分析优化结果可见,响应面模型预测的鸭肉剪切力结果存在最小值,为20.208 N,最佳的嫩化工艺参数为温度44.63 ℃、pH 7.2、酶添加量349.27 U/g、超声波功率83.90 W、嫩化时间15 min。按照实际可操作性,将实验条件修正为温度45 ℃、pH 7.2、酶添加量350 U/g、超声波功率80 W、嫩化时间15 min,在此基础上进行验证实验,实际鸭肉剪切力为21.110 N,与预测值接近,证明此预测模型合理可靠。
2.2 超声波与菠萝蛋白酶协同作用对鸭肉嫩化的作用机理
2.2.1 协同嫩化与对照组理化指标的比较
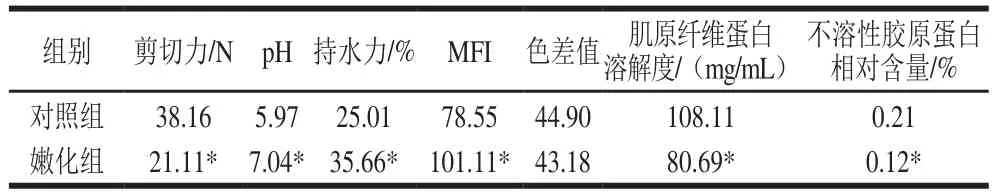
表4 对照组与嫩化组鸭肉的嫩化指标Table4 Physicochemical properties of control and tenderized duck muscle
由表4可见,除色差外,其余指标在嫩化组和对照组间均出现了显著的变化(P<0.05)。剪切力由未处理时鸭肉的38.16 N下降到嫩化后的21.11 N。本实验中用较高pH值(7.2)的磷酸缓冲液溶解酶并处理鸭肉,增加肉的pH值(鸭肉本身pH 6.23),同时也是肌肉蛋白水解所致。而pH值的增加会使肌内蛋白分子表面带有更多的净负电荷,从而使肌肉蛋白分子结合更多的水分子。肌丝(肌原纤维蛋白)间的静电斥力会使肌原纤维膨胀,也会使肌丝发生部分溶解,这都会导致持水力的增加[8],而在肉的食用品质中,持水力是一个非常重要的指标,它在很大程度上决定了肉的嫩度。MFI是指肌原纤维碎片程度,是肉类嫩化的标志,经嫩化处理的鸭肉MFI程度明显增加,由对照组的78.55增加到嫩化后的101.11,后期透射电镜也显示姜汁处理组鸭肉在肌原纤维Z线附近发生了大量的断裂现象。由表4可知,嫩化处理并未引起鸭肉色泽的变化。超声波和菠萝蛋白酶处理的鸭肉嫩度的增加是由于超声波促使菠萝蛋白酶在肉中的渗透,而菠萝蛋白酶和肌肉内源酶作用导致肌肉pH值和持水力的增加,致使蛋白质的功能性发生了改变。Dikeman等[23]指出肉类嫩度与肌原纤维蛋白含量之间呈负相关。Shin等[24]研究发现添加外源蛋白酶可以显著降低牛肉的肌原纤维蛋白含量。本实验中,经嫩化处理的鸭肉的肌原纤维蛋白溶解度明显下降(P<0.05),MFI增加,鸭肉得到了良好的嫩化。结缔组织主要由胶原纤维构成,胶原纤维主要成分是胶原蛋白,胶原蛋白含量和不溶性胶原蛋白含量与肉的嫩度呈现负相关,不溶性胶原蛋白相对含量由未处理时的0.21%下降到嫩化处理后的0.12%,因此,超声波和菠萝蛋白酶协同处理可以同时水解肉的“背景硬度”——肌原纤维和胶原蛋白,对肉的嫩化起到更好的作用。
2.2.2 超声波协同嫩化与单一菠萝蛋白酶嫩化的比较
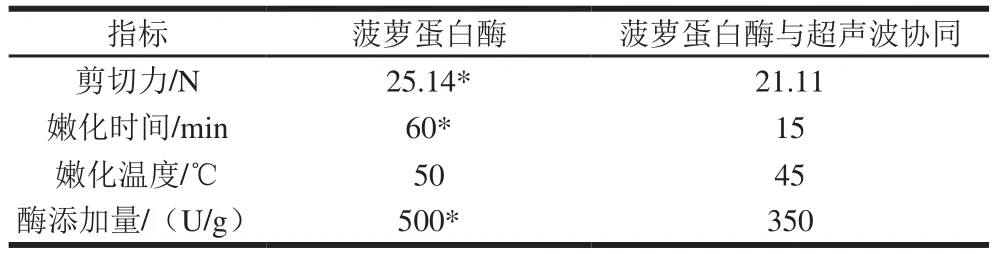
表5 超声波协同嫩化与单一菠萝蛋白酶嫩化的比较Table5 Comparison of duck meat tenderization with ultrasonicassisted bromelain and single bromelain
由表5可见,利用单一菠萝蛋白酶对鸭肉进行嫩化,通过最佳工艺参数获得的最低剪切力为25.14 N,显著高于超声波与酶的协同作用的21.11 N(P<0.05)。超声波协同嫩化时间远远低于单一菠萝蛋白酶所需要的60 min
(P<0.05)。在2 种嫩化方法的嫩化温度没有显著性差别的基础上,协同嫩化方法所需要的酶量显著少于单一嫩化方法(P<0.05)。推测是因为超声波提高了菠萝蛋白酶的活性[12]。
2.2.3 SDS-PAGE结果
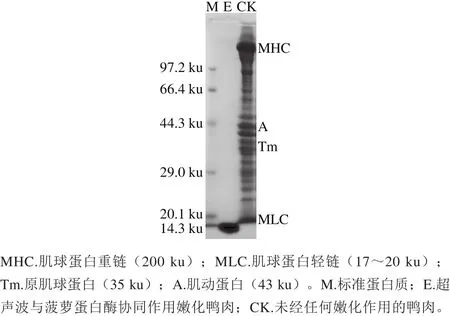
图7 超声波与菠萝蛋白酶协同作用嫩化鸭肉的SDS-PAGE图Fig.7 SDS-PAGE protein prof i les of duck muscle treated with ultrasound-assisted bromelain
由图7可见,与对照组相比,超声波与酶协同嫩化鸭肉组的大分子条带几乎完全消失,而分子质量为14.3 ku附近的条带明显加深变粗,说明大分子蛋白被水解成小分子多肽或氨基酸,而此种降解主要由肌球蛋白和肌动蛋白构成的肌原纤维蛋白发生了明显的降解所致。蛋白质水解表明肌原纤维结构的降解以及剪切力的下降,从而肉的嫩度得以改善。Rawdkuen等[17]研究发现植物巯基蛋白酶能降解肌肉中的肌球蛋白和肌动蛋白,进而在肉的嫩化和肉保水性的提高方面起着重要作用。Gerelt等[25]指出用木瓜蛋白酶处理肌原纤维使肌球蛋白重链降解成小分子肽类。Sawdy等[26]也证实了肌球蛋白重链碎片化程度和肉嫩度的高度相关性,水解形成的碎片越多,肉的嫩度越好。与作者前期对木瓜蛋白酶的嫩化研究[3]相比,菠萝蛋白酶具有更强的蛋白水解能力,在超声波辅助作用下,肌肉蛋白水解为分子质量更小的分子。
2.2.4 透射电镜结果

图8 鸭肉肌原纤维透射电镜微观组织结构图(×4 000)Fig.8 Ultrastructure of myof i brils of duck muscle treated with ultrasound-assisted bromelain by TEM (×4 000)
由图8可见,对照组样品肌原纤维的肌节完整,Z线平滑,I带和A带清晰可见;嫩化组的鸭肉肌原纤维Z线断裂弥散,肌节松弛变形缩短,I带和A带变得模糊,肌原纤维结构被破坏,由图8B可发现肌原纤维小片化现象。有研究用扫描电镜观察菠萝蛋白酶处理的牛肉发现,肌原纤维和肌节都发生了收缩变短现象,牛肉嫩度得到了极大改善[27-28]。Ha等[29]研究发现木瓜蛋白酶、生姜蛋白酶、中华猕猴桃蛋白酶和菠萝蛋白酶4 种植物水解蛋白酶都能有效地水解牛肉中的肌原纤维和胶原蛋白,而作者前期研究姜汁嫩化鸭肉实验中也显示其中的姜汁蛋白酶能够降解鸭肉中的肌原纤维和胶原蛋白[30],因此,与单纯蛋白酶一样,超声波与菠萝蛋白酶协同作用对鸭肉的嫩化也是通过肌原纤维和结缔组织的降解,而且水解能力更强。
3 结 论
采用Box-Behnken设计优化了超声波辅助菠萝蛋白酶嫩化鸭肉的最佳嫩化工艺参数为处理温度44.63 ℃、pH 7.2、菠萝蛋白酶添加量349.27 U/g、超声波功率83.90 W、嫩化时间15 min。数据采用逐步回归拟合,得到剪切力对温度(A)、pH值(B)、菠萝蛋白酶添加量(C)和超声波功率(D)的模型,按实际可操作性,将条件修正为处理温度45 ℃、pH 7.2、菠萝蛋白酶添加量350 U/g、超声波功率80 W、嫩化时间15 min,预测值为20.208 N,实测值为21.110 N。各因素的影响大小为酶添加量>温度>超声波功率>pH值。
相对于未处理的鸭肉,嫩化组鸭肉的pH值、持水力和MFI显著增加,剪切力、肌原纤维溶解度和不溶性胶原蛋白的相对含量显著下降,而色差无明显变化。SDSPAGE图谱显示嫩化组鸭肉中大分子蛋白被水解成小分子,透射电镜显示嫩化组鸭肉肌原纤维Z线断裂溶解,肌节变形,出现了肌原纤维小片化现象。本实验说明超声波与菠萝蛋白酶协同作用对鸭肉的嫩化具有显著的效果,大大缩短了嫩化时间,使鸭肉更加多汁并富有弹性,鸭肉的品质得到了极大的改善。
[1] ZATUL I M A, AZURA A, FARIDAH Y, et al. Bromelain: an overview of industrial application and purification strategies[J].Applied Microbiological Biotechnology, 2014, 98: 7283-7297.DOI:10.1007/s00253-014-5889-y.
[2] HAGE D S, ANGUIZOLA J A, BI C, et al. Pharmaceutical and biomedical applications of aff i nity chromatography: recent trends and developments[J]. Journal of Pharmaceutical and Biomedical Analysis,2012, 69(8): 93-105. DOI:10.1016/j.jpba.2012.01.004.
[3] 赵立, 陈军, 李苗云, 等. 木瓜蛋白酶嫩化鸭肉效果的研究[J]. 食品与发酵科技, 2015, 51(6): 41-46.
[4] SULLIVAN G A, CALKINS C R. Application of exogenous enzymes to beef muscle of high and low-connective tissue[J]. Meat Science,2010, 85(4): 730-734. DOI:10.1016/j.meatsci.2010.03.033.
[5] LIZUKA K, AISHIMA T. Tenderization of beef with pineapple juice monitored by Fourier transform infrared spectroscopy and chemometric analysis[J]. Journal of Food Science, 1999, 64(6): 973-977.DOI:10.1111/j.1365-2621.1999.tb12262.x.
[6] KETNAWA S, RAWDKUEN S. Application of bromelain extract for muscle foods tenderization[J]. Food and Nutrion Sciences, 2011, 2:393-401. DOI:10.4236/fns.2011.25055.
[7] CHUAPOEHUK P, RAKSAKULTHAI N. Use of papain and bromelain in the production of oyster sauce[J]. Asean Food Journal,1992, 7(4): 196-199. DOI:10.3389/fbioe.2016.00059.
[8] AHMAD R, HASNAIA A. Ultrasonication of chicken natural actomyosin: effect on ATPase activity, turbidity and SDS-PAGE profiles at different protein concentrations[J]. American Journal of Biochemistry and Molecular Biology, 2013, 1: 1-8. DOI:10.3923/ajbmb.2013.
[9] STADNIK J, DOLATOWSKI Z J, BARANOWSKA H M. Effect of ultrasound treatment on water holding properties and microstructure of beef (M. semimembranosus) during ageing[J]. LWT-Food Science and Technology, 2008, 41(10): 2151-2158. DOI:10.1016/j.lwt.2007.12.003.
[10] 常海军, 徐幸莲, 周光宏. 超声波处理对结缔组织胶原蛋白和肉嫩度的影响[J]. 肉类工业, 2009(12): 48-52.
[11] JAYASOORIYA S D, BHANDARI B R, TORLEY P, et al. Effect of high power ultrasound waves on properties of meat: a review[J].International Journal of Food Properties, 2004, 7(2): 301-319.DOI:10.1081/JFP-120030039.
[12] NAHIDUL I M D, ZHANG M, ADHIKARI B. The inactivation of enzymes by ultrasound: a review of potential mechanisms[J]. Food Reviews International, 2014, 30(1): 1-21. DOI:10.1016/S0168-1605(03)00075-8.
[13] LEE S H, NGUYEN H M, KOO Y M, et al. Ultrasound-enhanced lipase activity in the synthesis of sugar ester using ionic liquids[J].Process Biochemistry, 2008, 43(9): 1009-1012. DOI:10.1016/j.procbio.2008.05.001.
[14] 张永军, 黄惠华. 超声波对菠萝蛋白酶热稳定性及二级结构的影响[J]. 中国食品添加剂, 2009(6): 110-114. DOI:10.3969/j.issn.1006-2513.2009.06.019.
[15] 王晶, 田莹俏, 张艳花, 等. 菠萝蛋白酶和超声波对羊肉嫩度的影响[J].肉类工业, 2015(3): 14-18.
[16] NAVEENA B M, RAMAKRISHNA C, VAITHIYANATHAN S, et al.Effect of ammonium hydroxide on ultrastructure and tenderness of buffalo meat[J]. Meat Science, 2011, 88: 727-732. DOI:10.1016/j.meatsci.2011.03.005.
[17] RAWDKUEN S, JAIMAKREU M, BENJAKUL S. Physicochemical properties and tenderness of meat samples using proteolytic extract from Calotropis procera latex[J]. Food Chemistry, 2013, 136(2): 909-916. DOI:10.1016/j.foodchem.2012.08.077.
[18] TSAI L L, YEN N J, CHOU R R. Changes in Muscovy duck breast muscle marinated with ginger extract[J]. Food Chemistry, 2012,130(2): 316-320. DOI:10.1016/j.foodchem.2011.07.044.
[19] 臧大存. 鸭肉嫩度影响因素及变化机制的研究[D]. 南京: 南京农业大学, 2007: 69.
[20] AMINI A, MASOUMI-MOGHADDAM S, MORRIS D L. Utility of bromelain and N-acetylcysteine in treatment of peritoneal dissemination of gastrointestinal mucin-producing malignancies[M].Switzerland: Springer International Publishing, 2016: 63-80.
[21] 吴茂玉, 马超, 乔旭光, 等. 菠萝蛋白酶的研究及应用进展[J]. 食品科技, 2008, 33(8): 78-81. DOI:10.13684/j.cnki.spkj.2008.08.018.
[22] 周丹, 文连奎, 董周永, 等. 响应面试验优化超声波辅助木瓜蛋白酶嫩化河蚌肉工艺[J]. 食品科学, 2016, 37(4): 62-67. DOI:10.7506/spkx1002-6630-201604011.
[23] DIKEMAN M E, TUMA H J, BEECHER G R. Bovine muscle tenderness as related to protein solubility[J]. Journal of Food Science,1971, 36(2): 190-193. DOI:10.1111/j.1365-2621.1971.tb04022.x.
[24] SHIN H G, CHOI Y M, KIM H K, et al. Tenderization and fragmentation of myofibrillar proteins in bovine Longissimus dorsi muscle using proteolytic extract from Sarcodon aspratus[J]. LWT-Food Science and Technology, 2008, 41(8): 1389-1395. DOI:10.1016/j.lwt.2007.08.019.
[25] GERELT B, IKEUCHI Y, SUZUKI A. Meat tenderization by proteolyticenzymes after osmotic dehydration[J]. Meat Science, 2000,56(3): 311-318. DOI:S0309-1740(00)00060-7.
[26] SAWDY J, KAISER S, ST-PIERRE N, et al. Myofibrillar 1-D fingerprints and myosin heavy chain MS analyses of beef loin at 36 h postmortem correlate with tenderness at 7 days[J]. Meat Science,2004, 67(3): 421-426. DOI:10.1016/j.meatsci.2003.11.014.
[27] HUFF-LONERGAN E, LONERGAN S M. Mechanisms of waterholding capacity of meat: the role of postmortem biochemical and structural changes[J]. Meat Science, 2005, 71(1): 194-204.DOI:10.1016/j.meatsci.2005.04.022.
[28] CHAURASIYA R S, SAKHARE P Z, BHASKAR N, et al. Eff i cacy of reverse micellar extracted fruit bromelain in meat tenderization[J].Journal of Food Science and Technology, 2015, 52(6): 3870-3880.DOI:10.1007/s13197-014-1454-z.
[29] HA M, BEKHIT A E D A, CARNE A, et al. Characterisation of commercial papain, bromelain, actinidin and zingibain protease preparations and their activities toward meat proteins[J]. Food Chemistry,2012, 134(1): 95-105. DOI:10.1016/j.foodchem.2012.02.071.
[30] 赵立, 陈军, 李苗云, 等. 姜汁提取物对鸭肉嫩化及肌原纤维微观组织结构的影响[J]. 现代食品科技, 2016, 32(12): 241-246.DOI:10.13982/j.mfst.1673-9078.2016.12.037.

