肿瘤性骨软化症特征及诊治
李 伟,王向党,左庆瑶,王 红,黄彦弘,宋 慧,邓 微
肿瘤性骨软化症(tumor-induced osteomalacia ,TIO),是一种罕见的骨软化症,是由肿瘤引起肾脏排磷增加造成的获得性低血磷性骨软化症,目前世界上仅报道了350例[1]。近年研究表明,TIO的病因是由于肿瘤分泌成纤维细胞生长因子-23(fibroblast growth factor23,FGF23)、细胞外基质磷酸糖蛋白(matrix extracellular phosphoglycoprotein,MEPE)、分泌型卷曲相关蛋白(screted Frizzled related protein 4,sFRP4)等物质,使磷酸盐在肾小管的重吸收减少,进而引起低磷血症[2];慢性低磷血症最终导致骨矿化不足引起骨软化,临床表现为乏力、骨痛,严重者出现骨折、骨骼畸形。其中以分泌FGF23的肿瘤最为常见[3]。由于TIO的肿瘤的种类较多,绝大多数为间叶组织起源,分布广泛,很难被发现;造成此病诊断率低,与遗传原因引起的低磷骨软化症鉴别困难。本研究分析我院15例TIO患者的诊治情况,并对临床特征进行分析,以提高对TIO的认识及临床诊治水平。
1 对象与方法
1.1 对象 选择北京积水潭医院内分泌科2012-01至2017-10确诊的15例TIO患者。
1.2 方法 (1)完善病史采集;(2)完善化验检查资料采集:血生化检查、骨代谢标志物检查、血气分析、尿液检查(尿 pH、尿糖,尿磷、尿蛋白、尿肌酐)、CT或MR、骨密度、骨扫描、奥曲肽显像或PET-CT;(3)肿瘤体积计算公式[4]:(长×宽×高)/2;(4)肾小管磷重吸收率(TRP)=1-(磷酸盐清除率/肌酐清除率)=1-(血肌酐×尿磷/血磷×尿肌酐)。肾磷酸根阈值(RTPC)=肾小管最大磷重吸收量(TmP)/肾小球滤过率(GFR),根据血磷和TRP在 Walton-Bijvoet 线列图上测得TmP/GFR[5];(5)血清FGF23测定:应用酶联免疫吸附测定C-末端片段浓度(immtopics,san clemente,CA,USA);(6)骨密度应用双能X射线吸收法骨密度仪测定;(7)全身骨扫描显像采用99mTc-MDP为显像剂,奥曲肽显像采用99mTc-OCT为显像剂,PET-CT采用18F-FDG(例8为68Ga-DOTA-TATE)为显像剂。

2 结 果
2.1 临床资料及检验结果 15例(19例次)中,男8例,女7例。其中,2例复发(13.3%),1例为复发后恶变(6.7%)。平均(42.8±10.7)岁,平均病程(3.5±2.8)年。15例均有骨痛及肌无力,重者翻身及行走困难;8例有身高变矮(53.3%);4例出现脆性骨折(26.7%,表1)。
患者入院血磷均明显低于正常,平均为(0.41±0.10)mmol/L;尿磷平均为(17.95±11.35)mmol/24 h,大多低于正常(79%),仅4例次(21.1%)正常。RTPC均减低,为(0.33±0.10)mmol/L(表1)。其他骨代谢指标:Ca(42%减低,58%正常)及25-VitD(75%减低,25%正常)减低或正常;tP1NP(87%升高,13%正常)、β-CTX(75%升高,25%正常)、OC(13%升高,87%正常)、PTH(47%升高,53%正常)、ALP(63%升高,37%正常)升高或正常(表2)。其中4例行FGF23的检测。病例11行FGF23化验为>2000 RU/ml(正常范围5~105 RU/ml),病例13为782.23 RU/ml,病例14为196.45 RU/ml,病例15为583.52 RU/ml。
2.2 肿瘤定位检查 共5例次查体发现肿瘤(26.3%);18人次行奥曲肽现象检查,13例次阳性(72.2%);11人次行PET-CT,均为阳性;7例次行彩超检查,均为阳性;18人次行CT/MR检查,均为阳性。19例次病灶中位于骨骼组织的为10例次(52.6%),位于软组织的9例次(47.4%,表3)。
2.3 骨扫描及骨密度检查 有15例次行全身骨扫描检查,均表现为严重骨质疏松代谢性骨病征,伴多发机能不全骨折,符合骨软化症。有9例次行骨密度检查,结果提示为骨量减少或骨质疏松;4例次于术后1年复查,较前有明显改善(t=-6.984,P=0.006,见表4)。
2.4 治疗及病理 15例均行手术治疗,例1行2次手术,例11行4次手术,其中13例手术一次治愈(86.7%)。手术一次治愈患者中,除例13外,手术后血磷均于3 d内恢复(92.3%),平均恢复时间为(3.7±1.6)d。19次术后病理结果均为磷酸盐尿性间叶细胞瘤混合结缔组织型(PMTMCT),其中例11为PMTMCT肿瘤良性恶变(Ki67分别为<5%、8%、15%、24%)。例11曾给予皮下及静脉奥曲肽治疗,血磷由0.31升至0.42 mmol/L(表1)。
2.5 不同组织来源肿瘤临床特征比较 因例11及其复发病例存在组织类型改变,不予分析。对剩余15人次的进行分析:肿瘤位于软组织患者(6例)较肿瘤位于骨组织患者(9例),血磷(0.37±0.07vs0.48±0.10;t=2.264,P=0.041)及RTPC(0.30±0.07vs0.41±0.03;t=3.158,P=0.010)均减低,肿瘤体积无明显差异(10.7±12.0vs6.8±5.3;Z=-0.118,P=0.906)。相关性分析显示:血磷与RTPC、β-CTX、肿瘤组织来源相关(r=0.893、0.517、0.647;P<0.001、0.049、0.009);RTPC与tP1NP、肿瘤体积、肿瘤组织来源相关(r=0.586、-0.698、0.801;P=0.045、0.012、0.002)。回归分析显示:血磷主要受RTPC影响(标准系数0.836,t=3.862,P=0.005);RTPC受肿瘤体积、肿瘤组织来源相关影响(标准系数0.405、0.546,t=-2.635、3.925,P=0.030、0.004,表3)。
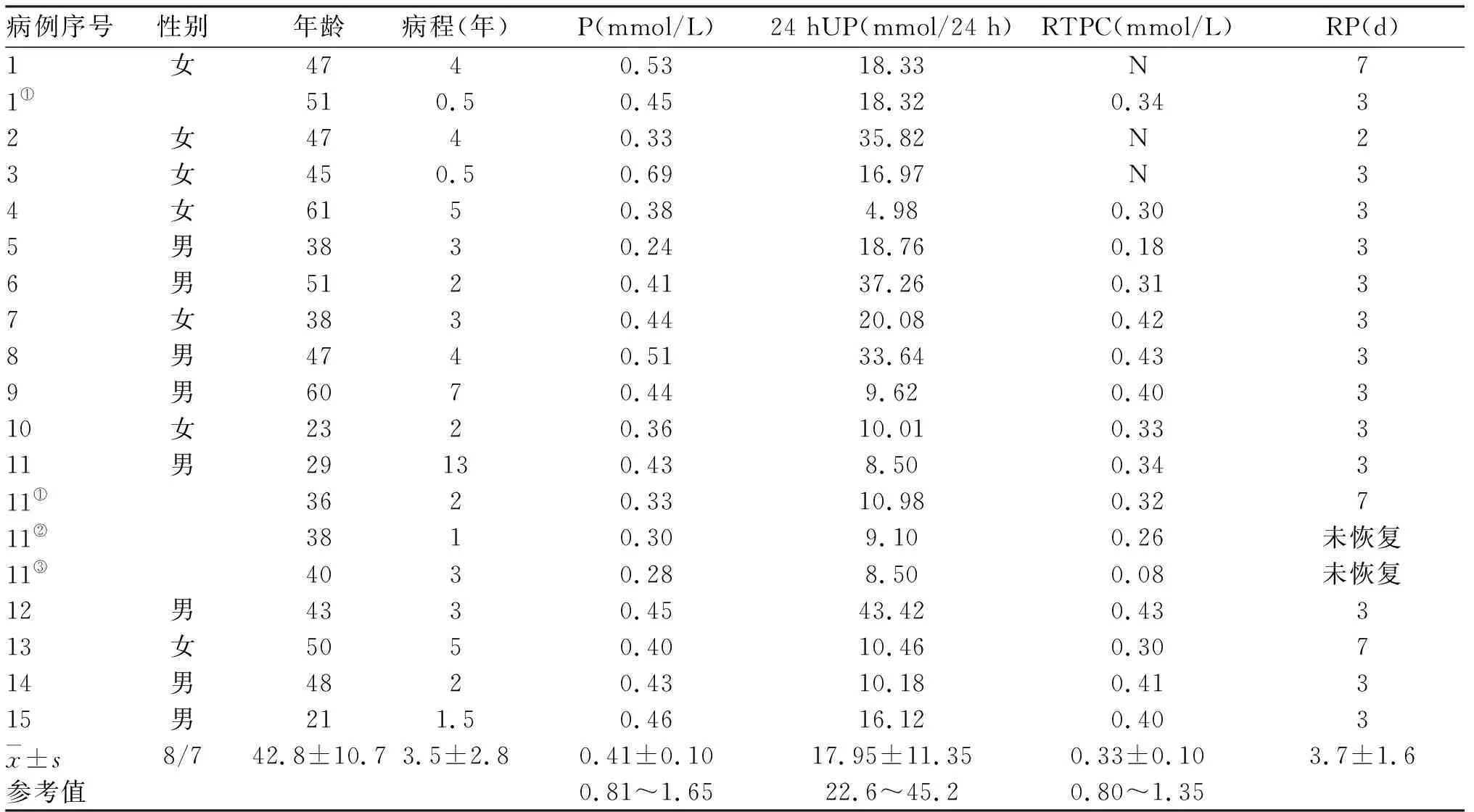
表1 15例TIO患者19人次住院一般资料及生化特征
注:①第1次复发;②第2次复发;③第3次复发;N:未测2 hUP:24小时尿磷;RP:术后血磷恢复正常时间;RTPC:肾磷酸根阈值

表2 15例TIO患者19人次骨代谢标志物情况
注:①:第一次复发;②:第二次复发;③:第三次复发;N:未测;2 hUP:24小时尿磷;RP:术后血磷恢复正常时间;RTPC:肾磷酸根阈值
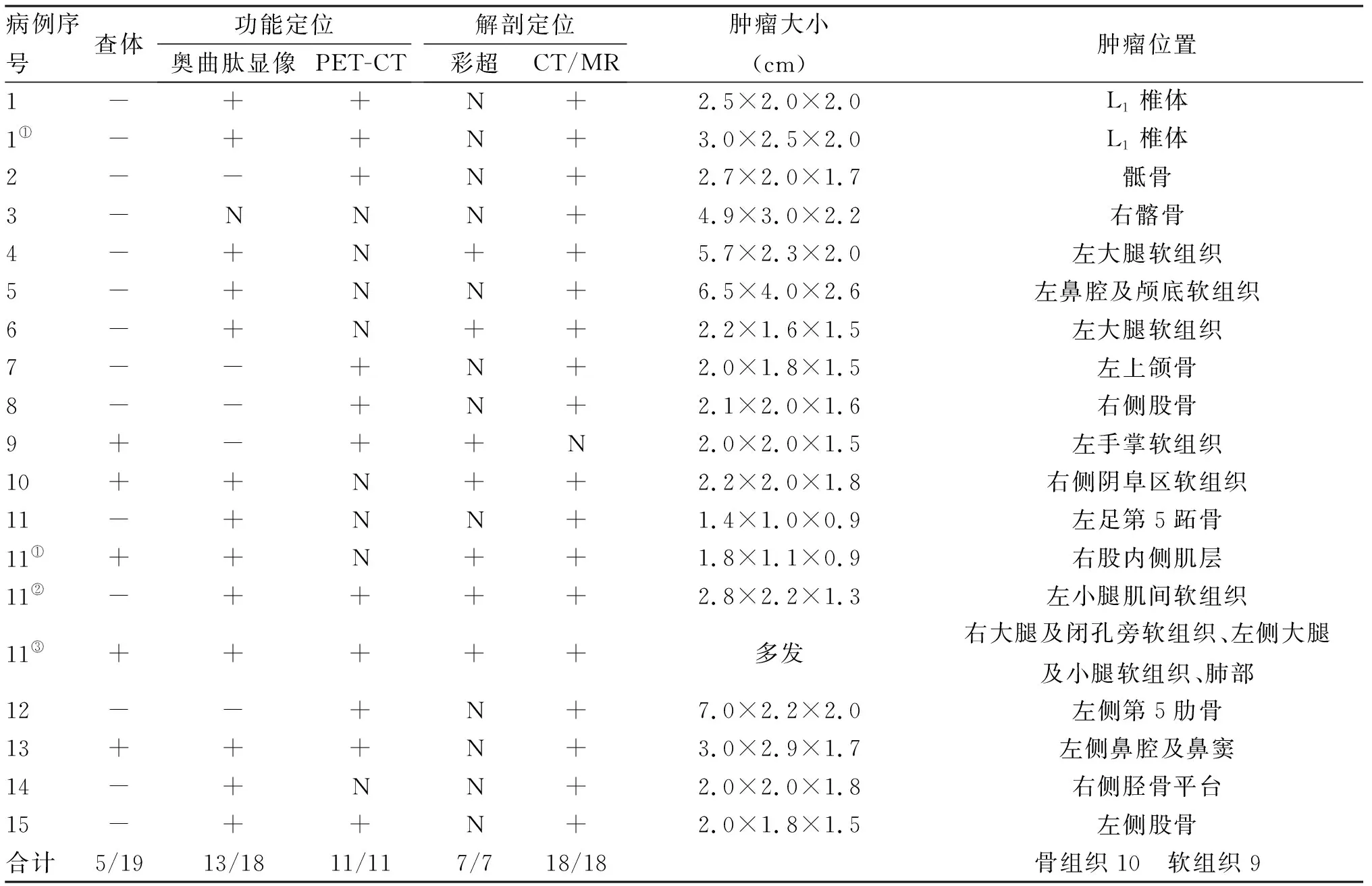
表3 15例TIO患者19人次肿瘤定位检查情况
注:①:第一次复发;②:第二次复发;③:第三次复发;N:未测;2hUP:24小时尿磷;RP:术后血磷恢复正常时间;RTPC:肾磷酸根阈值;PE:体格检查;US:超声;-:检查未发现;+:检查有阳性发现;N:未做
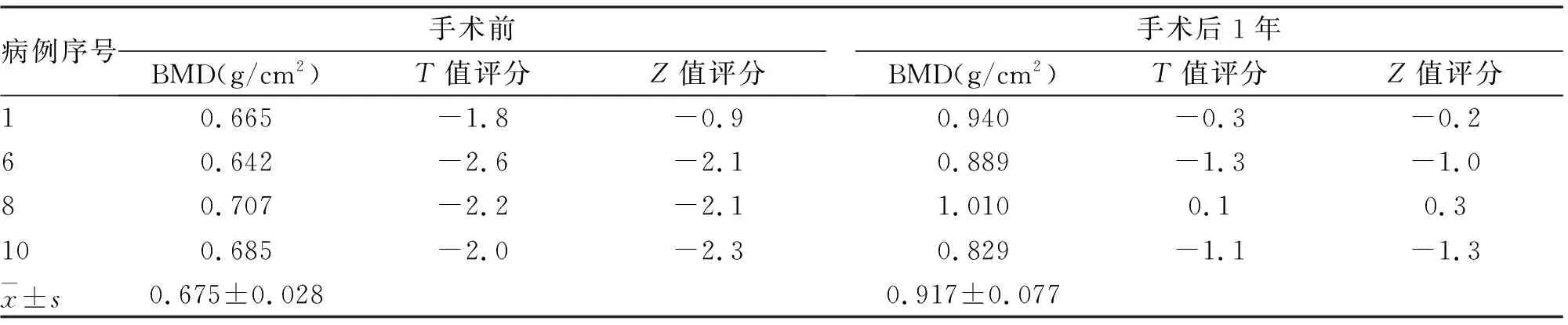
表4 4例TIO患者手术前及术后1年股骨颈骨密度检查
3 讨 论
TIO是一种因肿瘤分泌相关物质使磷排出增加而导致的低磷骨软化症,以分泌FGF23最为常见。FGF23增多后引起抑制近端肾小管的钠-磷共转运蛋白(NaPi),促使肾小管对磷的排泄。同时,抑制肾脏1a-羟化酶的活性,导致1,25(OH)2D3的合成减少,使磷由肠道的吸收减少。两者共同导致了低磷血症,进而骨软化症[6]。从病理生理角度讲,该病尿磷排出增加。但本研究发现24 h尿磷检查79%的TIO患者低于正常(仅21%的患者为正常),未见升高,且相关性分析及回归分析均未显示24 h尿磷对血磷有显著影响。此种现象是由于尿磷会随血磷减低而下降,随着尿磷的逐渐减少,24 h尿磷正常甚至低于正常;另外,24 h尿磷受肾小球滤过率的影响,以上两者使24 h尿磷并不能体现磷丢失的情况。而RTPC可以较好的避免上述情况,较好的反映肾小管重吸收磷的受损情况,本研究也显示RTPC与血磷有很好的相关性,并且是其主要影响因素[7]。
本研究显示,TIO患者典型临床表现为:骨痛及肌肉无力,部分出现骨软化和骨折;血磷低,RTPC低,Ca及25-维生素D减低或正常,tP1NP、β-CTX、OC、PTH、ALP升高或正常;骨密度减低,骨扫描提示为代谢性骨病。这些异常表现的病生理基础是血磷的下降,引起骨骼及肌肉的;与遗传、药物等原因引起的低磷骨软化症类似,无法明确鉴别[8]。因此,肿瘤的定位就成为诊断及治疗的关键,但由于TIO的责任病灶几乎可以分布在机体任何部位,这使其定位困难[9]。目前主张采取循序渐进的方式,包括体格检查、功能成像(奥曲肽显像及PET/CT)、解剖成像(CT、MR、B超),当然对于特殊的肿瘤可以采取其他的方法(如内镜等)。体格检查在临床中易被忽视,本研究显示体格检查就可以发现26.3%的病灶,而且还有助于其他定位检查准确度的提高[1]。肿瘤的功能成像为初始步骤,目前主要有奥曲肽显像及PET/CT,总体上看,前者的特异性强于后者,敏感性差于后者[10]。另外科研机构和国外还有68Ga DOTA-TATE PET/CT、111In-octreotide SPECT/CT等,进一步提高了TIO责任病灶的准确性[11,12]。功能成像完成后需要解剖成像进行确认,规划后进行手术。常规影像学检查阴性而临床高度怀疑TIO者,也可以进行静脉分段取血测血清FGF-23浓度[13]。目前没有一种方法可以完全准确的确认TIO的责任病灶,因此在医疗条件不足的情况下,可疑责任病灶的切除不失为一种方法。此外,对于病理类型不适于手术治疗的患者,也可以考虑放化疗治疗[3]。对于手术无法切除或无法发现责任病灶的患者,既往主要是补充中性磷溶液和1,25-(OH)2VitD治疗,但长期治疗有诱发三发性甲状旁腺亢进症的风险[14];也有应用奥曲肽及射频消融治疗的有效的报道[15,16],本研究中的11c病例应用奥曲肽治疗,血磷较前稍所上升。FGF23特异性单克隆抗体可能是此类患者未来治疗的一种选择。
需要注意的是,既往文献认为TIO的责任病灶基本均为良性,恶性及复发概率<5%[3]。但本研究中,复发病例占13%,其中1例为复发后恶变,恶性病例占7%,与近期报道类似[8,15]。可见TIO的患者存在复发及恶性风险,应该提高警惕,加强随诊。本研究显示,手术一次性治愈的患者血磷大多可以在3 d内恢复正常,复发及恶性病例血磷恢复时间相对较长,一般大于7 d,甚至不恢复。
绝大多数 TIO 是由骨或软组织的 PMT 引起,也有报道称与肺小细胞癌 、结肠腺癌 、前列腺癌及多发性神经纤维瘤病等有关;但也有病理为PMT,但非TIO的个案报道[7,17]。本研究患者的肿瘤病理均为尿磷酸盐间叶细胞肿瘤混合结缔组织型(PMTMCT),分别发生在软组织及骨组织。分析发现在肿瘤体积无明显差异的情况下,肿瘤位于软组织患者较肿瘤位于骨组织患者血磷及RTPC均更低;这可能与软组织较骨组织血供更为丰富,产生的FGF23能够更多的到达血循环中相关。回归分析显示RTPC受肿瘤体积、肿瘤组织来源相关影响,可见对于良性TIO患者来说,软组织的大肿瘤病情可能分泌FGF23更多,病情更重。
由于本文是回顾性研究,未完全检查所有患者的FGF23浓度,只能通过血磷及RTPC来间接反应FGF23的浓度。目前TIO肿瘤产生FGF23的机制尚不清楚,有研究认为可能与FN-FGFR1(fibronectin-fibroblast growth factor receptor 1)融合蛋白表达异常;氧诱导因子-1(hypoxia-inducible factor-1α,HIF-1α)活性增强等原因相关[18,19]。
综上所述,对于TIO的患者应警惕恶性及复发的可能;RTPC能较24 h尿磷更好的反映肾小管重吸收磷的受损情况;肿瘤位于软组织患者较肿瘤位于骨组织病情更为严重。
【参考文献】
[1] Kumar R,Folpe A L, Mullan B P. Tumor-induced osteomalacia[J].Transl Endocrinol Metab,2015,7(3):1-23.
[2] Berndt T J, Schiavi S, Kumar R."Phosphatonins" and the regulation of phosphorus homeostasis[J].Am J Physiol Renal Physiol,2005,289(6):F1170-1182.
[3] Hautmann A H, Hautmann M G, Klbl O,etal.Tumor-Induced Osteomalacia: an up-to-date review[J].Curr Rheumatol Rep, 2015,17(6):512.
[4] Euhus D, Hudd C, LaRegina M. Tumor measurement in the nude mouse[J].J Surg Oncol,1986,31: 229-234.
[5] Walton R J, Bijvoet O L. Nomogram for derivation of renal thresholdphosphate concentration[J]. Lancet,1975,2(7929):309-310.
[6] Florenzano P, Gafni R I, Collins M T. Tumor-induced osteomalacia[J].Bone Rep,2017,209(7):90-97.
[7] Minisola S, Peacock M, Fukumoto S,etal.Tumor-induced osteomalacia[J].Nat Rev Dis Primers,2017,3(17044):1-15.
[8] Feng J,Jiang Y,Wang O,etal.The diagnostic dilemma of tumor induced osteomalacia:a retrospective analysis of 144 cases[J].Endocr J,2017, 64(7):675-683.
[9] Gore M O, Welch B J, Geng W,etal.Renal phosphate wasting due to tumor-induced osteomalacia: a frequently delayed diagnosis[J].Kidney Int, 2009,76(3):342-347.
[10] Sun Z J,Jin J,Qiu G X,etal.Surgical treatment of tumor-induced osteomalacia: a retrospective review of 40 cases with extremity tumors[J].BMC Musculoskelet Disord,2015,16(43):1-8.
[11] Breer S, Brunkhorst T, Beil F T,etal.68Ga DOTA-TATE PET/CT allows tumor localization in patients with tumor-induced osteomalacia but negative 111In-octreotide SPECT/CT[J].Bone,2014,64:222-227.
[12] Singh D, Chopra A, Ravina M,etal.Correction to oncogenic osteomalacia: role of Ga-68 DOTANOC PET/CT scan in identifying the culprit lesion and its management[J].Br J Radiol,2017,90(1079):20160811e.
[13] Lee J Y, Park H S, Han S,etal.Localization of oncogenic osteomalacia by systemic venous sampling of fibroblast growth factor 23[J].Yonsei Med J,2017,58(5):981-987.
[14] Bhadada S K,Palnitkar S,Qiu S,etal.Deliberate total parathyroidectomy: a potentially novel therapy for tumor-induced hypophosphatemic osteomalacia[J].J Clin Endocrinol Metab,2013,98(11):4273-4278.
[15] Seufert J, Ebert K, Müller J,etal.Octreotide therapy for tumor-induced osteomalacia[J].N Engl J Med,2001,345(26):1883-1888.
[16] Tella S H, Amalou H, Wood B J,etal.Multimodality image-guided cryoablation for inoperable tumor-induced osteomalacia[J].J Bone Miner Res,2017,32(11):2248-2256.
[17] Honda R, Kawabata Y, Ito S.Phosphaturic mesenchymal tumor, mixed connective tissue type, non-phosphaturic variant: report of a case and review of 32 cases from the Japanese published work[J].J Dermatol,2014,41(9):845-849.
[18] Lee J C, Su S Y, Changou C A,etal.Characterization of FN1-FGFR1 and novel FN1-FGF1 fusion genes in a large series of phosphaturic mesenchymal tumors[J].Mod Pathol,2016,29(11):1335-1346.
[19] Zhang Q, Doucet M, Tomlinson R E,etal.The hypoxia-inducible factor-1α activates ectopic production of fibroblast growth factor 23 in tumor-induced osteomalacia[J].Bone Res,2016,4:16011.

