HMGB1改善耐吉西他滨胰腺癌PANC1细胞化疗敏感性的作用及其机制研究
陆德文 李先鹏 张波 姜玉华 许丰 郭世伟
胰腺癌化疗敏感性低,容易产生耐药性,因此探索其耐药机制并寻求新的化疗药物对胰腺癌的治疗具有重要的临床意义[1-2]。高迁移率族蛋白1(high mobility group box 1, HMGB1)是细胞内高丰度的染色体结合蛋白,在应激状态下的细胞DNA损伤修复中具有重要作用。研究发现某些肿瘤通过高表达HMGB1及其晚期糖基化终末产物受体(receptor for advanced glycation end products, RAGE)适应不利的微环境,包括能量和供氧压力、机体免疫系统的攻击等[3-4]。本研究通过抑制胰腺癌耐吉西他滨细胞株HMGB1的表达,观察其对吉西他滨敏感性的影响,并探讨其可能机制。
材料与方法
一、耐吉西他滨胰腺癌PANC1细胞株的建立
人胰腺癌PANC1细胞株为鄞州人民医院实验室冻存,常规复苏、培养、传代。通过浓度梯度递增诱导培养的方法建立耐吉西他滨胰腺癌PANC1细胞株(PANC1-GR),即取对数生长期细胞接种于培养瓶中,以5 μmol/L吉西他滨诱导培养3 d,去除死亡细胞后更换培养液继续培养3 d,传代后梯度增加吉西他滨浓度(10、20、30、50、75、100、150 μmol/L)继续诱导培养。确定细胞能够存活并稳定传代的最高吉西他滨浓度,以获得PANC1-GR细胞株。
二、靶向HMGB1的siRNA转染PANC1细胞
分别取对数生长期PANC1和PANC1-GR细胞,以5×104/孔的密度接种于24孔培养板,采用脂质体法将靶向HMGB1的siRNA转染细胞,按试剂盒说明书操作。转染后的细胞分别为siRNA-HMGB1-PANC1细胞及siRNA-HMGB1-PANC1-GR细胞。
三、吉西他滨对PANC1细胞的半数抑制浓度(IC50)和耐药指数(resistance index, RI)检测
取对数生长期的PANC1、PANC1-GR、siRNA-HMGB1-PANC1、siRNA-HMGB1-PANC1-GR细胞,以5×103/孔的密度接种于96孔培养板,以含0.5、1.0、2.0、5.0、10.0 μmol/L吉西他滨的培养液处理PANC1细胞,以含50、100、150、200、300 μmol/L吉西他滨的培养液处理PANC1-GR细胞。每个浓度设6个复孔,以未处理细胞作为对照。48 h后更换培养液,每孔加入10 μl的CCK-8继续培养3 h,置酶联免疫检测仪检测各孔450 nm波长的吸光度值(A450值)。绘制生长曲线获取IC50值,通过公式计算RI。RI=PANC1-GR的IC50值/PANC1的IC50值。
四、蛋白质印迹法检测PANC1细胞HMGB1、Beclin1蛋白表达
取对数生长期的PANC1、PANC1-GR及siRNA-HMGB1-PANC1、siRNA-HMGB1-PANC1-GR细胞,常规培养24 h后分别用150 μmol/L吉西他滨诱导培养48 h。收集各组细胞,通过RIPA裂解液获取细胞总蛋白。经BCA试剂盒定量后,取30 μg常规行蛋白质印迹法检测HMGB1及自噬标志蛋白Beclin1的表达,以β-actin为内参。小鼠抗人HMGB1、Beclin1单抗均1∶1 000稀释,辣根过氧化物酶标记的二抗1∶2 000稀释,最后经ECL发光,在凝胶成像系统(ImageQuant, GE)成像,应用Image J图像分析软件检测各条带灰度值,以目的条带与内参条带灰度值比表示蛋白相对表达量。实验重复3次,取均值。
五、流式细胞术检测细胞凋亡水平
取上述4株对数生长期细胞,以5×105/孔的密度接种于6孔培养板,常规培养24 h后,用150 μmol/L吉西他滨处理48 h。收集各组细胞,用预冷的PBS洗涤2次,加入500 μl的Binding buffer悬浮细胞,依次加入5 μl Annexin V-FITC、5 μl PI,混匀后置室温避光反应10 min,上流式细胞仪检测各组细胞凋亡率。
六、统计学分析

结 果
一、吉西他滨对4株PANC1细胞的IC50值
PANC1细胞在100 μmol/L吉西他滨处理后能稳定生长和传代,从而建立了PANC1-GR细胞株。吉西他滨对PANC1和PANC1-GR的IC50值分别为(4.7±0.4)μmol/L和(166.5±13.6)μmol/L,PANC1-GR细胞显著高于PANC1细胞,差异有统计学意义(t=-25.826,P<0.01);RI均值为35.4。siRNA-HMGB1-PANC1、siRNA-HMGB1-PANC1-GR细胞的IC50值分别为(3.2±0.3)、(52.4±8.4)μmol/L,显著低于相应的未转染细胞,差异均有统计学意义(t值分别为8.257、14.524,P值均<0.01);RI均值为16.4。
二、PANC1和PANC1-GR细胞HMGB1蛋白表达
PANC1和PANC1-GR细胞HMGB1蛋白相对表达量分别为0.17±0.08和0.38±0.11,PANC1-GR细胞中的表达量显著高于PANC1细胞,差异有统计学意义(t=-7.934,P<0.01,图1)。
三、4株PANC1细胞的Beclin1蛋白表达
PANC1、PANC1-GR、siRNA-HMGB1-PANC1、siRNA-HMGB1-PANC1-GR细胞Beclin1蛋白相对表达量分别为2.68±0.33、3.28±0.15、0.68±0.23、0.78±0.11,2株转染细胞的Beclin1表达量显著低于相应的未转染细胞,差异均有统计学意义(t值分别为9.853、14.62,P值均<0.01,图2)。
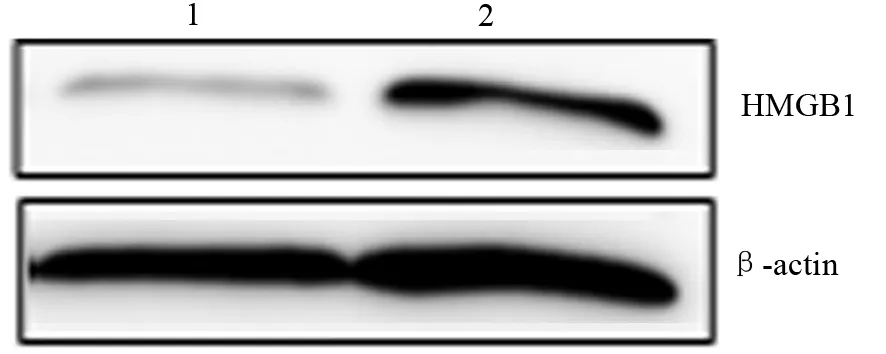
图1 HMGB1蛋白在PANC1(1)、PANC1-GR(2)细胞中的表达
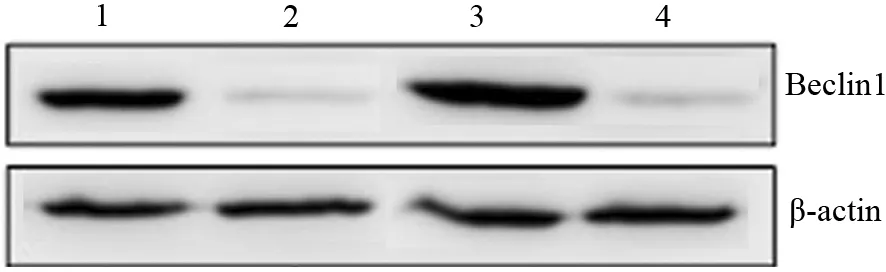
图2 Beclin1蛋白在PANC1(1)、siRNA-HMGB1-PANC1(2)、PANC1-GR(3)、siRNA-HMGB1-PANC1-GR(4)细胞中的表达
四、4株PANC1细胞的凋亡率
PANC1、PANC1-GR、siRNA-HMGB1-PANC1、siRNA-HMGB1-PANC1-GR的细胞凋亡率分别为(34.58±3.14)%、(19.41±1.53)%、(79.56±3.58)%、(34.57±2.94)%,2株转染细胞的凋亡率均显著高于相应的未转染细胞,差异有统计学意义(t值分别为-49.717、-24.753,P值均<0.01,图3)。
讨 论
细胞自噬是细胞在营养缺乏或应激条件下,通过清除胞质内错误折叠的蛋白质、脂类及受损细胞器,回收代谢物质、降低活性氧簇(reactive oxygen species, ROS)伤害的一种自救和质控方式[5-6]。目前研究证实,放化疗过程中一部分癌细胞能够通过自噬的方式获得耐药性,从而逃避凋亡命运[7]。
胰腺癌细胞在基础条件下表现出的组成性自噬被抑制时,ROS增加,引起DNA损伤和线粒体氧化磷酸化减少,进而使胰腺癌细胞生长抑制导致肿瘤消退[8-9]。而ROS过度会引起HMGB1的易位和释放,二硫化物HMGB1与RAGE结合,诱导Beclin 1依赖性自噬,并增加肿瘤细胞对化疗药物或电离辐射的抗性[10-11]。HMGB1-RAGE途径在诱导自噬中发挥关键作用, 抑制HMGB1-RAGE可导致胰腺癌细胞凋亡增加和自噬减少,而RAGE可通过p53抑制化疗引起的细胞凋亡。核内p53以转录依赖的方式刺激自噬,而胞质内p53以不依赖转录的方式抑制自噬体的形成[12-13]。RAGE还可通过降低雷帕霉素靶标(mTOR)的磷酸化或增加Beclin 1-Vps34相互作用,进而调节介导自噬体形成的某些分子,维持自噬水平[14]。因此,HMGB1的自噬调节作用可能是通过HMGB1-RAGE途径介导的,内源性HMGB1是增强细胞存活并限制程序性细胞凋亡的关键因子[15]。

图3 PANC1(3A)、siRNA-HMGB1-PANC1(3B)、PANC1-GR(3C)、siRNA-HMGB1-PANC1-GR(3D)的细胞凋亡
本研究结果显示,抑制HMGB1表达可下调自噬标志蛋白Beclin1,从而改善PANC1细胞对吉西他滨的敏感性。以HMGB1为靶标,利用HMGB1受体的单抗和转染抑制剂,抑制HMGB1信号转导通路,并与其他抗癌药物协同作用可能是克服肿瘤细胞抗药性的有效策略。
参 考 文 献
[1] Baines AT, Martin PM, Rorie CJ. Current and emerging targeting strategies for treatment of pancreatic cancer[J].Prog Mol Biol Transl Sci,2016,144:277-320.DOI:10.1016/bs.pmbts.2016.09.006.
[2] Fogel EL, Shahda S, Sandrasegaran K, et al. A multidisciplinary approach to pancreas cancer in 2016: A review[J].Am J Gastroenterol,2017,112(4):537-554.DOI:10.1038/ajg.2016.610.
[3] Kang R, Tang D, Lotze MT, et al. RAGE regulates autophagy and apoptosis following oxidative injury[J].Autophagy,2011,7(4):442-444.
[4] Sims GP, Rowe DC, Rietdijk ST, et al. HMGB1 and RAGE in inflammation and cancer[J].Annu Rev Immunol,2010,28:367-388.DOI: 10.1146/annurev.immunol.021908.132603.
[5] Auberger P, Puissant A. Autophagy, a key mechanism of oncogenesis and resistance in leukemia[J].Blood,2017,129(5):547-552.DOI:10.1182/blood-2016-07-692707.
[6] Gugnoni M, Sancisi V, Manzotti G, et al. Autophagy and epithelial-mesenchymal transition: an intricate interplay in cancer[J].Cell Death Dis,2016,7(12):e2520.DOI:10.1038/cddis.2016.415.
[7] Yang ZJ, Chee CE, Huang S, et al. The role of autophagy in cancer: therapeutic implications[J].Mol Cancer Ther,2011,10(9):1533-1541.DOI:10.1158/1535-7163.MCT-11-0047.
[8] Kang R, Tang D. Autophagy in pancreatic cancer pathogenesis and treatment[J].Am J Cancer Res,2012,2(4):383-396.
[9] Yang S, Wang X, Contino G, et al. Pancreatic cancers require autophagy for tumor growth[J].Genes Dev,2011,25(7):717-729.DOI: 10.1101/gad.2016111.
[10] Tang D, Loze MT, Zeh HJ, et al. The redox protein HMGB1 regulates cell death and survival in cancer treatment[J].Autophagy,2010,6(8):1181-1183.DOI:10.4161/auto.6.8.13367.
[11] Mou K, Liu W, Han D, et al. HMGB1/RAGE axis promotes autophagy and protects keratinocytes from ultraviolet radiation-induced cell death[J].J Dermatol Sci,2017,85(3):162-169.DOI: 10.1016/j.jdermsci.2016.12.011.
[12] Kang R, Tang D, Loze MT, et al. Apoptosis to autophagy switch triggered by the MHC class III-encoded receptor for advanced glycation endproducts (RAGE)[J].Autophagy,2011,7(1):91-93.DOI: 10.1038/cdd.2009.149.
[13] Livesey KM, Kang R, Vernon P, et al. p53/HMGB1 complexes regulate autophagy and apoptosis[J].Cancer Res,2012,72(8):1996-2005.DOI:10.1158/0008-5472.CAN-11-2291.
[14] Kang R, Tang D, Schapiro NE, et al. The receptor for advanced glycation end products (RAGE) sustains autophagy and limits apoptosis, promoting pancreatic tumor cell survival[J].Cell Death Differ,2010,17(4):666-676.DOI: 10.1038/cdd.2009.149.
[15] Tang D, Kang R, Livesey KM, et al. Endogenous HMGB1 regulates autophagy[J].J Cell Biol,2010,190(5):881-892.DOI:10.1083/jcb.200911078.

