大黄素联合5AzA-cdR对胰腺癌裸鼠皮下移植瘤抑癌基因p16、RASSF1A、ppENK的去甲基化作用
周鸿鲲 梅小平 潘杰 褚永权 姚明 陈亮
胰腺癌发生是多基因遗传和表观遗传共同作用的结果,基因异常甲基化是胰腺癌发病的重要原因之一,抑癌基因的高度甲基化可引起转录抑制甚至丧失,癌基因低甲基化可使其异常活跃,表达失控,从而导致细胞异常分化和增殖,发生癌变[1-2]。DNA甲基化指在DNA甲基转移酶(DNMTs)催化下将甲基加到CG二核苷酸的胞嘧啶上,使之变成5甲基胞嘧啶(5-mc)的化学修饰过程[3],DNMTs在肿瘤中表达增强,导致抑癌基因(TSG)高甲基化并失活,最终促进肿瘤发生。目前最常用于去甲基化的药物有5AzA-cdR和地西他滨两种核苷类似物,主要通过抑制DNMT的活性而发挥去甲基化作用[4]。但研究表明这两种药物的去甲基化作用特异性低且药物安全窗小,易导致全部基因组的低甲基化。此外,核苷类似物不良反应大,限制了其在临床上治疗肿瘤的应用。本课题组前期研究证实大黄素、5AzA-cdR可以通过抑制DNMTs的表达对体外胰腺癌细胞PANC1的抑癌基因p16、RASSF1A、ppENK发挥一定程度的去甲基化作用[5-7],当两者联合用药时去甲基化作用更为明显,故本研究通过建立胰腺癌裸鼠皮下移植瘤模型,在体内水平进一步验证大黄素联合5AzA-cdR对p16、RASSF1A、ppENK去甲基化的作用。
材料与方法
一、材料和试剂
大黄素(纯度≥98%)、5AzA-cdR购于Sigma公司,分别用DMSO配成10、20 mmol/L溶液储存于-70℃,实验前用培养液稀释成工作浓度。细胞/组织基因组DNA提取试剂盒(离心株型)购于上海捷瑞生物工程有限公司,EpiTect®MSP Kit试剂盒购于Qiagen公司。RNA提取试剂盒、RNA逆转录试剂盒购于Ferments公司,甲基化引物以及PCR引物由上海捷瑞生物技术有限公司合成,Anti-RASSF1a抗体、ppENK抗体购于Abcam公司,p16/INK4a抗体购于Epitomics公司。
二、细胞培养和胰腺癌裸鼠移植瘤模型的建立
人胰腺癌细胞株PANC1由本研究组引进并保存,常规培养传代。4~6周龄的雌性裸鼠BALB/CA-nu(nu/nu)购于上海肿瘤研究所,体重18~20 g,饲养于嘉兴学院医学院实验动物中心无特定病原体(SPF)环境中,并保持室温在25℃、相对空气湿度在40%~60%之间。适应性喂养1周后,取对数生长期PANC1细胞,用无血清培养液稀释,于裸鼠右下腹部皮下注入含5×106个细胞的200 μl细胞悬液,喂养4~5周,待皮下移植瘤体积达到100~150 mm3时随机分为4组,给予不同治疗方案。对照组腹腔注射生理盐水,大黄素组给予大黄素50 mg/kg灌胃,5AzA-cdR组腹腔注射5AzA-cdR 0.1 mg/kg,联合用药组给予大黄素50 mg/kg灌胃联合腹腔注射5AzA-cdR 0.1 mg/kg,每组10只,每3 d治疗1次,持续30 d。用药期间每6 d用游标卡尺测量肿瘤的长度(L)和宽度(W),按体积(V)=L×W2/2计算肿瘤体积。最后一次治疗后1周处死裸鼠,取移植瘤组织,部分液氮保存,部分用4%甲醛溶液固定。
三、甲基化特异性PCR法(methylmion specific PCR,MSP)检测抑癌基因甲基化水平
按照细胞/组织基因组DNA提取试剂盒说明书的方法分别提取上述4组移植瘤组织的DNA,分光光度法检测DNA纯度及浓度后,取1 μg DNA按照EpiTect®Bisulfite Kit修饰试剂盒说明书进行亚硫酸盐修饰。参见本课题组既往发表的方法[5-7],修饰后的DNA立即行RASSF1A、p16、ppENK的MSP反应,实验重复3次。部分修饰后的DNA保存于-20℃冰箱。
四、荧光定量PCR法检测抑癌基因mRNA表达
应用Trizol试剂提取上述4组移植瘤组织的总RNA,按试剂盒说明书先逆转录合成cDNA,再以cDNA为模板行荧光定量PCR扩增。各个基因引物序列、反应体系以及条件参见本课题组既往发表的文章[5-7],以GAPDH为内参,用p16、RASSF1A、ppENK的灰度值与GAPDH的灰度值比统计分析,实验重复3次。
五、蛋白质印迹法检测抑癌基因的蛋白表达
应用RIPA裂解液提取上述4组移植瘤组织总蛋白,使用BCA试剂盒定量蛋白后常规行蛋白质印迹法检测p16、RASSF1A、ppENK蛋白表达,以GAPDH为内参。抗p16、RASSF1A抗体工作浓度1∶500稀释,抗ppENK抗体工作浓度1∶1 000稀释。最后ECL发光,X片曝光、显影、定影。采用Image J软件进行条带扫描,以目的条带与内参条带的灰度值比表示蛋白相对表达量。
六、统计学处理
结 果
一、大黄素联合5AzA-cdR治疗的抑瘤作用
对照组、大黄素组、5AzA-cdR组、联合用药组移植瘤重量分别为(0.28±0.01)、(0.17±0.01)、(0.12±0.02)、(0.08±0.01)g;体积分别为(517±0.02)、(382±0.01)、(232±0.03)、(169±0.01)mm3(图1),3个治疗组移植瘤的重量及体积均显著小于对照组,联合用药组又显著小于2个单独用药组,差异均有统计学意义(P值<0.05或<0.01)。
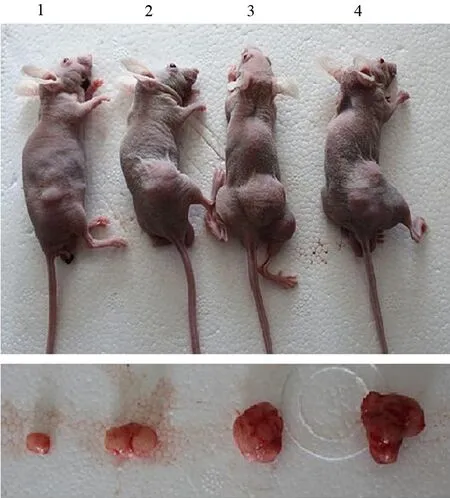
图1 联合用药组(1)、5AzA-cdR组(2)、大黄素组(3)、对照组(4)裸鼠移植瘤的的生长状况
二、大黄素联合5AzA-cdR治疗对p16、RASSF1A、ppENK甲基化的影响
对照组、大黄素组、5AzA-cdR组、联合用药组移植瘤组织p16、RASSF1A、ppENK甲基化状态见表1及图2。对照组3个基因均呈高甲基化状态,大黄素组p16、RASSF1A、ppENK甲基化程度轻微降低, 5AzA-cdR组去甲基化程度显著强于大黄素组,联合用药组的去甲基化程度又显著强于单独用药组,差异均有统计学意义。
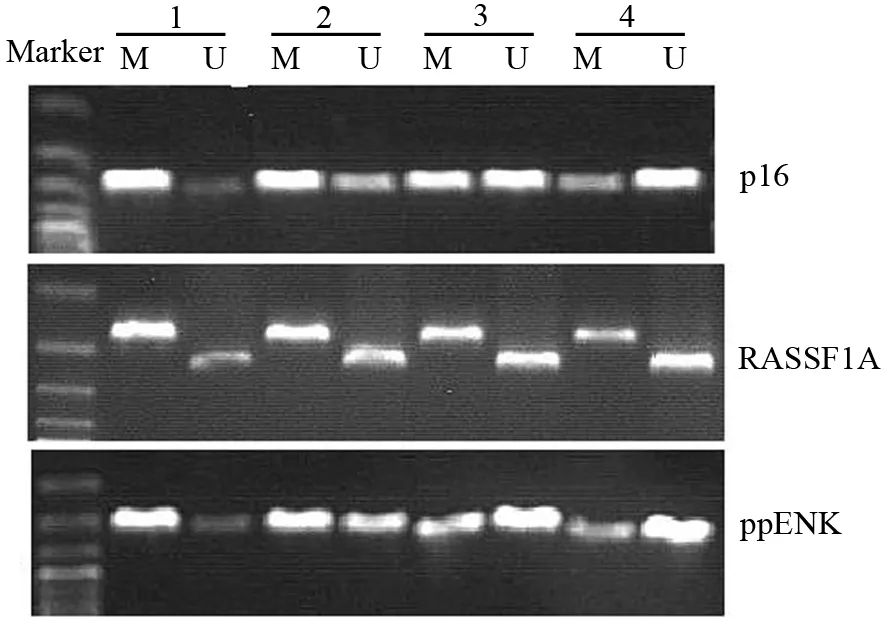
注:M:甲基化;U:非甲基化图2 对照组(1)、大黄素组(2)、5AzA-cdR组(3)、联合用药组(4)大鼠移植瘤p16、RASSF1A、ppENK甲基化状态
三、大黄素联合5AzA-cdR治疗对p16、RASSF1A、ppENK mRNA及蛋白表达的影响
3个治疗组裸鼠移植瘤组织p16、RASSF1A、ppENK mRNA及蛋白表达量均显著高于对照组,联合用药组的表达量又显著高于单独用药组,差异均有统计学意义(P值<0.05或0.01,表2,图3)。

图3 对照组(1)、大黄素组(2)、5AzA-cdR组(3)、联合用药组(4)大鼠移植瘤p16、RASSF1A、ppENK蛋白表达
讨 论
大黄素治疗胰腺癌的作用包括它可以诱导胰腺癌细胞发生凋亡,抑制新生血管形成以及联合吉西他滨用药可改善胰腺癌细胞对吉西他滨的耐药性等方面,但其具体的机制并不是很明确。本课题组既
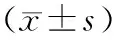
表1 四组大鼠移植瘤组织p16、RASSF1A、ppENK甲基化状态
注:与对照组比较,aP<0.05,bP<0.01
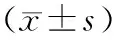
表2 四组大鼠移植瘤组织p16、RASSF1A、ppENK mRNA及蛋白的表达
注:与对照组比较,aP<0.05,bP<0.01
往的研究结果显示,大黄素可以通过去甲基化作用使胰腺癌细胞PANC1的抑癌基因p16、RASSF1A、ppENK甲基化水平下降而重新发挥抗癌活性,尤其当大黄素和5AzA-cdR联合作用时其作用最强,表明大黄素抗胰腺癌细胞生长不仅可以通过凋亡途径,亦可以通过对抑癌基因的去甲基化作用途径。
目前关于胰腺癌的抑癌基因甲基化研究方兴未艾,已报道的关于胰腺癌抑癌基因有CDKN1C、SPA、RC、TFPI-2、BNIP3、TSLC1、HHIP、MUC2、CXCR4、p16、RASSF1A、ppENK等,它们在胰腺癌组织中都有不同程度的甲基化,与其伴随的是相应的mRNA表达不同程度的缺失,其中研究最多的抑癌基因甲基化主要有p16、RASSF1A、ppENK。Ueki等[8]和Fukushima等[9]报道,超过90%的胰腺癌组织ppENK基因发生甲基化。Schutte等[10]报道,95%的胰腺癌p16基因失活,其中15%和甲基化有关。Moore等[11]报道,27%的胰腺癌细胞系p16基因发生甲基化。Dammann等[12]报道,64%原发性胰腺导管细胞癌、83%的胰腺内分泌肿瘤以及88%的胰腺癌细胞系RASSF1A基因发生甲基化,应用去甲基化药物5AzA-cdR处理胰腺癌细胞后,因去甲基化作用而失表达的ppENK、p16、RASSF1A得到不同程度的重新表达。
本研究的体内实验结果显示,大黄素、5AzA-cdR以及两者联合用药可以抑制裸鼠移植瘤的生长,两者联合用药的抑制作用最强;移植瘤组织p16、RASSF1A、ppENK 3个抑癌基因启动子区高度甲基化状态得到不同程度的逆转,5AzA-cdR去甲基化作用较大黄素强,联合用药的作用更强,同时p16、RASSF1A、ppENK mRNA和蛋白的表达均增加,5AzA-cdR的作用强于大黄素,联合用药的作用又强于单独用药,此发现为大黄素治疗胰腺癌的机制研究提供了一个新的思路。
参 考 文 献
[1] 李慧超, 王宁, 郑荣寿,等. 中国2010年胰腺癌发病和死亡分析[J]. 中国肿瘤, 2015, 24(3):163-169.DOI:10.11735/j.issn.1004-0242.2015.03.A001.
[2] Miranda TB, Jones PA. DNA methylation: the nuts and bolts of repression[J]. J Cell Physiol, 2009, 213(2):384-390.
[3] Cheng X, Blumenthal RM. Mammalian DNA methyltransferases: a structural perspective[J]. Structure, 2008, 16(3):341-350.DOI: 10.1016/j.str.2008.01.004.
[4] Brueckner B, Kuck D, Lyko F. DNA methyltransferase inhibitors for cancer therapy[J]. Cancer Journal, 2007, 13(1):17-22.
[5] Zhang H, Chen L, Bu HQ, et al. Effects of emodin on the demethylation of tumor-suppressor genes in pancreatic cancer PANC-1 cells[J]. Oncol Rep, 2015, 33(6):3015-3023.DOI: 10.3892/or.2015.3914.
[6] 陈亮, 郭敬强, 林胜璋,等. 大黄素对胰腺癌细胞抑癌基因P16、RASSF1A去甲基化作用研究[J]. 肝胆胰外科杂志, 2014, 26(4):312-316.
[7] Pan FP, Zhou HK, Bu HQ, et al. Emodin enhances the demethylation by 5-Aza-CdR of pancreatic cancer cell tumor-suppressor genes P16, RASSF1A and ppENK[J]. Oncology Rep, 2016, 35(4):1941-1949.DOI: 10.3892/or.2016.4554.
[8] Ueki T, Toyota M, Skinner H, et al. Identification and characterization of differentially methylated CpG islands in pancreatic carcinoma[J]. Cancer Res, 2001, 61(23):8540-8546.
[9] Fukushima N, Sato N, Ueki T, et al. Aberrant methylation of preproenkephalin, and p16, genes in pancreatic intraepithelial neoplasia and pancreatic ductal adenocarcinoma[J]. Am J Pathol, 2002, 160(5):1573-1581.
[10] Schutte M, Hruban RH, Geradts J, et al. Abrogation of the Rb/p16 tumor-suppressive pathway in virtually all pancreatic carcinomas[J]. Cancer Res, 1997, 57(15):3126-3130.
[11] Moore PS, Sipos B, Orlandini S, et al. Genetic profile of 22 pancreatic carcinoma cell lines[J]. Virchows Archiv, 2001, 439(6):798-802.
[12] Dammann R, Schagdarsurengin U, Liu L, et al. Frequent RASSF1A promoter hypermethylation and K-ras mutations in pancreatic carcinoma[J]. Oncogene, 2003, 22(24):3806-3812.

