IL-27在小鼠结肠炎中的作用及对NLRP3炎性小体的影响*
张目涵,周力为,贺 欣,路 瑶,赵美华,马 娜,冯百岁
(郑州大学第二附属医院消化内科, 炎症性肠病中心, 吴阶平医学基金会中国炎症性肠病联盟河南省炎症性肠病中心, 河南 郑州 450014)
炎症性肠病(inflammatory bowel diseases,IBD)包括克罗恩病(Crohn disease,CD)和溃疡性结肠炎(ulcerative colitis,UC),是以反复发作与缓解为特征的慢性非特异性肠炎。近年来亚洲的发病率飙升,但具体发病机制尚不明确,可能与免疫、环境、感染和遗传有关。免疫反应中各种细胞因子发挥了主要作用。最近研究发现白细胞介素27(interleukin-27,IL-27)在感染、肿瘤和自身免疫性疾病中可激活淋巴和非淋巴细胞发挥免疫调节功能,属于IL-6/IL-12家族中的一员,主要由单核吞噬细胞合成[1]。研究发现IL-27既可促进初始CD4+T细胞向Th1分化[2],又可抑制Th2和Th17免疫反应[3]。NLRP3炎性小体由NOD样受体蛋白 3(NOD-like receptor protein 3,NLRP3)、caspase-1和含CARD的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)构成,同样参与固有免疫调节,其中活化的caspase-1可促进IL-1β和IL-18前体的加工剪切为其成熟形式,具有强大的促炎作用[4]。近年来研究表明,NLRP3炎性小体在感染及自身免疫性疾病中,对免疫反应的调节发挥重要作用[5]。因此,我们通过观察不同剂量的IL-27对葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的结肠炎小鼠结肠组织,以及对NLRP3炎性小体的影响,从而探究IL-27在IBD发病中的作用及可能的作用机制。
材 料 和 方 法
1 材料
SPF级雄性C57BL/6小鼠48只,6~8周龄(北京维通利华实验动物技术有限公司);DSS(36~50 kD;MP Biomedicals);重组IL-27注射液(eBioscience);抗NLRP3、caspase-1和IL-1β抗体(Santa Cruz);第一链 cDNA 合成试剂盒和SYBR Green Ⅰ荧光定量 PCR 试剂盒(成都福际生物技术有限公司);IL-1β和IL-18 ELISA 试剂盒(达科为);总RNA提取剂Trigol(北京鼎国昌盛生物技术有限责任公司);RIPA裂解液(北京雷根生物技术有限公司)。
2 方法
2.1动物实验分组与标本处理 雄性C57BL/6小鼠48只随机分为4组,每组12只。对照(control)组自由进食水,不进行干预;DSS组给予蒸馏水配制的3% DSS溶液自由饮用10 d;低剂量IL-27(500 ng IL-27)组除自由饮用3% DSS溶液以外,用500 ng IL-27溶于300 μL去离子水中每日给予小鼠腹腔注射;高剂量IL-27(1 μg IL-27)组除自由饮用3% DSS溶液以外,用1 μg IL-27 溶于300 μL去离子水中每日给予小鼠腹腔注射。观察小鼠体重变化、粪便性状及便血情况,根据McCarthy等[6]在文献中制定的疾病活动指数(disease activity index,DAI)评分标准评估炎症程度。第12天将小鼠用颈椎脱臼法处死,取眼眶动静脉血后离心,取血清保存在-20 ℃冰箱中为ELISA检测做准备。取结肠组织部分液氮迅速冻存后保存于-80 ℃冰箱作为qPCR及Western blot检测的标本;部分经4%多聚甲醛固定,石蜡包埋用于病理观察。
2.2结肠组织标本的HE染色 石蜡包埋后连续5 μm连续切片,所有切片均经过脱蜡,梯度乙醇脱水,苏木素染色,盐酸乙醇分化,伊红液染色,常规脱水,封片,根据Dieleman等[7]在文献中制定的标准对组织行组织损伤指数(histological index,HI)评分。
2.3免疫组化检测肠上皮组织中NLRP3的表达 所有蜡块经脱蜡,水化后,枸橼酸盐缓冲溶液于压力锅中加热5 min高压修复抗原,3% H2O2灭活内源性过氧化物酶,5%山羊血清封闭10 min后加 I 抗,4 ℃过夜。后标本于室温下PBS缓冲液冲洗,加生物素标记的 II 抗10 min后用PBS缓冲液,加辣根过氧化物酶标记的链霉卵白素10 min后用PBS缓冲液。DAB显色10 min,苏木素复染,乙醇脱水后封片。显微镜观察,结果以细胞核或细胞质有棕黄色颗粒为阳性细胞。评分标准:按阳性细胞数所占百分比评分,≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分;按染色强度评分,没有染色为0分,浅黄色为1分,棕黄色为2分,深呈棕色为3分。将两项得分相乘,0 分为阴性(-),1~4 分为弱阳性(+),5~8 分为阳性(++),9~12 分为强阳性(+++)。
2.4qPCR检测肠道组织NLRP3和IL-1β的mRNA表达 首先提取肠道组织总RNA,在液氮中研磨组织,按照Trigol试剂说明书逐步加入氯仿、异丙醇和乙醇等提取后用50 μL ddH2O溶解RNA样品,提取后的产物用琼脂凝胶电泳检测纯度,用紫外光分光光度检测浓度。然后合成第一链cDNA,根据mRNA浓度,按试剂盒说明书分别加2×RT、随机引物、RNA模板和RNase-free ddH2O,逆转录为cDNA,取反应物用于PCR,NLRP3、IL-1β及内参照β-actin的引物序列见表1,反应体系包括2× RealPCR 10 μL、上下游引物各0.8 μL、cDNA模板1 μL、50×ROX reference dye 1 μL和DNase-free ddH2O 6.4 μL,共20 μL。反应条件:95 ℃ 3 min; 95 ℃ 5 s, 60 ℃ 30 s,循环数40次。采用2-ΔΔCt法对各个基因的相对表达量进行计算。

表1 引物序列Table 1. Sequences of the primers
2.5Western blot检测肠道组织caspase-1表达 称取结肠组织40 mg剪碎,加RIPA裂解液(含PMSF)400 μL,于冰上裂解10 min,4 ℃、12 000 r/min 离心10 min,取上清液,并用BCA法检测蛋白浓度。将检测好浓度的蛋白样品溶解后加入配置好的SDS-PAGE凝胶,在电泳槽中加入电泳缓冲液,100 V 20 min, 150 V 1 h。5%脱脂奶粉TBST溶液封闭1 h后加 I 抗,4 ℃过夜,洗涤5 min,共3次,加入 II 抗,室温2 h,洗涤5 min,共5次。加入发光液后进行灰度分析。
2.6血清IL-1β和IL-18的ELISA检测 根据标准品稀释,加样,温育,加酶,温育,洗涤,显色后终止反应,测定IL-1β和IL-18。
3 统计学处理
所有实验数据采用SPSS 13.0统计软件进行分析,计量数据采用均数±标准差(mean±SD)描述,用Levene检验方法进行方差齐性分析,多组数据采用单因素方差分析(one-way ANOVA),对方差分析有意义者行SNK-q法进行两两比较。以P<0.05为差异有统计学意义。描述变量之间的关系采用Pearson相关分析。
结 果
1 各组小鼠一般状况、DAI评分、结肠组织的HE染色及HI评分
对照组小鼠表现活跃,大便成形,体重逐步上升;DSS模型组第4天,小鼠开始出现活跃度下降,软便,体重呈下降趋势,第5天出现肉眼血便,体重明显下降IL-27 (1 μg)组第5天出现稀便,第7天出现肉眼血便,体重下降程度明显小于DSS模型组。各组小鼠DAI评分结果见表2。
取小鼠结肠组织做HE染色及HI评分,镜下表现示对照组小鼠结肠组织黏膜完好,腺体结构正常,未见炎性细胞浸润;DSS模型组可见大片糜烂、溃疡,黏膜组织结构破坏严重,正常腺体结构消失,黏膜层炎性细胞浸润;高剂量IL-27组黏膜上皮基本完整,腺体基本排列规则,可见上皮层小片状坏死,黏膜层少量淋巴细胞浸润;低剂量IL-27组与DSS模型组类似。4组的HE染色见图1,HI 评分结果见表2。

Figure 1. HE staining of mouse colonic sections in four groups (×100).
图1各组小鼠结肠组织HE染色
2 免疫组织化学检测肠组织NLRP3的表达
对照组小鼠肠道黏膜可见少量NLRP3阳性细胞,染色强度较弱;模型组小鼠肠道黏膜层可见大量阳性细胞; 高剂量IL-27组NLRP3表达较模型组明显下调(P<0.05);低剂量IL-27组较模型组稍下调。NLRP3免疫组化结果见图2,各组NLRP3阳性染色的百分比见表2。

Figure 2. The expression of NLRP3 in mouse colonic tissues (×400).
图2NLRP3在小鼠结肠组织中的表达
表2各组小鼠DAI评分、HI评分和结肠组织NLRP3蛋白表达的阳性率
Table 2. The DAI score, HI score and positive rate of NLRP3 protein expression in mouse colonic tissues in the four groups (Mean±SD.n=12)

GroupDAI scoreHI score NLRP3 positive (%)Control1.48±0.300.49±0.310.75±0.75DSS7.86±0.97∗6.52±0.67∗9.16±1.4∗IL-27(500 ng)7.83±1.19∗6.41±0.91∗8.17±1.12∗IL-27(1 μg)6.61±0.92∗#4.68±0.64∗#6.10±1.6∗#
*P<0.05vscontrol group;#P<0.05vsDSS group.
3 qPCR检测结肠组织NLRP3和IL-1β mRNA的表达
qPCR结果显示,模型组中NLRP3和IL-β的mRNA表达水平高于对照组,高剂量 IL-27组低于模型组,差异均有统计学意义(P<0.05);低剂量 IL-27 组与模型组对比差异无统计学显著性。各组NLRP3和IL-1β的mRNA在结肠的相对表达量见图3。
4 Western blot检测结肠组织caspase-1的蛋白表达
Western blot结果示,模型组中cleaved caspase-1蛋白水平高于对照组, 高剂量IL-27组低于模型组,差异有统计学意义(P<0.05),低剂量IL-27组与模型组相比差异无统计学显著性,见图4。

Figure 3. The mRNA expression of NLRP3 and IL-1β in colonic tissues. Mean±SD.n=12.*P<0.05vscontrol group;#P<0.05vsDSS group.
图3NLRP3和IL-1β结肠组织中mRNA的表达
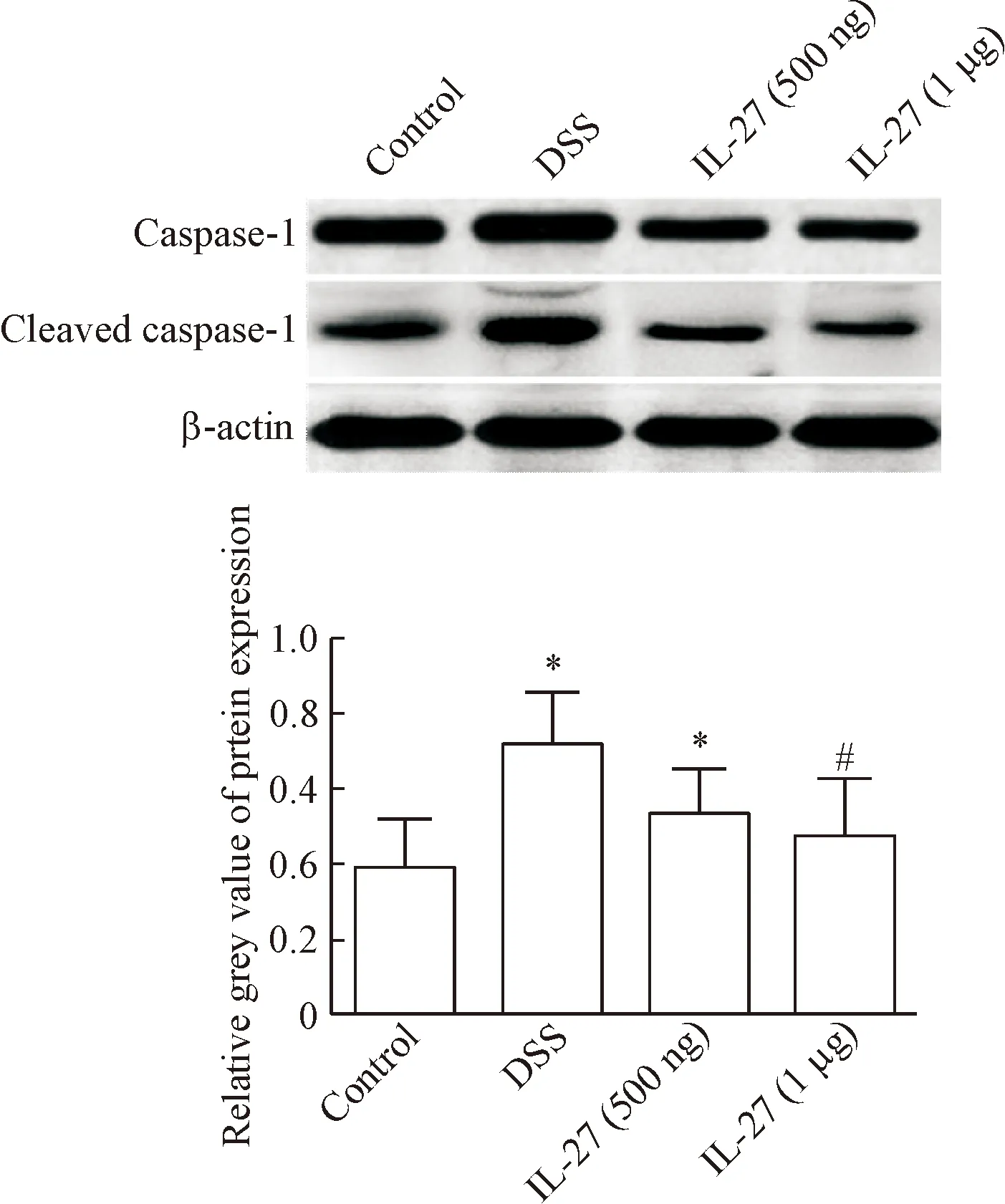
Figure 4. The protein expression of caspase-1 detected by Wes-tern blot. Mean±SD.n=12.*P<0.05vscontrol group;#P<0.05vsDSS group.
图4Westernblot检测caspase-1的蛋白表达
5 ELISA检测血清中IL-1β和IL-18的含量
ELISA结果显示,模型组血清中IL-1β和IL-18含量高于对照组,高剂量 IL-27 组低于模型组,低剂量IL-27 组同样低于模型组,差异有统计学意义(P<0.05),见表3。
表3小鼠血清IL-1β和IL-18含量的变化
Table 3. The IL-1β and IL-18 levels in the serum of mice (Mean±SD.n=12)

GroupIL-1βIL-18 Control102.00±6.5070.20±7.04 DSS118.00±2.70∗86.50±7.79∗ IL-27 (500 ng)89.20±4.32#73.40±6.47∗# IL-27 (1 μg)86.00±4.36#69.30±5.08∗#
*P<0.05vscontrol group;#P<0.05vsDSS group.
讨 论
炎症性肠病是一组以反复发作与缓解为特征的慢性非特异性肠炎。尽管其发病机制尚不明确,但目前普遍认为是由环境因素,遗传易感性、免疫异常反应和感染等多种因素共同引起的,其中自身异常免疫反应是主要的致病因素[8]。
IL-27是近期发现的IL-6/IL-12家族的细胞因子,可参与多种自身免疫性疾病,如多发性硬化、类风湿性关节炎、系统性红斑狼疮、银屑病和炎症性肠病等[9],然而在炎症性肠病中的作用尚不明确。有研究发现在炎症发生早期IL-27可诱发初始CD4+T细胞向Th1型细胞分化,从而促进干扰素γ(inter-feron-γ,IFN-γ)产生,还可增加NK细胞、CD8+T细胞、单核细胞和肥大细胞的活化,产生IFN-γ、IL-18肿瘤坏死因子(tumor necrosis factor,TNF)等炎性细胞因子,从而发挥促炎症作用[10-11]。然而在炎症持续发展过程中,IL-27可抑制Th17及Th2应答,促进Treg细胞中Th1细胞的分化,分泌Th1细胞的特异性抑炎因子IL-10[12-15]。因此IL-27既可促进炎症反应又可抑制炎症反应,具有双向调节的作用。本实验研究了IL-27对DSS诱导的结肠炎模型的影响。实验中我们分别用低剂量IL-27(500 ng)及高剂量IL-27(1 μg)干预DSS诱导的结肠炎小鼠,可以看到低剂量IL-27组小鼠血便、体重下降等情况无明显好转,镜下表现与模型组相比无明显变化;而高剂量IL-27干预后临床症状可减轻,一定程度上缓解了结肠炎的发展,镜下表现黏膜上皮基本完整,腺体排列基本规则,仅有少量炎性细胞浸润。因此初步说明了IL-27对结肠炎有一定的缓解作用。
NLRP3炎性小体是目前研究较为深入的炎性小体,在免疫和炎症反应中起重要作用,其是由NLRP3、caspase-1和ASC构成的多蛋白复合物[16]。前体caspase-1(procaspase-1)活化后可促进巨噬细胞等炎症细胞的趋化因子及促炎因子的活化成熟和分泌[17]。ASC是炎性小体重要的衔接蛋白,利用其N端的热蛋白结构域和C端的CARD结构域招募NLRP3和pro caspase-1,从而组装成NLRP3炎性小体。目前对炎性小体激活的机制还不是十分明确,可能为各种内外源性配体信号通过K+外流、合成大量的活性氧簇和细胞内ROS累积等激活NLRP3炎性小体[7,18-19]。激活的NLRP3炎性小体可促进IL-18及IL-1β的分泌。近期实验结果已证实成熟的IL-1β可通过NLRP3炎性小体促进肠道炎症反应[20]。又有研究发现IL-1β可通过促进IL-17A分泌的固有淋巴细胞和CD4+Th17 细胞的聚集调节肠道慢性炎症[21]。同时还有研究发现在结肠黏膜组织中的IL-18可抑制杯状细胞的成熟导致肠道功能障碍[22]。以上研究均说明了NLRP3炎性小体及剪切活化的IL-1β和IL-18在结肠炎中主要起促炎作用。本实验结果也证实了在DSS模型小鼠中NLRP3和caspase-1表达量均增加,并且caspase-1剪切活化的IL-18及IL-1β同样增加。
有研究证实在自身免疫性疾病中,IL-27还可诱导调节树突状细胞的免疫调节分子CD39的表达,而CD39表达量的增加可降低细胞外ATP的浓度,从而抑制核苷酸依赖激活的NLRP3炎性小体[23]。但在结肠炎中,IL-27与NLRP3炎性小体的相关研究较少。因此我们进一步探究了IL-27是否可以通过影响NLRP3炎性小体的生成和激活从而影响结肠炎严重程度。我们在建立DSS结肠炎模型的基础上,通过免疫组织化学和qPCR在蛋白和基因水平检测了小鼠结肠黏膜NLRP3的表达。与对照组相比DSS模型组其表达量增高,高剂量IL-27干预后其表达量下降;而低剂量IL-27干预后无明显变化。同样检测IL-1β的mRNA在结肠炎小鼠中的表达增高,高剂量IL-27干预后可抑制其转录。因此该提示了IL-27可能是通过抑制NLRP3炎性小体的激活,从而抑制NLRP3及IL-1β的表达。Western blot结果显示DSS模型组小鼠肠黏膜中活化形式的caspase-1增高,经IL-27干预后caspase-1较模型组下降。进而检测小鼠血清中IL-1β和IL-18,模型组两者升高,而高剂量IL-27组抑制了其表达。因此我们推测,高剂量的IL-27可能是通过抑制NLRP3基因表达及活化的caspase-1蛋白的表达,减少NLRP3炎性小体的激活,从而抑制成熟的IL-1β、IL-18生成,减轻结肠炎的炎症反应。但低剂量的IL-27对结肠炎的缓解作用不明显,与DSS模型组差异无统计学显著性。因此说明了IL-27需达到一定剂量才会对结肠炎起缓解作用。
综上所述,本实验证实了当IL-27达到一定浓度时对结肠炎有一定的缓解作用,并且可影响NLRP3炎性小体的激活从而减轻炎症反应,因此可为临床治疗提供新的思路和靶向。
[参 考 文 献]
[1] Roewe J, Higer M, Riehl DR, et al. Neuroendocrine modulation of IL-27 in macrophages[J]. J Immunol, 2017, 199(7):2503-2514.
[2] Brombacher F, Kastelein RA, Alber G. Novel IL-12 family members shed light on the orchestration of Th1 responses[J]. Trends Immunol, 2003, 24(4):207-212.
[3] Do JS, Visperas A, Sanogo YO, et al. An IL-27/Lag3 axis enhances Foxp3+regulatory T cell-suppressive function and therapeutic efficacy[J]. Mucosal Immunol, 2016, 9(1):137-145.
[4] Dey N, Sinha M, Gupta S, et al. Caspase-1/ASC inflammasome-mediated activation of IL-1β-ROS-NF-κB pathway for control ofTrypanosomacruzireplication and survival is dispensable in NLRP3-/-macrophages[J]. PLoS One, 2014, 9(11):e111539.
[5] Kanneganti TD, Lamkanfi M, Núez G. Intracellular NOD-like receptors in host defense and disease[J]. Immunity, 2007, 27(4):549-559.
[6] McCarthy J, O’Mahony L, O’Callaghan L, et al. Double blind, placebo controlled trial of two probiotic strains ininterleukin 10 knockout mice and mechanistic linkwith cytokine balance[J]. Gut, 2003, 52(7):975-980.
[7] Dieleman LA, Palmen MJ, Akol H, et al. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines[J]. Clin Exp Imunol, 1998, 114(3):385-391.
[8] 梅 俏, 项 立, 赵宗豪, 等. 结肠炎大鼠结肠免疫功能的改变和褪黑素调节[J]. 中国病理生理杂志, 2004, 20(3):448-451.
[9] Meka RR, Venkatesha SH, Dudics S, et al. IL-27-induced modulation of autoimmunity and its therapeutic potential[J]. Autoimmun Rev, 2015, 14(12):1131-1141.
[10] Trinchieri G, Pflanz S, Kastelein RA. The IL-12 family of heterodimeric cytokines: new player in the regulation of T cell response[J]. Immunity, 2003, 19(5):641-644.
[11] Rosas LE, Satoskar AA, Roth KM, et al. Interleukin-27R(WSX-1/T cell cytokine receptor) gene-deficient micedisplay enhanced resistance to Leishmaniadonovani infection but develop severe liver immunopathology[J]. Am J Pathol, 2006, 168(1):158-169.
[12] Anderson CF, Stumhofer JS, Hunter CA, et al. IL-27 re-gulates IL-10 and IL-17 from CD4+cells in nonhealingLeishmaniamajorinfection[J]. J Immunol, 2009, 183(7):4619-4627.
[13] Perona-Wright G, Kohlmeier JE, Bassity E, et al. Persistent loss of IL-27 responsiveness in CD8+memory T cells abrogates IL-10 expression in a recall response[J]. Proc Natl Acad Sci U S A, 2012, 109(45):18535-18540.
[14] Greenhill CJ, Jones GW, Nowell MA, et al. Interleukin-10 regulates the inflammasome-driven augmentation of inflammatory arthritis and joint destruction[J]. Arthritis Res Ther, 2014, 16:419.
[15] Gurung P, Li B, SubbaraoMalireddi RK, et al. Chronic TLR stimulation controls NLRP3 inflammasome activation through IL-10 mediated regulation of NLRP3 expression and caspase-8 activation[J]. Sci Rep, 2015, 5:14488.
[16] Elliott EI, Sutterwala FS. Initiation and perpetuation of NLRP3 inflammasome activation and assembly[J]. Immunol, 2015, 265(1):35-52.
[17] Sutterwala FS, Haasken S, Cassel SL. Mechanism of NLRP3 inflammasome activation[J]. Ann N Y Acad Sci, 2014, 1319:82-95.
[18] Choi AJ, Ryter SW. Inflammasomes: molecular regulation and implications for metabolic and cognitive diseases[J]. Mol Cells, 2014, 37(6):441-448.
[19] Vyleta ML, Wong J, Magun BE. Suppression of ribosomal function triggers innate immunesignaling through activation of the NLRP3 inflammasome[J]. PLoS One, 2012, 7(5):e36044.
[20] Seo SU, Kamada N, Muoz-Planillo R, et al. Distinct commensals induce interleukin-1β via NLRP3 inflammasome in inflammatory monocytes to promote intestinal inflammation in response to injury[J]. Immunity, 2015, 42(4):744-755.
[21] Coccia M, Harrison OJ, Schiering C, et al. IL-1β mediates chronic intestinal inflammation, by promoting the accumulation of IL-17A secreting innate lymphoid cells and CD4+Th17 cells[J]. J Exp Med, 2012, 209(9):1595-1609.
[22] Nowarski R, Jackson R, Gagliani N, et al. Epithelial IL-18 equilibrium controls barrier function in colitis[J]. Cell, 2015, 163(6):1444-1456.
[23] Mascanfroni ID, Yeste A, Vieira SM, et al. IL-27 acts on DCs to suppress the T cell response and autoimmunity by inducing expression of the immunoregulatory molecule CD39[J]. Nat Immunol, 2013, 14(10):1054-1063.

