睡眠剥夺对小鼠脑内细胞型朊蛋白表达水平的影响及可能的意义
胡丽 由振东 李澎 金红阳 黄流清
细胞型朊蛋白(Cellular prion protein,PrPC)是在正常人体内表达的一种细胞膜蛋白,可表达于中枢神经系统、血液系统与淋巴系统等多个组织系统,以中枢神经系统最为丰富。目前研究发现,它可能具有多种的生理功能,如参与细胞黏附及跨膜信号转导、细胞凋亡与分化、抗氧化应激等过程;还可能与睡眠、记忆以及神经发育与保护有关[1]。淀粉样蛋白(beta-amyloid protein,Aβ)是由淀粉样前体蛋白(amyloid precusor protein,APP)代谢产生,有研究发现小鼠脑组织间液中Aβ水平与睡眠-觉醒周期之间存在相关性[2]。此外,有研究者提出PrPC可通过调节BACE1的活性而影响APP的代谢分解过程[3]。因此,本研究检测正常昼夜节律小鼠脑组织内PrPC表达的昼夜周期变化规律,并进一步检测睡眠剥夺后海马内PrPC与Aβ表达水平变化,旨在探讨PrPC在睡眠剥夺诱导的认知功能损害中可能的作用。
1 材料与方法
1.1 实验动物
(1)雄性C57BL/6小鼠(6周,第二军医大学实验动物中心提供)按体重大小排序,完全随机分为6组:建立正常睡眠一觉醒周期1周,以开灯时间(08∶00)为起点,每隔4 h,共6个时间点,分别为CT0、CT4、CT8、CT12、CT16、CT20(n=8);自由获取食物和水。每天08∶00点开灯,20∶00点熄灯(12 h光照,12 h黑暗);保持环境温度22~24 ℃,湿度50%~60%;(2)按体重大小随机分成睡眠剥夺组、环境对照组、正常对照组(n=6)。睡眠实验室适应1周,建立正常昼夜节律。在进行睡眠剥夺实验之前让小鼠在水平台上适应1周,每天适应1 h。
1.2 快速眼动睡眠剥夺
采用改良多平台睡眠剥夺法进行持续72h的快速眼动睡眠剥夺[4]。睡眠剥夺组使用的睡眠剥夺水槽(41 cm×34 cm×16.5 cm)包含12个水平台(平台直径3 cm,高度5 cm),各个平台之间间隔3 cm;小鼠在平台上可自由活动,正常获取食物和饮水;水槽内水平面位于平台平面下1 cm处,小鼠通过四肢抓站在平台上,进入REM期睡眠时四肢肌张力降低触水即醒,从而实现REM期睡眠剥夺。环境对照组使用大平台,大平台直径足够大,小鼠可以在上面睡觉。正常对照组的小鼠饲养在鼠笼中。
1.3 酶联免疫吸附试验
分别于6个设定时间断头处死小鼠,分离出海马、皮层在预冷PBS(0.01 mol/L,pH 7.0~7.2)中匀浆,离心后取上清;标本准备完毕后开始进行ELISA测验;朊蛋白检测试剂盒(SEB680Mu 96T)和Aβ1-42检测试剂盒(CEA946Mu 96T)都购买于美国CLOUD-CLONE公司。基本操作流程:加样、孵育、洗涤、加酶结合物、洗涤、显色、终止后自动酶标仪读值(OD490)及判定。
1.4 蛋白印迹实验
于72 h睡眠剥夺后断头处死小鼠,分离出海马在加入蛋白酶抑制剂cocktail(Roche公司,瑞士)的组织裂解液(武汉谷歌生物科技有限公司,中国武汉)中匀浆,然后离心,取上清;将上清与上样缓冲液混匀,煮沸15 min,使用SDS-PAGE凝胶电泳以12%分离胶电泳分离;然后转至硝酸纤维素膜上;10%的脱脂奶封闭后,加入一抗抗prp抗体(EP1802Y:1∶10000,Abcam公司,英国),4 ℃孵育过夜;二抗室温孵育1 h,最后用化学发光法曝光;条带的OD值用Image-J 2x图像分析软件测定,并使用GAPDH为内参。
1.5 余弦法生物节律分析
采用Halberg余弦节律分析法进行生物节律分析[5],即用余弦函数拟合周期性变化的时序数据。其拟合函数是y(t)=M+Acos(wt+ψ),式中M(Mesor)是中值,A(Amplitude)是振幅,ω是角频率ω=π(π是周期,t是采样时间,ψ是峰值时相)。一般情况下P≤0.05,则证明确实存在节律性,A/M比率越高,节律性越强。
1.6 统计学处理
计量数据用均数±标准误(χ±SEM)表示,按时间节点获得数据采用重复测量方差分析,睡眠剥夺后组间比较采用单因素方差分析、两两比较用LSD-T检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 海马与皮层PrPC与Aβ表达水平的昼夜节律变化
C57B6/L小鼠24 h正常睡眠-觉醒周期中的6个时间点海马与皮层Aβ表达水平发生具有明显差异的波动性变化(F=3.247,P<0.05),而组间无明显差异(F=1.269,P>0.05)。其中,海马Aβ表达水平于睡眠期间CT4(12∶00)达到低谷,而后逐渐升高,觉醒时保持相对稳定水平。海马与皮层PrPC水平均于夜间出现短暂高峰期,分别是CT20(4∶00)与CT16(24∶00),但是此变化无明显差异(F=1.314,P>0.05)。单余弦分析显示海马Aβ表达水平具有昼夜节律变化(F=26.72,P<0.05),皮层Aβ表达水平波动性变化无明显昼夜节律性(F=1.885,P>0.05);PrPC在皮层具有昼夜节律性 (F=11.22,P<0.05),海马PrPC表达水平波动性变化无明显昼夜节律性(F=6.232,P>0.05)(图1~2)。
2.2 睡眠剥夺后海马PrPC与Aβ表达水平的变化
睡眠剥夺后睡眠剥夺组海马PrPC的表达水平(0.22±0.05)较正常对照组(0.64±0.16)和环境对照组(0.58±0.09)明显下调(F=4.366,P<0.05)。睡眠剥夺组Aβ的表达水平(13.03±0.71)较正常对照组(8.22±0.8)和环境对照组(8.6±0.57)明显上调(F=14.511,P<0.05)(表1~2、图3~4)。
3 讨 论
昼夜节律是指人体生命活动以24 h为周期的动态变化,其产生的基础是生物钟基因的昼夜节律性表达。人体许多生命活动如激素分泌、细胞分化与凋亡、睡眠活动等都存在昼夜节律性[6-7]。哺乳动物的昼夜节律有多种生物钟基因来调控,这些生物钟基因主要位于下丘脑视交叉上核(suprachiasmatic nucleus,SCN)。
体内许多组织代谢、功能、蛋白表达等生命活动都具有昼夜节律性。PrPC是在正常人体内表达的一种细胞膜蛋白,可表达于中枢神经系统、血液系统与淋巴系统等多个组织系统,它可能具有多种生理功能,有研究者提出PrPC的表达跟睡眠之间存在关联,也可能具有昼夜节律性。有人对此进行了初步探讨。Tobler等对体内PrPC基因敲除小鼠进行睡眠监测发现,与野生型小鼠比较,基因敲除小鼠的睡眠结构发生变化,出现显著地睡眠片段化,觉醒次数增多以及非快速动眼睡眠期(non-REM sleep,NREMS)周期缩短[8-9]。Cagampang等利用放射自显影技术检测大鼠前脑组织内(视交叉上核、顶叶皮层、尾状壳核等)PrPCmRNA表达水平发现,PrPCmRNA表达水平在CT14或ZT14出现短暂高峰期,而且高峰期的出现与觉醒的增加无关, 提示体内PrPCmRNA表达水平可能存在昼夜节律变化[10]。临床上也观察到,很多研究发现致死性家族性失眠患者大部分生理节律发生较大变化[11-12],因此提出PrPC与睡眠-觉醒以及睡眠结构之间存在相关性。本研究采用ELISA方法检测小鼠海马、顶叶皮层PrPC表达水平,使用单余弦分析显示顶叶皮层PrPC表达水平具有昼夜节律变化,PrPC的表达水平在CT16出现短暂高峰期。这进一步佐证了小鼠皮层PrPC的表达水平具有昼夜节律变化。

图1 海马、皮层PrPC和Aβ在24 h正常睡眠-觉醒周期实际表达水平变化 CT0为开灯时间(08∶00)

图2 PrPC和Aβ在皮层和海马的余弦拟合曲线 CT0为开灯时间(08∶00)
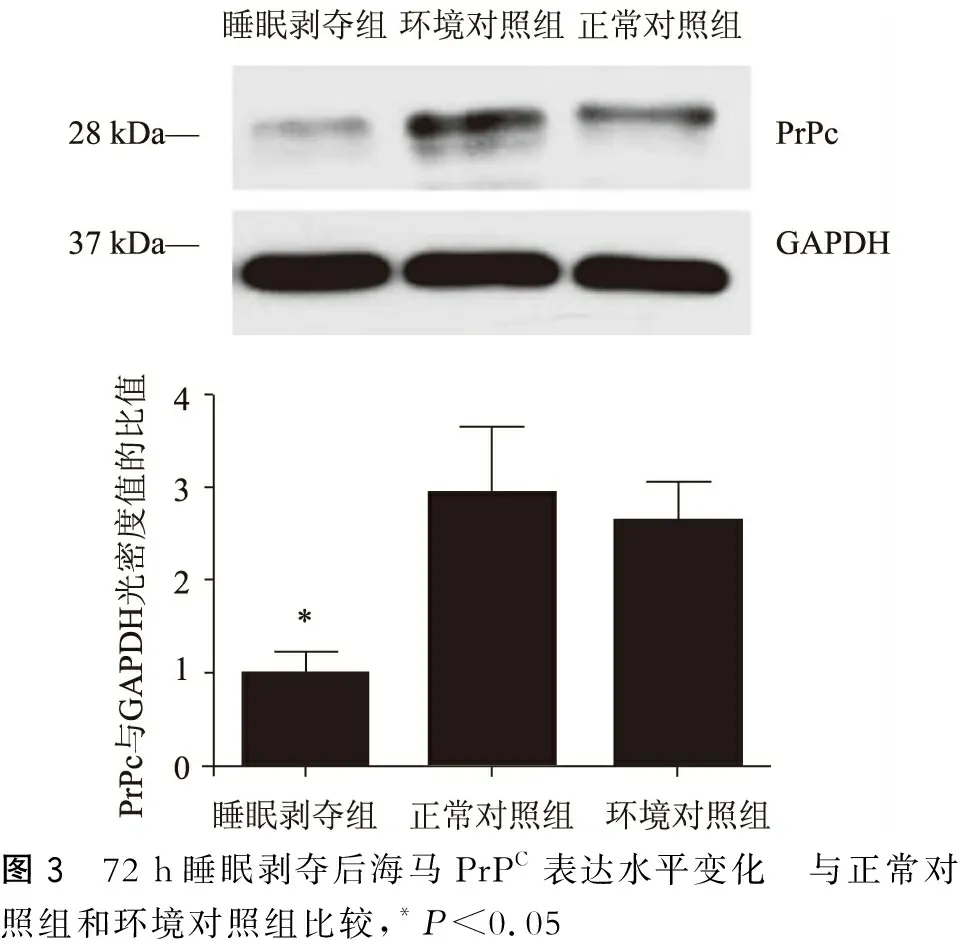
图3 72 h睡眠剥夺后海马PrPC表达水平变化 与正常对照组和环境对照组比较,*P<0.05

图4 72 h睡眠剥夺后海马Aβ表达水平变化 与正常对照组和环境对照组比较,*P<0.01

表1 睡眠剥夺后海马PrPC表达水平变化
注:与正常对照组和环境对照组比较,*P<0.05
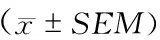
表2 睡眠剥夺后海马Aβ表达水平变化
注:与正常对照组和环境对照组比较,*P<0.05
睡眠是人体必不可少的生命活动,并在大脑功能活动中发挥重要作用,尤其是认知功能,可促进大脑内神经毒性代谢产物的清除以及学习记忆相关突触的形成与维护[13-14]。目前研究已证实睡眠剥夺可诱导认知功能损害,特别是海马依赖的学习记忆显著损害[15-16]。Aβ是APP在β-分泌酶(β-secretase 1,BACE1)作用下分解代谢产生,机体内Aβ的产生和清除之间存在相对平衡,这个平衡的破坏可能是多种神经系统疾病的发病机制—Aβ在胞外沉积形成老年斑是AD发病的主要病理过程。Kang等通过动物实验证实Aβ的产生和清除与睡眠-觉醒周期之间有密切关系—胞外Aβ在觉醒期呈现高水平,睡眠期呈现低水平,急性睡眠剥夺后Aβ表达水平升高[17]。本研究检测正常小鼠海马和皮层内Aβ表达水平发现24 h正常睡眠-觉醒周期中Aβ表达水平发生具有统计学意义的波动性变化。单余弦分析显示海马内Aβ表达水平具有昼夜节律变化,余弦曲线显示海马内Aβ的表达水平在睡眠期呈现低水平,而在觉醒期呈现高水平,这与目前的研究基本相符。在此基础上本研究进一步观察发现72 hREM期睡眠剥夺后海马Aβ表达水平升高,这可能与睡眠剥夺后认知功能损害有密切关联。目前,在体外细胞实验中已证实PrPC可通过作用于关键酶BACE1,调节APP的分解,从而影响Aβ的产生[18-19]。结合本研究结果发现睡眠剥夺后海马PrPC表达水平下调, Aβ表达水平升高。PrPC基因敲除小鼠脑组织内Aβ表达水平明显高于野生型小鼠[20]。因此,本研究推测睡眠剥夺诱导认知功能损害机制,即由于睡眠剥夺后PrPc表达下调而对BACE1的抑制作用减弱,使APP分解产生Aβ增多,进而引起认知功能损害。
基于脑组织内PrPC表达水平存在昼夜周期规律变化,睡眠剥夺后海马PrPC与Aβ表达水平变化提示PrPC在睡眠剥夺诱导的认知功能损害中可能起到影响Aβ表达的桥接作用,有望成为AD治疗的新靶点之一,值得进一步研究。
[1] Rafael L,Martins VR,Marco AP,et al.Physiology of the prion protein[J].Physiol Rev,2008,2(88):673-728.
[2] Jae-Eun K,Miranda ML,Randall JB,et al.The Sleep-Wake cycle amyloid- dynamics are regulated by orexin and the Sleep-Wake cycle[J].Science,2009,326(13):1005-1007.
[3] Parkin.Watt NT,hussain I,et al.cellular prion protein regulates beta-secretase cleavage of the alzheimer's amyloid precursor protein[J].Proc Natl Acad Sci U S A,2007,104(26):11062-11067.
[4] S-Nunes A,Bizzarro B,Egydio F,et al.The dual effect of paradoxical sleep deprivation on murineimmune functions[J].J Neuroimmunol,2016,290:9-14.
[5] Nelson W,Tong YL,Lee JK,et al.Methods for cosinor rhyth-mometry Chronobiology[Z],1979:305.
[6] Panda S,Antoch MP,Miller BH,et al.Coordinated transcription of key pathways in the mouse by the circadian clock[J].Cell,2002,109(3):307-320.
[7] Baggs JE,Price TS,Ditacchio L,et al.Network features of the mammalian circadian clock[J].PLoS Biol,2009,7(3):563-575.
[8] Tobler I,Gaus SE,Deboer T,et al.Altered circadian activity rhythms and sleep in mice devoid of prion protein[J].Nature,1996,380(6575):639-642.
[9] Tobler I,Deboer T,Fischer M.Sleep and sleep regulation in normal and prion protein-deficient mice[J].Journal of Neuroscience,1997,17(5):1869-1879.
[10] Caganpang F,Whatley S,Mitchell AL,et al.Circadian regulation of prion protein messenage RNA in the forebrain:a widespread and synchronous rhythm[J].Neuroscience,1999,91(4):1201-1204.
[11] Fiorino AS.Sleep, genes and death: Fatal familial insomnia[J].Brain Res Rev,1996,22(3):258-264.
[12] Sforza E,Montagna P,Tinuner P,et al.Sleep-wake cycle abnormalities in fatal familial insomnia.Evidence of the of the thalamus in sleep regulation[J].Electroencephalogr Clin Neurophysiol,1995,94:398-405.
[13] Xie L,Kang H,Xu Q,et al.Sleep drives metabolite clearance from the adult brain[J].Science,2013,342(6156):373-377.
[14] Yang G,Lai CS,Cichon J,et al.Sleep promotes branch-specific formation of dendritic spines after learning[J].Science,2014,344(6188):1173-1178.
[15] Xie ML,Yan J,He C,et al.Short-term sleep deprivation impairs spatial working memory and modulates expression levels of ionotropic glutamate receptor subunits in hippocampus[J].Behav Brain Res,2015,286:64-70.
[16] Xie ML,Chao L,Chao H,et al.Short-term sleep deprivation disrupts the molecular composition of ionotropic glutamate receptors in entorhinal cortex and impairs the rat spatial reference memory[J].Behav Brain Res,2016,300:70-76.
[17] Jae-Eun K,Miranda ML,Randall JB,et al.Amyloid-b dynamics are regulated by orexin and the Sleep-Wake cycle[J].Science,2009,11(13):1005-1007.
[18] Parkin.Watt NT,hussain I,eckman EA,eckman CB,manson JC,et al.cellular prion protein regulates beta-secretase cleavage of the alzheimer's amyloid precursor protein[J].Proc Natl Acad Sci U S A,2007,104:11062-11067.
[19] Parkin ET,Watt NT,Hussain I,et al.Cellular prion protein regulates beta-secretase cleavage of the Alzheimer's amyloid precursor protein[J].Proc Natl Acad Sci U S A,2007,104(26):11062-11067.
[20] Griffiths HH,Whitehouse IJ,Baybutt HA,et al.Prion protein interacts with BACE1 protein and differentially regulates its activity toward wild type and Swedish mutant amyloid precursor protein[J].J Biol Chem,2011,286(38):33489-33500.

