草氨酸钠抑制乏氧鼻咽癌细胞CNE2血管紧张素Ⅱ生成提高放射敏感性
程坦 郑杰灵 刘颖 谢国柱 袁亚维
南方医科大学南方医院放疗科(广州510515)
鼻咽癌(nasopharyngeal carcinoma)是鼻咽部起源的最常见的恶性肿瘤,好发于中国东南部、东南亚地区,并以广东最为高发[1]。目前,放射治疗(放疗)或以放疗为主的综合治疗是鼻咽癌的主要治疗手段。虽然初诊未转移鼻咽癌患者综合治疗后5年生存率已接近85%左右,但仍有部分患者因局部复发或肿瘤转移未能获得长期生存[2-3]。包括鼻咽癌在内的大多数实体瘤中广泛存在乏氧,乏氧也被公认为是肿瘤对包括放疗在内的多种治疗手段抵抗的重要原因。因此,改善肿瘤组织内乏氧的肿瘤细胞的放射抵抗对提高鼻咽癌患者的放疗疗效具有重要的意义[4-5]。肿瘤细胞即使在有氧条件下,仍然主要通过糖酵解获取能量[6]。乳酸脱氢酶(lactate dehydrogenase,LDH)是催化肿瘤细胞胞浆中乳酸生成的糖酵解的关键酶之一。以往研究表明LDH-A抑制剂草氨酸钠对体外常氧培养的胃癌、肺癌细胞有一定的生长抑制作用。但草氨酸钠对乏氧鼻咽癌细胞的增殖以及放射敏感性的影响却罕见报道。在此笔者使用草氨酸钠干预体外乏氧培养的人鼻咽癌细胞CNE2,观察其对细胞增殖、放射敏感性的影响,初步探讨其潜在机制,为进一步的体内研究奠定了基础。
1 材料与方法
1.1 主要试剂与仪器 显微镜(日本Olympus公司);人鼻咽癌细胞CNE2为南方医科大学南方医院放疗科实验室冻存;RPMI-1640培养基、0.25%胰酶(美国Gibco公司);南美胎牛血清(美国Gibco公司);PBS溶液(美国Hyclone公司);100X青链霉素溶液(美国Gibco公司);草氨酸钠(上海麦克林生化科技有限公司),纯度>98%;乳酸测定试剂盒(南京建成生物科技有限公司);人血管紧张素ⅡELISA试剂盒(美国Ray Biotech公司);DMSO、MTT粉剂(美国Sigma公司);酶标仪(美国Thermo公司)。
1.2 实验方法
1.2.1 细胞培养 人鼻咽癌CNE2细胞株采用含10%胎牛血清RMPI-1640培养液置5%CO2,37℃孵箱培养,待细胞进入对数生长期用PBS溶液清洗2次,然后0.25%胰酶消化,终止消化后反复吹打为单细胞悬液,计数后平铺置96孔板、6孔板或培养皿内继续培养准备后续实验。细胞乏氧时,将贴壁后的细胞置于充满5%CO2、95%N2混合气体,O2浓度维持在1%的37℃孵箱中继续培养。
1.2.2 细胞内乳酸含量测定 向常氧、乏氧条件下培养的已贴壁的CNE2鼻咽癌细胞培养皿中加入草氨酸钠溶液(草氨酸钠终浓度为20 mmol/L),对照组加入等体积的PBS。培养48 h后吸去培养基,用PBS液清洗2次,然后用0.25%胰酶消化,终止消化后1 000 r/min离心5 min得沉淀的细胞。用PBS重悬清洗细胞后再次离心,向装有细胞的EP管中加入已预冷的生理盐水并置于冰上匀浆。将制备好的匀浆4℃3 000 r/min离心15 min,吸取上清并按乳酸测定试剂盒说明书要求操作测定乳酸含量。
1.2.3 上清中血管紧张素Ⅱ含量测定 在24孔板内接种2×105个/孔状态良好的肿瘤细胞,并加入1 mL培养基,待细胞贴壁后,实验组和对照组分别接受20 mmol/L和等体积PBS处理,乏氧培养24 h后吸取培养基上清至离心管内,按照血管紧张素Ⅱ检测试剂盒说明书步骤测定上清中血管紧张素Ⅱ含量。
1.2.4 四氮噻唑蓝(MTT)实验 接种于96孔板的细胞乏氧条件培养12 h后分别加入经培基稀释的不同浓度草氨酸钠(终浓度分别为30、60、90 mmol/L),同时设置对照组(加入等体积的培养液),各组均设置6个复孔,置孵箱中继续乏氧培养,药物作用24、48、72 h后,取出相应的96孔板每孔分别加入5 mg/mL的MTT 20 μL,继续培养4 h。吸弃各孔液体,每孔加入150 μL DMSO,振荡待蓝色晶体溶解后酶标仪于490 nm波长处检测每孔的吸光度(A490)值,确定药物对肿瘤细胞的抑制率。计算细胞生长抑制率:细胞生长抑制率(%)=(1-实验组OD值/对照组OD值)×100%。
1.2.5 平板克隆形成实验(colony formation assay)检测细胞的放射敏感性[7]用0.25%胰蛋白酶消化对数生长期的CNE2鼻咽癌细胞,制成单细胞悬液,以每孔200、400、2 000、4 000、和10 000个细胞接种于六孔板中,每个剂量接种3个复孔。待细胞贴壁后,草氨酸钠组和对照组分别用20 mmol/L草氨酸钠溶液和PBS液继续培养24 h并给予0、2、4、6、8 Gy的6 MV X线满射野照射。照射后继续培养9 d,取出培养皿,弃去培养液,用1XPBS清洗2次,甲醛固定15 min。弃去固定液并用0.1%结晶紫染色并在显微镜下技术大于50个细胞的克隆。以0 Gy组克隆形成率为对照,计算出各个剂量组的细胞存活率。克隆形成率(PE)=对照组克隆数(0 Gy组克隆数)/接种细胞数×100%,存活分数(SF)=实验组克隆数/(接种细胞数×PE)。
1.3 统计学方法 数据统计分析采用SPSS 18.0软件进行,实验结果以均数±标准差表示。两组间比较采用两独立样本t检验,多组样本的比较采用单向方差分析,当P<0.05时认为差异具有统计学意义。
2 结果
2.1 草氨酸钠抑制CNE2细胞乳酸的生成 细胞内乳酸水平检测结果显示,即使在常氧条件下,CNE2细胞内也有较多的乳酸积累,乏氧条件下乳酸水平进一步提升。加入草氨酸钠处理后,两种条件下的CNE2细胞乳酸水平均显著降低。见图1。
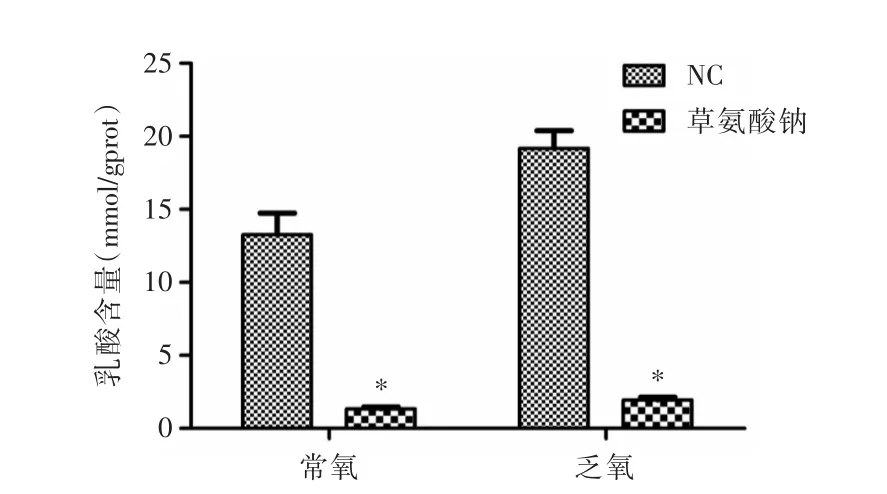
图1 草氨酸钠处理对CNE2细胞乳酸含量的影响Fig.1 Effect of sodium oxalate on the production of lactate in CNE2 cells
2.2 草氨酸钠抑制肿瘤细胞血管紧张素的生成常氧条件下,CNE2细胞仅产生少量的血管紧张素Ⅱ,乏氧条件下CNE2细胞上清血管紧张素Ⅱ含量明显增多。20 mmol/L草氨酸钠处理可减少两种条件下肿瘤细胞血管紧张素Ⅱ的分泌。见图2。
2.3 草氨酸氨对乏氧CNE2细胞增殖的抑制作用 MTT检测结果显示,经30、60、90 mmol/L不同浓度草氨酸钠处理不同时间对乏氧CNE2细胞的增殖有一定的抑制作用,且呈现出时间和剂量依赖性(表1),与对照组相比差异具有统计学意义(P< 0.05)。

图2 草氨酸钠处理对CNE2细胞上清血管紧张素Ⅱ含量的影响Fig.2 Effect of sodium oxalate on the production of angiotensinⅡin CNE2 cells
表1 不同浓度草氨酸钠与不同作用时间对乏氧CNE2细胞增殖的抑制率Tab.1 Inhibitory rate of sodium oxalate on proliferation in hypoxic CNE2 cells ± s,%

表1 不同浓度草氨酸钠与不同作用时间对乏氧CNE2细胞增殖的抑制率Tab.1 Inhibitory rate of sodium oxalate on proliferation in hypoxic CNE2 cells ± s,%
草氨酸钠浓度(mmol/L)30 60 90作用时间24 h 2.68±0.59 13.83±3.21 30.61±5.46 48 h 11.45±2.44 23.97±5.54 47.99±10.26 72 h 15.97±4.21 32.50±4.67 59.75±9.73
2.4 草氨酸钠增加了乏氧肿瘤细胞的放射敏感性 克隆形成实验结果显示,草氨酸钠降低了乏氧条件下培养的CNE2细胞经不同剂量照射后的存活分数(survival fraction,SF)(图3),提高了乏氧CNE2细胞的放射敏感性。

图3 草氨酸钠对乏氧CNE2细胞放射敏感性的影响Fig.3 Effect of sodium oxalate on the radiosensitivity of hypoxic CNE2 cells
3 讨论
近年来,随着放射生物学,尤其是放射物理学的快速发展,鼻咽癌放疗临床获益显著,但仍有部分患者因局部区域肿瘤的复发和发生远处转移而导致治疗失败。造成这一局面的重要原因是肿瘤细胞的放射生物学抵抗[8]。同其他实体瘤一样,鼻咽癌也存在瘤内的乏氧,与普通细胞相比乏氧的肿瘤细胞对射线有更强的抵抗力,在放疗中这部分细胞不易被杀死,成为治疗后复发和转移的潜在根源[9]。因此克服乏氧肿瘤细胞放射抵抗仍然是目前恶性肿瘤放射治疗面临的重要挑战。
能量代谢异常是恶性肿瘤最鲜明的特征之一,虽然与氧化磷酸化相比糖酵解是一种低效的能量代谢方式,但是肿瘤细胞即使在有氧条件下仍活跃地摄取葡萄糖进行糖酵解来供应能量。肿瘤细胞的这种能量代谢方式被称作“有氧糖酵解”或“Warburg效应”[6]。LDH是调节糖酵解的重要酶之一,在胞浆内催化糖酵解途径的产物丙酮酸生成乳酸完成糖酵解全过程。草氨酸钠(sodium oxamate)是LDH-A(LDH的5种同工酶之一)的特异性抑制剂,可抑制癌细胞糖酵解的发生,阻断癌细胞的能量供应来源[10]。YAND等[11]在人肺腺癌H1395中发现草氨酸钠可诱导细胞凋亡并引起G2/M期阻滞。LIU等[12]使用草氨酸钠处理胃癌SGC-7901细胞和BGC-823细胞发现可抑制其增殖并降低细胞的侵袭性,诱导它们发生凋亡。ZHAO等[13]也在胃癌细胞中得到了相一致的结果,并发现草氨酸钠可诱导胃癌细胞发生保护性自噬。
在此,本课题组研究了草氨酸钠对乏氧鼻咽癌细胞CNE2体外增殖和放射敏感性的影响,及其潜在机制。结果显示,由于“Warburg效应”的存在,鼻咽癌细胞CNE2即使在常氧条件下仍有较多的乳酸生成,乏氧条件下乳酸的产生进一步增多。草氨酸钠在两种条件下均能够显著抑制乳酸的生成。相似地,在乏氧鼻咽癌细胞CNE2中,草氨酸钠也可呈时间和剂量依赖性抑制其增殖。
肾素-血管紧张素系统(renin-angiotensin system,RAS)在肿瘤生物学中发挥着重要作用[14],近年来的研究显示其参与了肿瘤的化学治疗、免疫治疗抵抗[15-16]。血管紧张素Ⅱ(AngiotensinⅡ,AngⅡ)被认为是RAS最主要的生物活性物质。本课题组之前的研究显示乏氧肿瘤中AngⅡ水平明显升高,血管紧张素Ⅱ受体1型(AngiotensinⅡreceptor type 1,AT1R)信号阻断可提高乏氧鼻咽癌细胞的放射敏感性[17-19]。为研究草氨酸钠对乏氧鼻咽癌细胞AngⅡ水平的影响,笔者检测了CNE2上清中AngⅡ的含量发现无论常氧还是乏氧条件下草氨酸钠均可抑制鼻咽癌细胞AngⅡ的生成。克隆形成实验证实了草氨酸钠可显著提高乏氧鼻咽癌细胞CNE2的放射敏感性,因此笔者推测,其抑制AngⅡ的生成,下调AT1R信号可能是草氨酸钠放射增敏效应的机制之一,但仍有待进一步实验来证实。
草氨酸钠因其对正常组织细胞的毒性较低,作为新型放射增敏剂具有广阔的应用前景。笔者将继续深入研究草氨酸钠抑制乏氧肿瘤细胞AngⅡ生成,增强放射敏感性的分子机制并为动物水平的实验打下基础。总之,本研究为理解乏氧肿瘤细胞放射抵抗的机制提供了一定的理论依据,同时为克服鼻咽癌放疗抵抗从而减少放疗后转移和复发提供了新的潜在策略与手段。
[1]TANG L L,CHEN W Q,XUE W Q,et al.Global trends in incidence and mortality of nasopharyngeal carcinoma[J].Cancer Lett,2016,374(1):22-30.
[2]HUANG T L,CHIEN C Y,TSAI W L,et al.Long-term late toxicities and quality of life for survivors of nasopharyngeal carcinoma treated with intensity-modulated radiotherapy versus non-intensity-mod μLated radiotherapy[J].Head Neck,2016,38(S1):E1026-E1032.
[3]ZHANG L,HUANG Y,HONG S,et al.Gemcitabine plus cisplatin versus fluorouracil plus cisplatin in recurrent or metastatic nasopharyngeal carcinoma:a multicentre,randomised,open-label,phase 3 trial[J].Lancet,2016,388(10054):1883-1892.
[4]WILSON W R,HAY M P.Targeting hypoxia in cancer therapy[J].Nat Rev Cancer,2011,11(6):393-410.
[5]COLLIEZ F,GALLEZ B,JORDAN B F.Assessing tumor oxygenation for predicting outcome in radiation oncology:a review of studies correlating tumor hypoxic status and outcome in the preclinical and clinical settings[J].Front Oncol,2017,7:10.
[6]CHEN X,QIAN Y,WU S.The Warburg effect:evolving interpretations of an established concept[J].Free Radical Bio Med,2015,79(4):253-263.
[7]BREE C V,RODERMOND H M,HAVEMAN J,et al.Clonogenic assay of cells in vitro.[J].Nat Protoc,2006,1(5):2315-2319.
[8]PERRI F,PACELLI R,CELLA L,et al.Radioresistance in head and neck squamous cell carcinoma:Biological bases and therapeutic implications[J].Head Neck,2015,37(5):763-770.
[9]HIROSHI H.Hypoxia-inducible factor 1-mediated characteristic features of cancer cells for tumor radioresistance[J].J Radiat Res,2016,57(Suppl 1):i99-i105.
[10]KINNAIRD A,MICHELAKIS E D.Metabolic modulation of cancer:a new frontier with great translational potential[J].J Mol Med,2015,93(2):127-142.
[11]YANG Y,SU D,ZHAO L,et al.Different effects of LDH-A inhibition by oxamate in non-small cell lung cancer cells[J].Oncotarget,2014,5(23):11886.
[12]LIU X,YANG Z,CHEN Z,et al.Effects of the suppression of lactate dehydrogenase A on the growth and invasion of human gastric cancer cells[J].Oncol Rep,2015,33(1):157-162.
[13]ZHAO Z,HAN F,YANG S,et al.Oxamate-mediated inhibition of lactate dehydrogenase induces protective autophagy in gastric cancer cells:Involvement of the Akt-mTOR signaling pathway[J].Cancer Lett,2015,358(1):17-26.
[14]GEORGE A J,THOMAS W G,HANNAN R D.The renin-angiotensin system and cancer:old dog,new tricks[J].Nat Rev Cancer,2010,10(11):745-759.
[15]CHAUHAN V P,MARTIN J D,LIU H,et al.Angiotensin inhibition enhances drug delivery and potentiates chemotherapy by decompressing tumour blood vessels[J].Nat Commun,2013,4(10):2516.
[16]PINTER M,JAIN R K.Targeting the renin-angiotensin system to improve cancer treatment:Implications for immunotherapy.[J].Sci Transl Med,2017,9(410):eaan5616.
[17]林淑慧,谢国柱,张静芳,等.坎地沙坦对人乳腺癌细胞株MCF-7生长抑制作用的研究[J].实用医学杂志,2014,30(4):511-514.
[18]刘颖,张兰芳,程坦,等.坎地沙坦提高乏氧鼻咽癌CNE1细胞辐射敏感性[J].实用医学杂志,2017,33(8):1212-1216.
[19]XIE G,LIU Y,YAO Q,et al.Hypoxia-induced angiotensin II by the lactate-chymase-dependent mechanism mediates radioresistance of hypoxic tumor cells[J].Sci Rep,2017,7:42396.

